HIV感染者认知功能正常时静息态脑功能连接的研究
2017-08-07张倩倩赵方罗杰棋张辉徐六妹郑广平王辉李宏军陆普选
张倩倩, 赵方, 罗杰棋, 张辉, 徐六妹, 郑广平, 王辉, 李宏军, 陆普选
·传染病影像学·
HIV感染者认知功能正常时静息态脑功能连接的研究
张倩倩, 赵方, 罗杰棋, 张辉, 徐六妹, 郑广平, 王辉, 李宏军, 陆普选
目的:探讨认知功能正常时HIV感染者与正常人的静息态脑功能连接情况。方法:按照入选标准搜集25例HIV感染者和27例健康志愿者作为正常对照组,比较蒙特利尔认知评估量表评分、年龄、性别、教育水平的差异。应用静息态脑功能技术以双侧大脑各区为种子点,分析两组各种子点与全脑功能连接的差异,体素P取0.005,团簇P取0.05。结果:HIV感染组与正常对照组各种子点均有统计学差异,经多重校正后有19个种子点8个脑区差异具有统计学意义。HIV感染组在以左侧额极内侧、双侧海马、双侧前扣带回、左侧顶叶、左侧丘脑、左侧梭状回的种子点与全脑的功能连接高于正常组;HIV感染组在以双侧视觉皮层枕叶、左侧岛叶区域的种子点与全脑的功能连接低于正常组;HIV感染组在以右侧运动皮层、左侧顶下叶的种子点与全脑的功能连接与正常组比较既有升高又有降低。结论:HIV感染者认知功能正常时的静息态脑功能连接与正常人有显著差异,提示HIV感染者在认知功能正常时脑功能连接可能已经出现异常,HIV病毒可能影响脑功能的连接。
HIV感染; 静息态; 功能磁共振成像; 艾滋病痴呆复合征
近几年全国HIV感染的发病率逐渐增加。HIV感染后不久HIV病毒可以透过血脑屏障,通过多种机制引起神经元损伤[1-3],其中有多达50%的HIV感染者有神经认知功能损伤[4],临床上称为HIV相关神经认知疾病(HIV-associated neurocognitive disorders,HAND)。HIV病毒对神经系统的损伤是从无症状、轻度到严重的过程。随着HIV感染及时合理的应用高效抗反转录病毒治疗(highly active anti-retroviral therapy,HARRT),严重的神经损伤发病率下降,而无症状和轻度的神经损伤的发病率相对增加[5]。
基于血氧水平依赖效应(BOLD)的脑功能成像技术目前有两种,分别是任务态脑功能成像(task-fMRI)和静息态脑功能成像(rs-fMRI)。早期研究任务态的较多,因为任务态可以明确大脑皮层区域与任务事件的关系,利用任务态对HAND的研究结果表明:语义事件排序任务是依赖于前额叶皮层与基底节之间的相互作用,额叶-纹状体系统是HIV认知功能障碍的基础,背侧前扣带皮层(ACC)和背外侧前额叶、顶叶皮层(DLPFC)的BOLD信号及激活水平有异常表现[6-9]。但临床上task-fMRI研究难以操作,而rs-fMRI同样发现HAND患者背侧尾状核连接到额叶和顶叶脑区功能下降[10],双侧楔前叶和前额叶皮层的功能连接降低等[11]。临床上无认知功能障碍症状的HIV感染者脑功能又是怎样的呢?在探讨应用功能磁共振技术评估认知障碍的方法还有待进一步细化。
本文用rs-fMRI来研究临床上无认知功能障碍症状的HIV感染者脑功能是否有异常,为HIV病毒感染神经系统的病理生理过程提供一定科学依据,为HIV感染者的脑功能研究提供参考。
材料与方法
1.研究对象
本研究经深圳市第三人民医院伦理委员会同意,所有入选的研究对象均了解实验目的,自愿参加,并签署书面知情同意书。
HIV感染组入选标准:①所有实验组患者均符合HIV感染诊断的金标准[12]即HIV 1/2抗体检测阳性。②患者年龄20~45岁。③患者临床资料完整,包括:是否治疗、感染HIV的时间、用药的时间、用药的方案、近三个月最低CD4+T细胞浓度及血浆HIV病毒载量。④均为右利手。⑤蒙特利尔认知评估量表MoCA评分≥26分。⑥常规MRI扫描无明确的脑部结构和信号异常。⑦无精神类疾病,无酒精中毒,过去12个月内未使用海洛因、鸦片或其他静脉注射药物,过去3个月内未使用可卡因。
随机招募健康志愿者作为健康对照组,入选标准:①年龄20~45岁。②均为右利手。③教育程度与实验组匹配。④注意力及记忆力良好,无认知功能下降的相关表现。⑤蒙特利尔认知评估量表MoCA评分≥26分。⑥既往无任何精神、神经病史或其他认知功能下降。⑦常规MRI无明确脑部结构和信号异常。
根据入选标准,2016年9月-2016年12月在深圳市第三人民医院爱心门诊搜集25例HIV感染者,其中男23例,女2例,均经性传播感染,其中4例经异性传播,21例经同性传播。对照组共招募 27例受试者,男26例,女1例,性别、年龄与HIV感染者相匹配。采用SPSS 22对两组性别、年龄和教育水平进行t检验或卡方检验。
2.检查设备及方法
数据采集前当天由同一位经过专业训练的爱心门诊副主任医师进行MoCA量表评估。静息态数据采集时要求受试者扫描过程中闭眼、安静、清醒的状态平卧于检查床,不进行任何思维活动,数据采集前先行环境适应性训练。
采用Philips Achieva 1.5T磁共振成像系统,16通道头部阵列线圈,以前后联合(A0-PO)的连线作为扫描基线。采用T1W-3D-FFE序列,TR 25 ms, TE shortest,翻转角 30°,视野234 mm×234 mm×152 mm,层数190。BOLD-fMRI功能成像,采用FE-EPI序列, TR 2500 ms, TE 45 ms,翻转角90°,视野224 mm×224 mm×141 mm,层厚4.4 mm,体素3.5 mm×3.5 mm×4.4 mm,层数32,层间距0,隔层采集。
3.数据后处理及统计学分析
所有软件均在Matlab R2013a上运行,采用SPM12软件(http://www.fil.ion.ucl.ac.uk/spm/)做预处理。将数据进行整理,保证每个文件夹内的数据无误,采用SPM12软件对数据进行预处理,以去除噪声、生理信息、提高信噪比、使不同的脑标准化,以便进行受试者间的比较。首先对原始数据进行初始化,即格式转化,删除不稳定数据前10个时间点,层间的时间校正;再进行空间校正,包括重组、配准(EPI Template)、平滑(FWHM=4 mm);最后进行时间校正,包括去漂移、去协变量(去除头动、脑白质、脑脊液流动)、时间滤波0.01~0.1 Hz。预处理完后检查数据,保证每个数据无误、配准图像都匹配。
预处理后的数据用静息态脑功能软件(http://www.nitrc.org/projects/seecat/)进行种子点连接(seed-based connectivity)、统计分析及Brain Net Viewer[13]可视化。取SPM 12上解剖结构中双侧大脑半球所有区域作为种子点,左右大脑半球共146个种子点,以每个解剖区域为种子点分析与全脑体素功能连接,经软件计算得到每个种子点体素与全脑体素的原始的pearson相关系数图(FC)和经Fisher变换将r转化为正态分布的z相关系数图(zFC),通过z值表示功能连接性。将每个种子点zFC图的两组样本进行t检验,有统计学意义后再将有显著差异的区域进行多重校正,统计过程中采用体素P取0.005,团簇P取0.05[11,14],双侧检验,GRF校正。最后将有差异种子点的显著区域进行归纳统计,峰值强度为负值或颜色为冷色的是正常组小于实验组的区域,峰值强度为正值或颜色为暖色的是正常组大于实验组的区域,峰值强度有正负两个值时为混合。
结 果
1.临床资料
25例HIV感染者均进行了抗反转录病毒(HAART)治疗,平均感染时间为2.6年,用药方案有5种,近期血浆病毒载量大于500 copies/mL者8例,近期CD4+T细胞计数<200/μL者6例。对照组组与实验组的年龄、性别构成比、教育程度差异均无统计学意义(表1)。
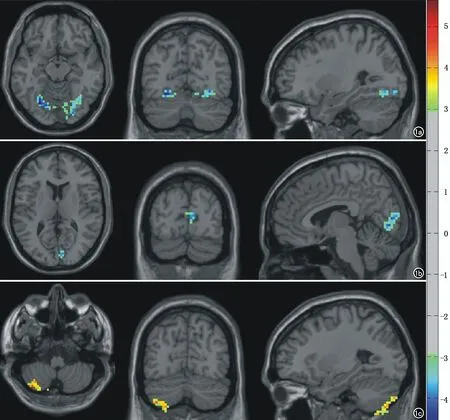
图1 正常组部分种子点与HIV感染组相比差异显著的连接区域的色彩标值(横轴面、冠状面、矢状面)。a) 左侧海马与双侧枕叶、梭状回连接正常组
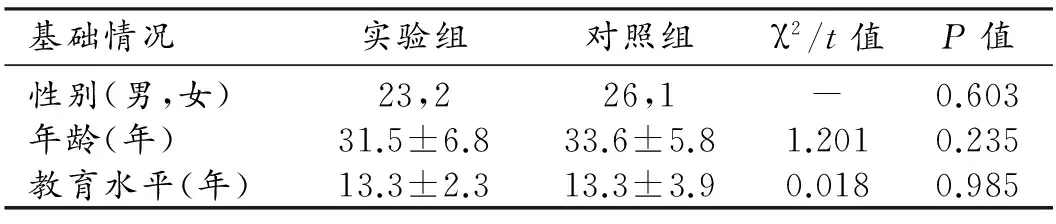
表1 两组性别、年龄、教育水平比较
2.各种子点与全脑功能连接结果
两组各种子点差异均有统计学意义(t=2.938,P<0.005),多重校正后34个种子点有差异有统计学意义(P<0.05)。但大于最小团簇有显著差异的有19个种子点8个脑区(表2,图1~2),分别是左侧额极内侧1个种子点、双侧海马5个种子点、左侧丘脑1个种子点、双侧前扣带回2个种子点、双侧视觉皮层(左侧梭状回、双侧枕叶)5个种子点、左侧岛叶1个种子点、左侧顶叶3个种子点及右侧运动皮层1个种子点。19个种子点钟左侧大脑半球有14个(74%),右侧大脑半球有5个(26%)。连接显著差异的区域以双侧小脑后叶和双侧枕叶为主;无论是种子点还是显著差异区,连接异常的主要是双侧海马、顶枕叶、小脑后叶。
HIV感染组在左侧额极内侧、双侧海马、双侧前扣带回、左侧顶叶上回及下回部分、左侧丘脑的躯体感觉腹后核区、左侧视觉皮层的梭状回区域与全脑的功能连接高于正常组,有12个种子点,约占所有阳性种子点的63%。HIV感染组在双侧海马、前扣带回与双侧枕叶的功能连接、左侧额极内侧与右侧额下回的功能连接、左侧丘脑与左侧边缘叶的连接、左梭状回与邻近皮层左海马的功能连接、左侧顶叶(SPL-5Ci、IPL-PGp)与双侧小脑后叶功能连接均高于正常组(图1a~b,冷色、负值)。
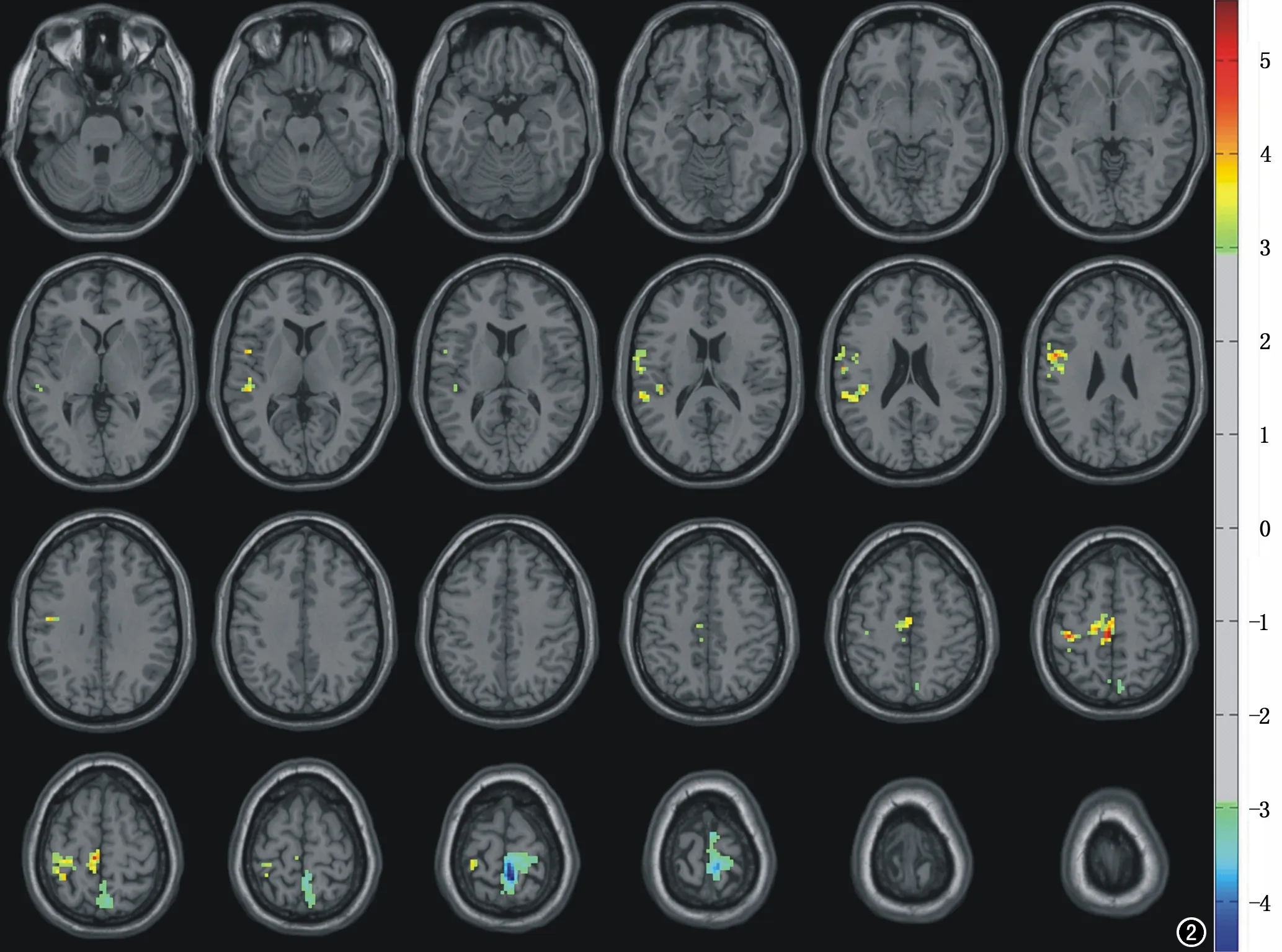
图2 种子点运动皮层正常组与HIV感染组相比差异显著区域的横轴面图像,层厚5mm。
HIV感染组在双侧视觉皮层枕叶、左侧岛叶区域与全脑的功能连接低于正常人组,有5个种子点,约占所有阳性种子点的26%。HIV感染组在双侧枕叶视觉皮层与左侧小脑后叶的功能连接低于正常人组、在左岛叶与右侧小脑后叶的功能连接低于正常组(图1c,暖色、正值)。
右侧运动皮层和左侧顶下叶区域与全脑的功能连接,HIV感染组与正常组比较既有升高又有降低;右侧皮层以降低为主,左侧顶叶下回以升高为主。HIV感染组在左顶叶与全脑各叶的功能连接与正常组有差异、在右侧运动皮层与周围大脑皮层的功能连接有异常,约占所有阳性种子点的11%(图2,冷暖色均有)。
讨 论
rs-fMRI是目前研究脑功能磁共振成像技术比较成熟的影像学方法,现已广泛应用于认知领域的研究,而基于种子点功能连接分析又是rs-fMRI较常用的研究方法。本文中所研究的对象是认知功能正常HIV感染者,用静息态研究此类患者的较少且种子点区域有限,因此,笔者采取双侧大脑皮层和基底节区所有的解剖区为种子点,逐一与正常组作比较分析,较为全面。尽管有研究[15]证明了年龄和HIV病毒是两个独立的因素引起rs-fMRI的下降,且HIV可能导致脑功能基线下降与年龄引起的脑功能退化是一样的。但是目前还没有明确的相关指南,本研究为了分析HIV病毒对中枢神经系统的影响过程还是排除了年龄因素,研究对象的年龄在45岁以下。
本研究中所有患者均为右利手,结果中阳性差异有74%的种子点位于左侧大脑半球,而阳性结果中的运动皮层则是右侧。任务态运动执行功能实验表明,HIV感染者的右手运动时脑信号激活区域比正常人减低[16],HIV阳性患者表现为脑运动皮层信号不对称[17],而性取向可能会影响脑信号不对称的因素[18-19]。实验中25例HIV感染者中均经过HAART治疗,并为性传播感染,有4例经异性传播,21例经同性传播。因此,性取向不能排除对这种双侧大脑异常连接的不对称性影响,为明确感染途径这一因素的影响,还有待更多的实验研究证明。
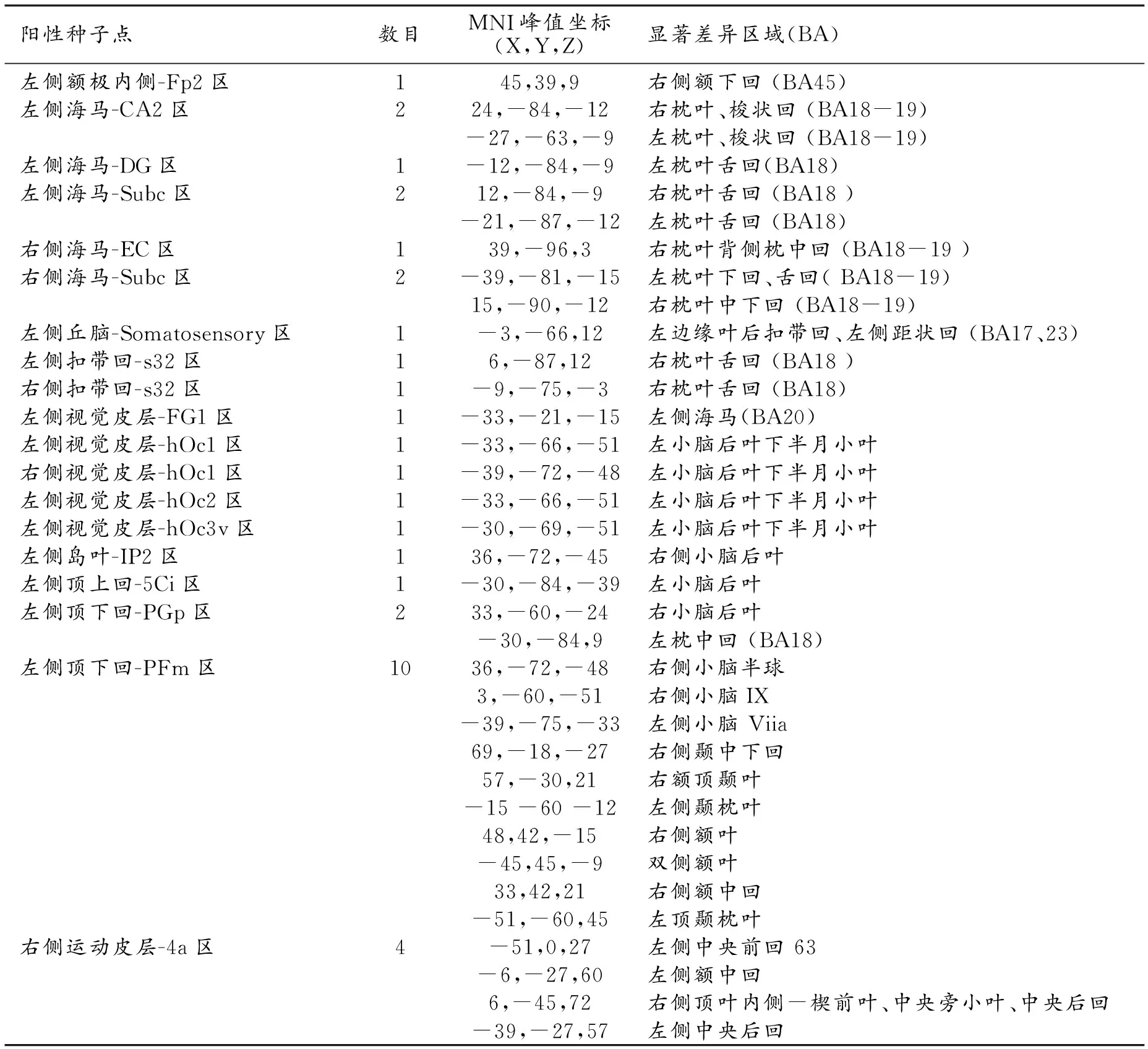
表2 双侧大脑半球阳性种子点结果
在以左侧额极内侧、双侧海马、双侧前扣带回、左侧顶叶、左侧丘脑、左侧梭状回为种子点与全脑的功能连接,认知功能正常的HIV感染组高于正常对照组。在以双侧视觉皮层枕叶、左侧岛叶区为种子点与全脑的功能连接,认知功能正常的HIV感染组低于正常对照组。而在早期的任务态研究认知功能正常时发现前外侧额叶皮层的BOLD信号增加,在后顶叶皮层、辅助运动区、丘脑、尾状核和枕叶皮层的信号无异常[20];右侧海马的BOLD信号减低,右额下回外侧和左侧舌回的BOLD信号增加[21];这些脑区与本实验结果不一样。可能是在HIV感染者认知功能正常时采用任务态和静息态两种脑功能研究方法的不同,导致受试者脑激活区和异常功能连接结果不一致。有研究结果表明视觉皮层的静息态脑血流量(rCBF)降低[22],视觉皮层的脑BOLD信号和rCBF基线都降低,这与本研究中双侧视觉皮层与左侧小脑后叶的功能连接降低是相呼应的。而在认知功能减低时静息态脑功能连接中也有研究表明,视觉网络在HIV早期感染者的静息态功能连接上有明显异常变化[23]。因此,推测HIV感染者无论认知功能是否有异常视觉网络均有异常表现。认知功能降低时使用任务态和静息态实验表明,额叶-纹状体系统信号及功能连接降低[10,24],以顶叶、扣带回种子点的功能连接降低为主[11,25]。而本研究证明认知功能正常时,双侧前扣带回、左侧顶叶为种子点的功能连接升高,这可能是神经在受到病毒侵犯时的应激反应。左侧额极内侧、双侧海马、左侧顶叶、左侧丘脑、左侧梭状回为种子点与全脑的功能连接升高,虽没有认知功能异常时的研究相对照,但也应该是神经在受到病毒侵犯时的应激反应,后续笔者将进一步研究认知功能障碍时在以这些区域为种子点的脑功能连接是否有异常。近期Janssen等[26]研究结果表明在病毒控制的情况下,HIV感染者的脑功能连接与正常人无差异,实验中所采用的数据处理方法和所选择种子点与本实验均不一样,这可能是与本实验结论不一致的原因。
另外,本研究中所搜集的HIV感染者均有抗病毒治疗,不能完全排除药物影响;但在临床中,一经发现HIV感染者,都有规律用抗病毒药或干预治疗,所以对是否要排除药物影响以及药物是否有影响的临床意义还有待思考。
总之,认知功能正常的HIV感染者的脑功能连接与正常人是有差异的;提示HIV感染者在认知功能正常时脑功能连接可能已经出现异常,HIV病毒可能影响脑功能的连接,在今后的临床应用中不能仅用静息态功能连接异常来评判认知功能异常。
本文是一种前瞻性研究,结果有一定数据支持,有新的结果和新的发现,但每一项研究都需要不断的复制和创新来验证:本研究的样本量有限;所搜集的患者均已用药,不能完全排除药物影响;HIV病毒感染的时间段与静息态功能连接是否存在线性关系有待分析,还需要脑血流量、血容量、DTI等多模态脑功能成像进行验证。
[1] Kaul M,Lipton SA.Chemokines and activated macrophages in HIV gp120-induced neuronal apoptosis[J].Proc Natl Acad Sci USA,1999,96(14):8212-8216.
[2] Nath A.Human immunodeficiency virus (HIV) proteins in neuropathogenesis of HIV dementia[J].J Infect Dis,2002,186(Suppl 2):S193-S198.
[3] Burdo TH,Lackner A,Williams KC.Monocyte/macrophages and their role in HIV neuropathogenesis[J].Immunol Rev,2013,254(1):102-113.
[4] Heaton RK,Clifford DB,Franklin DR Jr,et al.HIV-associated neurocognitive disorders persist in the era of potent antiretroviral therapy:CHARTER study[J].Neurology,2010,75(23):2087-2096.
[5] Yakasai AM,Gudaji MI,Muhammad H,et al.Prevalence and correlates of HIV-associated neurocognitive disorders (HAND) in northwestern nigeria[J].Neurol Res Int,2015:486960.
[6] Tinaz S,Schendan HE,Schon K,et al.Evidence for the importance of basal ganglia output nuclei in semantic event sequencing:an fMRI study[J].Brain Res,2006,1067(1):239-249.
[7] Melrose RJ,Tinaz S,Castelo JM,et al.Compromised fronto-striatal functioning in HIV:an fMRI investigation of semantic event sequencing[J].Behav Brain Res,2008,188(2):337-347.
[8] Jiang X,Barasky R,Olsen H,et al.Behavioral and neuroimaging evidence for impaired executive function in "cognitively normal" older HIV-infected adults[J].AIDS Care,2016,28(4):436-440.
[9] Connolly CG,Bischoff-Grethe A,Jordan SJ,et al.Altered functional response to risky choice in HIV infection[J].PLoS One,2014,9(10):e111583.
[10] Ipser JC,Brown GG,Bischoff-Grethe A,et al.HIV infection is associated with attenuated frontostriatal intrinsic connectivity:a preliminary study[J].J Int Neuropsychol Soc,2015,21(3):203-213.
[11] Ann HW,Jun S,ShinNY,et al.Characteristics of resting-state functional connectivity in HIV-associated neurocognitive disorder[J].PLoS One,2016,11(4):e0153493.
[12] 中华医学会感染病学分会艾滋病组.艾滋病诊断指南(第三版)[J].中华传染病杂志,2015,33(10):577-593.
[13] Xia M,Wang J,He Y.Brain net viewer:a network visualization tool for human brain connectomics[J].PLoS One,2013,8(7):e68910.
[14] Slotnick SD,Moo LR,Segal JB,et al.Distinct prefrontal cortex activity associated with item memory and source memory for visual shapes[J].Brain Res Cogn Brain Res,2003,17(1):75-82.
[15] Thomas JB,Brier MR,Snyder AZ,et al.Pathways to neurodegeneration effects of HIV and aging on resting-state functional connectivity[J].Neurology,2013,80(13):1186-1193.
[16] 赵晶,李宏军,员达,等.HIV相关脑痴呆BOLD fMRI运动功能成像[J].放射学实践,2011,26(10):1028-1031.
[17] Jing Zhao,Hongjun Li,Panli Zuo,et al.Altered brain functions in HIV positive patients free of HIV-associated neurocognitive disorders:a MRI study during unilateral hand movements[J].Radiol Infect Dis,2015,2:83-87.
[18] Witelson SF.Neural sexual mosaicism:sexual differentiation of the human temporo-parietal region for functional asymmetry[J].Psychoneuroendocrinology,1991,16(1-3):131-153.
[19] McCormick CM,Witelson SF.Functional cerebral asymmetry and sexual orientation in men and women[J].Behav Neurosci,1994,108(3):525-531.
[20] Ernst T,Chang L,Jovicich J,et al.Abnormal brain activation on functional MRI in cognitively asymptomatic HIV patients[J].Neurology,2002,59(9):1343-1349.
[21] Ances BM,Sisti D,Vaida F,et al.Resting cerebral blood flow:a potential biomarker of the effects of HIV in the brain[J].Neurology,2009,73(9):702-708.
[22] Ances B,Vaida F,Ellis R,et al.Test-retest stability of calibrated BOLD-fMRI in HIV-and HIV+subjects[J].Neuroimage,2011,54(3):2156-2162.
[23] Wang X,Foryt P,Ochs R,et al.Abnormalities in resting-state functional connectivity in early human immunodeficiency virus infection[J].Brian Connect,2011,1(3):207-217.
[24] Plessis SD,Vink M,Joska JA,et al.HIV infection and the fronto-striatal system:a systematic review and meta-analysis of fMRI studies[J].AIDS,2014,28(6):803-811.
[25] 王玲,史大鹏,闫镔,等.磁共振弥散张量成像与静息态功能磁共振成像联合应用对艾滋病患者轻度认知功能下降的初步研究[J].中国传染病杂志,2013,31(1):37-43.
[26] Janssen MA,Hinne M,Janssen RJ,et al.Resting-state subcortical functional connectivity in HIV-infected patients on long-term cART[J].Brain Imaging Behav,2016.DOI:10.1007/s11682-016-9632-4.
A study on resting state brain functional connectivity in HIV infected patients with normal cognitive function
ZHANG Qian-qian,ZHAO Fang,LUO Jie-qi,et al.
The Third Peoples Hospital of Shenzhen,Guangdong Medical University,Guangdong 518112,China
Objective:The purpose of this study was to investigate whether there is any abnormality in the resting state brain network connection in HIV infected patients with normal cognitive function compared with normal subjects.Methods:According to the inclusion criteria,25 patients with HIV infection and 27 normal subjects were collected.The differences in Montreal cognitive assessment score,age,gender,and education level were compared.The resting brain function technique was used as the seed point in the bilateral brain regions.Difference of each seed point connected with the whole brain network between the two groups was analyzed.The voxelPwas 0.005 and the clusterPwas 0.05.Results:Difference between the two groups was statistically significant in each of the seed points;there were significant differences in the 8 brain regions of the 19 seed points after multiple correction.The function connectivity between the seed points and the whole brain were higher in HIV infection group than that in normal group in the left medial frontal,bilateral hippocampus,bilateral anterior cingulate gyrus,left parietal lobe,left thalamus,and left fusiform gyrus.The function connectivity was lower in the bilateral visual cortex of the occipital and left insula.Either higher or lower in the right motor cortex and the left low parietal lobe.Conclusion:There is a significant difference in the resting state brain network connectivity between HIV infected patients with normal cognitive function and normal subjects.It suggests that HIV infected individuals may have abnormal brain function connections during normal cognitive function,and that the HIV virus may affect brain function connections.
HIV infections; Resting state; Functional magnetic resonance imaging; AIDS dementia complex
518112 广东,广东医科大学附属深圳市第三人民医院(张倩倩、赵方、罗杰棋、张辉、徐六妹、郑广平、王辉、李宏军、陆普选);首都医科大学附属北京佑安医院(李宏军)
张倩倩(1987-),女,河南周口人,硕士研究生,主要从事HIV相关认知功能的功能磁共振研究。
陆普选,E-mail:lupuxuan@126.com
北京市医院管理局临床医学发展专项经费资助(扬帆计划)(ZYLX201511);广东省医学科学技术研究基金项目(A2015011);深圳市科技计划资助项目(JCYJ20150402111430645)
R445.2; R512.91
A
1000-0313(2017)07-0744-06
10.13609/j.cnki.1000-0313.2017.07.018
2017-03-16)
