双能量CT碘定量参数评估肝硬化患者肝脏血流灌注重分布及肝功能的临床价值
2017-08-07石桥谢婷婷袁知东林兰英唐润辉成官迅
石桥, 谢婷婷, 袁知东, 林兰英, 唐润辉, 成官迅
双能量CT碘定量参数评估肝硬化患者肝脏血流灌注重分布及肝功能的临床价值
石桥, 谢婷婷, 袁知东, 林兰英, 唐润辉, 成官迅
目的:通过研究肝硬化患者双能量CT碘定量参数肝动脉供血比重碘分数(AIF)及门静脉血流碘含量(PVIC)改变,探讨AIF及PVIC反映肝硬化患者血流灌注分布情况及肝功能的临床价值。方法:选择55例经临床确诊肝硬化患者(研究组)及26例健康者(对照组),进行上腹部CT扫描,增强动脉期、门静脉期、延迟期为能谱成像(GSI)模式扫描,应用能谱分析软件进行后处理。分别在动脉期、静脉期物质分离碘基图上于肝脏左外叶、左内叶及右叶各取1个直径10 mm的ROI,测得ROI的碘浓度均值为增强扫描动脉期碘浓度(Ia)及门静脉期碘浓度(Ip),计算AIF、PVIC。对肝硬化组及正常对照组AIF、PVIC进行单因素分析,组间均数两两比较;肝硬化组AIF、PVIC分别与肝功能CTP分级评分进行Spearman相关性分析,P<0.05认为差异具有统计学意义。结果:肝硬化组Child-Pugh B级、C级AIF与正常对照组均数差异具有统计学意义(F=68.650,P<0.01),且Child-Pugh B级、C级AIF均高于正常对照组,分别为 (31.70±5.07)%,(47.74±5.75) % vs (21.06±4.29)%, AIF与肝硬化CTP分级评分呈正相关(r1=0.780,r2=0.848,P<0.01)。肝硬化组Child-Pugh A、B、C级PVIC与正常对照组均数差异均具有统计学意义(F=14.949,P<0.01),且均低于正常对照组,分别为(1.72±0.51)、(1.37±0.38)、(0.94±0.27)和(2.08±0.54) mg/mL;肝硬化组Child-Pugh A、B、C级PVIC呈逐级递减,差异具有统计学意义(P<0.05),与肝硬化CTP分级评分呈负相关(r1=-0.608,r2=-0.548,P<0.01)。结论:双能量CT参数AIF及PVIC的改变反映了肝硬化后门静脉对肝脏的血流灌注相对减少,且随肝硬化程度加重而呈逐级递减,Child-Pugh B级、C级出现肝动脉血流灌注增多;AIF及PVIC与肝硬化的临床分级相关,可作为评估肝功能储备状况的参考依据。
肝硬化; 体层摄影术,X线计算机; 肝功能
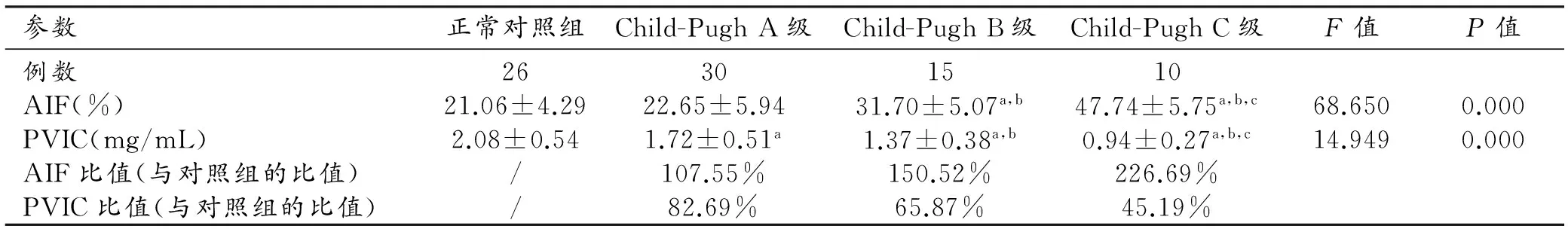
表2 正常对照组与肝硬化组AIF及PVIC比较
注:a与正常对照组相比,P<0.05;b与Child-Pugh A级相比,P<0.05;c与Child-Pugh B级相比,P<0.05。
肝脏储备功能的测定和评估是肝移植的标准,能预测肝硬化患者首次曲张静脉破裂出血后1年内的死亡率等[1-2],目前临床常用Child-Pugh分级来评估肝脏储备功能和患者预后,但是肝储备功能是多方面的,Child-Pugh分级仍存在一定局限性。本研究通过双能量CT碘定量参数肝动脉供血比重碘分数(arterial iodine fraction,AIF)及门静脉血流碘含量(portal venous blood flow iodine content,PVIC)变化,反映肝硬化患者肝动脉及门静脉血流灌注重分布及其与肝功能的相关性,旨在为肝脏储备功能的评价提供更多信息。
材料与方法
1.一般资料
搜集2013年7月-2016年7月北京大学深圳医院临床诊断为肝硬化的55例患者的病例资料,其中男42例,女13例,年龄26~75岁,平均(51±10)岁,所有患者均为乙肝肝硬化。肝硬化临床诊断标准:参考2000年中华医学会传染病与寄生虫病学分会、肝病学分会联合修订的病毒性肝炎防治方案[3]。根据CTP评分标准:积分≤6分为A级,7~9分为B级,≥10分为C级(表1)。CTP分级与CT扫描间隔小于3天。肝硬化CTP分级A级30例,B级15例,C级10例。CTP 评分5~13分,中位分值9分。另外随机选取本院行上腹部CT平扫及增强扫描中最后临床诊断无肝脏、脾脏疾病等相关疾病的26例作为正常对照组,其中男17例,女9例,年龄14~82岁,平均(50±14)岁。排除标准:肝脏形态变异、肝囊肿直径>5 mm、肝脏肿瘤、肝内胆管结石或钙化、脂肪肝、门静脉病变等。

表1 肝功能Child-Turcotte-Pugh(CTP)评分与分级标准
2.检查方法
采用GE Discovery CT 750HD能谱CT机,增强扫描动脉期、静脉期及延迟期行能谱成像(GSI)。扫描范围从膈顶上方至脐上方。对比剂采用碘海醇(350 mg I/mL,北陆药业),剂量1.2~1.5 mL/kg,采用高压注射器自肘正中静脉以3.0~3.5 mL/s流率团注。扫描参数:螺距0.984,球管转速0.6 s/r,探测器宽度为0.625 mm×64层,电压为高低能量(140 kVp和80 kVp)瞬时(0.5 ms)切换,管电流为640 mA。增强扫描时动脉期监测的ROI设定在腹主动脉,阈值达120 HU后5.4 s触发扫描。门静脉扫描于动脉期扫描开始后30 s进行。
3.ROI选择及碘浓度测定
原始数据传输至ADW 4.5工作站,在能谱分析软件物质分离碘基图上测量动脉期肝实质碘浓度(Ia)及门静脉期肝实质碘浓度(Ip)。在肝脏左内、外叶及右叶各选取1个直径为10 mm的圆形ROI(避开尾状叶、胆管、血管、小的囊肿),其平均值代表该时相肝实质碘浓度,各时相ROI选取位置尽量保持一致(图1~4),计算得AIF=Ia/Ip;单纯门静脉血流贡献的肝实质碘浓度PVIC≈Ip-Ia[4-6]。
4.统计学方法
结 果
肝硬化组Child-PughA级、B级、C级AIF与正常对照组差异具有统计学意义(F=68.650,P<0.01),Child-Pugh B级、C级AIF均高于正常对照组及A级,Child-Pugh C级AIF高于B级(P均<0.05)。肝硬化组Child-Pugh A、B、C级PVIC与正常对照组差异具有统计学意义(F=14.949,P<0.01),正常对照组最高,Child-Pugh A、B、C级依次降低(P均<0.05,表2)。
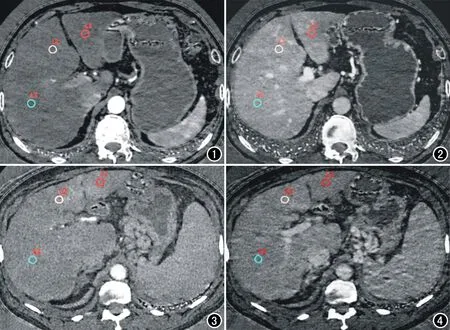
图1 正常组增强扫描动脉期碘基图像。 图2 正常组增强扫描门静脉期碘基图像。图3 肝硬化组增强扫描动脉期碘基图像。 图4 肝硬化组增强扫描门静脉期碘基图像。
AIF与肝硬化CTP分级及评分呈正相关(r1=0.780,r2=0.848,P<0.01)。PVIC与肝硬化CTP分级及评分呈负相关(r1=-0.608,r2=-0.548,P<0.01),且肝硬化组Child-Pugh A、B、C级PVIC逐级递减,差异具有统计学意义(P<0.05,表3,图5~8)。
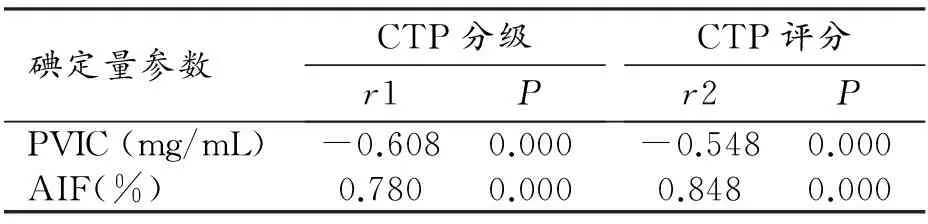
表3 肝硬化CTP分级及评分与碘定量参数的相关性
讨 论
1.双能CT成像原理及AIF、PVIC的意义
双能量CT成像基于单源瞬时kVp切换技术,使用高、低球管电压(140 kVp和80 kVp)瞬时切换并实现两组数据同时采样[7-8],测量出物质X线衰减系数。任何感兴趣物质都可以通过两种基物质的组合产生相同的衰减效应来表达,这个过程即双能量CT的物质分离定量功能[9-10]。人体组织含水丰富,CT对比剂为含碘溶液,且水-碘的衰减系数高低差别明显,常选用水-碘作为基物质对。在增强扫描中物质分离碘基图上表达的是碘空间和时间分布信息[11],测得的碘浓度的升高实际是增强扫描后灌注血流中含有碘对比剂所致,其变化程度间接反映其血供情况。
肝脏由肝动脉及门静脉供血,在肝动脉期肝实质的碘含量升高仅来自于含碘对比剂的肝动脉灌注,故在此阶段测量肝实质的碘浓度主要反映肝动脉血流量;在门静脉期肝实质碘含量升高来自于携带碘对比剂的肝动脉、门静脉灌注,此时碘基值由肝动脉和门静脉血流灌注量共同决定,反映了肝实质总的血流量。动脉期与门静脉期碘浓度之比为AIF,反映肝动脉占肝脏总血供的比例,以往有作者定义为肝动脉碘分数[4],但该概念对AIF的实质表述并不完整,故本文使用“肝动脉供血比重碘分数”这一概念。若肝动脉所携带碘的浓度从动脉期到门静脉期的变化忽略不计,则门静脉期肝实质碘浓度与动脉期碘浓度之间的差值为单纯门静脉血流供给的碘浓度[12](PVIC),反映了门静脉的血流灌注量。
2.AIF、PVIC反映肝硬化肝脏血流重分布
本研究显示肝硬化患者PVIC较正常组下降,包括Child-Pugh A级,即在肝硬化早期门静脉血供已经下降,肝硬化组Child-Pugh A、B、C级PVIC分别为正常对照组的83%、66%、45%(表2),这种下降趋势反映了门脉血流灌注肝硬化程度加重而逐渐减少。肝硬化后Disse间隙及汇管区纤维组织大量增生,一方面导致窦周间隙肝窦毛细血管化,肝窦顺应性减少,门静脉阻力增加;另一方面小叶下肝静脉闭塞扭曲,引起门静脉窦后梗阻,两种因素的协同作用使门静脉血流流速减慢,管腔逐渐扩张,最终使门脉阻力增加,门静脉灌注减少,即PVIC下降[13-14]。
门静脉和肝动脉小分支的血流汇合于肝小叶内的肝窦,两种压力不同的血流在肝小叶间汇管区由动静脉间的小交通支互相沟通后达到平衡,肝动脉对门静脉间血流灌注的改变以负反馈的方式应答,以保持肝脏血供的稳定,即肝动脉缓冲效应(hepatic arterial buffer response,HABR)[15]。本研究肝硬化Child-Pugh B、C级动脉期碘浓度增高,呈上升趋势,该现象证实了肝动脉缓冲效应的存在。在终末的肝小动脉、门静脉小支及终末胆管周围存在Mall间隙,当门静脉血流量减少时,间隙中腺苷的清除减少,腺苷浓度的升高导致肝动脉扩张,使肝动脉血流量增加;另一方面由于肝硬化后肝功能不良,一氧化碳、胰高血糖素等活性物质未被灭活而直接进入体循环,引起血管平滑肌舒张,体循环阻力下降,体循环处于高动力状态,而使肝动脉血流量增加[16-17]。
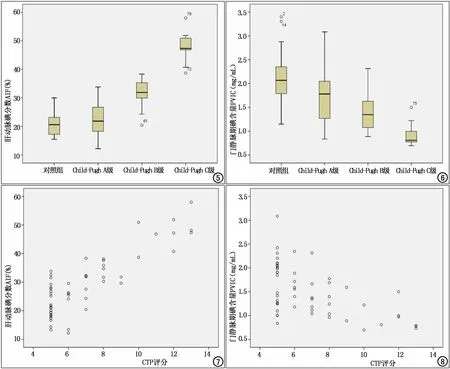
图5 正常组和肝硬化组AIF箱形图。 图6 正常组和肝硬化组PVIC箱形图。 图7 CTP评分与AIF的散点图。图8 CTP评分与PVIC的散点图。
3.AIF、PVIC与肝硬化肝功能储备的相关性
肝脏储备功能包括两方面的因素,肝脏血流灌注和肝实质细胞容积,其中肝脏的血流灌注是维持肝脏正常功能的重要因素,血流灌注减少将导致肝功能储备的损害,因此肝脏的血流动力学参数是判断肝脏功能的重要指标[18],肝硬化后AIF及PVIC的改变可反映肝脏功能的改变。本研究显示AIF与肝硬化CTP分级评分呈正相关,PVIC与肝硬化CTP分级评分呈负相关,AIF及PVIC与Child-Pugh分级有较好的相关性。肝硬化是动态发展的过程,从肝炎、肝纤维化、早期肝硬化、肝硬化到并发症等进展。早期肝硬化时,由于肝功能储备、机体代偿能力可,且尚能通过临床治疗抑制其进展,治疗效果较好;但晚期肝硬化由于并发症多,肝功能储备较低,治疗效果较差。评估肝硬化肝功能储备对临床意义重大,可指导临床治疗及判断其预后。Child-Pugh分级由于其易用,长期广泛应用于临床肝硬化肝功能储备的评估。其局限性在于部分指标波动较大,影响评分准确性;且其分级较窄,仅5~15分,同一分级内的患者,病情可能差别很大[19],目前Child-Pugh评级已经不能完全满足临床肝硬化肝功能分级需要。AIF反映肝动脉及门静脉供血比例,PVIC反映门静脉的血流量,作为评价肝硬化血流动力学改变的重要参数,与Child-Pugh评级相比,AIF及PVIC更为客观且受人为因素影响较小,且可以精确定量测定,并与肝硬化程度密切相关,能较好反映肝硬化血供的特点及肝功能损害程度,为评估肝脏储备功能提供重要参考依据。
综上所述,双能量CT碘定量参数AIF及PVIC的改变反映了肝硬化后门静脉对肝脏的血流灌注相对减少,而肝动脉血流灌注有所增多;AIF及PVIC与肝硬化的临床分级相关,表现为AIF越高、PVIC越低,肝脏储备功能越差,AIF及PVIC可作为评估肝功能储备状况的参考依据。
[1] Zardi EM,Di Matteo FM,Pacella CM,et al.Invasive and non-invasive techniques for detecting portal hypertension and predicting variceal bleeding in cirrhosis:a review[J].Ann Med,2014,46(1):8-17.
[2] Castera L,Pinzani M,Bosch J.Non invasive evaluation of portal hypertension using transient elastography[J].J Hepatol,2012,56(3):696-703.
[3] 中华医学会传染病与寄生虫病学分会,肝病学分会.病毒性肝炎防治方案[J].中华肝脏病杂志,2000,8(6):324-329.
[4] 赵丽琴,贺文,胡志海,等.肝动脉碘分数在不同肝功能分级肝硬化患者中的变化特点[J].首都医科大学学报,2013,6(3):329-332.
[5] 丁贺宇,王成林,黎永滨,等.肝硬化与正常肝脏双重血流量定量对比研究[J].中国CT和MRI杂志,2013,11(6):52-55.
[6] Zhao LQ,He W,Yan B,et al.The evaluation of haemodynamics in cirrhotic patients with spectral CT[J].Br J Radiol,2013,86(1028):20130228.
[7] Takahashi H,Shigefuku R,Yoshida Y,et al.Correlation between hepatic blood flow and liver function in alcoholic liver cirrhosis[J].World J Gastroenterol,2014,20(45):17065-17074.
[8] 谢婷婷,王成林,丁贺宇,等.采用双能量CT碘定量法研究正常活体肝脏的肝动脉和门静脉血供特点[J].中华放射学杂志,2013,47( 6):526-528.
[9] Glišic TM,Perišic MD,Dimitrijevic S,et al.Doppler assessment of splanchnic arterial flow in patients with liver cirrhosis:correlation with a mmonia plasma levels and MELD score[J].J Clin Ultrasound,2014,42(5):264-269.
[10] Petersilka M,Bruder H,Krauss B,et al.Technical principles of dual source CT[J].Eur J Radiol,2008,68(3):362-368.
[11] Dilmanian FA,Wu XY,Kress J,et al.Dual energy iodine contrast CT with monochromatic X-rays[J].IEEE Nucl Sci Symp Conf Rec,1995,3(3):1392-1396.
[12] Mileto A,Mazziotti S,Gaeta M,et al.Pancreatic dual-source dual-energy CT:is it time to discard unenhanced imaging[J].Clin Radiol,2012,67(4):334-339.
[13] 李卫侠,柴维敏,杜联军,等.不同程度肝纤维化的肝脏多层螺旋CT灌注成像初步研究[J].中华消化杂志,2009,29(4):231-235.
[14] Nishiura T,Watanabe H,Ito M,et al.Ultrasound evaluation of the fibrosis stage in chronic liver disease by the simultaneous rise of low and high frequency probes[J].Br J Radiol,2005,78(927):189-197.
[15] Brouwers MC,Bilderbeekbeckers MA,Georgieva AM,et al.Fatty liver is an integral feature of familial combined hyperlipidemia:relationship with fat distribution and plasma lipids[J].Clin Sci,2007,112(2):123-130.
[16] Castera L,Pinzani M,Bosch J.Non invasive evaluation of portal hypertension using transient elastography[J].J Hepatol,2012,56(3):696-703.
[17] 贾晶,陈勇,冀鑫,等.CT灌注成像结合CT肝体积测量评价肝硬化肝脏储备功能的应用[J].实用放射学杂志,2014,30(3):445-449.
[18] Miles KA,Hayball MP,Dixon AK.Functional images of hepatic perfusion obtained with dynamic CT[J].Radiology,1993,188(2):405-411.
[19] Papatheodoridis GV,Cholongitas E,Dimitriadou E,et al.MELD vs Child-Pugh and creatinine-modified Child-Pugh score for predicting survival in patients with decompensated cirrhosis[J].World J Gastroenterol,2005,11(20):3099-3104.
The clinical value of dual-energy CT-based iodine quantification parameters in the evaluation of hemodynamics and liver function in patients with cirrhosis
SHI Qiao,XIE Ting-ting,YUAN Zhi-dong,et al.
Medical Imaging Center,Peking University Shenzhen Hospital,518036 Guangdong,China
Objective:To assess the clinical value of dual-energy CT (DECT) parameters including arterial iodine fraction (AIF) and portal venous blood flow iodine content (PVIC) in the evaluation of hemodynamics and liver function in patients with cirrhosis.Methods:A total of 55 cases with liver cirrhosis (study group) and 26 cases without hepatic disease (control group) were enrolled in the study.All cases underwent upper abdomen CT scan.The enhancement scan protocol of gemstone spectral imaging (GSI) including arterial phase,portal venous phase and delayed phase were performed with DECT scanner (GE Discovery CT 750 HD).Iodine concentration was measured on material decomposition of iodine base figure.Region of interest (ROI) was selected in left lateral lobe,left medial lobe and right lobe of liver respectively and mean liver parenchyma iodine concentration of arterial phase (Ia) and portal venous phase (Ip) were calculated.The arterial iodine fraction (AIF=Ia/Ip) and the portal venous blood flow iodine content (PVIC≈Ip-Ia) were calculated.AIF and PVIC were compared by single factor analysis,and the difference between groups was analyzed in pairs.The correlation among AIF,PVIC and CTP grade,score were evaluated by Spearman's correlation analysis.Results:Liver cirrhosis group (Child-Pugh B,C) and control group were statistically different in AIF (F=68.650,P<0.01).AIF of Child-Pugh B,C were higher than that of control group [(31.70±5.07)%,(47.74±5.75)% vs (21.06±4.29)%].AIF was positively correlated with CTP grade in patients with liver cirrhosis (r1=0.780,r2=0.848,P<0.01).Liver cirrhosis group (Child-Pugh A,B,C) and control group were different in PVIC with statistically significance (F=14.949,P<0.01).PVICs of Child-Pugh A,B,C were lower than that of control group [(1.72±0.51),(1.37±0.38),(0.94±0.27) vs (2.08±0.54)mg/mL],and showed an declining trend with statistically significance.PVIC was negatively correlated with CTP grade score in patients with liver cirrhosis (r1=-0.608,r2=-0.548,P<0.01).Conclusion:The change of AIF and PVIC reflects a relative decrease of portal venous blood flow quantity (Child-Pugh A,B,C),even presenting a gradual decrease with the degree of cirrhosis,and an increase of hepatic artery blood flow quantity in patients with hepatic cirrhosis (Child-Pugh B,C).AIF and PVIC were correlated to CTP grade,which can be an important reference in the evaluation of liver function reserve.
Liver cirrhosis; Tomography,X-ray computed; Liver function
518036 广东,北京大学深圳医院医学影像科
石桥(1977-),男,湖南邵东人,博士,副主任医师,主要从事腹部影像诊断工作。
成官迅,E-mail:18903015678@189.cn
深圳市科技计划项目(JYCJ20150403091443313)
R814.42; R575.2
A
1000-0313(2017)07-0734-05
10.13609/j.cnki.1000-0313.2017.07.016
2017-02-27)
