3-溴丙酮酸联合索拉菲尼对人肝癌细胞增殖和凋亡的影响
2017-08-07丁体龙郑海伦
王 云,倪 敏,汪 念,丁体龙,张 配,刘 浩,魏 伟,郑海伦,马 勇,*
(1安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,合肥 230032;2解放军第123医院药械科;3解放军第123医院肝病中心;4蚌埠医学院药学系,安徽省生化药物工程技术研究中心;5蚌埠医学院第一附属医院消化科;△共同第一作者;*通讯作者,E-mail:my4973966@163.com;#共同通讯作者,E-mail:alanhailun@163.com)
3-溴丙酮酸联合索拉菲尼对人肝癌细胞增殖和凋亡的影响
王 云1,2,倪 敏2△,汪 念2,丁体龙3,张 配4,刘 浩4,魏 伟1,郑海伦5#,马 勇1,3*
(1安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,合肥 230032;2解放军第123医院药械科;3解放军第123医院肝病中心;4蚌埠医学院药学系,安徽省生化药物工程技术研究中心;5蚌埠医学院第一附属医院消化科;△共同第一作者;*通讯作者,E-mail:my4973966@163.com;#共同通讯作者,E-mail:alanhailun@163.com)
目的 探讨3-溴丙酮酸(3-BrPA)联合索拉菲尼(SOR)对人肝癌细胞SMMC7721、HepG2增殖和凋亡的影响及其相关分子机制。 方法 首先采用MTT法检测不同浓度3-BrPA(20,40,80,160,320 μmol/L)、索拉菲尼(2,4,8,16,32 μmol/L)以及100 μmol/L 3-BrPA与索拉菲尼(2,4,8,16,32 μmol/L)联合对肝癌细胞SMMC7721、HepG2作用24 h的增殖抑制作用。之后将肝癌细胞分为对照组、3-BrPA组、SOR组、3-BrPA+SOR组,PI单染流式细胞术检测肝癌细胞SMMC7721、HepG2凋亡;DAPI染色检测SMMC7721、HepG2细胞核的变化;Western blot检测SMMC7721、HepG2细胞Bcl-2和Bax蛋白表达。 结果 3-BrPA、索拉菲尼以及两药联合作用于SMMC7721、HepG2细胞24 h细胞存活率随浓度增高而降低(P<0.05)。100 μmol/L 3-BrPA与索拉菲尼联合作用于SMMC7721、HepG2细胞24 h的存活率显著高于同浓度的索拉菲尼单独处理(P<0.05)。100 μmol/L 3-BrPA与16 μmol/L索拉菲尼联合诱导肝癌细胞SMMC7721、HepG2的凋亡率为(47.4±5.02)%、(46.2±4.14)%,显著高于对照组和单独用药组(P<0.05)。DAPI染色结果显示3-BrPA+SOR组细胞表现为细胞核皱缩浓集,呈现亮蓝色荧光,或细胞核呈分叶、碎片状,且明显多于单独用药组;Western blot结果显示3-BrPA+SOR组明显下调SMMC7721细胞Bcl-2的表达(P<0.05),但对促凋亡蛋白Bax的表达无明显影响。 结论 3-BrPA能增强索拉菲尼对肝癌细胞SMMC7721、HepG2的增殖抑制作用,且能增强索拉菲尼诱导肝癌细胞的凋亡,其机制可能与下调抑制凋亡蛋白Bcl-2的表达有关。
肝癌; 3-溴丙酮酸; 细胞凋亡; 索拉菲尼; Bcl-2; Bax
肝癌是十分常见的恶性肿瘤,恶性程度高,易侵袭转移。手术治疗是肝癌的主要手段,但因发现时多处于中晚期,多出现远处转移或肝内转移,丧失手术机会。因此,非手术治疗在肝癌的治疗中占有重要地位。索拉非尼(SOR)是多激酶抑制剂,是被证实能显著延长晚期肝癌患者总生存期的药物,也是被FDA批准用于晚期肝癌系统化疗的药物[1]。索拉菲尼存在患者耐药现象,成为其在临床应用中的一大障碍[2-5]。因此,研究其耐药机制,提高肿瘤细胞对索拉菲尼的敏感性十分重要[6]。糖酵解抑制剂3-溴丙酮酸(3-BrPA)能选择性杀伤肿瘤细胞,而对重要脏器功能无明显影响,且能杀死对常见化疗药物不敏感的肿瘤细胞,有望成为理想的抗肿瘤新药[7-9]。本研究探讨3-BrPA联合索拉非尼对肝癌细胞增殖和凋亡的影响,并初步探讨其作用机制,以期为肝癌的治疗提供新的思路和方案。
1 材料与方法
1.1 主要试剂及仪器
胎牛血清、DMEM培养基与糜蛋白酶购自美国Gibco公司;索拉菲尼购自美国Selleck公司;MTT购自碧云天公司;3-BrPA、PI购自美国Sigma公司;二甲基亚砜(DMSO)购自美国Amresco公司;山羊抗兔IgG、山羊抗鼠IgG与β-actin购自合肥BioSharp公司;ECL发光试剂盒购自美国Millipore公司;Bcl-2与Bax购自英国Abcam公司。
CO2培养箱(Themo公司,美国);IX73倒置荧光显微镜(Olympus公司,日本);BioTek酶标仪(SynergyHT公司,美国);AccuriC6流式细胞仪(Becton Dicknson公司,美国);ChemDocXRS凝胶成像系统(Bio-Rad公司,美国)。
1.2 细胞株及细胞培养
肝癌细胞株SMMC7721、HepG2由中山大学惠赠,蚌埠医学院生化药理实验室保存。SMMC7721、HepG2细胞使用含有10%的胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的DMEM高糖培养基,37 ℃、5%CO2细胞培养箱中培养,24 h观察细胞生长情况,贴壁后更换培养液。2-3 d待细胞长满培养瓶底即可传代。传代时先用PBS漂洗细胞2次,加入0.25%胰蛋白酶消化,待细胞变圆后终止消化,收集细胞悬液于离心管中。900 r/min离心4 min,弃上清后用培养液重悬传代培养。
1.3 MTT法检测肝癌细胞存活率
将肝癌细胞接种于96孔板,7×103个/孔,培养24 h弃去培养液,加入不同浓度的3-BrPA(20,40,80,16,320 μmol/L),索拉菲尼(2,4,8,16,32 μmol/L)以及用100 μmol/L 3-BrPA预处理2 h联合索拉菲尼(2,4,8,16,32 μmol/L),设阴性对照组和空白对照组,每个浓度5个复孔,继续培养24 h,加入15 μl的MTT溶液(5 mg/ml)孵育4 h。结束后吸弃培养液,每孔加入150 μl DMSO,37 ℃放置20 min。振荡5 min用酶标仪在570 nm处测吸光度(A),计算细胞存活率:存活率(%)=(药物组A值-空白组A值)/(对照组A值-空白组A值)×100%。以上实验重复3次。
1.4 PI单染流式细胞术检测肝癌细胞凋亡
将肝癌细胞接种于12孔板,2×105个/孔,培养18-24 h待细胞覆盖板底70%弃去培养液,加入浓度为100 μmol/L 3-BrPA、16 μmol/L索拉菲尼以及用100 μmol/L 3-BrPA预处理2 h加入16 μmol/L索拉菲尼联合处理细胞,同时设对照组,继续培养24 h。结束后收集各组细胞,1 500 r/min离心10 min,弃上清,加入75%预冷乙醇固定,4 ℃存放过夜。检测前1 000 r/min离心10 min,弃上清,加入600 μl PI缓冲液重悬混匀,4 ℃避光放置2 h,用流式细胞仪检测细胞凋亡率。以上实验重复3次。
1.5 DAPI染色检测细胞核变化
将肝癌细胞接种于12孔板,2×105个/孔,培养24 h加入浓度为100 μmol/L 3-BrPA、16 μmol/L索拉菲尼以及用100 μmol/L 3-BrPA预处理2 h加入16 μmol/L索拉菲尼联合处理细胞,继续培养24 h吸除培养液,用PBS溶液洗涤细胞1次,每孔加入1.0 ml 4%多聚甲醛固定细胞5 min,PBS洗涤3次,每孔加入600 μl DAPI染色液避光反应15 min,通过荧光显微镜观察细胞核形态学变化。
1.6 Western blot检测凋亡相关蛋白表达
将肝癌细胞接种于6孔板,5×105个/孔,培养24 h加入浓度为100 μmol/L的3-BrPA、16 μmol/L的索拉菲尼以及用100 μmol/L3-BrPA预处理2 h加入16 μmol/L索拉菲尼联合处理细胞,继续培养24 h收集各组细胞,2 500 r/min离心10 min,弃上清,加入适量细胞裂解液,冰上裂解30 min,提取细胞总蛋白。BCA蛋白浓度测定试剂盒检测蛋白浓度。用细胞裂解液稀释各组蛋白至等浓度,每组取50 μg蛋白样品,10% SDS-PAGE凝胶电泳分离蛋白,转膜至PVDF膜,5%脱脂牛奶封闭4 h,用TPBS洗涤后加入一抗室温孵育2 h,TPBS洗膜后二抗孵育2 h。ECL发光试剂盒显影后获取条带,实验重复3次。
1.7 统计学分析

2 结果
2.1 3-BrPA增强索拉菲尼对人肝癌细胞SMMC7721、HepG2的增殖抑制作用
不同浓度的3-BrPA(20,40,80,16,320 μmol/L)、索拉菲尼(2,4,8,16,32 μmol/L)以及两药联合使用作用于SMMC7721、HepG2细胞24 h细胞存活率随浓度增高而降低(P<0.05,见图1)。100 μmol/L 3-BrPA与索拉菲尼(2,4,8,16,32 μmol/L)联合作用于SMMC7721、HepG2细胞24 h的存活率明显低于索拉菲尼组(P<0.05,见图1C)。

与对照组(0μmol/L)比较,*P<0.05;与图1B中同浓度SOR比较,#P<0.05图1 3-BrPA、索拉菲尼及两药联合对HepG2和SMMC7721细胞存活率的变化Figure1 ChangesoftheviabilityofHepG2andSMMC7721cellsaftertreatedwith3-BrPA,sorafenib,ortheircombinedtreatment
2.2 3-BrPA增强索拉菲尼诱导人肝癌细胞的凋亡
100 μmol/L 3-BrPA、16 μmol/L索拉菲尼以及两药联合能明显诱导肝癌细胞SMMC7721、HepG2的凋亡(见图2),100 μmol/L 3-BrPA诱导肝癌细胞SMMC7721、HepG2的凋亡率分别为(13.1±3.03)%、(15.3±2.66)%, 16 μmol/L索拉菲尼诱导肝癌细胞SMMC7721、HepG2的凋亡率分别为(10.1±3.04)%、(11.8±3.89)%,与对照组比较差异有统计学意义(P<0.05)。两药联合联合诱导肝癌细胞SMMC7721、HepG2的凋亡率分别为(47.4±5.02)%、(46.2±4.14)%,显著高于对照组和单独用药组(P<0.05,见图3)。
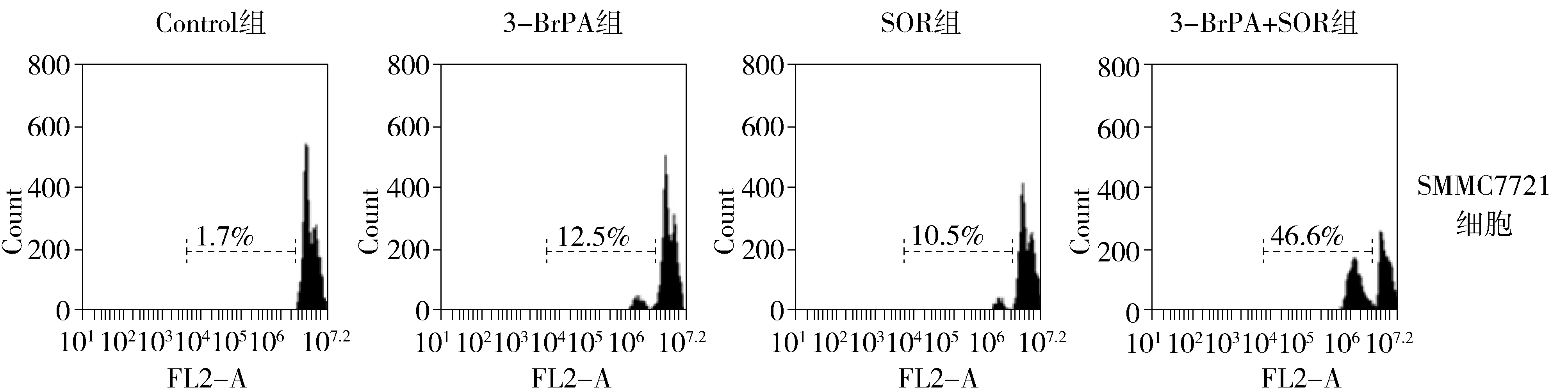

图2 3-BrPA,索拉菲尼及两者联用对肝癌细胞凋亡影响的PI单染结果Figure 2 PI staining results of effect of 3-BrPA,sorafenib and their combination on apoptosis of SMMC 7721 and HepG2
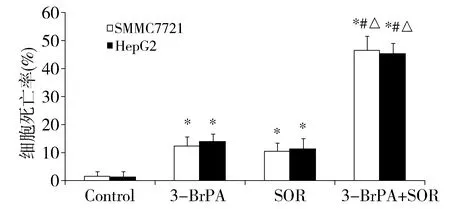
与对照组比较,*P<0.05;与3-BrPA组比较,#P< 0.05;与SOR组比较,△P<0.05图3 3-BrPA与索拉菲尼以及两者联用时SMMC7721和HepG2细胞的凋亡率变化Figure 3 Changes of the cell apoptosis rate of HepG2 and SMMC7721 cells after treated with 3-BrPA,sorafenib or their combination
将100 μmol/L 3-BrPA,16 μmol/L索拉菲尼,以及100 μmol/L 3-BrPA联合16 μmol/L索拉菲尼处理SMMC7721、HepG2细胞24 h,DAPI染色后荧光显微镜观察细胞核的变化。结果显示:联合组细胞核皱缩浓集,呈现亮蓝色荧光,细胞核呈分叶、碎片状,且明显多于单独用药组(见图4)。2.3 3-BrPA对索拉菲尼诱导的人肝癌细胞SMMC7721和HepG2相关蛋白表达的影响
人肝癌细胞SMMC7721、HepG2给予不同的刺激后收集蛋白,Western blot检测Bcl-2和Bax蛋白表达,结果显示联合用药组Bcl-2的表达降低(见图5A),联合用药组SMMC7721细胞Bcl-2的相对表达量为0.43±0.05,低于对照组和单独用药组(P<0.05),而联合用药组对HepG2细胞Bcl-2的表达影响不明显(见图5B)。同时,3-BrPA与索拉菲尼对Bax的表达无明显影响(见图5C)。
3 讨论
索拉菲尼是治疗晚期肝癌的一线药物,能显著改善晚期肝癌患者的生存期[1]。索拉菲尼主要从两个途径发挥抗肿瘤作用,一是索拉菲尼可以通过抑制血管生成相关的受体,如血小板衍生生长因子受体(PDGFR)和血管内皮生长因子受体(VEGFR)等,抑制肿瘤血管的生成,发挥间接抗肿瘤作用。二是索拉菲尼可以通过抑制RAF/MEK/ERK信号通路,诱导肿瘤细胞发生凋亡,发挥直接抗肿瘤作用[10]。然而,单独使用索拉菲尼患者易发生耐药现象[11],肝癌细胞的糖酵解水平是其对索拉菲尼耐药的潜在标志[12],如果抑制糖酵解,可以抑制肝癌细胞的增殖和转移并诱导其凋亡[13]。3-BrPA与丙酮酸化学结构类似,抑制己糖激酶活性,从而抑制肿瘤细胞的糖酵解,降低ATP的生成从而导致肿瘤细胞凋亡。研究发现,3-BrPA对肝癌、乳腺癌、胰腺癌等具有良好的抗肿瘤作用,且能杀伤对常见化疗药物不敏感的肿瘤细胞,以及增强耐药细胞对化疗药物的敏感性[14]。本实验根据MTT结果,绘制3-BrPA的剂量-效应曲线,选择低于半数抑制浓度(IC50)的100 μmol/L 3-BrPA联合索拉菲尼作用于肝癌细胞SMMC7721、HepG2后,明显增强索拉菲尼对肝癌细胞的抑制作用,并随着药物剂量的增大,索拉菲尼对肝癌细胞的增殖抑制作用明显增强。

图4 DAPI染色检测3-BrPA与索拉菲尼以及两者联合使用对SMMC7721和HepG2细胞核的影响Figure 4 Changes of HepG2 and SMMC7721 cell nuclei after treated with 3-BrPA,sorafenib and their combination by DAPI staining
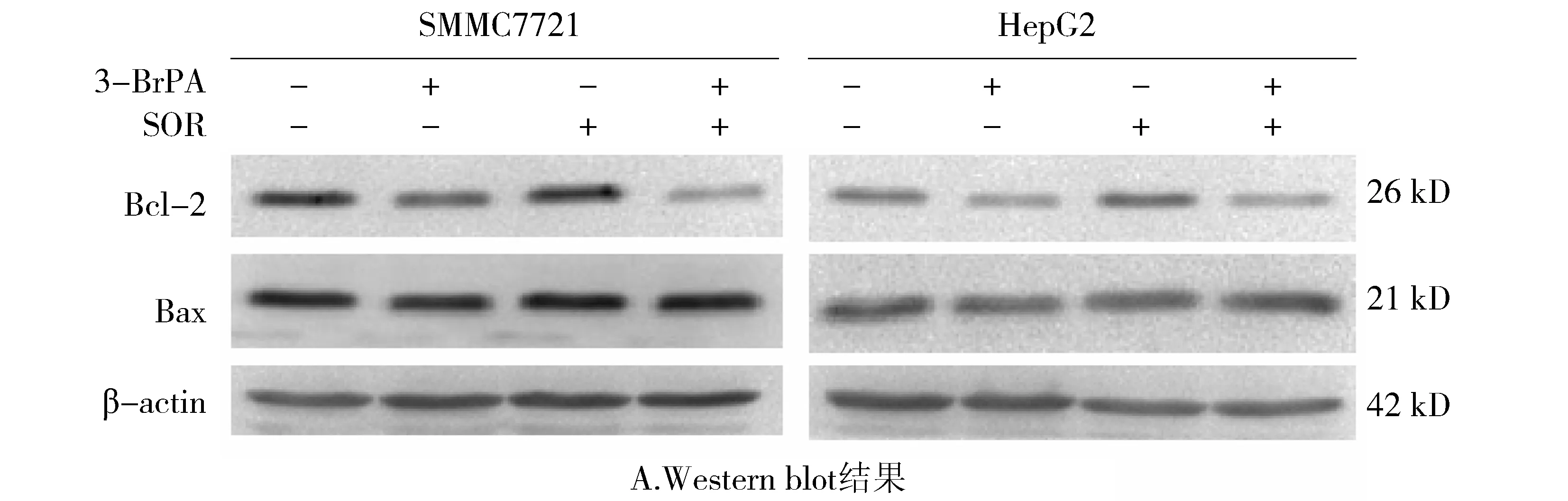
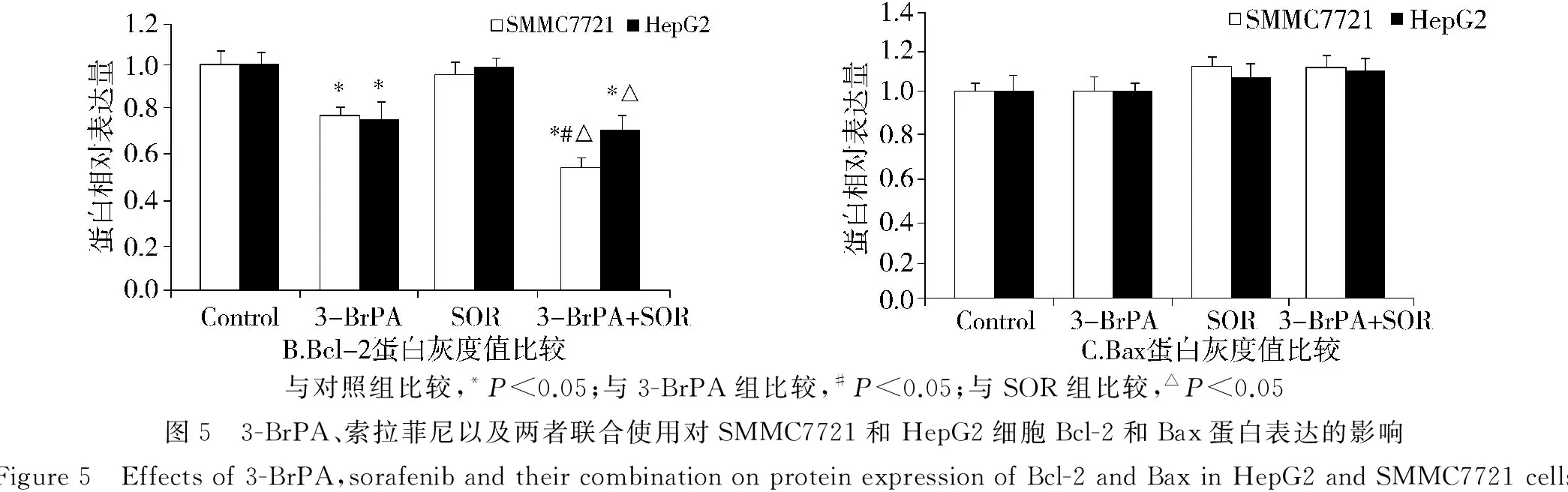
与对照组比较,*P<0.05;与3-BrPA组比较,#P<0.05;与SOR组比较,△P<0.05图5 3-BrPA、索拉菲尼以及两者联合使用对SMMC7721和HepG2细胞Bcl-2和Bax蛋白表达的影响Figure5 Effectsof3-BrPA,sorafenibandtheircombinationonproteinexpressionofBcl-2andBaxinHepG2andSMMC7721cells
细胞凋亡是一个主动死亡过程,其中涉及基因的激活、表达、调控等一系列的细胞生命活动。细胞凋亡可以被多种内在或外在的刺激诱发,是细胞对刺激的应答反应。大部分的抗肿瘤药物也是通过诱导凋亡发挥抗肿瘤作用。细胞发生凋亡时形态学改变表现为胞质浓缩、核染色质凝缩、细胞膜内陷和凋亡小体形成。为了进一步证实实验结果,本课题根据MTT的结果,选择了100 μmol/L 3-BrPA和16 μmol/L索拉菲尼联用,通过流式单染和DAPI染色检测肝癌细胞的凋亡情况,结果显示联合用药组细胞凋亡明显增加,凋亡率明显高于单用3-BrPA或索拉菲尼组,且联合用药组细胞数量明显减少,细胞核分叶、碎片明显增多,核缩浓呈亮蓝色荧光,细胞凋亡明显。
Bcl-2家族蛋白调控细胞凋亡,其成员具有双重功能,其中Bcl-2、Mcl-1、Bcl-XL等蛋白抗凋亡,而Bax、Bak、Bad等蛋白具有促凋亡作用。Bcl-2蛋白定位表达于线粒体膜上,是目前发现的抗凋亡作用很强的蛋白之一。它在细胞凋亡调控机制中处于终末部分,对肿瘤的发生、发展和抗肿瘤治疗具有重要意义[15]。Bcl-2抗凋亡的机制是Bcl-2能够增强线粒体膜电位,抑制线粒体钙离子的释放,使核酸内切酶无法活化,从而抑制肿瘤细胞凋亡。Bax在细胞中广泛存在,当细胞受到外界刺激引发凋亡时,Bax与线粒体膜结合,两个Bax蛋白相互聚合形成同源二聚体,促进细胞凋亡。如果Bcl-2表达增强,细胞中Bcl-2蛋白增多,Bcl-2与Bax形成异源二聚体,比同源二聚体更稳定,抑制Bax的凋亡作用[16]。因此,Bcl-2/Bax比值最终决定了细胞的存亡。为了研究3-BrPA增强索拉菲尼诱导细胞凋亡的可能机制,通过Western blot检测Bcl-2和Bax蛋白的表达,发现3-BrPA与索拉菲尼联合时,Bax蛋白表达有上调趋势,但趋势不明显。在SMMC7721细胞中凋亡抑制蛋白Bcl-2的表达被明显下调,但在HepG2细胞中Bcl-2的下调不明显。
本研究证明了3-BrPA具有增强索拉菲尼对肝癌细胞SMMC7721、HepG2的增殖抑制作用,且能增强索拉菲尼诱导的凋亡,其机制可能是通过下调抑制凋亡蛋白Bcl-2的表达来发挥作用。具体的分子机制以及在动物模型中联合应用的效果还有待进一步的研究。该研究结果将为临床应用索拉菲尼治疗晚期肝癌提供新的思路和策略。
[1] Kirstein MM,Schweitzer N,Schmidt S,etal.Long-lasting tumour response to sorafenib therapy in advanced hepatocellular carcinoma[J].Acta Gastroenterol Belg,2014,77(4):386-388.
[2] Gao DY,Lin TST,Sung YC,etal.CXCR4-targeted lipid-coated PLGA nanoparticles deliver sorafenib and overcome acquired drug resistance in liver cancer[J].Biomaterials,2015,67:194-203.
[3] van Malenstein H,Dekervel J,Verslype C,etal.Long-term exposure to sorafenib of liver cancer cells induces resistance with epithelial-to-mesenchymal transition,increased invasion and risk of rebound growth[J].Cancer lett,2013,329(1):74-83.
[4] Hutchinson L.Liver cancer:sorafenib resistance uncovered by novel RNAi screen[J].Nat Rev Clin Oncol,2014,11(11):622.
[5] Rudalska R,Dauch D,Longerich T,etal.InvivoRNAi screening identifies a mechanism of sorafenib resistance in liver cancer[J].Nat Med,2014,20(10):1138-1146.
[6] Simons AL,Mattson DM,Dornfeld K,etal.Glucose deprivation-induced metabolic oxidative stress and cancer therapy[J].J Cancer Res Ther,2009,5(Suppl 1):S2-6.
[7] Icard P,Zhang XD,Lemoisson E,etal.Experimental results using 3-bromopyruvate in mesothelioma:invitroandinvivostudies[J].J Bioenerg Biomembr,2012,44(1):81-90.
[8] Chapiro J,Sur S,Savic LJ,etal.Systemic delivery of microencapsulated 3-bromopyruvate for the therapy of pancreatic cancer[J].Clin Cancer Res,2014,20(24):6406-6417.
[9] Xian SL,Cao W,Zhang XDetal.3-Bromopyruvate inhibits human gastric cancer tumor growth in nude mice via the inhibition of glycolysis[J].Oncol lett,2015,9(2):739-744.
[10] Lin YT,Lu HP,Chao CC.Oncogenic c-Myc and prothymosin-alpha protect hepatocellular carcinoma cells against sorafenib-induced apoptosis[J].Biochem Pharmacol,2015,93(1):110-124.
[11] Fischer TD,Wang JH,Vlada A,etal.Role of autophagy in diffe-rential sensitivity of hepatocarcinoma cells to sorafenib[J].World J Hepatol,2014,6(10):752-758.
[12] Shen YC,Ou DL,Hsu C,etal.Activating oxidative phosphorylation by a pyruvate dehydrogenase kinase inhibitor overcomes sorafenib resistance of hepatocellular carcinoma[J].Br J Cancer,2013,108(1):72-81.
[13] Dai W,Wang F,Lu J,etal.By reducing hexokinase 2,resveratrol induces apoptosis in HCC cells addicted to aerobic glycolysis and inhibits tumor growth in mice[J].Oncotarget,2015,6(15):13703-13717.
[14] Sun Y,Liu Z,Zou X,etal.Mechanisms underlying 3-bromopyruvate-induced cell death in colon cancer[J].J Bioenerg Biomembr,2015,47(4):319-329.
[15] Shore GC,Viallet J.Modulating the bcl-2 family of apoptosis suppressors for potential therapeutic benefit in cancer[J].Hematology Am Soc Hematol Educ Program,2005:226-230.
[16] Zhang N,Ye F,Zhu W,etal.Cardiac ankyrin repeat protein attenuates cardiomyocyte apoptosis by upregulation of Bcl-2 expression[J].Biochim Biophys Acta,2016,1863(12):3040-3049.
Effects of 3-bromopyruvate combined with sorafenib on proliferation and apoptosis of human hepatic carcinoma cellsinvitro
WANG Yun1,2,NI Min2△,WANG Nian2,DING Tilong3,ZHANG Pei4,LIU Hao4,WEI Wei1,ZHENG Hailun5#,MA Yong1,3*
(1InstituteofClinicalPharmacology,AnhuiMedicalUniversity,KeyLaboratoryofAntiinflammatoryandImmunopharmacologyofEducationMinistry,Hefei230032,China;2DepartmentofPharmacy,123thHospitalofPLA;3DepartmentofLiverDiseases,123thHospitalofPLA;4FacultyofPharmacy,BengbuMedicalCollege,AnhuiEngineeringTechnologyResearchCenterofBiochemicalPharmaceuticals;5DepartmentofGastroenterology,FirstAffiliatedHospitalofBengbuMedicalCollege;△Co-firstauthor;*Correspondingauthor,E-mail:my4973966@163.com;#Co-correspondingauthor,E-mail:alanhailun@163.com)
ObjectiveTo investigate the effects of 3-bromopyruvate(3-BrPA)combined with sorafenib(SOR)on the proliferation and apoptosis of human hepatic carcinoma cellsinvitroand its related molecular mechanism.MethodsMTT assay was used to detect the viability of hepatic carcinoma HepG2 and SMMC7721 cells after exposed to different concentrations of 3-BrPA(20,40,80,160,320 μmol/L),SOR(2,4,8,16,32 μmol/L),and 100 μmol/L 3-BrPA combined with SOR(2,4,8,16,32 μmol/L).Then the experiment was divided into four groups:control group,3-BrPA group,SOR group,and 3-BrPA+SOR group.The apoptosis rate of cells was assessed using flow cytometry with PI staining,DAPI staining was performed to demonstrate the cell nucleus changes,and the expression of Bcl-2 and Bax was analyzed using Western blot.ResultsThe cell viability of HepG2 and SMMC7721 cells decreased in a concentration-dependent manner after treated with 3-BrPA,SOR,and 100 μmol/L 3-BrPA combined with SOR,respectively(P<0.05).The survival rates of HepG2 and SMMC7721 cells after treated with 100 μmol/L 3-BrPA combined with SOR for 24 h were lower than that of the single dose of SOR(P<0.05).The apoptotic rate was (47.4±5.02)% in SMMC7721 cells and (46.2±4.14)% in HepG2 cells after combined treatment for 24 h,which were also significantly higher than that of cells treated with 3-BrPA or SOR(P<0.05).DAPI staining showed that HepG2 and SMMC7721 cell nucleus became significantly condensed and fragmented in 3-BrPA+SOR group.Bcl-2 protein in SMMC7721 cells was down-regulated clearly in 3-BrPA+SOR group(P<0.05).Conclusion3-BrPA can inhibit the proliferation of HepG2 and SMMC7721 cells and enhance sorafenib-induced cell death,which may be caused by down-regulating Bcl-2.
hepatic carcinoma; 3-bromopyruvate; apoptosis; sorafenib; Bcl-2; Bax
安徽省高等学校自然科学研究项目(KJ2015A177)
王云,男,1984-09生,硕士,E-mail:214903722@qq.com 倪敏,女,1984-03生,学士,E-mail:pfczhou@163.com
2016-11-17
R735.7
A
1007-6611(2017)04-0310-06
10.13753/j.issn.1007-6611.2017.04.003
