木麻黄青枯病抗性鉴定方法比较及抗病种质筛选
2017-08-07许秀玉张卫强黄钰辉甘先华仲崇禄张华新
许秀玉, 张卫强, 黄钰辉, 甘先华, 仲崇禄, 张华新
(1 中国林业科学研究院 国家林业局盐碱地研究中心, 北京 100091; 2 广东省森林培育与保护利用重点实验室/广东省林业科学研究院,广东 广州 510520; 3 中国林业科学研究院 热带林业研究所, 广东 广州 510520)
木麻黄青枯病抗性鉴定方法比较及抗病种质筛选
许秀玉1,2, 张卫强2, 黄钰辉2, 甘先华2, 仲崇禄3, 张华新1
(1 中国林业科学研究院 国家林业局盐碱地研究中心, 北京 100091; 2 广东省森林培育与保护利用重点实验室/广东省林业科学研究院,广东 广州 510520; 3 中国林业科学研究院 热带林业研究所, 广东 广州 510520)
【目的】筛选出简便、准确、可靠的木麻黄(Casuarinaceae)青枯病抗性鉴定方法,对我国现有的木麻黄种质资源开展抗病性鉴定与评价,筛选出优良抗病无性系。【方法】在木麻黄抗病品系筛选技术基础上,参考番茄Lycopersiconesculentum、烟草Nicotiana及桉树Eucalyptus等植物青枯病抗性鉴定方法,设计8种木麻黄青枯菌人工接种方法,系统探讨水培生根苗、嫩枝、绿梗小枝、褐梗小枝、青枯菌粗毒素及盆栽小苗伤根接种、盆栽小苗无伤接种等接种方法对木麻黄青枯病抗性鉴定的影响。【结果】不同无性系利用盆栽幼苗伤根接种法接种后的死亡率介于25.79%~83.06%,无性系K18、A14与G1、30差异极显著(P<0.05);不同无性系用褐梗小枝室内水培接种的病情指数介于2.16~69.48,无性系K18、A14与G1、30差异极显著(P<0.05)。这2种接种方法能够有效区分木麻黄抗、感无性系,且呈极显著正相关(r=0.856 5)。不同无性系在盆栽幼苗不伤根接种及水培生根小苗、嫩枝室内水培接种中抗病性差异不显著(P>0.05),不能有效区分抗、感无性系。绿梗小枝接种后症状变化小,不易分级,容易出现观测误差;青枯菌粗毒素接种存在浓度难以控制等问题。利用褐梗小枝室内水培接种法,对53份木麻黄育种材料进行抗性评价,筛选出X1、30、杂交、G1等12份高抗材料。【结论】盆栽幼苗伤根接种及褐梗小枝室内水培接种方法是木麻黄青枯病抗性鉴定的较好方法,文中其他接种方法不是木麻黄青枯病抗性鉴定的优选方法。
木麻黄; 青枯病; 抗病性; 鉴定方法; 种质资源
植物细菌性青枯病为青枯劳尔氏菌Ralstoniasolanacearum引起的毁灭性土传病害,是世界范围内传播广泛、危害严重、最难防治的细菌性重大病害之一[1],可危害54科的450余种植物[2]。木麻黄科Casuarinaceae植物原产澳大利亚和太平洋岛屿,包括4属96种,木麻黄是该科植物的统称。由于具有抗风、抗旱、耐盐碱、速生的特点,木麻黄被广泛用于防风固沙、盐碱地改良和干旱区造林,已成为广东省沿海防护林主栽树种。长期以来,随着少量无性系大面积造林,使得木麻黄防护林带退化,遗传多样性降低,林木生长衰退,木麻黄青枯病迅速扩展蔓延。近几年广东省大面积伐除感病沿海防护林带,但却没有其他树种可替代种植,严重影响该地区生态安全与国土安全。木麻黄青枯病的防治目前仍是一大难题,对已有木麻黄种质资源进行抗性评价并选育出抗病无性系是最经济有效的途径。抗病性鉴定是抗病育种的基础,而抗性鉴定方法又是此项工作的关键。
国内外对木麻黄青枯病的研究较少,相关研究工作主要集中在20世纪末,如接种方法及接种条件的研究[3-4]、木麻黄不同树种或种源的青枯病抗病能力评价[5-7]和抗病优良品系的筛选[3,8-10]等,选育出了A8、A13、501等一些抗病无性系。但由于青枯菌能与植物、环境相互作用,协同进化产生变异[11],原来选育出的抗病无性系随着时间推移其抗病性大大降低。本研究在郭权等[3]、王军[4]、梁子超等[12]及陈炳铨等[13]木麻黄抗病品系筛选技术基础上,参考番茄Lycopersiconesculentum、烟草Nicotiana、广藿香Pogostemoncablin及桉树Eucalyptus等植物青枯病抗性鉴定方法[14-18],设计了8种木麻黄青枯菌人工接种方法,系统探讨和评价不同接种方法对木麻黄青枯病抗性鉴定的影响,筛选出盆栽幼苗伤根接种及褐梗小枝室内接种等准确、可靠的抗性鉴定方法,并对我国现有的木麻黄种质资源开展青枯病抗病性鉴定,选育出优良抗病无性系。这为现有防护林体系的树种替换提供了有潜力的种植材料,对有效控制我国木麻黄青枯病、提高木麻黄防护林的质量及促进木麻黄抗病育种均有重要意义。
1 材料与方法
1.1 试验材料
利用广东省林业科学研究院分离鉴定出的木麻黄强致病性青枯菌株Rs-M、Rs-GL-2和Rs-H为供试菌株。选择抗性不同的木麻黄无性系A14、K18、G1及30作为抗性鉴定方法研究的试验材料,对广东、福建、海南根据不同的育种目的选育出来的53个木麻黄优良无性系进行抗性评价。试验苗木由广东省林业科学院中心苗圃提供。
1.2 菌液的制备
参考刘勇等[14]方法,供试菌株在TTC培养基(2,2,3-三苯基四唑氯琼脂培养基)上活化培养48 h后,挑选单菌落接种到CPG液体培养基(蛋白胨10 g·L-1,水解酪蛋白1 g·L-1,葡萄糖5 g·L-1)中,30 ℃条件下摇床培养28~36 h。培养液于5 000 r·min-1离心15 min,收集菌体,用无菌水配制成 3×108cfu·mL-1(平板计数法)菌悬液用于室内水培接种,配制成2.7×109cfu·mL-1(平板计数法)菌悬液用于盆栽接种。
1.3 抗性鉴定方法
1.3.1 盆栽接种及病情调查 设计2种盆栽接种方法。幼苗伤根接种(M1):参考移栽浸根法[15],除去袋苗外层的塑料袋,抖落土壤,洗净根部,除去基部黄化叶片,剪去1/3根系,再浸入配制好的细菌悬浮液中,30~31 ℃条件下保湿浸根培养30 min,然后种植于装有草木灰与黄心土(体积比为1∶2)的塑料盆中。 幼苗不伤根接种(M2):于试验前1个月将试验小苗移栽到装有草木灰与黄心土(体积比为1∶2)的塑料盆中,移栽1个月待小苗完全恢复生长后进行淋根接种试验。
接种试验按随机完全区组设计,每个无性系种3盆,每盆种20~25株,以无菌水作阴性对照。接种后每天浇水保持盆内湿润,昼夜温度为30~35 ℃,相对湿度80%左右,每天观察记录植株发病情况,接菌后10 d进行病情调查。调查时以盆为单位进行,记录无病植株数与死亡植株数,计算死亡率:
死亡率=死亡植株数/总株数×100%。
1.3.2 室内水培接种及病情调查 采用恒温水培法[4],将试验材料浸入盛有200 mL青枯菌悬浮液的玻璃瓶内,置于人工气候箱中培养,培养温度30 ℃,相对湿度85%,光照时间13 h,光照强度为8 000 lx。设计4种不同类型接种材料:水培生根小苗接种(M3),即刚萌发出新根的幼嫩小苗接种,轻微损伤根尖;嫩枝接种(M4),即无分枝,高8~15 cm,基径1 mm左右的非木质化绿色幼嫩小枝接种;绿梗小枝接种(M5),即多分枝,基径2~3 mm的绿色半木质化小枝接种;褐梗小枝接种(M6):即多分枝,基径2~5 mm的褐色木质化小枝接种。
接种试验按随机完全区组设计,每个无性系接种3瓶,无菌水作对照。嫩枝及水培生根苗接种试验时,每瓶装20~25条7~10 cm长嫩枝或生根小苗。绿梗及褐梗小枝接种试验时,将生长一致的绿梗及褐梗小枝剪成长15~20 cm的茎段,每个茎段含有8~10个分枝,每瓶装3~4个茎段。每天观察记录植株发病情况,用第5天数据进行统计分析。
室内水培接种试验抗性水平的划分方法参考相对病害强度(RDI)[4]及Yamazaki[19]的分级标准,将侵染后的木麻黄小枝病情分为4个等级:0级,分枝无症状;1级,分枝萎蔫下垂,保持绿色;2级,分枝枯黄、萎蔫下垂;3级,小枝干枯死亡。计算病情指数(I):

1.3.3 青枯菌粗毒素接种及病情调查 采用过滤灭菌法及高温高压灭菌法制备青枯菌粗毒素[16,20]。过滤灭菌法(M7):供试菌株在CPG液体培养基中、30 ℃条件下摇床培养28~36 h后,在5 000 r·min-1条件下离心15 min,取上清液,经孔径0.22 μm的细菌过滤膜抽真空过滤。高温高压灭菌法(M8):供试菌株在CPG液体培养基中30 ℃条件下摇床培养28~36 h后,在121 ℃条件下高压灭菌25 min。
将得到的青枯菌粗毒素稀释5倍,用于室内水培接种木麻黄褐化小枝,设计4个无性系,每个无性系3次重复,无菌水作对照,病害强度分级标准及病情调查同1.3.2室内水培接种。
1.4 木麻黄种质资源抗性评价
根据以上试验结果,利用木麻黄最佳人工接种鉴定方法,设计3个菌株、53个无性系、3~5次重复的双因素交叉试验,以A13无性系接种无菌水为对照(CK),对我国现有木麻黄种质资源开展青枯病的抗性鉴定与评价,将53份参试材料分为高感(HS,病情指数70以上)、中感(MS,病情指数50~70)、中抗(MR,病情指数30~50)及高抗(HR,病情指数30以下)4个等级。
1.5 数据处理
试验数据用平均值±标准差(SD)表示,采用SAS V8.1统计软件对试验结果进行方差分析、相关分析及Duncan’s多重比较检验不同平均值间的差异等。
2 结果与分析
2.1 抗性鉴定方法的比较
2.1.1 不同方法的抗性鉴定结果 由表1可以看出,幼苗不伤根情况下进行盆栽接种引起的苗木死亡率较低(小于10%),不能很好地区分出4个供试的抗、感无性系,G1无性系中未发现死亡幼苗。幼苗伤根后进行盆栽接种可以很好地鉴定出4个供试无性系的抗性强弱,无性系K18、A14与G1、30死亡率差异极显著,接种10 d后木麻黄K18、A14无性系死亡率在80%以上,表现为感病;无性系G1、30死亡率分别为25.79%、33.77%,表现为抗病。
室内水培接种试验表明:以水培生根小苗及嫩枝进行人工接种,5 d后所有小枝或分枝均保持绿色,几乎不萎蔫,病情指数低于1,各无性系间无显著差异,不能区分出4个供试的抗感病无性系;以绿梗小枝进行人工接种,虽然无性系K18、A14与G1、30间病情指数差异显著,K18、A14表现为感病,G1、30表现为抗病,但病情指数较小(16.58~27.36),绿梗小枝上的分枝只表现出绿色萎蔫下垂及枯黄萎蔫下垂,极少出现干枯死亡的症状,不能明显反映材料的抗感病特性;以褐梗小枝进行人工接种,病情指数在无性系K18、A14与G1、30间差异极显著,K18、A14病情指数分别为69.48、51.87,表现为感病,G1、30病情指数为2.41、2.16,表现为抗病,随着发病进程,褐梗小枝上的分枝先后表现出绿色萎蔫下垂、枯黄萎蔫下垂及干枯3种不同形态。
青枯菌粗毒素接种试验表明,无论是用高温高压灭菌法还是过滤灭菌法获得的粗毒素都能让木麻黄褐梗小枝迅速表现青枯病典型症状,无性系K18、A14与G1、30间病情指数差异极显著,A14及K18感病无性系的病情指数达40以上,G1及30抗病无性系病情指数均低于10,从数据上看,青枯菌粗毒素2种制备方法对褐梗小枝的致病性无显著差异。
表1 木麻黄抗、感无性系在不同抗性鉴定方法下的鉴定结果1)
Tab.1 Resistance identification results for Casuarinaceae clones with various resistance degrees using different inoculation methods

无性系室外盆栽接种的死亡率/%室内水培接种的病情指数青枯菌粗毒素接种的病情指数M1M2M3M4M5M6M7M8A1481.29±13.55a4.01±3.04a0.89±0.22a0.96±0.13a26.69±7.88a51.87±26.27a53.76±8.67a40.28±11.6aK1883.06±16.86a5.70±3.10a0.81±0.34a0.89±0.22a27.36±12.55a69.48±14.55a60.50±23.53a59.48±14.55aG125.79±14.02b0.00±0.00b0.86±0.13a0.92±0.22a20.83±3.11b2.41±1.07b1.89±0.77b3.83±1.43b3033.77±12.32b6.57±4.51a0.74±0.26a0.82±0.13a16.58±1.23b2.16±2.02b1.33±1.34b4.05±2.73b
1)同列数据后凡是具有一个相同小写字母者,表示在0.05水平差异不显著(Duncan’s法)。M1:盆栽幼苗伤根接种;M2:盆栽幼苗不伤根接种;M3:水培生根小苗室内水培接种;M4:嫩枝室内水培接种;M5:绿梗小枝室内水培接种;M6:褐梗小枝室内水培接种;M7:高温高压灭菌法制备青枯菌粗毒素室内水培接种;M8:过滤灭菌法制备青枯菌粗毒素室内水培接种。
2.1.2 不同鉴定方法的相关性 相关分析表明(表2),不同鉴定方法之间既有正相关,也有负相关。盆栽幼苗不伤根接种、水培生根小苗室内水培接种及嫩枝室内水培接种与其他鉴定方法均相关性不显著,进一步说明这几种鉴定方法对木麻黄无性系抗性鉴定的参考意义不大。
盆栽幼苗伤根接种、绿梗小枝室内水培、褐梗小枝室内水培及青枯菌粗毒素接种等5种鉴定方法之间呈极显著正相关,除绿梗小枝室内接种方法外,其他4种鉴定方法间相关系数均大于0.800 0,其中盆栽幼苗伤根接种与褐梗小枝室内水培鉴定法相关系数达0.856 5,褐梗小枝室内水培鉴定法与高温高压灭菌法制备青枯菌粗毒素接种鉴定法相关系数为0.889 8,结合表1抗性鉴定结果表明,这几种鉴定方法对木麻黄青枯病抗性鉴定较为有效。
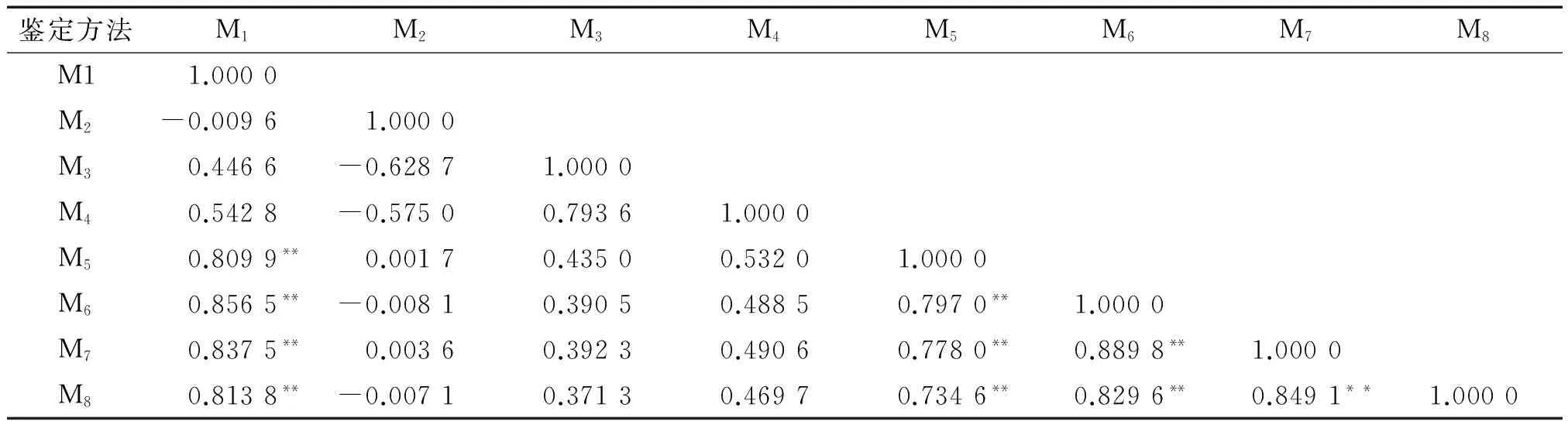
表2 不同抗性鉴定方法的相关分析1)Tab.2 Correlation analysis among different identification methods
1)**表示极显著相关(P<0.01),*表示显著相关(P<0.05);M1:盆栽幼苗伤根接种;M2:盆栽幼苗不伤根接种;M3:水培生根小苗室内水培接种;M4:嫩枝室内水培接种;M5:绿梗小枝室内水培接种;M6:褐梗小枝室内水培接种;M7:高温高压灭菌法制备青枯菌粗毒素室内水培接种;M8:过滤灭菌法制备青枯菌粗毒素室内水培接种。
2.1.3 不同抗性鉴定方法的优缺点 虽然盆栽幼苗伤根接种、绿梗小枝室内水培接种、褐梗小枝室内水培接种及青枯菌粗毒素接种等5种鉴定法都能有效地区分木麻黄抗、感无性系,且相关极显著,但这些鉴定方法都有各自的优缺点(表3)。
盆栽接种鉴定法可以模拟自然状态下青枯菌由植物根部表皮细胞、皮层细胞、中柱鞘细胞侵入植物维管束组织的过程,能够最真实地反映植物材料的抗性水平,但是这种鉴定方法需要较多的参试材料(每处理75~100株),且要求苗龄一致,生长状态一致。盆栽幼苗伤根接种法还需要剪根、浸泡及种植等过程,操作较复杂;盆栽幼苗不伤根鉴定法接种死亡率大大降低,难以较好地区分抗、感无性系。
室内水培接种鉴定法简便易行,操作简单、无需大型仪器设备,所需植物材料少、发病进程短,但要想获得可靠的鉴定结论,避免枝条自然干枯,试验过程要保持环境湿度85%以上,温度28 ℃以上。此外,室内水培接种鉴定法对茎段的选择要求严格。水培生根小苗及嫩枝对青枯菌抗性强,接种5 d后病情指数低于1,不能区分抗、感材料;绿梗小枝水培接种5 d后病情指数有所上升,但分枝只表现出萎蔫下垂及发黄的症状,且症状变化小,不易分级,容易出现观测误差,影响鉴定结果;褐梗小枝水培接种法的病程短,5 d后即可进行观测,分枝可明显地分为正常、萎蔫下垂、枯黄萎蔫下垂及干枯几个等级,能有效区分抗、感无性系。
青枯菌粗毒素接种法与褐梗小枝室内接种法呈极显著正相关,相关系数大于0.88,但是利用高温高压灭菌法制备青枯菌粗毒素时,对粗毒素的浓度难以准确控制;利用过滤灭菌法难以一次性将青枯菌完全过滤干净,得到的粗毒素通常放置12~24 h后又长出青枯菌,需要反复多次过滤并设置空白对照,因此利用青枯菌粗毒素接种不是木麻黄青枯病抗病鉴定的优选方法。
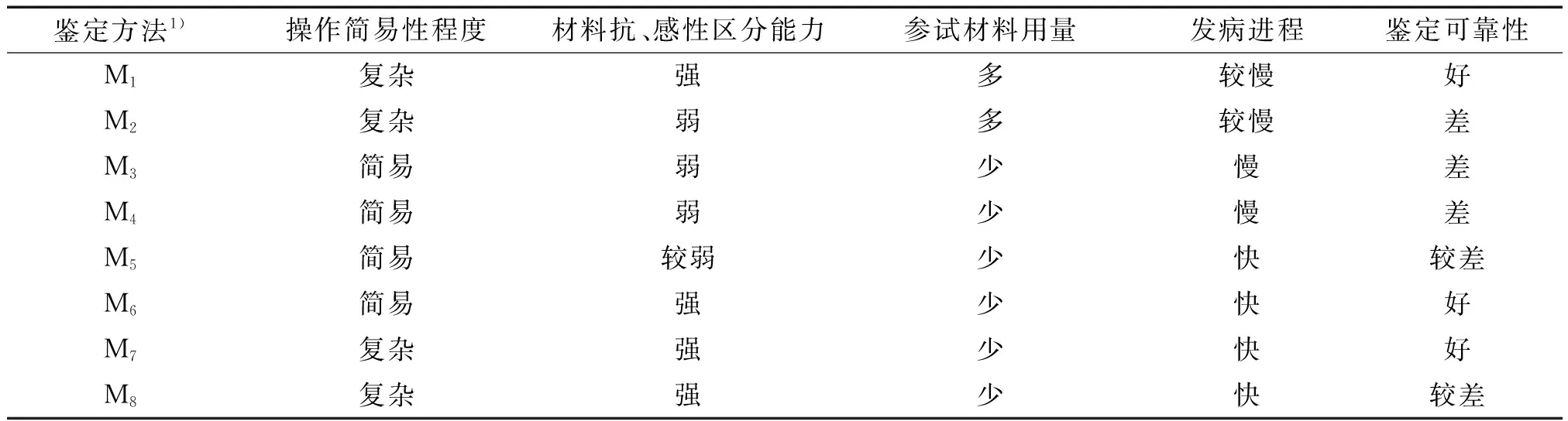
表3 不同抗性鉴定方法的比较Tab.3 Comparison of different identification methods
1)M1:盆栽幼苗伤根接种;M2:盆栽幼苗不伤根接种;M3:水培生根小苗室内水培接种;M4:嫩枝室内水培接种;M5:绿梗小枝室内水培接种;M6:褐梗小枝室内水培接种;M7:高温高压灭菌法制备青枯菌粗毒素室内水培接种;M8:过滤灭菌法制备青枯菌粗毒素室内水培接种。
综上所述,盆栽幼苗伤根接种及褐梗小枝室内接种是木麻黄青枯病抗性鉴定的最佳方法,这2种方法能够有效区分木麻黄抗、感无性系,可靠性好,鉴定结果极显著正相关,相关系数为0.856 5。盆栽幼苗不伤根接种及水培生根小苗、嫩枝室内接种不适宜作为木麻黄青枯病抗性鉴定方法,绿梗小枝室内接种与青枯菌粗毒素接种也不是优选方法。
2.2 木麻黄种质资源抗性评价
根据上述研究成果,选用Rs-M、Rs-GL-2、Rs-H菌株,利用褐梗小枝室内接种法对53份木麻黄育种材料进行抗病性差异的比较。结果(表4)显示:53个木麻黄参试无性系病情指数具有极显著差异,菌株、无性系以及菌株与无性系的交互作用都对木麻黄植株发病程度具有极显著的影响(P<0.01)。53个参试无性系病情指数在0 ~ 100之间(表5),12、抗风、83、59、65、K18及A14无性系在Rs-GL-2菌株中病情指数达100,接种5 d后几乎所有小枝黄化、干枯死亡; X1、45、平5、W6、501及41无性系在Rs-H菌株中病情指数小于10;X1、45、30、杂交、501、G1、503无性系在Rs-M菌株中病情指数为0,无发病症状,生长状况良好,小枝保持浓绿色,挺立生长,不萎蔫、不下垂。
表4 木麻黄无性系病情指数方差分析1)
Tab.4 Variance analysis of disease indexes for Casuarinaceae clones
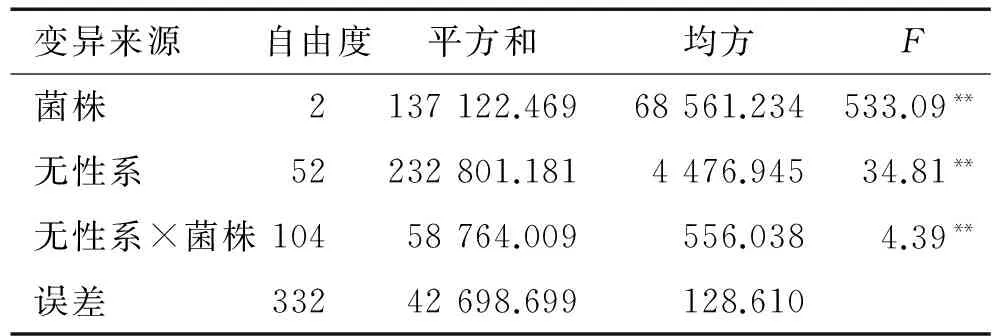
变异来源自由度平方和均方F菌株2137122.46968561.234533.09**无性系52232801.1814476.94534.81**无性系×菌株10458764.009556.0384.39**误差33242698.699128.610
1)**表示0.01水平差异极显著(不等重复试验双因素方差分析)。

表5 53个木麻黄无性系青枯病抗性鉴定结果Tab.5 Resistance identification results of 53 Casuarinaceae clones
续表5 Tab.5 continued
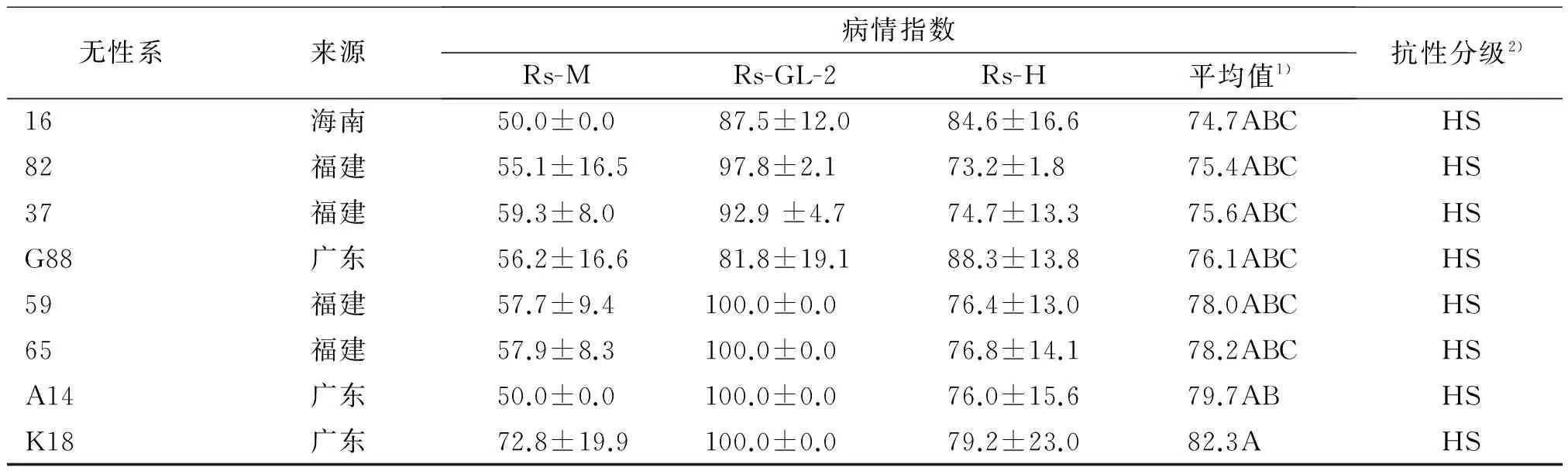
无性系来源病情指数Rs-MRs-GL-2Rs-H平均值1)抗性分级2)16海南50.0±0.087.5±12.084.6±16.674.7ABCHS82福建55.1±16.597.8±2.173.2±1.875.4ABCHS37福建59.3±8.092.9±4.774.7±13.375.6ABCHSG88广东56.2±16.681.8±19.188.3±13.876.1ABCHS59福建57.7±9.4100.0±0.076.4±13.078.0ABCHS65福建57.9±8.3100.0±0.076.8±14.178.2ABCHSA14广东50.0±0.0100.0±0.076.0±15.679.7ABHSK18广东72.8±19.9100.0±0.079.2±23.082.3AHS
1)该列数据后,凡是有一个相同大写字母者,表示在0.01水平差异不显著(Duncan’s法); HR:高抗,病情指数30以下;MR:中抗,病情指数30~50;MS:中感,病情指数50~70;HS:高感,病情指数70以上。
利用 Duncan’s法进行多重比较发现,X1、45、平5、30、W6、杂交、501、G1无性系之间抗性无显著差异,平均病情指数介于13.3~17.0;20、21、C7、2、16、82、37、G88、59及65无性系间无显著差异,平均病情指数为73.7~78.2。利用平均病情指数结合多重比较将这53份参试材料分为高感(HS)、中感(MS)、中抗(MR)及高抗(HR)4个等级(表5),筛选出X1、45、平5、30、W6、杂交、501、G1、503、41、A1及A1-3等12个高抗无性系。
3 讨论与结论
建立可靠、真实反映病害程度的鉴定方法是从事木麻黄抗病育种研究的基础。不同鉴定方法效果不同,试验表明,盆栽幼苗伤根接种及褐梗小枝室内水培接种是木麻黄青枯病抗性鉴定的最佳方法,能够有效区分木麻黄抗、感无性系,准确可靠,鉴定结果极显著正相关。这2种方法各有优势,可视参试材料、试验条件选择。
研究发现病菌侵入植物后在根内组织迅速增殖和扩展是其产生较强致病性的重要原因[21],虽然不伤根接种法是马铃薯Solanumtuberosum[22]及广藿香[23]等植物青枯病抗性鉴定的有效方法,但木麻黄盆栽幼苗不伤根接种死亡率大大降低,且抗、感无性系差异不显著,这表明木麻黄根系对于青枯菌的入侵是一自然屏障,能够阻止病菌自由进入寄主体内,具有抗侵入作用。这也部分解释了广东省木麻黄沿海防护林青枯病大爆发通常发生在台风过后这种现象。台风引起的林木根系松动、断裂及损伤等都有利于青枯菌从根部侵入。
室内接种试验时,木麻黄接种材料越幼态其抗性越好,这可能与幼态材料含有更高生理活化酶有关[4]。水培生根小苗接种5 d后几乎不萎蔫,抗、感无性系间无显著性差异,与褐梗小枝鉴定结果相关性不显著,不宜作为木麻黄室内水培接种试验材料,此结论与王军[4]无根苗与水培出根后的幼苗室内接种发病趋势一致的结论相左。王军[4]研究认为绿梗小枝也适用于木麻黄青枯病抗性鉴定,但笔者认为绿梗小枝病害症状变化小,不易分级,容易出现观测误差,不是优选方法。
甘薯Dioscoreaesculenta[24]、广藿香[16]、花生Arachishypogaea[25]等植物均可利用青枯菌粗毒素进行抗病性鉴定,本研究中青枯菌粗毒素对木麻黄褐化小枝具有致病性,且高温高压对粗毒素生物活性没有影响,此结论与王军等[20]研究结果相类似,与张燕玲等[16]、种藏文等[24]认为高温会使粗毒素毒力大大降低的结论不同。研究发现经孔径0.22 μm的细菌过滤膜抽真空过滤制备粗毒素的效果不好,得到的粗毒素通常放置12~24 h后又长出青枯菌,此方法也不是木麻黄青枯病抗病鉴定的优选方法。
本试验利用褐梗小枝室内水培接种法,对53份木麻黄育种材料进行抗性评价,筛选出X1、45、平5、30、W6、杂交、501、G1、503、41、A1及A1-3等12份高抗材料,这不仅可为现有防护林体系提供抗病种植材料,也为今后的木麻黄杂交育种、抗性分子标记等研究奠定基础。经鉴定,早期选育出的木麻黄抗病无性系A14、A13及A8抗性明显降低,这与桉树抗病性存在衰退的结论相一致[26],这一方面可能与无性系退化有关,另一方面可能与青枯菌具有与植物、环境协同进化,发生变异有关。
木麻黄青枯病是一种严重病害,但是目前相关研究不多,建立起一套快速、可靠、高效的检测方法还需要进一步的试验研究。此外,抗源的筛选结果也难以令人满意,虽然抗病性广泛存在,但还未发现免疫类型,所以更全面筛选、寻找、创造抗源材料是今后的一个研究方向。
[1] SALANOUBAT M, GENIN S, ARTIGUENAVE F, et al. Genome sequence of the plant pathogenRalstoniasolanacearum[J]. Nature, 2002, 415(6871): 497-502.
[2] 乔俊卿, 陈志谊, 刘邮洲, 等. 茄科作物青枯病研究进展[J]. 植物病理学报, 2013, 43 (1): 1-10.
[3] 郭权, 梁子超. 木麻黄抗青枯病品系的筛选技术和综合防治措施[J]. 林业科技通讯, 1986(4): 7-9.
[4] 王军. 影响木麻黄青枯病抗性测定的几项因素研究[J]. 林业科学, 1996, 32(3): 225-229.
[5] 何学友. 木麻黄病害研究概述[J]. 防护林科技, 2007(2): 27-30.
[6] 黄金水, 何益良, 郑辉棋. 几种木麻黄抗病虫性调查报告[J]. 福建林业科技, 1985, 12(2): 41-45.
[7] 魏素梅, 谭天泳. 木麻黄地理种源的苗期试验[J]. 林业科学研究, 1990, 3(2): 119-126.
[8] 梁子超, 陈小华. 木麻黄抗青枯病品系的筛选[J]. 华南农学院学报, 1984, 5(1): 53-59.
[9] 彭国强. 木麻黄抗青枯病无性系造林对比试验[J]. 广东林业科技, 2000, 16(3): 35-37.
[10]柯玉铸, 黄金水, 林延生, 等. 普通木麻黄抗逆无性系的筛选[J]. 福建林业科技, 1994, 21(1): 39-43.
[11]苗立祥. 番茄抗青枯病的AFLP分子标记及其相关基因的克隆[D]. 杭州: 浙江大学, 2008.
[12]梁子超, 王祖太. 粗杂木麻黄对青枯病抗性的测定[J]. 热带林业科技, 1982(1): 31-34.
[13]陈炳铨, 张景宁. 木麻黄无性系对青枯菌抗性及菌株变异初探[J]. 广东林业科技, 1995, 11(2): 33-36.
[14]刘勇, 秦西云, 李文正, 等. 抗青枯病烟草种质资源在云南省的评价[J]. 植物遗传资源学报, 2010, 11(1): 10-16.
[15]尹贤贵, 王小佳, 张赟, 等. 我国番茄青枯病及抗病育种研究进展[J]. 云南农业大学学报, 2005, 20(2): 163-167.
[16]张燕玲, 贺红, 吴立蓉, 等. 广藿香抗青枯病离体筛选技术的研究[J]. 广西植物, 2009, 29(5): 678-682.
[17]王艳丽. 桉树抗青枯病的鉴定及其抗病机制研究[D]. 石家庄: 河北农业大学, 2010.
[18]王胜坤. 桉树青枯菌菌株致病力分化、吸附识别及PCR快速检测研究[D]. 北京: 中国林业科学研究院, 2007.
[19]YAMAZAKI H. Relation between resistance to bacterial wilt and calcium nutrition in tomato seedlings[J]. Jarq-Japan Agric Res Quart, 2001, 35(3): 163-169.
[20]王军, 苏海, 邓志文. 青枯假单胞杆菌对木麻黄致病机理的初步研究[J]. 森林病虫通讯, 1997(2): 21-22.
[21]罗焕亮, 王军, 邵志芳, 等. 木麻黄青枯菌的根表吸附及根内增殖与其致病性关系[J]. 林业科学研究, 2002, 15(1): 21-27.
[22]李广存, 金黎平, 谢开云, 等. 马铃薯青枯病抗性鉴定新方法[J]. 中国马铃薯, 2006, 20(3): 129-134.
[23]徐燃, 贺红, 邓素坚, 等. 青枯菌侵染广藿香的组织病理学研究[J]. 广州中医药大学学报, 2013, 30(2): 236-239.
[24]种藏文, 卢同, 李本金, 等. 甘薯青枯菌粗毒素的制备及热、紫外线、酶对粗毒素生物活性的影响[J]. 福建农业学报, 1998, 13(1): 36-40.
[25]袁宗胜, 刘芳, 胡方平. 花生离体培养条件下不同外植体对青枯菌粗毒素的抗性反应[J]. 福建农业学报, 2010, 25(5): 618-622.
[26]COUTINHO T A, ROUX J, RIEDEL K H, et al. First report of bacterial wilt caused byRalstoniasolanacearumon eucalypts in South Africa[J]. Forest Pathol, 2000, 30(4): 205-210.
【责任编辑 李晓卉】
Comparison of identification methods of bacterial wilt resistance in Casuarinaceae and screening of resistant germplasm resources
XU Xiuyu1,2, ZHANG Weiqiang2, HUANG Yuhui2, GAN Xianhua2, ZHONG Chonglu3, ZHANG Huaxin1
(1 Research Centre on Saline and Alkali Lands of State Forestry Administration,Chinese Academy of Forestry,Beijing 100091,China; 2 Guangdong Provincial Key Laboratory of Silviculture, Protection and Utilization/Guangdong Academy of Forestry,Guangzhou 510520,China; 3 Research Institute of Tropical Forestry,Chinese Academy of Forestry,Guangzhou 510520,China)
【Objective】 To select convenient, accurate and reliable identification methods of bacterial wilt resistance in Casuarinaceae, identify and evaluate the bacterial wilt resistance of Casuarinaceae germplasm resources in China, and screen out highly resistant clones.【Method】Based on the screening techniques of Casuarinaceae resistant lines as well as the identification methods of bacterial wilt in other plants, such asLycopersiconesculentum,NicotianaandEucalyptus, we designed eight different approaches to inoculateRalstoniasolanacearuminto Casuarinaceae. The effects of using hydroponic rooting seedling, twig, lignified green branch, lignified brown branch, bacterial wilt crude toxin, and root with or without injure of potted seedlings in inoculation on bacterial wilt resistance identification were studied. 【Result】After injured root inoculation of potted seedling,the mortalities of different Casuarinaceae clones ranged from 25.79% to 83.06% with significant differences among A14, K18 and G1, 30 clones(P<0.05). After hydroponic inoculation of lignified brown branch,the disease indexes of different clones ranged from 2.16 to 69.48 with significant differences among A14, K18 and G1, 30 clones(P<0.05). These two inoculation approaches enabled effective discrimination between resistant and infected clones, and had highly significant positive correlation (r=0.856 5). Non-injured root inoculation of potted seedling, hydroponic inoculation of rooting seedling and tender branch did not result in significantly differences in disease resistance among clones(P>0.05), and they couldn’t help with effective identification of bacterial wilt resistance in Casuarinaceae. Inoculation of lignified green branch only resulted in small differences among clones, and therefore it led to difficulties in classification and could easily cause detection error. The concentration of bacterial wilt crude toxin was hard to control during inoculation. Using hydroponic inoculation of lignified brown branch, 53 Casuarinaceae clones were evaluated and 12 highly resistant clones such as X1, 30, hybrid and G1 clones were screened out. 【Conclusion】 Injured root inoculation of potted seedling and hydroponic inoculation of lignified brown branch are both preferred inoculation approaches for identifying bacterial wilt resistance of Casuarinaceae. The rest inoculation approaches tested in this study were not suitable for identification of bacterial wilt resistance in Casuarinaceae.
Casuarinaceae; bacterial wilt; disease resistance; identification method; germplasm resource
2016- 10- 26 优先出版时间:2017- 06-22
许秀玉(1977—),女,教授级高级工程师,博士研究生,E-mail:81250908@163.com;通信作者:张华新(1962—),男,研究员,博士,E-mail:18611572609@163.com
广东省林业科技创新项目(2014KJCX017,2013KJCX018-03)
S432.4
A
1001- 411X(2017)04- 0087- 08
优先出版网址:http://kns.cnki.net/kcms/detail/44.1110.s.20170622.1010.006.html
许秀玉, 张卫强, 黄钰辉, 等.木麻黄青枯病抗性鉴定方法比较及抗病种质筛选[J].华南农业大学学报,2017,38(4):87- 94.
