印楝素对min6细胞增殖及胰岛素分泌的影响
2017-08-07王得华徐汉虹
张 玲, 王得华, 马 义, 徐汉虹
(1暨南大学 生命科学技术学院, 广东 广州510632; 2天然农药与化学生物学教育部重点实验室/华南农业大学 农学院, 广东 广州 510642)
印楝素对min6细胞增殖及胰岛素分泌的影响
张 玲1,2, 王得华1, 马 义1, 徐汉虹2
(1暨南大学 生命科学技术学院, 广东 广州510632; 2天然农药与化学生物学教育部重点实验室/华南农业大学 农学院, 广东 广州 510642)
【目的】研究印楝素对min6细胞增殖、葡萄糖摄取及胰岛素分泌的影响,并探讨其作用机制。【方法】不同浓度印楝素处理min6细胞48 h,检测细胞增殖量。在5.5和25.0 mmol·L-1葡萄糖条件下,检测印楝素处理细胞的葡萄糖摄取水平,胰岛素ELISA检测试剂盒检测细胞胰岛素的分泌。【结果】与对照组相比,在5.5和25.0 mmol·L-1葡萄糖条件下,印楝素均表现促进细胞增殖活性。印楝素处理下,与25.0 mmol·L-1葡萄糖条件相比,5.5 mmol·L-1葡萄糖表现出更显著地促进葡萄糖摄取和胰岛素分泌的作用。【结论】印楝素可能通过调控葡萄糖水平影响胰岛素的分泌。
印楝素; min6细胞; 细胞增殖; 胰岛素分泌; ELISA检测
印楝素是从印楝AzadirachtaIndica种子中提取的柠檬素类化合物,属于四环三萜类化合物,包括10多个结构类似物[1]。印楝素对生长发育的调控表现为抑制昆虫的生长发育和干扰昆虫的内分泌导致其变态发育异常[2-3]。印楝素对昆虫的生长发育的调控可能涉及多种因素,印楝素能明显地影响昆虫体内糖、蛋白质和脂肪的合成代谢,影响内源激素的调控途径[4-5]。在昆虫生长发育中,胰岛素信号通路参与调控营养代谢物,间接调控昆虫的变态生长发育[6-7]。在前期研究中,天然农药与化学生物学教育部重点实验室通过对印楝素作用下的昆虫幼虫和离体细胞差异表达基因/蛋白文库分析,提出了印楝素可能通过营养-胰岛素信号(IIS)途径调控昆虫生长发育[6]。
哺乳动物的胰岛素是机体中促进合成和代谢的多肽类激素。胰岛β细胞是胰岛素合成和分泌的主要场所,调控机体中糖、脂肪及蛋白质代谢等[8-9]。胰岛β细胞合成和分泌胰岛素受到营养物质等多种因素的调控,葡萄糖是最主要的调控因子[10]。本研究在胰岛β细胞min6 细胞水平,研究印楝素对胰岛素信号途径的影响,通过印楝素对葡萄糖和胰岛素的调控,探讨印楝素可能的作用机制。
1 材料与方法
1.1 材料
小鼠胰岛瘤细胞min6细胞,采用DMEM基础培养基(分别含5.5和25.0 mmol·L-1葡萄糖)培养,15%(φ)胎牛血清临用前添加, 加入胎牛血清、100 U·mL-1青霉素、0.1 mg·mL-1链霉素、50 μmol·L-1β-巯基乙醇,调节pH 至7.35~7.45,在37 ℃,5%(φ) CO2条件下常规培养。
印楝素从印楝素种子中提取,其中印楝素A质量分数>90%,由天然农药与化学生物学教育部重点实验室提供。DMEM培养液、0.05%(φ)胰酶-EDTA、胎牛血清均购自Gibco 公司;D-(+) -葡萄糖、2β-巯基乙醇、DMSO,购自Sigma 公司。ELISA胰岛素试剂盒购自Linco公司。
KRBH 缓冲液 (1 L):NaCl 7.54 g;KCl 0.36 g;MgSO40.15 g;KH2PO40.16g;CaCl20.28 g;NaHCO30.42 g;BSA 1.00 g;HEPES 2.38 g;去离子水 1 L,磁力搅拌器混匀后,调节 pH 7.4,过滤除菌,4 ℃保存备用。
1.2 方法
1.2.1 细胞增殖测定 用MTT 法检测印楝素对min6 细胞增殖活性的影响。取对数生长期的min6 细胞,调整浓度为 2×105mL-1,接种至96 孔板中,每孔加入DMEM 完全培养液150 μL,培养24 h,细胞贴壁后,弃培养液,PBS缓冲液洗2 次。加入印楝素200 μg·mL-1150 μL,顺序加入倍半稀释浓度,培养48 h 后,每孔加CCK8 20 μL,继续孵育4 h; 孵育4 h 后小心吸弃上清液,每孔加入150 μL 的DMSO,振荡10 min。酶标仪测定570 nm的光密度值。
1.2.2 min6细胞葡萄糖摄取量测定 将min6细胞以 2×105个细胞接种于 12 孔培养板中,细胞贴壁后,弃去板中培养基,用 KRBH 缓冲液轻柔地洗2次,再用含 100 μg 印楝素的 KRBH 缓冲液继续孵育2 h。然后,加入5.5和25.0 mmol·L-1的葡萄糖孵育20 min,收集上清液,通过检测上清液中葡萄糖的含量反映细胞对葡萄糖的吸收。
1.2.3 min6细胞内胰岛素含量的测定 取对数生长期的细胞,消化后计数,调整细胞密度至2× 105L-1,接种于12孔板, 24 h 后弃细胞培养基,用 KRBH 缓冲液轻柔地洗2次,再用 KRBH 预孵育 2 h,使细胞对葡萄糖致敏。然后,换用新鲜的 KRBH 缓冲液分别加入0、50、100、150、200 μg·mL-1印楝素, 以及5.5 或者25.0 mmol·L-1葡萄糖继续孵育 1 h,收集上清液,ELISA胰岛素试剂盒测定胰岛素的含量。
以上试验均重复6次。
1.3 数据处理
应用SPSS 17. 0 统计软件对试验结果进行统计学分析,采用方差分析和t检验进行差异显著性分析。应用Sigmaplot 软件绘图。
2 结果与分析
2.1 印楝素对min6细胞增殖的影响
不同浓度印楝素分别作用于高糖培养基(25.0 mmol·L-1葡萄糖)和低糖培养基(5.5 mmol·L-1葡萄糖)培养的min6 细胞,48 h 后检测细胞存活率。试验结果如图1所示。不同浓度印楝素分别处理 48 h后,采用CCK8检测min6细胞的存活状态。由图1可知,min6细胞在高糖和低糖培养基条件下均生长良好,印楝素均表现出促进增殖活性,且表现出一定的浓度依赖性。印楝素质量浓度为100 μg·mL-1时,在低糖培养基中,增殖率提高20%,而在高糖培养基中,增殖率提高13%。
2.2 印楝素对min6细胞葡萄糖摄取的影响
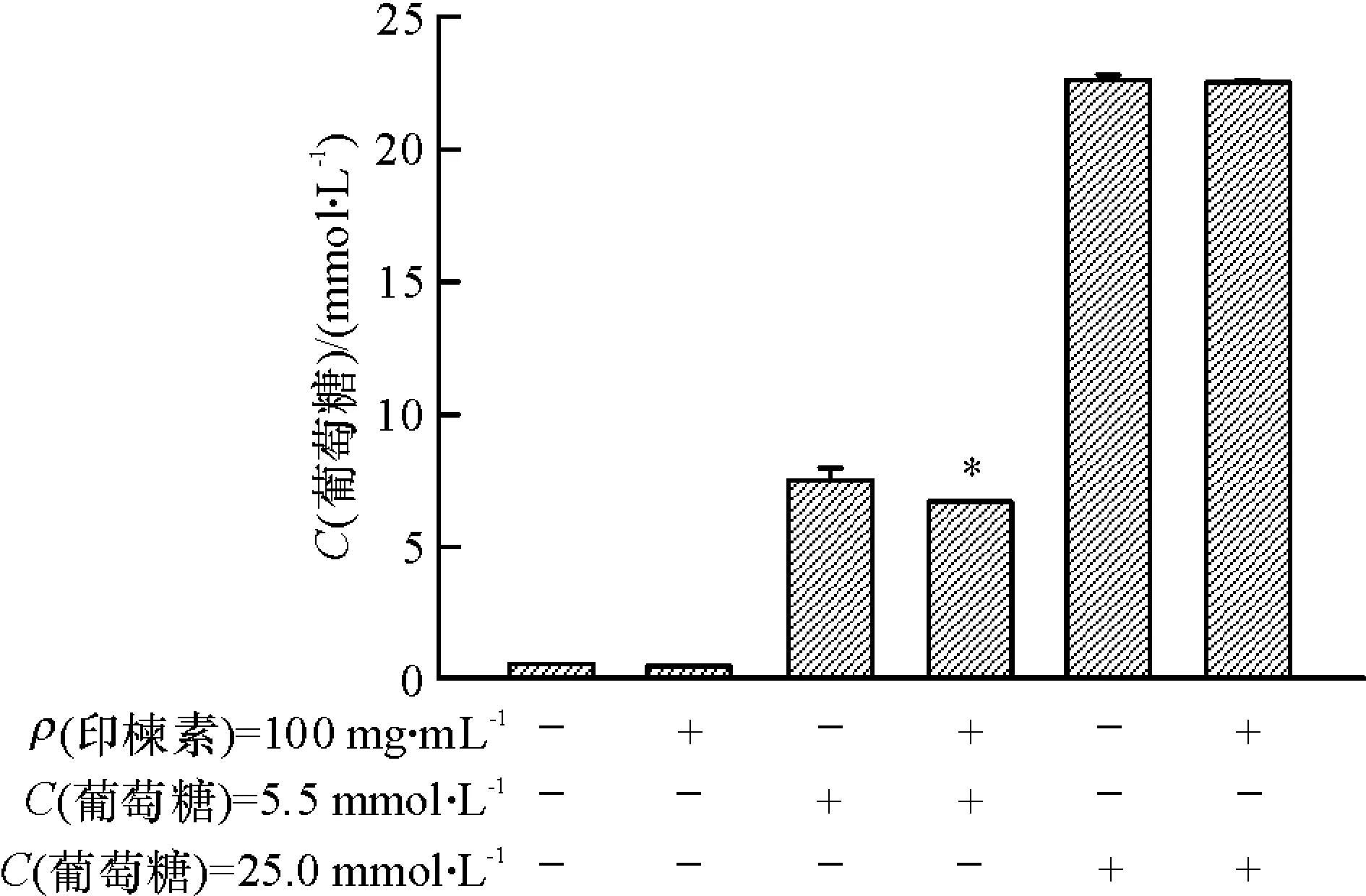
min6细胞过夜培养,加入缓冲溶液饥饿 2 h 后,分别在5.5和25.0 mmol·L-1葡萄糖新鲜的KRBH缓冲溶液中,用100 μg·mL-1印楝素处理,继续培养 20 min,取上清检测培养基中葡萄糖的含量。
试验结果如图2所示,在低糖培养条件下,印楝素处理组培养基中葡萄糖浓度与无药物处理组相比明显降低,试验检测葡萄糖浓度降低11%,表明细胞对葡萄糖的摄取量增加,间接表明印楝素可以促进胰岛β细胞对葡萄糖的吸收。而在无糖对照组中,印楝素处理组与未用药组没有显著差异。在高糖培养条件下,印楝素处理组培养基中葡萄糖浓度降低,与未用药组比较差异不显著。
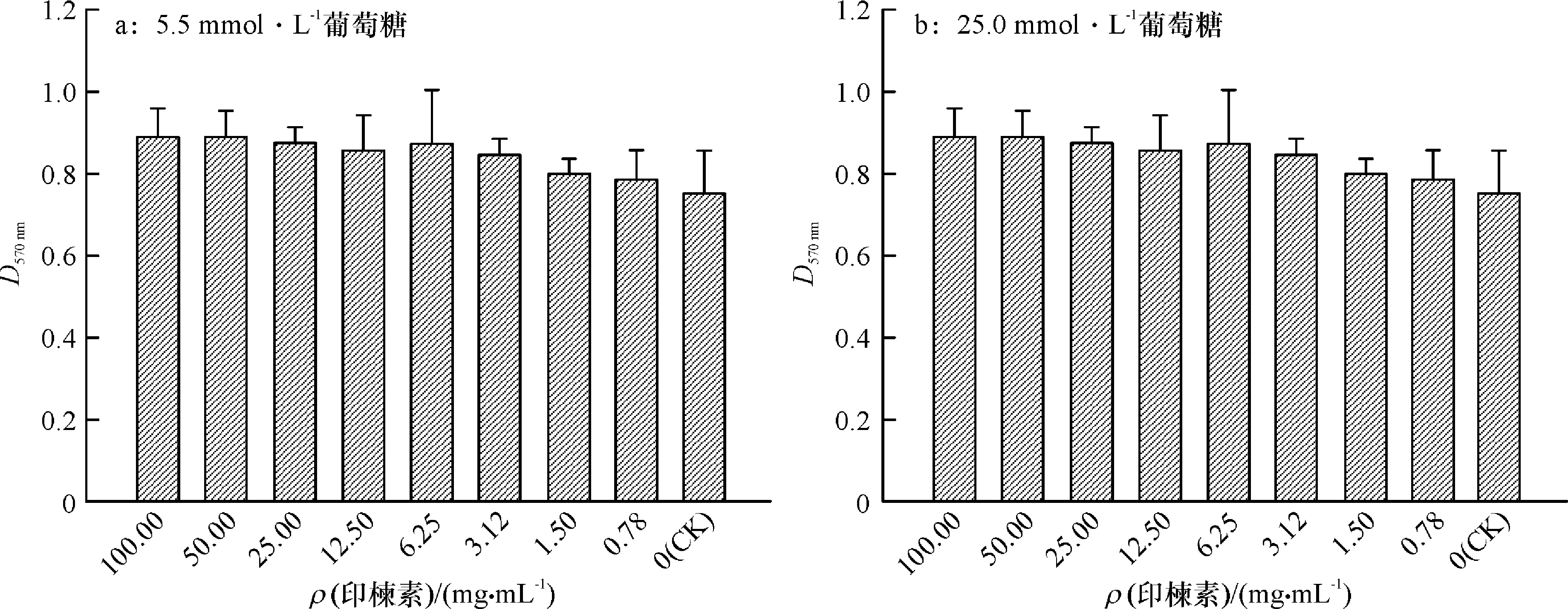
图1 印楝素对min6细胞增殖的影响Fig.1 Effect of azadirachtin on proliferation of min6 cells
* 表示处理与对照差异显著(P<0.05,DMRT法)。
2.3 印楝素对min6细胞胰岛素分泌的影响
min6细胞培养24 h后,用KRBH缓冲溶液孵育使细胞对葡萄糖致敏,检测不同溶度印楝素处理下胰岛素的含量。试验结果表明,当min6细胞在5.5 mmol·L-1葡萄糖环境中,印楝素对细胞的胰岛素分泌产生影响,如图3a所示,当印楝素的浓度为50、100、150 μg·mL-1时,胰岛素的分泌量先随浓度增加,与无药对照组相比差异显著(P<0.05)。然后在印楝素浓度200 μg·mL-1胰岛素分泌量增加有所下降,与对照差异不显著。 当印楝素为100 μg·mL-1时,胰岛素分泌量增加25%。
当min6细胞处于25.0 mmol·L-1葡萄糖环境中,印楝素同样表现为促细胞胰岛素分泌,如图3b所示,与低葡萄糖试验组同样的4个印楝素处理浓度,胰岛素分泌增加较少,同样随印楝素处理浓度增加而胰岛素分泌量增加。与低葡萄糖浓度刺激相比,在高葡萄糖浓度刺激下,印楝素处理组促胰岛素的分泌量相对较低。

分泌的胰岛素以每小时计,* 表示处理与对照差异显著(P<0.05,DMRT法)。
3 讨论与结论
昆虫min6细胞系是胰岛素分泌研究中常用的细胞模型,该模型已经具备完善的研究方法和理论基础,在该细胞模型中研究印楝素处理下对葡萄糖以及胰岛素分泌的影响,可为后续的昆虫体系的试验提供理论参考。
在β细胞中,营养因子葡萄糖是刺激胰岛素分泌的最主要因素。葡萄糖由葡萄糖转运载体转运进入胰岛β细胞,参与生物体血糖的调节,因而细胞中影响葡萄糖代谢的影响因子均对胰岛素的分泌产生影响。因此,选择胰岛β细胞作为研究印楝素对营养因子及其相关信号调控的研究体系。
在本研究中试验结果显示不同浓度的印楝素,在5.5和25.0 mmol·L-1葡萄糖培养基中,均表现出对胰岛β细胞不同程度的促增殖作用。在5.5 mmol·L-1葡萄糖培养基中促增殖作用更加显著。同时,印楝素在低葡萄糖和高葡萄糖环境下能够促进细胞对葡萄糖的吸收,在5.5 mmol·L-1低葡萄糖条件细胞摄取更多的葡萄糖。而糖的吸收和代谢是葡萄糖依赖的胰岛素分泌的主要影响因素。影响葡萄糖在β细胞代谢中的因素均可影响到胰岛素的分泌。试验结果显示,检测不同浓度印楝素处理的细胞胰岛素分泌水平,在5.5 mmol·L-1低糖培养基中,胰岛素分泌水平增加,这与相同条件下试验检测的葡萄糖摄取水平一致。作为葡萄糖依赖的胰岛素分泌,胰岛素的分泌主要受葡萄糖的刺激影响,葡萄糖的摄取量增加直接导致胰岛素的分泌增加。试验结果显示印楝素在低葡萄糖环境中促进细胞对葡萄糖的吸收,促进胰岛素的分泌,进而推断印楝素的作用可能是调控葡萄糖的吸收,间接的产生葡萄糖刺激胰岛素分泌的响应。而在高葡萄糖环境中,印楝素促葡萄糖吸收作用减弱,胰岛素分泌量没有显著的增加。试验结果表明,印楝素作用的胰岛β细胞中,胰岛素的分泌和印楝素作用下葡萄糖的吸收结果一致。因此可以推断印楝素可能是通过调控细胞内葡萄糖浓度,进而影响到细胞胰岛素的释放,而不是简单作用于胰岛素及其受体本身。
在之前的文献报道中,印楝素在多种细胞上均表现出抑制细胞生长作用。在昆虫细胞中,印楝素表现出明显的抑制生长和诱导凋亡[11-12]。在哺乳动物细胞中,文献报道印楝素提取物也表现出抑制细胞增殖,诱导凋亡等[13-14]。在子宫癌Hela细胞系中,印楝素显著地抑制细胞的增殖,诱导细胞凋亡[14]。因而,印楝素通常情况下具有抑制细胞的生长作用。本研究结果表明,min6细胞在葡萄糖存在条件下,印楝素表现出促增殖活性,促进细胞对葡萄糖的摄取以及细胞胰岛素的分泌,因而推断在min6细胞中印楝素调控胰岛素分泌可能与印楝素调控抑制细胞生长和诱导凋亡的机制不同。在胰岛β细胞中,葡萄糖-胰岛素信号途径为主要的调控通路,而细胞生长是通过PI3K信号通路调控的,因而印楝素在胰岛β细胞中可能是通过调节葡萄糖合成和代谢中的靶标,达到调控葡萄糖吸收的目的,间接地调控细胞内胰岛素的释放。
文献报道番石榴酸在Ins-1胰岛β细胞中表现相似的促细胞增殖活性和影响胰岛素合成和分泌的作用[15]。番石榴酸结构上属于羟基萜类化合物,鉴于印楝素与羟基萜类化合物在结构上的相似性,该类化合物在葡萄糖-胰岛素调控中的作用机制研究可以成为印楝素进一步研究的参考。
[1] BUTTERWORTH J H, MORGAN E D. Isolation of a substance that suppresses feeding in locusts[J]. J Chem Soc Chem Commun, 1968(1): 23-24.
[2] 李晓东, 赵善欢. 印楝素对昆虫的毒理作用机制[J]. 华南农业大学学报, 1995, 17(1): 118-122.
[3] MORGAN E D. Azadirachtin, a scientific gold mine[J]. Bioorg Med Chem, 2009, 17: 4096-4105.
[4] MORDUE A J, BLACKWELL A. Azadirachtin: An update[J]. J Insect Physiol, 1993, 39: 903-924.
[5] 查友贵, 徐汉虹. 印楝及印楝生物农药[J]. 世界农药, 2003, 25(4): 29-30.
[6] LAI D, JIN X, WANG H, et al. Gene expression profile change and growth inhibition inDrosophilalarvae treated with azadirachtin[J]. J Biotechnol, 2014, 185: 51-56.
[7] WANG H, LAI D, YUAN M, et al. Growth inhibition and differences in proteinpro files in azadirachtin-treatedDrosophilamelanogasterlarvae[J]. Electrophoresis, 2014, 35(8): 1122-1129.
[8] RITZEL R A. Therapeutic approaches based on beta-cell mass preservation and/or regeneration[J]. Front Biosci, 2009, 14: 1835-1850.
[9] WEIR G C, BONNER-WEIR S. Isletβcell mass in diabetes and how it relates to function, birth, and death[J]. Ann NY Acad Sci, 2013, 1281(1): 92-105.
[10]GEMBAL M, GILON P, HENQUIN J C. Evidence that glucose can control insulin release independently from its action on ATP-sensitive K+channels in mouseβcells[J]. J Clin Invest, 1992, 89(4): 1288-1295.
[11]程杏安, 黄劲飞, 胡美英, 等. 印楝素A诱导Sf9细胞凋亡的显微和超微形态变化[J]. 华南农业大学学报, 2010, 31(4): 52-58.
[12]HUANG J F, SHUI K J, LI H Y, et al. Antiproliferative effect of azadirachtin A onSpodopteralituraSl-1 cell line through cell cycle arrest and apoptosis induced by up-regulation of p53[J]. Pestic Biochem Physiol, 2011, 99(1): 16-24.
[13]MAHAPATRA S, KARNES R J, HOLMES M W, et al. Donkena, novel molecular targets ofAzadirachtaindicaassociated with inhibition of tumor growth in prostate cancer[J]. The AAPS J, 2011, 13: 365-377.
[14]GUNADHARINI D N, ELUMALAI P, ARUNKUMAR R, et al. Induction of apoptosis and inhibition of PI3K/Akt pathway in PC-3 and LNCaP prostate cancer cells by ethanolic neem leaf extract[J]. J Ethnopharmacol, 2011, 134(3): 644-650.
[15]王婧茹, 赵晶晶, 叶春玲, 等. 番石榴叶总三萜对2 型糖尿病大鼠的降血糖和血脂作用[J]. 中国病理生理杂志, 2012, 28(6): 1109-1113.
【责任编辑 霍 欢】
Effects of azadirachtin on proliferation and insulin secretion of min6 cells
ZHANG Ling1,2, WANG Dehua1, MA Yi1, XU Hanhong2
(1 College of Life Science and Technology, Jinan University,Guangzhou 510632,China; 2 Key Laboratory of Natural Pesticide and Chemical Biology, Ministry of Education/ College of Agriculture,South China Agricultural University, Guangzhou 510642,China)
【Objective】 To investigate the effects of azadirachtin on cell proliferation,glucose uptake and insulin secretion in min6 cells and their possible mechanisms. 【Method】 The min6 cells were culturedinvitroand treated with various concentrations of azadirachtin for 48 h.Cell proliferation was measured. In the presence of 5.5 and 25.0 mmol·L-1glucose,glucose uptake was measured and insulin secretion in min6 cells were detected by the insulin ELISA kit. 【Result】 Azadirachtin promoted the proliferation of min6 cells in the presence of 5.5 and 25.0 mmol·L-1glucose compared to the control group. Compared with the 25.0 mmol·L-1glucose condition,azadirachtin in the presence of 5.5 mmol·L-1glucose more significantly promoted glucose uptake and insulin secretion in min6 cells. 【Conclusion】Azadirachtin could affect insulin secretion by regulating glucose concentration.
azadirachtin; min6 cells; cell proliferation; insulin secretion; ELISA test
2017- 03- 03 优先出版时间:2017- 06-21
张 玲(1970—),女,助理研究员,博士,E-mail:tzl@jnu.edu.cn;通信作者:徐汉虹(1961—),男,教授,博士,E-mail: hhxu@scau.edu.cn
广东省自然科学基金(2015A030313333)
S511; S502
A
1001- 411X(2017)04- 0025- 05
优先出版网址:http://kns.cnki.net/kcms/detail/44.1110.s.20170621.1923.008.html
张 玲, 王得华, 马 义, 等.印楝素对min6细胞增殖及胰岛素分泌的影响[J].华南农业大学学报,2017,38(4):25- 29.
