基于 HPLC 指纹图谱对救必应与其伪品的鉴别研究
2017-08-07马玉翠王淳王蔚吴翠杜宁孙文李慧巢志茂
马玉翠,王淳,王蔚,吴翠,杜宁,孙文,李慧,巢志茂
1.中国中医科学院中药研究所,北京 100700;2.北京市理化分析测试中心,北京 100094
基于 HPLC 指纹图谱对救必应与其伪品的鉴别研究
马玉翠1,王淳1,王蔚2,吴翠1,杜宁2,孙文1,李慧1,巢志茂1
1.中国中医科学院中药研究所,北京 100700;2.北京市理化分析测试中心,北京 100094
目的 建立救必应与其伪品米碎木的 HPLC 指纹图谱,进行真伪鉴别。方法 收集各地名为“救必应”的药材,采用 HPLC 指纹图谱方法对救必应及其伪品米碎木进行检测,采用《中药色谱指纹图谱相似度评价系统 2004A 版》对指纹图谱进行评价。结果 建立了救必应和米碎木的 HPLC 指纹图谱,方法学考察符合指纹图谱技术要求。救必应与其伪品米碎木指纹图谱轮廓特征明显不同,救必应有31个共有峰,米碎木有 28 个共有峰。主成分分析可将样品分为 2 组,聚类分析也可将样品分为 2 类。结论 采用 HPLC 指纹图谱及其数据分析,可以对救必应与其伪品进行鉴别,为救必应的质量评价提供有效方法。
救必应;米碎木;高效液相色谱法;指纹图谱;主成分分析;质量控制
冬青科植物铁冬青 Ilex rotunda Thunb.是岭南地区多湿热环境中生长的乔木,主要分布于广东、广西、福建、台湾、云南等地[1]。其干燥树皮为中药救必应,功效清热解毒、利湿止痛,用于暑湿发热、咽喉肿痛、湿热泻痢、脘腹胀痛、风湿痹痛等症[2],主要含三萜及其苷类、黄酮类、酚类、鞣质类化学成分,具有降低冠脉流量、抗心律失常、降压、减慢心率、提高耐缺氧能力、抗肿瘤、抑菌、抗炎、止血等活性,用于治疗消化系统疾病、心血管疾病及多种感染性疾病[3-5],是腹可安片、肠胃适胶囊、复方救必应胶囊等中成药的组成之一[6-7]。救必应还是岭南地区凉茶的主要组成成分[8],在牙膏中也有应用[9-10]。救必应的伪品米碎木为米碎木 I. godajam (Colebr.) Wall.的干燥树皮[11],外观与救必应极其相似,在商品流通中也常有米碎木混作救必应的现象[12],导致救必应的质量参差不齐。曾有报道对救必应进行高效薄层指纹图谱[13]、定性定量分析[12]等的研究,并对救必应和米碎木进行了性状、显微、薄层色谱的比较[11-12]。
中药指纹图谱是一种综合、宏观和可量化的鉴别手段,可用于对中药材和中成药进行真伪鉴别,能较全面地反映中药的品质,控制中药材的质量[14]。本研究收集 16 个批次称为“救必应”的样品,进行 HPLC指纹图谱的表征和比较,并进行相似度分析、主成分分析和聚类分析,为救必应的鉴别和质量评价提供依据,并为临床用药的安全性和有效性提供技术保障。
1 仪器与试药
Shimadzu LC-20AT 型高效液相色谱仪(日本岛津公司):SPD-M 20A 二极管阵列检测器(PDA)、SIL-20A 自 动 进 样 器 、 DGU-20A5在 线 脱 气 机 、CTO-10ASvp 柱温箱和 Shimadzu LC-solution 工作站;KQ-100E 型超声清洗器(100 W,40 kHz,昆山市超声仪器有限公司);HHS 型电热恒温水浴锅(上海医疗器械五厂);Sartorius CP225D 型电子天平(赛多利斯科学仪器北京有限公司)。
乙腈为色谱纯(德国 Merck 公司),水为重蒸水,其他试剂为分析纯。收集的 16批样品均经广州市药品检验所刘柏英鉴定,样品信息见表 1,保存在中国中医科学院中药研究所 1016 实验室。
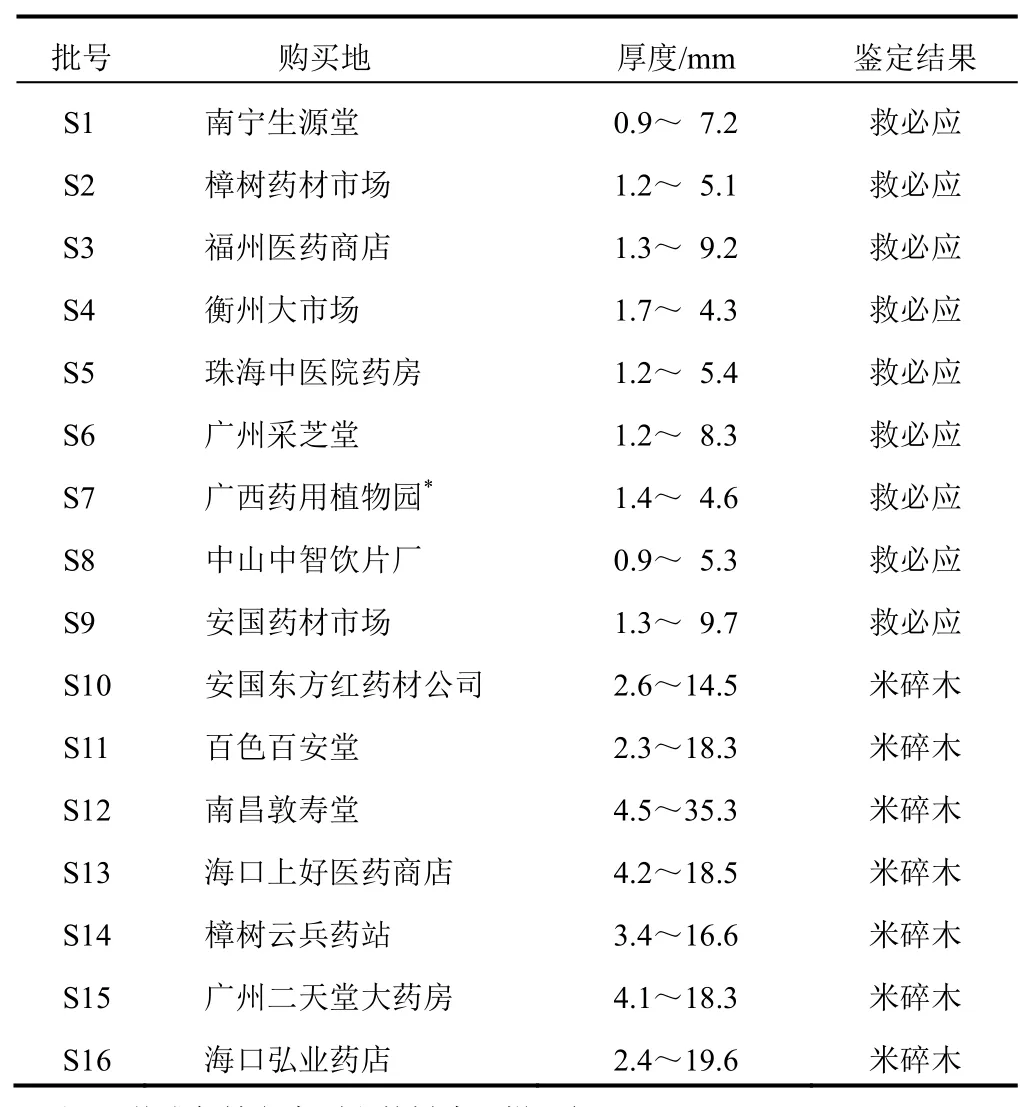
表 1 救必应与米碎木样品来源信息
2 方法与结果
2.1 供试品溶液的制备
样品粉碎,过 3 号筛,精密称取 0.1 g,加入 50%甲醇 25 m L,称定质量,超声处理 30 m in,放冷,再称定质量,用 50%甲醇补足减失的质量,摇匀,过0.45 µm 微孔滤膜,取续滤液,即得。
2.2 色谱条件
采用 Agilent Zorbax SB-C18 色谱柱(4.6 mm× 250 mm,5 µm),流动相 A 为乙腈、B 为水,流速1 m L/m in,检测波长 210~370 nm Max Plot,进样量10 µL,柱温 30 ℃,梯度洗脱程序见表 2。

表 2 流动相梯度洗脱程序(%)
2.3 方法学考察
2.3.1 精密度试验 取 S6 样品粉末,按“2.1”项下方法制备供试品溶液,按“2.2”项下色谱条件连续进样6次,采用软件对样品的HPLC图谱进行自动匹配。结果显示相似度均大于 0.98,且 RSD 值均小于 1%,表明该仪器的精密度良好,符合指纹图谱要求。
2.3.2 重复性试验 精密称取 S6 样品粉末 0.1 g,6份,按“2.1”项下方法制备供试品溶液,按“2.2”项下色谱条件进样 6次,采用软件对样品的 HPLC 图谱进行自动匹配。结果显示相似度均大于 0.98,且RSD 值均小于 1%,表明该方法的重复性良好,符合指纹图谱要求。
2.3.3 稳定性试验 精密吸取 S6 的供试品溶液,分别于 0、2、4、6、8、10、12、24 h 进样,采用软件对样品的 HPLC 图谱进行自动匹配。结果显示 24 h内色谱图的相似度均大于 0.98,且 RSD 值均小于 1%,表明该供试品溶液在 24 h 内稳定。
2.4 指纹图谱的建立
将 16 批样品按“2.1”项下方法制备供试品溶液,按“2.2”项下色谱条件进行 HPLC 测定,可以明显将图谱分成 2 类。其中 S1~S9 的 9 批样品为一类(见图 1),与通过性状鉴别鉴定的救必应一致;S10~S16的 7 批样品为另一类(见图 2),与通过性状鉴别鉴定的米碎木一致。
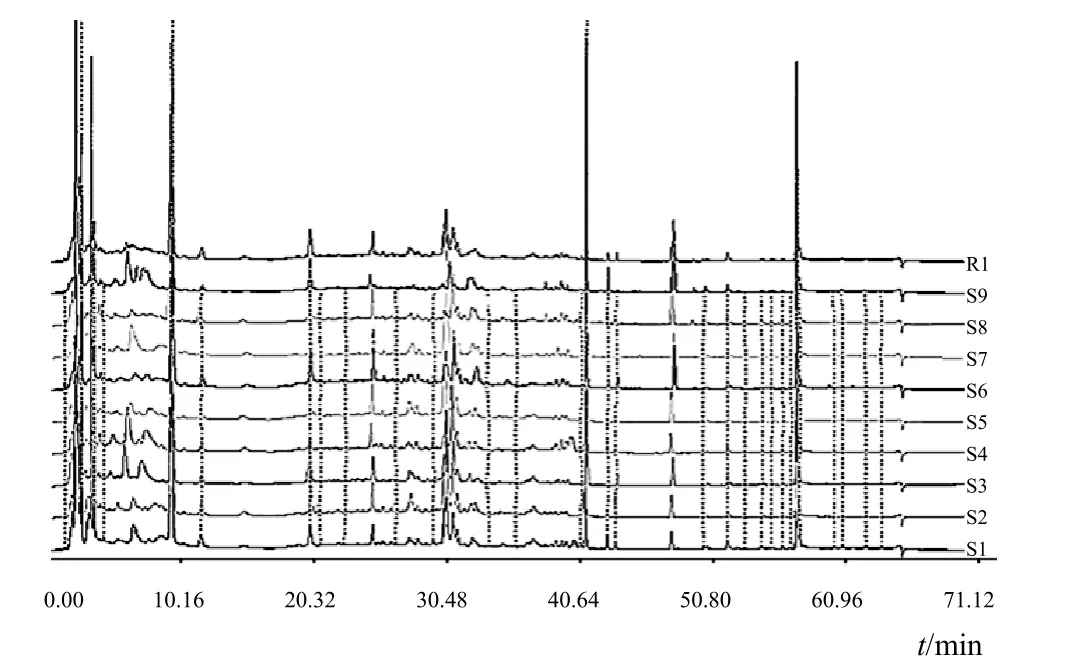
图 1 救必应 HPLC 指纹图谱叠加图
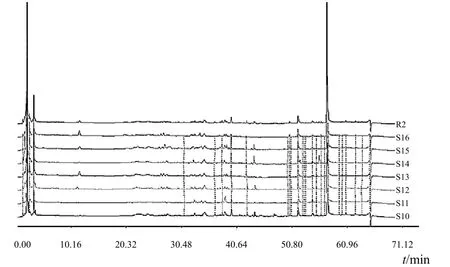
图 2 米碎木 HPLC 指纹图谱叠加图
2.5 相似度评价
将9批救必应指纹图谱导入国家药典委员会《中药色谱指纹图谱相似度评价系统 2004A 版》中,以中位数生成救必应对照指纹图谱(R1),确定了 31 个共有峰。R1的相似度定为 1,计算各指纹图谱与 R1的相似度,见表 3。将 7批米碎木进行相同处理,生成米碎木对照指纹图谱(R2),确定了 28 个共有峰,计算各指纹图谱与 R2的相似度值,见表 4。
2.6 救必应的真伪鉴别
2.6.1 聚类分析 将16批样品HPLC 指纹图谱中各色谱峰的峰面积与样品号建立矩阵,导入 SPSS19.0软件,采用组间联接法,以欧氏距离的平方为测度,对数据进行标准化转换,得到所有样品的聚类分析谱图,见图 3。结果表明,16 批样品可明显地分为 2 类,S1~S9 聚为一类,S10~S16 聚为另一类,与相似度分析结果一致。

图 3 16 批样品指纹图谱聚类分析图
2.6.2 主成分分析 采用 SPSS19.0 软件对全部样品进行主成分分析,见图 4。结果表明,S1~S9 分布在轴右侧区域,而 S10~S16 分布在轴左侧区域。该图直观反映了各批样品之间的差异大小,与聚类分析、相似度分析结果一致。
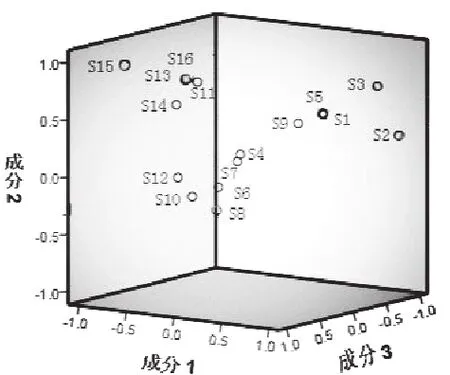
图 4 主成分分析图
3 讨论
救必应主要含有黄酮类和三萜类化合物,这2类化合物的最大吸收波长差异较大,相关文献中的检测波长也不一致,有 210 nm[12]、265 nm[15]、290 nm[16]。岛津高效液相色谱仪 PDA 检测器有 Max Plot绘图功能,每个峰都是在其最大吸收波长下采集的,因此本试验结果可以反映各化合物最优的色谱图。
本试验对色谱条件考察了乙腈-0.5%冰乙酸溶液、乙腈-水、甲醇-水、甲醇-0.5%冰乙酸溶液等不同流动相体系[1,11-13],结果甲醇-0.5%冰乙酸溶液的色谱峰峰形好且稳定,大多数峰分离良好;同时考察了 25、30、35 ℃柱温条件下各色谱峰的分离情况,结果表明,不同柱温条件下色谱峰略有区别,当温度升高时,部分峰发生位移与合并,使分离度降低,因此选择柱温为 30 ℃[13,16]。
本试验分别对提取溶剂(30%、50%、70%、100%甲醇)、提取方式(超声、加热回流)、提取时间(30、60 m in)及提取体积(10、20、30 m L)进行了考察,最终选用 50%甲醇超声提取 30 m in,提取体积 10 m L,可以使提取更为完全,提取效率更高。
《中华人民共和国药典》对救必应性状的描述是“厚 1~15 mm”,但本研究收集的 16 批样品厚度均不超过 10 mm,米碎木厚度也有低于 15 mm 的,厚度不应成为救必应与米碎木的区别特征。文献[12,17]认为救必应与米碎木的特征性区别在于后者断面呈沙粒样,但本研究收集的救必应药材的断面也具有少量的沙粒样。两者表面均比较粗糙,内表面均具有浅条纹,救必应更多地具有卷筒状外观,米碎木并不都是块状。依据这些性状尚不能确切对两者进行鉴别。
本研究成功建立了救必应及其伪品米碎木的HPLC 指纹图谱,指出了救必应与米碎木的显著差异,救必应有 31 个共有峰,米碎木有 28 个共有峰。从 16批样品 HPLC 指纹图谱的相似度及聚类分析、主成分分析可以看出,S1~S9 为一类,S10~S16 为另一类,与性状鉴别的鉴定结果一致,能够客观、准确地判别救必应药材的真伪,可以有效用于救必应药材的质量控制。本研究建立的指纹图谱评价方法简便易行、稳定可靠、重复性好,可为进一步提高救必应的质量提供科学依据。
[1] 陆小鸿.“药王奇树”铁冬青[J].广西林业,2014(5):28-29.
[2] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:312.
[3] 彭喻嫄,梁敬钰,冯锋.救必应的研究进展[J].海峡药学,2014,26(12):4-8.
[4] WANG C, CHAO Z M, SUN W, et al. Isolation of f ive glycosides f rom the barks of Ilex rotunda by high-speed counter-cur rent chromatography[J]. J Liquid Chromatogr Relat Technol,2014,37(16): 2363-2376.
[5] WANG C, CHAO Z, SUN W, et al. Enrichment and purif ication of pedunculoside and syringin f rom the barks of Ilex rotunda with macroporous resins[J]. J Liq Chromatogr Relat Technol,2014,37(4):572-587.
[6] 苏碧茹.中成药中救必应的薄层色谱鉴别[J].中药材,2000,23(8):490.
[7] 缪亚秀,柯进.和胃安神方治疗失眠的临床观察[J].中国处方药,2016, 14(7):95-96.
[8] 刘莉,刘强.一种消暑利湿的凉茶及其制备方法:201010506323.X[P]. 2011-04-06.
[9] 孔婷,张朝燕,包斌,等.中草药活性成分在功效型牙膏中的研究与应用[J].中药材,2013,36(1):156-162.
[10] 徐春生,徐文霞.救必应中药牙膏的安全性研究[J].口腔护理用品工业,2014,24(6):9-14.
[11] 梁永枢,谈丽华.救必应及其混淆品米碎木的鉴别[J].时珍国医国药, 2002,13(11):封 4.
[12] 欧阳燕琴,严萍,陈桌俊,等.救必应商品药材的质量评价[J].广州中医药大学学报,2015,32(6):1075-1081,1152.
[13] 代蕾,应鸽,黄培琪,等.救必应及其常用同属药用植物高效薄层指纹图谱研究[J].广东药学院学报,2012,28(3):277-281.
[14] 李凤丽,李进,吴娇.指纹图谱技术在中药领域研究中应用现状[J].天津药学,2014,26(3):52-57.
[15] 李惠琴.不同来源救必应紫丁香苷的含量测定[J].海峡药学,2014, 26(10):57-58.
[16] 蒋莉娟,皮胜玲,方铁铮,等.救必应药材高效液相色谱指纹图谱研究[J].中南药学,2016,14(3):235-238.
[17] 顾利红,毕福钧,陈蔼.不同来源救必应药材的质量评价[J].中草药, 2013,44(5):622-625.
Identification of Ilicis Rotundae Cortex and Its Adulterant Based on HPLC Fingerprint
Yu-cui1, WANG Chun1, WANG Wei2, WU Cui1, DU Ning2, SUN Wen1, LI Hui1, CHAO Zhi-mao1(1. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China; 2. Beijing Center for Physical and Chemical Analysis, Beijing 100094, China)
Objective To establish HPLC fingerprints for the identification of Ilicis Rotundae Cortex (Jiubiying), dried bark of Ilex rotunda Thunb., and its adulterant, dried bark of Ilex godajam (Colebr.) Wall.. Methods Some samples named “Jiubiying” were collected from some medicine markets and drugstores. The HPLC fingerprints were obtained to detect Jiubiying and Ilex godajam. The software “Similarity Evaluation System of Chromatographic Fingerprints of Traditional Chinese Medicine (2004A edition)” was used to evaluate fingerprints. Results The fingerprints of Jiubiying and Ilex godajam were established. Methodological study met the technical requirements of fingerprints. There were 31 and 28 common peaks in Jiubiying and Ilex godajam, respectively. Jiubiying and Ilex godajam could be classified into two clusters by principal component analysis and hierarchical clustering analysis. Conclusion Jiubiying and Ilex godajam can be identified by HPLC fingerprints. This method can provide an effective method for quality evaluation of Jiubiying.
Ilicis Rotundae Cortex (Jiubiying); Ilex godajam (Colebr) Wall.; HPLC; fingerprint; principal component analysis; quality control
R284.1
A
1005-5304(2017)08-0089-04
2017-01-03)
(
2017-02-27;编辑:陈静)
国家质量监督检验检疫总局行业科研专项(201210209)
巢志茂,E-mail:chaozhimao@163.com
10.3969/j.issn.1005-5304.2017.08.020
