加味当归贝母苦参丸对MFC胃癌荷瘤小鼠瘤组织Toll样受体通路分子的影响
2017-08-07李海龙王勇翟宇程小丽安霞李红亮康万荣吴红彦
李海龙,王勇,翟宇,程小丽,安霞,李红亮,康万荣,吴红彦
1.甘肃中医药大学临床医学院,甘肃 兰州 730000;2.甘肃省中医方药挖掘与创新转化重点实验室,甘肃省中药药理与毒理学重点实验室,甘肃 兰州 730000;3.甘肃中医药大学教学实验中心,甘肃 兰州 730000;4.甘肃中医药大学附属医院,甘肃 兰州 730020
加味当归贝母苦参丸对MFC胃癌荷瘤小鼠瘤组织Toll样受体通路分子的影响
李海龙1,2,王勇1,2,翟宇1,2,程小丽3,安霞4,李红亮2,康万荣2,吴红彦2
1.甘肃中医药大学临床医学院,甘肃 兰州 730000;2.甘肃省中医方药挖掘与创新转化重点实验室,甘肃省中药药理与毒理学重点实验室,甘肃 兰州 730000;3.甘肃中医药大学教学实验中心,甘肃 兰州 730000;4.甘肃中医药大学附属医院,甘肃 兰州 730020
目的 观察加味当归贝母苦参丸对 MFC 胃癌荷瘤小鼠瘤组织 Toll样受体(TLR2、TLR4、TLR6)、肿瘤坏死因子受体相关因子 6(TRAF6)和髓分化因子 88(MyD88)表达的影响,探讨其相关的作用机制。方法 建立 MFC 胃癌荷瘤小鼠模型进行体内抗肿瘤试验。将筛选合格的 48 只 MFC 胃癌荷瘤小鼠随机分为模型组,阳性对照组(顺铂组),加味当归贝母苦参丸高剂量组(当高组)、低剂量组(当低组)和顺铂联合加味当归贝母苦参丸高剂量组(顺高组)、低剂量组(顺低组),各给药组给予相应药物灌胃,连续 14 d,观察肿瘤生长情况及小鼠一般情况、肿瘤大体标本及 HE 染色后组织形态;RT-qPCR 和免疫组化分别检测肿瘤组织TLR2、TLR4、TLR6、TRAF6 和 M yD88 的表达。结果 模型组肿瘤细胞丰富,细胞大小不一、体积大、核大深染、异型明显,可见小灶性坏死,间质血管丰富;各给药组肿瘤细胞数量减少、排列疏松、细胞体积明显缩小、核固缩,细胞坏死明显增加,间质血管数量减少,胶原纤维增多,其中以顺低组、顺高组较为明显。与模型组比较,各给药组 TLR2、TLR4、TLR6、TRAF6 和 MyD88 mRNA 和蛋白表达均降低,顺低组、顺高组TLR2、TLR4、TLR6、TRAF6 和 M yD88 蛋白着色变浅,呈弱阳性表达,较顺铂组、当高组、当低组蛋白改变更加明显。结论 加味当归贝母苦参丸可能通过下调荷瘤小鼠肿瘤组织 TLR2、TLR4、TLR6、TRAF6 和MyD88 mRNA 和蛋白的表达,发挥抗肿瘤作用。
加味当归贝母苦参丸;胃癌;Toll样受体通路;小鼠
胃癌是全球高发的恶性肿瘤之一,据国家癌症中心 2015 年统计,胃癌在我国恶性肿瘤死亡排名第 3位[1]。体内外实验显示,当归贝母苦参丸干预胃癌和肝癌的药效明确[2-3]。当归贝母苦参丸出自《金匮要略》,原用于治疗妊娠小便困难。本实验以当归贝母苦参丸为基础方,增加黄芪、山慈菇、全蝎组成当归贝母苦参丸加味方。该方具有活血化瘀、化痰散结、解毒攻癌,兼顾调节机体补虚扶正、化生气血的功效。近年来研究发现,Toll样受体(TLRs)与炎症相关肿瘤发生发展密切相关[4]。TLRs 是机体天然免疫系统中模式识别受体,可识别不同病原体相关分子模式(PAMPs),从而启动相关下游 TLR4 胞内信号通路,包括髓分化因子(MyD88)依赖和非依赖途径[5]。TLR4激活 MyD88 后,活化的 MyD88 聚集并结合 IRAK1和 IRAK2,然后作用于肿瘤坏死因子受体相关因子 6(TRAF6),进一步激活丝裂原活化蛋白激酶(MAPK)和核因子-κB(NF-κB)信号转导通路[6]。本研究采用 RT-qPCR 和免疫组化检测,探讨加味当归贝母苦参丸的抑瘤作用及对荷瘤鼠 MFC 胃癌组织TLR2、TLR4、TLR6 和 MyD88 表达的影响,为其临床防治胃癌提供有效的科学依据。
1 材料与方法
1.1 动物
SPF 级 BALB/c-nu 小鼠 60 只,雌、雄各半,体质量(20±2)g,北京维通利华实验动物技术有限公司。动物许可证号 SCXK(京)2012-0001。饲养于室温 20~25 ℃、湿度 45%~55%环境,分笼饲养,自由摄食饮水。
1.2 细胞、药物及制备
MFC 前胃癌细胞,中科院上海细胞库。加味当归贝母苦参丸(黄芪、当归、浙贝母、苦参、山慈菇、全蝎),饮片购自甘肃中医药大学附属医院,加 10 倍量水浸泡 1 h,加热煮沸 40 m in,滤出煎液,药渣再加 6 倍量水加热煮沸 40 m in,合并 2 次煎液,70 ℃水浴蒸发浓缩至含 1.0 g 原药材/m L;顺铂注射液,江苏毫森药业股份有限公司,20 mg/支,批号 20160522,将 30 mg 顺铂粉针加生理盐水,稀释为 0.25 mg/m L,4 ℃冰箱保存备用。
1.3 主要试剂和仪器
胎牛血清(杭州四季青公司),反转录试剂盒DR036A(上海宝生物工程有限公司),扩增试剂盒(PREMEGO 公司),二抗(中杉金桥公司),TLR2、TLR4、TLR6、TRAF6 和 MyD88 一抗(IMMONOWAY公司)。生物安全柜、DMEM 培养基(健顺生物公司),CO2培养箱(力康公司),倒置显微镜(日本OLYMPUS),ABI7500 荧光 PCR 仪(美国 ABI公司)。
2 实验方法
2.1 造模
将冻存细胞株取出,快速置于 37 ℃水浴解冻,并转移细胞液于离心管中,加入适量培养液(高糖DMEM+10%胎牛血清),1000 r/m in 离心 3 min,弃上清液,加入适量培养液重悬细胞,将细胞悬液接种入培养瓶,置于 37 ℃、5%CO2、饱和湿度培养箱培养,待细胞完全贴壁后,PBS 清洗细胞 3遍,更换培养液。1~2 d 换液 1 次。每日倒置显微镜下观察,当细胞生长状态良好铺满瓶底时,25%胰酶常规方法消化、传代,待细胞长至对数生长期时传代,弃去培养基,将细胞制成悬液,浓度调整为 15×106/m L,小鼠腋下接种胃癌 MFC 细胞,每只 0.2 m L。
2.2 分组和给药
造模后观察肿瘤体积直径达 0.5 cm 时,剔除体积过大或过小小鼠,48 只筛选合格小鼠随机分为模型组、阳性对照组(顺铂组)、加味当归贝母苦参丸高剂量(当高组)、加味当归贝母苦参丸低剂量组(当低组)和顺铂联合加味当归贝母苦参丸高剂量组(顺高组)、顺铂联合加味当归贝母苦参丸低剂量组(顺低组)。第 2 日开始,模型组小鼠予蒸馏水 0.2 m L 灌胃及腹腔注射生理盐水 0.1 m L;当高组、当低组予中药 0.2 m L 灌胃,每日 1 次;顺铂组予蒸馏水 0.2 m L灌胃及腹腔注射顺铂(25 mg/kg)0.1 m L,隔 5 d 给药1次,共3次;顺高组、顺低组予等量中药灌胃及腹腔注射顺铂(25 mg/kg)0.1 m L,共 14 d。第 15 日18∶00 时禁食,不禁水。第 16 日处死小鼠取材备检。
2.3 肿瘤大体标本及组织形态观察
对荷瘤小鼠肿瘤组织进行剥离并进行肉眼观察,对肿瘤体积、颜色和质地进行记录,与此同时,需观察确定肿瘤组织假膜完整程度,是否存在出血状况等。随后 4%多聚甲醛固定,常规脱水,石蜡包埋,切片,染色。对肿瘤组织和细胞形态进行镜检,实体瘤疗效以抑瘤率表示。抑瘤率(%)=(模型组平均瘤重-实验组平均瘤重)÷模型组平均瘤重×100%。
2.4 荧光定量 PCR 检测 TLR2、TLR4、TLR6、TRAF6和 MyD88 mRNA 表达
称取 30 mg 肿瘤组织置于无 RNA 酶的 EP 管中匀浆,再加 1 m L 提取液静置 5 m in,常规低温抽提总RNA 后溶解并检测其浓度,用 Takara 036A 反转录试剂盒反转录合成 cDNA。使用 ABI7500 荧光定量 PCR仪进行扩增。扩增条件:95 ℃、5 m in 预变性,95 ℃、10 s,60 ℃、20 s,40 个循环,并分析融解曲线,确认扩增产物的特异性,相对表达量采用 2-ΔΔCT法计算,实验重复 3次,基因引物序列见表 1。
2.5 免疫组化检测 TLR2、TLR4、TLR6、TRAF6 和 MyD88蛋白表达
采用 ABC 法。切片常规脱蜡水化,3%去离子水灭活内源性酶 10 min,微波修复抗原 5 m in,间隔重复 1 次;然后依次滴加 TLR2、TLR4、TLR6、TRAF6和 MyD88 一抗及生物素化山羊抗兔二抗;滴加SABC,DAB 显色,苏木素复染,梯度脱水透明后封片,显微镜下观察。以胞浆中出现棕黄色颗粒为阳性。应用图像分析系统记录各自 TLR2、TLR4、TLR6、TRAF6 和 M yD88 积分光密度和平均灰度,作为蛋白表达的量化指标,每组各取材5个样本。
3 统计学方法
采用 SPSS17.0 统计软件进行分析。计量资料以—x±s表示,组间比较用方差分析,方差齐用 LSD 法,方差不齐用 Dunnett'T3 法。P<0.05 表示差异有统计学意义。
4 结果
4.1 加味当归贝母苦参丸对 MFC 胃癌荷瘤小鼠瘤组织抑制率的影响
顺铂组小鼠体质量逐渐下降,精神差,进食减少,反应迟钝,当高组、顺高组状态较好,瘤质量较模型组差异有统计学意义(P<0.05,P<0.01)。结果见表 2。
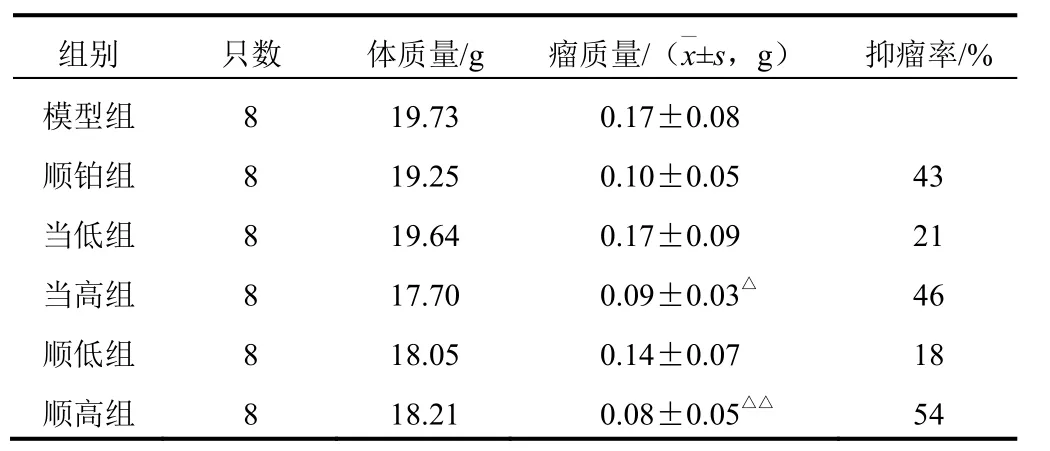
表 2 各组小鼠瘤质量和抑瘤率比较
4.2 肿瘤大体标本及组织形态观察结果
模型组肿瘤细胞丰富,细胞大小不一、体积大、核大深染、异型明显,可见小灶性坏死,间质血管丰富;当低组肿瘤细胞丰富,细胞大小不一、体积相对缩小、核大深染,部分细胞核固缩,可见小灶性坏死、间质血管丰富,肿瘤细胞周围胶原纤维增多;当低组、当高组、顺铂组、顺低组、顺高组肿瘤细胞数减少、排列疏松,细胞体积缩小、核固缩,细胞坏死增加,间质血管数量减少,胶原纤维增多。结果见图1。
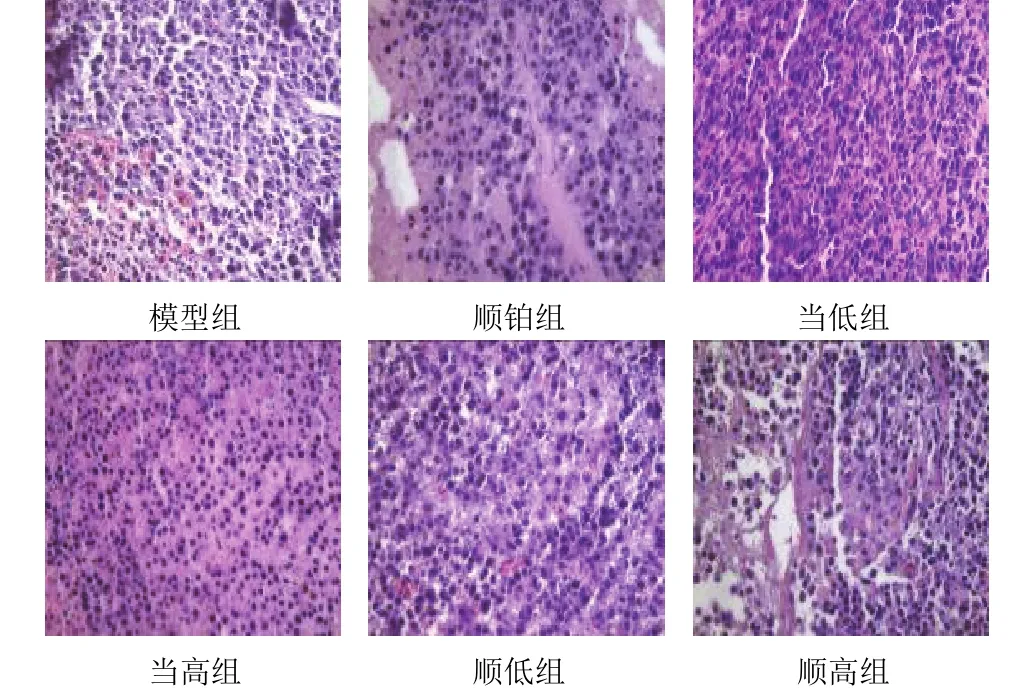
图 1 各组小鼠肿瘤组织病理形态(HE 染色,×400)
4.3 加味当归贝母苦参丸对荷瘤小鼠 MFC 胃癌瘤组织 TLR2、TLR4、TLR6、TRAF6 和 MyD88 mRNA 表达的影响
与模型组比较,各给药组 TLR2、TLR4、TLR6、TRAF6 和 MyD88 mRNA 表达均有不同程度变化,当高组、顺低组和顺高组变化较为明显。结果见表3。
4.4 加味当归贝母苦参丸对荷瘤小鼠 MFC 胃癌瘤组织 TLR2、TLR4、TLR6、TRAF6 和 MyD88 蛋白表达的影响
胞浆或胞膜出现黄色或棕黄色颗粒为阳性着色。与模型组比较,各给药组 TLR2、TLR4、TLR6、TRAF6和 MyD88 蛋白着色较深,表明为强阳性或阳性表达,而模型组则呈现弱阳性或阴性表达。结果见表4、表5和图 2~图 6。
表 3 各组小鼠肿瘤组织 TLR2、TLR4、TLR6、TRAF6 和 MyD88 mRNA 表达比较(±s,2-ΔΔCT)
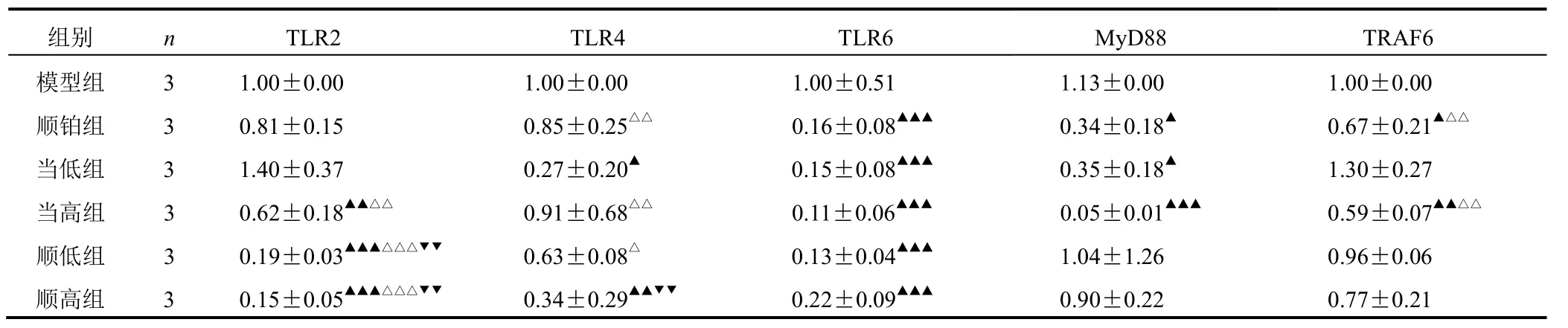
表 3 各组小鼠肿瘤组织 TLR2、TLR4、TLR6、TRAF6 和 MyD88 mRNA 表达比较(±s,2-ΔΔCT)
注:与模型组比较,▲P<0.05,▲▲P<0.01,▲▲▲P<0.001;与当低组比较,△P<0.05,△△P<0.01,△△△P<0.001;与顺铂组比较,▼P<0.05,▼▼P<0.01,▼▼▼P<0.001;与顺低组比较,▽P<0.05,▽▽P<0.01,▽▽▽P<0.001(下同)
组别 n TLR2 TLR4 TLR6 M yD88 TRAF6模型组 3 1.00±0.00 1.00±0.00 1.00±0.51 1.13±0.00 1.00±0.00顺铂组 3 0.81±0.15 0.85±0.25△△ 0.16±0.08▲▲▲ 0.34±0.18▲ 0.67±0.21▲△△当低组 3 1.40±0.37 0.27±0.20▲ 0.15±0.08▲▲▲ 0.35±0.18▲ 1.30±0.27当高组 3 0.62±0.18▲▲△△ 0.91±0.68△△ 0.11±0.06▲▲▲ 0.05±0.01▲▲▲ 0.59±0.07▲▲△△顺低组 3 0.19±0.03▲▲▲△△△▼▼ 0.63±0.08△ 0.13±0.04▲▲▲ 1.04±1.26 0.96±0.06顺高组 3 0.15±0.05▲▲▲△△△▼▼ 0.34±0.29▲▲▼▼ 0.22±0.09▲▲▲ 0.90±0.22 0.77±0.21
表 4 各组小鼠肿瘤组织 TLR2、TLR4、TLR6、TRAF6 和 MyD88 蛋白表达比较(s,积分光密度)

表 4 各组小鼠肿瘤组织 TLR2、TLR4、TLR6、TRAF6 和 MyD88 蛋白表达比较(s,积分光密度)
组别 n TLR2 TLR4 TLR6 M yD88 TRAF6模型组 5 51 580.77± 8 789.62 48 426.71±4009.63 59 149.07±12 242.74 60 528.31±14 388.93 40 908.03± 7 204.26顺铂组 5 26 004.03± 8 297.62▲▲▲△△△33 698.95±4463.42▲▲ 28 643.62± 6 182.55▲▲ 39 907.11± 6 382.09▲▲ 15 992.68± 6 162.31▲▲△△当低组 5 62 899.57± 9 564.33 36 716.74±6486.72▲▲ 51 396.54± 6 934.28 51 385.57±13 180.59 53 034.00±11 372.75当高组 5 29 292.88±14 203.12▲▲▲△△59 534.89±7761.74▲▲△△△ 26 444.05±12 110.22▲▲△△△49 113.19±10 848.19 33 959.18± 9 279.70顺低组 5 29 039.61± 8 219.32▲▲▲△△△25 638.99±3519.62▲▲△△▼ 19 987.26± 5 542.95▲▲△△△40 399.84±10 609.29▲▲ 19 515.75±11 404.74△顺高组 5 18 438.29± 7 323.22▲▲▲△△△19 805.51±3884.25▲▲△△△▼▼▼19 636.58±10 545.93▲▲△△△18 188.49± 8 369.30▲▲▲△△△▼▼▽▽28 206.35±14 656.73
表 5 各组小鼠肿瘤组织 TLR2、TLR4、TLR6、TRAF6 和 MyD88 蛋白表达比较(±s,平均灰度值)

表 5 各组小鼠肿瘤组织 TLR2、TLR4、TLR6、TRAF6 和 MyD88 蛋白表达比较(±s,平均灰度值)
组别 n TLR2 TLR4 TLR6 M yD88 TRAF6模型组 5 91.33±1.79 77.68±3.76 88.61±1.88 81.35±2.38 76.92±2.35顺铂组 5 109.29±2.23▲▲▲△△ 101.88±1.92▲▲▲△△△ 118.33±1.00▲▲▲△△△ 109.99±1.79▲▲▲△△△ 112.10±2.09▲▲▲△△△当低组 5 97.49±0.62▲▲ 91.89±0.75▲▲▲ 101.98±1.24▲▲▲ 89.24±4.90▲▲▲ 89.24±5.03▲▲▲当高组 5 104.04±4.19▲▲▲△△ 99.05±2.82▲▲▲△△△ 110.03±1.58▲▲▲△△△ 100.29±2.21▲▲▲△△△ 103.26±1.64▲▲▲△△△顺低组 5 114.14±2.43▲▲▲△△△ 119.40±1.49▲▲▲△△△▼▼▼ 126.43±1.93▲▲▲△△△▼▼▼ 114.02±1.97▲▲▲△△△▼ 116.36±2.02▲▲▲△△△▼顺高组 5 119.55±3.63▲▲▲△△△▼▼▼ 122.85±1.56▲▲▲△△△▼▼▼▽ 128.28±2.03▲▲▲△△△▼▼▼ 122.71±1.75▲▲▲△△△▼▼▼▽▽▽118.69±1.86▲▲▲△△△▼▼

图 2 各组小鼠肿瘤组织 TLR2 病理形态(免疫组化染色,×400)

图 3 各组小鼠肿瘤组织 TLR4 病理形态(免疫组化染色,×400)

图 4 各组小鼠肿瘤组织 TLR6 病理形态(免疫组化染色,×400)

图 5 各组小鼠肿瘤组织 M yD88 病理形态(免疫组化染色,×400)

图 6 各组小鼠肿瘤组织 TRAF6 病理形态(免疫组化染色,×400)
5 讨论
炎症可通过 TLRs诱导内源性介质,促进肿瘤发生发展。TLRs 高表达与肿瘤的增殖、侵袭转移密切相关,如陈战等[7]研究显示,胃癌组织中 TLR4 mRNA和蛋白表达高于癌旁组织,其表达与胃癌分期、远处转移具有相关性,孙运良等[8]研究显示,TLR4 可能参与了胃癌的发生和发展,有淋巴结转移者 TLR4阳性率显著高于无淋巴结转移者,TNM 分期为Ⅲ+Ⅳ期者 TLR4 蛋白表达率明显高于Ⅰ+Ⅱ期者,Spearman 等级相关分析表明,TLR4 蛋白表达与 MVD呈显著正相关。Pimentel-Nunes P 等[9]研究表明,TLR2与幽门螺杆菌感染及胃癌发生均相关。本课题组前期研究也发现,TLR2、TLR4、TLR6 mRNA 在不同分化程度胃癌细胞中的表达相对于正常胃黏膜上皮GES-1 细胞明显上调;不同浓度脂多糖干预胃癌SGC7901、BGC-823、MGC-803 细胞后,TLR2、TLR4、 TLR6 表达也明显上调[10]。
刘鹏军等[11]研究显示,胃癌组织 TRAF6 阳性表达高于癌旁正常组织,其阳性表达与胃癌组织分化程度、TNM 分期有关,可能参与胃癌的浸润及转移。Han F 等[12]研究认为,TRAF6 是预后不良的胃癌患者的预测。张金明等[13]研究显示,MyD88 在食管癌组织中的阳性表达率为 92.0%,明显高于癌旁组织中17.3%的阳性表达率;M yD88 的阳性表达与临床分期和淋巴结转移呈正相关。唐乐辉等[14]研究显示,与癌旁正常组织相比,M yD88 在乳腺癌组织中表达明显增高;MyD88 的阳性表达与肿瘤的 TNM 分期、肿瘤大小、淋巴侵袭转移密切相关。厉鸥等[15]研究发现,MyD88 蛋白在肝癌组织中的阳性表达高于癌旁组织,MyD88 和 STAT3 表达与性别、分化程度、有无 HBV感染和肝硬化有关。秦艳等[16]研究发现,MyD88 蛋白表达与结直肠腺瘤及结直肠癌中腺瘤异型性相关。
Maeda Y 等[17]研究表明,在炎症相关胃癌小鼠模型中,阻断 MyD88 的表达可以降低巨噬细胞中 TLR2与 COX-2/PGE2 的表达,M yD88 与 COX-2/PGE2 共同参与了肿瘤炎症微环境的产生,并通过诱导 TLR2的表达促进肿瘤的发生发展。Obonyo M 等[18]研究表明,幽门螺杆菌可以激活巨噬细胞中 TLR2 和 TLR4的表达,TLR2 激活 MyD88 通路对幽门螺杆菌诱导产生 IL-6 和 IL-1β 起到至关重要的作用。Kennedy C L等[19]报道,在 gp130 基因消减(F/F)小鼠胃癌模型中,TLR2 可以促进肿瘤的增殖,而沉默 MyD88 基因可以抑制肿瘤的发生,其作用与促进胃癌上皮细胞凋亡和抑制其增殖有关。
本研究结果显示,加味当归贝母苦参丸方可使肿瘤组织瘤体缩小,抑瘤作用明显,并且与化疗药物联用后抗肿瘤作用更加明显。免疫组化研究显示,当归贝母苦参丸加味方可抑制肿瘤组织 TLR2、TLR4、TLR6、TRAF6 和 MyD88 mRNA 和蛋白的表达,并且与化疗药物联用后 TLR2、TLR4、TLR6、TRAF6和 MyD88 mRNA 和蛋白下调表达更明显。另外,TLR2、TLR4、TLR6/MyD88 通路及下游 TRAF6 炎证相关通路参与了胃癌发病机制,加味当归贝母苦参丸可调控该通路发挥抗肿瘤作用。值得注意的是,中药治疗引起的靶标分子转录层次的改变与蛋白层次的改变并不同步,蛋白层次的表达改变更加显著一些,这说明中药治疗效应除经过基因转录外,表观遗传改变也可能起作用,这有待进一步深入研究。
综上所述,当归贝母苦参丸加味方对荷瘤小鼠MFC 胃癌的抗瘤作用与下调 TLRs通路分子 TLR2、TLR4、TLR6、RAF6 和 MyD88 mRNA 和蛋白的表达有关。
[1] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Cl in,2016,66(2):115-132.
[2] 师金凤,李海龙,吴红彦,等.当归贝母苦参丸含药血清对胃癌细胞SGC-7901 和侵袭转移能力和周期的影响[J].辽宁中医药大学学报,2014, 16(10):30-33.
[3] 闫德祺,刘永琦,李应东,等.当归贝母苦参丸对顺铂化疗 H22 荷瘤小鼠的抑瘤作用及对血清 HIF-1α和 LDH 的影响[J].中成药,2014,36(7):1351-1355.
[4] 曾治民,何静,刘安文.Tol l 样受体信号传导与炎症相关肿瘤的关系[J].中国癌症杂志,2011,21(6):489-494.
[5] PARK B S, LEE J O. Recognition of l ipopolysaccharide pat tern by TLR4 complexes[J]. Exp Mol Med,2013,45:e66.
[6] 杨一新,李桂源.LPS 所介导的信号转导通路研究进展[J].中南大学学报:医学版,2006,31(1):141-145.
[7] 陈战,涂永久,郭明,等.胃癌组织中 Tol l 样受体 4/9 的表达与肿瘤病理分期和转移的相关性[J].中国肿瘤生物治疗杂志,2011,18(2):201-205.
[8] 孙运良,满晓华,吴红玉,等.TLR4 蛋白在胃癌组织中的表达及其与微血管密度的关系[J].山东医药,2012,52(39):69-71.
[9] PIMENTEL-NUNES P, GONÇALVES N, BOAL-CARVALHO I, et al. Helicobacter pylori induces increased expression of Tol l-like receptors and decreased Tol l-interacting protein in gast ric mucosa that persists throughout gastric carcinogenesis[J]. Hel icobacter,2013,18(1):22-32.
[10] 侯金霞,王宏伟,李海龙.脂多糖对胃癌细胞 mir-146a-5p、mir-335-5p及 TLR(1~10)受体表达的影响[J].检验医学与临床,2016,13(15):2158-2162.
[11] 刘鹏军,石红建,张利霞,等.胃癌组织 TRAF3、TRAF6 阳性表达及意义[J].山东医药,2016,56(8):42-43.
[12] HAN F, ZHANG L, QIU W, et al. TRAF6 promotes the invasion and metastasis and predicts a poor prognosis in gast ric cancer[J]. Pathol Res Pract,2016,212(1):31-37.
[13] 张金明,陈延超,李德闽,等.髓样分化因子 MyD88 在食管癌组织中的表达及意义[J].山东医药,2014,54(9):57-58.
[14] 唐乐辉,任国胜.髓样分化因子 MyD88 在乳腺癌与癌旁正常组织中的表达与意义[J].第三军医大学学报,2012,34(13):1322-1325.
[15] 厉鸥,王方明.MyD88、TLR4 和 STAT3 在肝细胞癌组织中的表达及意义[J].中国现代医学杂志,2011,21(9):1089-1094.
[16] 秦艳,吴玉玉,白瑞珍,等.结直肠腺瘤及结直肠癌中 TLR7 TLR9 及MyD88 的表达[J].长治医学院学报,2013,27(6):406-409.
[17] MAEDA Y, ECHIZEN K, OSHIMA H, et al. Myeloid di f ferentiation factor 88 signaling in bone marrow-derived cel ls promotes gastric tumorigenesis by generation of inf lammatory microenvironment[J]. Cancer Prev Res (Phi la),2016,9(3):253-263.
[18] OBONYO M, SABET M, COLE S P, et al. Def iciencies of myeloid dif ferentiation factor 88, Tol l-l ike receptor 2 (TLR2), or TLR4 produce specif ic defects in macrophage cytokine secretion induced by Helicobacter pylori[J]. Infect Immun,2007,75(5):2408-2414.
[19] KENNEDY C L, NAJDOVSKA M, TYE H, et al. Dif ferential role of MyD88 and Mal/TIRAP in TLR2-mediated gast ric tumourigenesis[J]. Oncogene,2014,33(19):2540-2546.
Effects of Modified Danggui Beimu Kushen Pills on Toll-like Receptor Pathway Markers on MFC Gastric Cancer M ice
LI Hai-long1,2, WANG Yong1,2, ZHAI Yu1,2, CHENG Xiao-li3, AN Xia4, LI Hong-liang2, KANG Wan-rong2, WU Hong-yan2(1. School of Clinical Medicine, Gansu University of Chinese Medicine, Lanzhou 730000, China; 2. Key Laboratory of Traditional Chinese Herbs and Prescription Innovation and Transformation of Gansu Province, Key Laboratory of TCM Pharmacology and Toxicology in Gansu Province, Gansu University of Chinese Medicine, Lanzhou 730000, China; 3. Teaching and Research Center, Gansu University of Chinese Medicine, Lanzhou 730000, China; 4. Affiliated Hospital of Gansu University of Chinese Medicine, Lanzhou 730020, China)
Objective To study the effects of modified Danggui Beimu Kushen Pills on the expressions of TLR2, TLR4, TLR6, TRAF6 and M yD88 in tumor tissues on MFC gastric cancer bearing m ice; To discuss relevant mechanism of action. Methods MFC gastric cancer bearing mice were employed to perform anti-tumor experiment in vivo in this study. A total of eligible 48 mice were random ly divided into model group, DDP positive control group, modified Danggui Beimu Kushen Pills high-dose and low-dose groups, modified Danggui Beimu Kushen Pills high-dose and low-dose combined With DDP groups. The treatment was conducted once a day, and lasted for 14 continuous days. After the last administration of gavage orally treatment, all mice were anaesthetized and killed bycervical dislocation method to obtain tumor tissue completely for further HE staining measure and detection of TLR2, TLR4, TLR6, TRAF6 and MyD88 in tumor tissue With the method of RT-qPCR and immunohistochemistry. Meanwhile, the tumor grow th was observed and the general conditions of mice were recorded. Results The model group was rich in tumor cells; the sizes of cells were different; the volume was large; the nucleus was deeply stained and the heterotypic shape was obvious, and the small focal necrosis was seen. The number of tumor cells in each adm inistration group was reduced; the arrangement was loose; the cell volume was significantly reduced, and the nuclear pyknosis was reduced. Cell necrosis significantly increased; the number of interstitial blood vessels decreased; collagen fibers increased, especially in modified Danggui Beimu Kushen Pills high-dose and low-dose combined With DDP groups. Compared with the model group, the expressions of TLR2, TLR4, TLR6, TRAF6 and MyD88 mRNA and protein decreased in each adm inistration group. TLR2, TLR4, TLR6, TRAF6 and MyD88 were lighter and weakly positive expressed in modified Danggui Beimu Kushen Pillshigh-dose and low-dose combined With DDP groups, the protein changes were more obvious Compared with DDP positive control group, modified Danggui Beimu Kushen Pills high-dose and low-dose groups. Conclusion Modified Danggui Beimu Kushen Pills can down-regulate TLR2, TLR4, TLR6, TRAF6 and MyD88 expression of tumor tissue in MFC gastric cancer bearing mice at both mRNA and protein levels to play anti-tumor pharmacology action.
modified Danggui Beimu Kushen Pills; gastric cancer; Toll-like receptor pathway; m ice
10.3969/j.issn.1005-5304.2017.08.013
R285.5
A
1005-5304(2017)08-0054-06
2016-11-06)
(
2016-12-25;编辑:华强)
甘肃省科技厅自然科学基金 B 类计划项目(1310RJZA099);甘肃省中药药理与毒理学重点实验室开放基金项目(ZDSYS-KJ-2015-010)
吴红彦,E-mail:wu.hy@126.com
