猪流行性腹泻病毒变异毒株一步法SYBR Green I荧光RT-PCR检测方法的建立及应用
2017-08-07山东绿都生物科技有限公司于新友李天芝
■文/山东绿都生物科技有限公司 于新友 李天芝
猪流行性腹泻病毒变异毒株一步法SYBR Green I荧光RT-PCR检测方法的建立及应用
■文/山东绿都生物科技有限公司 于新友 李天芝
为了建立猪流行性腹泻病毒变异毒株快速、敏感的检测方法。本研究利用RT-PCR技术扩增出猪流行性腹泻病毒变异毒株S基因中298bp的保守序列,并克隆到pMD18-T载体中作为标准品制作标准曲线,建立了PEDV的SYBR Green I荧光定量RT-PCR检测方法。该方法检测灵敏度可达5.2×101拷贝,与猪流行性腹泻病毒经典毒株、猪瘟病毒、猪伪狂犬病毒、猪圆环病毒2型、猪蓝耳病毒、猪传染性胃肠炎病毒、轮状病毒均不发生交叉反应,具有良好的特异性和重复性。结果表明,建立的实时荧光定量RT-PCR具有特异、敏感、快速、定量、重复性好等优点,可用于临床PEDV变异毒株的检测。
猪流行性腹泻病毒变异毒株;SYBR Green I;荧光定量RT-PCR
猪流行性腹泻(Porcine Epidemic Diarrhea,PED)是由猪流行性腹泻病毒(Porcine Epidemic Di-arrhea Virus,PEDV)引起的一种猪肠道传染性病毒病,以水样腹泻、呕吐和脱水为特征[1]。该病首次报道于英国[2],随后,世界各国均有相关报道[3,4]。该病主要发生在冬季,夏季也可发生。各年龄的猪均可感染发病,哺乳仔猪、架子猪或育肥猪的感染发病率可达100%,哺乳仔猪病死率可达50%以上,常与猪传染性胃肠炎病毒(Porcine Transmissible Gastroenteritis Virus, TGEV)、轮状病毒(Porcine Rotavirus,PoRV)等其他肠道病毒混合感染,给养猪业带来了很大的经济损失[5]。PEDV属于冠状病毒科(Coronaviridae)、冠状病毒属(Coronavirus)成员,PEDV基因组全长约28kb,为单股正链RNA病毒。其中其主要结构蛋白纤突蛋白(S)对被感染宿主中和抗体的产生、特异性受体的结合以及细胞膜融合等方面具有重要的生物学意义[6],S蛋白的变异将会导致其宿主范围、组织细胞培养及毒力发生改变[7]。我国现阶段广泛流行的PEDV与以往的毒株相比,已经发生了较为明显的变异,变异毒株已成为优势毒株,这可能也是导致免疫失败的一个重要原因[8~10]。PEDV抗原传统的检测方法如病毒分离鉴定、荧光抗体检测、ELISA等,不仅操作繁琐,费时费力,难以检测出微量病毒,而且无法区分PEDV变异毒株与疫苗株或经典毒株。因此,有必要建立一种简便的PEDV变异毒株的检测方法。本试验据PEDV变异毒株S基因保守序列设计1对引物,建立PEDV变异毒株SYBR Green I荧光定量RT-PCR检测方法,为快速检测PEDV变异毒株提供了一种新的方法。
1 材料和方法
1.1 病毒株与病料
猪流行性腹泻病毒(PEDV)变异毒株、猪流行性腹泻病毒(PEDV)经典毒株、猪瘟病毒(CSFV)、猪伪狂犬病毒(PRV)、猪圆环病毒2型(PCV2)、猪蓝耳病毒(PRRSV)、猪传染性胃肠炎病毒(TGEV)、轮状病毒(RV)由山东省滨州畜牧兽医研究院预防兽医学与动物生物技术重点开放实验室保存,临床检测病料为2016年1~10月采自山东省各地猪场临床诊断为PEDV感染的猪的肠道、粪便等。
1.2 试剂和试剂盒
Taq DNA聚合酶、M-MLV反转录酶、RNasin、dNTPs、pMD18-T载体、DL2000 Marker、One Step SYBR PrimeScriptTMRT-PCR Kit(Perfect Real Time)等购自宝生物工程(大连)有限公司,多功能DNA纯化回收试剂盒、高纯质粒小量制备试剂盒购自北京百泰克生物科技有限公司产品,AxyPrep体液病毒DNA/RNA小量试剂盒购自爱思进生物技术(杭州)有限公司。
1.3 RT-PCR引物设计与合成
参照GenBank中登录的PEDV变异毒S基因(JQ257005)序列,应用Primer Premier 5.0软件,设计1对引物,扩增PEDV S基因部分片段298bp,引物由生工生物工程(上海)股份有限公司合成。P1:5'-CGAAAACCAGGGTGTCAA-3',P2:5'-CGGGATGGCTTTGTTAAATA-3'。1.4 PEDV S基因的 RT-PCR
按AxyPrep体液病毒DNA/RNA小量试剂盒使用说明书提取PEDV的RNA,作为模板,按照反转录说明书进行cDNA的合成,PCR扩增体系如下:反应总体系为25μL,其中Premix Taq 12μL,cDNA 2μL,上、下游引物各0.5μL(50μmol/L),加去离子水至25μL。反应程序为:95℃ 5min;94℃ 20s、52℃ 20s、72℃ 20s,35个循环;72℃ 10min。扩增后用质量分数为1.5%琼脂糖凝胶电泳进行检测。
1.5 制备重组质粒标准品
将PCR产物纯化回收后,连接到MD18-T载体,构建重组质粒pMD-S,重组质粒由宝生物工程(大连)有限公司测序验证。将重组质粒pMD-S利用紫外分光光度计测定其在260nm和280nm处的吸光度,计算出质粒中的DNA浓度和纯度,并进行10倍倍比梯度稀释,作为阳性定量标准模板,用于荧光定量RT-PCR的扩增和标准曲线的建立。
1.6 一步法荧光定量RT-PCR
按照One Step SYBR PrimeScript TM RT-PCR Kit(Perfect Real Time)说明配置反应体系,体系总体积为20μL:2×One Step RT-PCR Buffer 10μL,RNase freed H2O 5.6μL,P1(10pmol/μL)和P2(10 pmol/μL)各0.4μL,Ex Taq HS(5U/ μL)0.4μL,PrimeScript RT Enzyme MixⅡ0.4μL,模板RNA 2μL。离心数秒后,放入Light Cyeler 480实时荧光定量PCR仪中,按以下程序进行反应:42℃反转录5min,95℃预变性10s,95℃变性5s,52℃退火10s,72℃延伸10s(此处收集荧光),升降温速度均设置为20℃/s,扩增40个循环。扩增结果Ct值小于37的为阳性,Ct值在37~40之间的被认为可疑,重复试验如果仍然在37~40之间则视为阴性,无Ct值的为阴性。
1.7 荧光定量PCR的扩增及标准曲线的制备
以10倍梯度稀释的已知拷贝数的重组质粒为模板进行荧光定量RTPCR扩增,按1.6方法进行实时定量RT-PCR试验,并利用随机软件进行分析,得到动力学曲线及标准曲线。
1.8 荧光定量 PCR特异性、敏感性、重复性试验
用建立的荧光定量RT-PCR方法对PEDV变异毒株、PEDV经典毒株、CSFV、PRV、PCV2、PRRSV、TGEV、RV进行特异性检测。将模板质粒做10倍梯度稀释,用荧光定量RT-PCR进行扩增,以此测定荧光定量RT-PCR所能检出的最低模板的拷贝数,并与普通PCR比较。选取同一批次的3个不同浓度和不同批次3个不同浓度的质粒标准品作为模板,为评价标准品的稳定性,在同一批次试验中进行测定和在不同批次试验中进行测定,同时设NTC。
1.9 临床样品检测
用建立的荧光定量RT-PCR法对从山东省各地收集的临床疑似病料86份进行PEDV变异毒检测,同时用常规RT-PCR法进行检测,并比较二者检测结果。
2 结果
2.1 目的基因PCR扩增及克隆
利用RT-PCR扩增,琼脂糖凝胶电泳初步检测表明,扩增产物约为298bp,与预期结果相符(图1)。将扩增的目的片段纯化后,克隆于pMD18-T载体中,构建重组质粒pMD-S,将其测序结果与GenBank中PEDV变异毒S基因的相应片段进行比较,结果证实该扩增产物与PEDV变异毒S基因的相应区域的同源性为100%。
2.2 荧光定量PCR标准曲线的建立
以预试验筛选的5个稀释度的重组质粒作模板,进行荧光定量RTPCR扩增,生成动力学曲线和标准曲线,如图2所示,曲线1-5所对应的重组质粒模板浓度分别为5.2×108、5.2×107拷贝、5.2×106拷贝、5.2×105拷贝、5.2×104拷贝,曲线6是阴性对照(即NTC),未发生扩增,线性回归方程为Ct=-3.352×lgcopies+44.80(R2=0.9997)。
在SYBR Green I荧光定量RTPCR完成后进行熔解曲线分析,扩增产物的溶解温度Tm为85.5~86.0℃,无非特异性产物和引物二聚体的峰值出现,标准品均一稳定。
2.3 特异性检验
按建立方法对PEDV变异毒株、PEDV经典毒株、CSFV、PRV、PCV2、PRRSV、TGEV、RV的阳性样品进行荧光定量RT-PCR检测,只有PEDV变异毒株的样品孔出现了单一的s型扩增曲线(图3),表明所建立的针对PEDV的荧光定量RT-PCR方法具有较强的特异性。
2.4 敏感性试验
将制备的质粒模板10倍倍比稀释,并分别以此为模板进行荧光定量RT-PCR扩增,得到不同浓度的质粒标准模板的real-time PCR扩增曲线,曲线1-6所对应的重组质粒模板浓度分别为5.2×105、5.2×104、5.2×103、5.2×102、5.2×101、5.2×100拷贝,结果显示,其灵敏度为5.2×101拷贝,与常规RT-PCR结果对比,荧光定量RT-PCR的灵敏度比常规RT-PCR高100倍(图4)。
2.5 重复性检验
为了验证荧光RT-PCR检测结果的重复性,选取3个标准品进行批内和批间重复性测定,结果样品的Ct值及Tm值批内重复性试验CV值均小于2.0%,批间重复性试验CV值均小于1.0%,表明本方法的重复性好(表1)。D组阴性对照组,未检测到荧光信号。
2.6 临床样品检测
分别用建立SYBR Green I荧光定量RT-PCR和普通RT-PCR方法,对临床收集的86份疑似PEDV样品进行检测,检测结果为:SYBR Green I荧光定量RT-PCR检测到39份阳性,而普通RT-PCR检测到35份阳性。
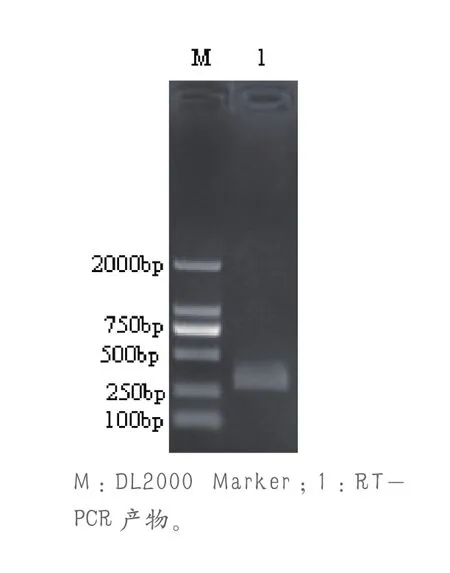
图1 PEDV VP60基因RT-PCR扩增结果
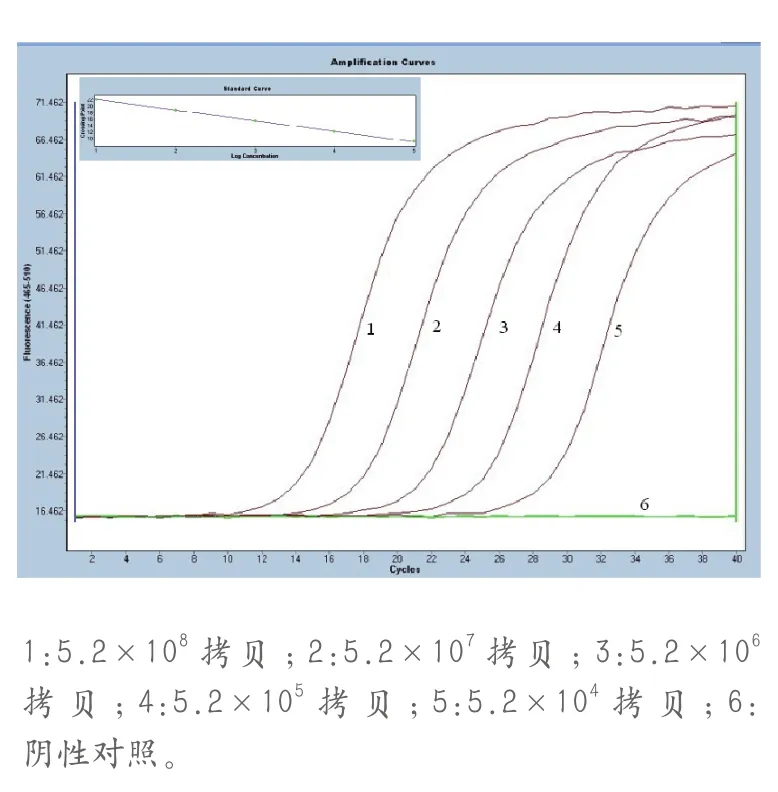
图2 荧光定量PCR动力学曲线和标准曲线
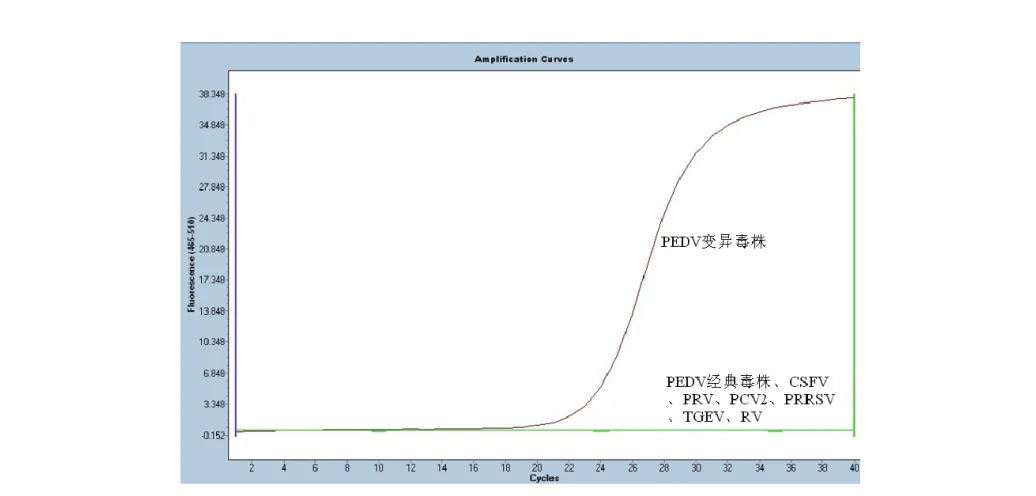
图3 PEDV变异毒株 S基因特异性检验动力学曲线
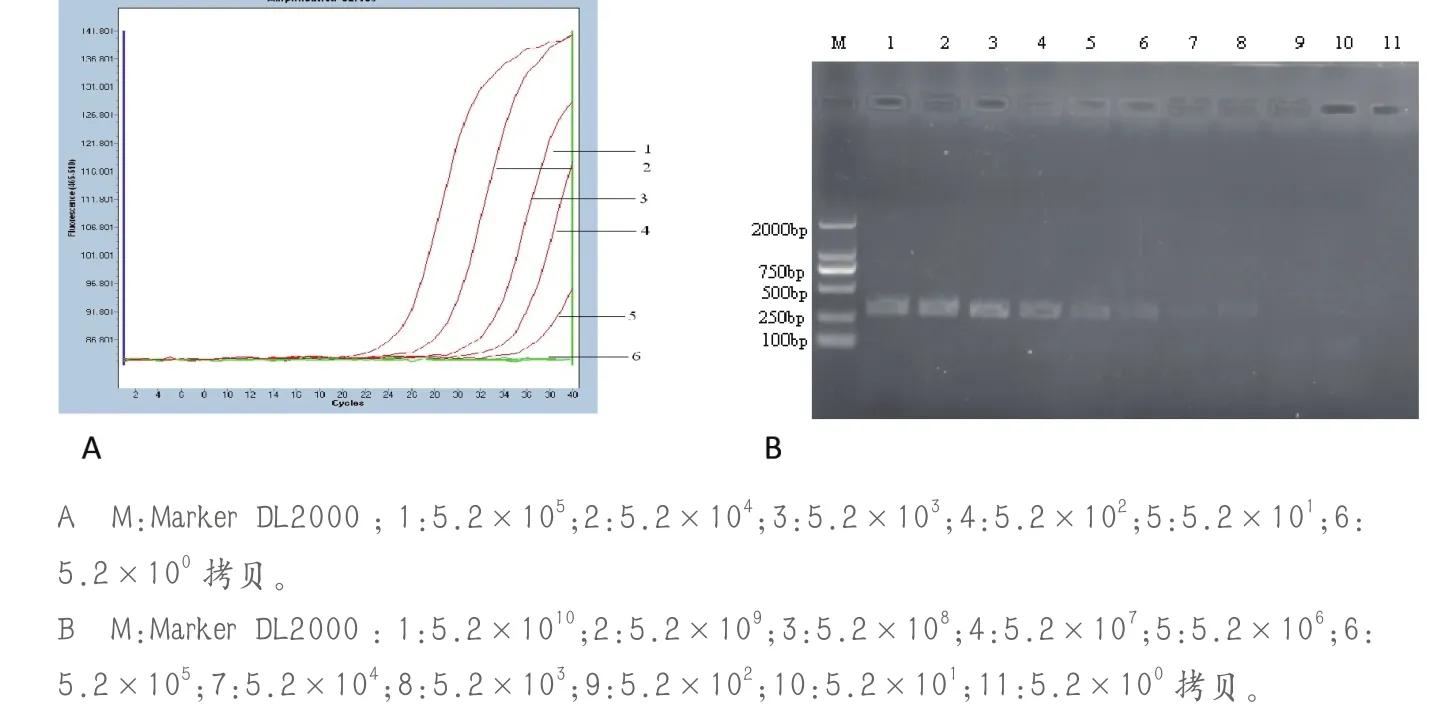
图4 PEDV变异毒株荧光定量RT-PCR(A)与常规RT-PCR(B)检测敏感性比较
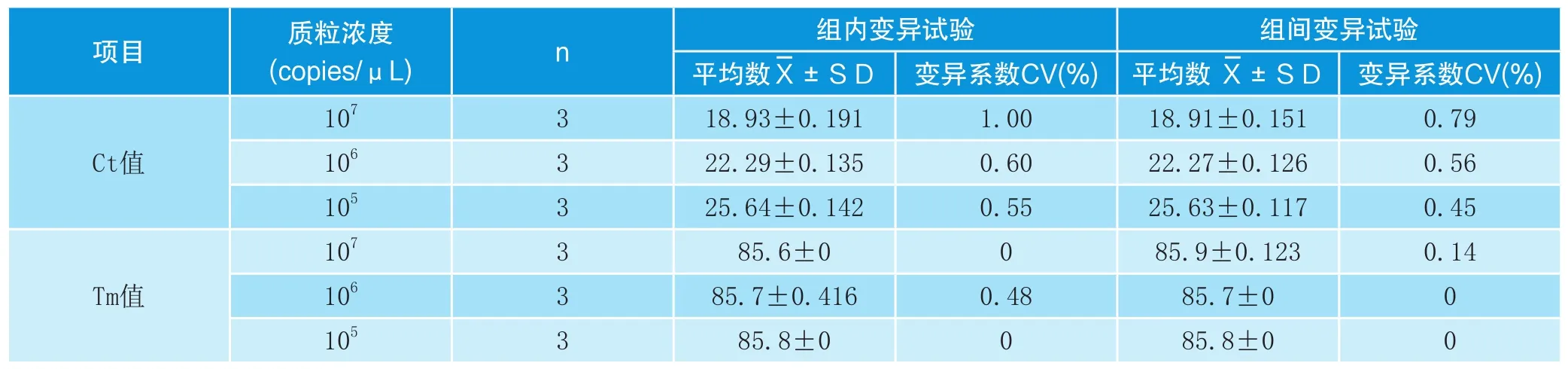
表1 SYBR GreenⅠ实时荧光PCR的组内和组间重复性试验结果
3 讨论
PED从2010年底开始在我国大范围暴发流行,临床上主要表现高发病率和高死亡率的哺乳仔猪腹泻(病死率达80%~100%),目前,临床上呈现变异毒株和经典毒株混合感染,但以变异毒感染为主[8],而国、内外商品化疫苗毒株如我国的CV777株,和韩国的KPED-9和DR13株均为经典毒株,因此,疫苗的免疫效果不理想。与传统的检测方法相比,荧光定量RT-PCR检测方法具有明显的优势。国内专家、学者曾采用染料法[11]和探针法[12]的荧光定量RT-PCR检测PEDV,但都属于两步法,即反转录和PCR反应时分开进行,操作繁琐,本研究采用一步法荧光定量RT-PCR方法检测PEDV变异毒,不需要单独做反转录,反转录与PCR扩增在同一个反应管中进行一步完成,操作简单,避免了由于多次操作而造成的污染问题,反转录时间只要5min,比传统的方法节省了1个多小时,能快速得到检测结果,可检测微量病毒,对质粒标准品最低检测限为5.2×101拷贝。得到的熔解曲线只出现特异的单个峰,产物的Tm值均一,表明没有引物二聚体及非特异性扩增产物出现,特异性好,对PEDV有阳性扩增信号,对PEDV经典毒株、CSFV、PRV、PCV2、PRRSV、TGEV、RV均无特异性反应,对临床86份病料进行检测结果显示,该法可检测出39份阳性,而普通RT-PCR仅检测出35份阳性,表明该SYBR Green I荧光定量方法对于PEDV的检测比普通RT-PCR方法灵敏度高,能检出普通RT-PCR不能检出的病料。
本研究建立的PEDV变异毒株一步法荧光定量RT-PCR检测方法简便、快速、特异、敏感,能够对当前流行的PEDV变异毒株进行定性和定量检测,对PEDV弱毒疫苗免疫后仍暴发PEDV野毒感染的研究更有临床意义,为进一步开展PEDV变异毒感染的分子流行病学调查和诊断,为研发变异毒PEDV的新型分子诊断试剂盒奠定了基础。■
[1] 殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:681~688.
[2] Pensaert M, de Ebouck P. A new coronavirus like particle associated with diarrhea in swine[J]. Arch Virol, 1978,58(3):243~247.
[3] Sergeev O V. Porcine epidemic diarrhea[J]. Vopr Virusol, 2009,54(2):4~8.
[4] Puranaveja S, Poolperm P, Lertwatcharasasakul P, et al. Chinese-like strain of porcine epidemic diarrhea virus, Thailand[J]. Emerg Infect Dis, 2009,15(7):1112~1115.
[5] Li Zhili, Zhu Ling, Ma Jingyun, et al. Molecular characterization and phylogenetic analysis of porcine epidemic diarrhea virus(PEDV)f i eld strains in south China[J]. Virus genes,2012,45(1):181~185.
[6] Duarte M, Tobler K, Bridgen A, et al. Sequence analysis of the porcine epidemic diarrhea virus genome between the nucleocapsid and spike protein genes reveals a polymorphic ORF[J]. Virology, 1994,198(2):466~476.
[7] Ballesteros ML, Sánchez CM, Enjuanes L. Two amino acid changes at the N-terminus of transmissible gastroenteritis coronavirus spike protein result in the loss of enteric tropism[J]. Virology,1997,227(2):378~388.
[8] 秦毅斌,卢冰霞,赵武,等.猪流行性腹泻病毒变异毒株与经典毒株RT-PCR鉴别检测方法的建立及应用[J].中国兽医科学, 2014,44(5):509~514.
[9] 郑逢梅,霍金耀,赵军,等.2010~2012年华中地区猪流行性腹泻病毒分子特征和遗传进化分析[J].病毒学报,2013,29(2):197~204.
[10] 刘孝珍,陈建飞,时洪艳,等.2011年猪流行性腹泻病毒的遗传变异分析[J].中国预防兽医学报,2012,34(3):180~183.
[11] 沈学怀,潘孝成,巩雅静,等.猪流行性腹泻病毒实时荧光定量RT-PCR检测方法的建立与应用[J].养猪,2014(6):109~112.
[12] 张志,刘自立,董雅琴,等.猪流行性腹泻病毒TaqMan荧光定量RT-PCR检测方法的建立[J].中国动物检疫,2014,31(4):76~84.
山东省现代农业产业技术体系生猪产业创新团队项目(SDAIT-08-17)。
