沉积物中芘对淡水底栖动物的急慢性毒性效应
2017-08-07钟文珏祝凌燕南开大学环境科学与工程学院天津城市生态环境修复与污染防治重点实验室教育部环境污染过程与基准重点实验室天津300350
钟文珏,张 瑜,祝凌燕(南开大学环境科学与工程学院,天津城市生态环境修复与污染防治重点实验室,教育部环境污染过程与基准重点实验室,天津 300350)
沉积物中芘对淡水底栖动物的急慢性毒性效应
钟文珏,张 瑜,祝凌燕*(南开大学环境科学与工程学院,天津城市生态环境修复与污染防治重点实验室,教育部环境污染过程与基准重点实验室,天津 300350)
研究了沉积物中芘对淡水底栖动物花翅羽摇蚊幼虫和淡水单孔蚓的急慢性毒性效应.芘对花翅羽摇蚊幼虫96h及14d的半数致死浓度(LC50)分别为189mg/kg干重和83.6mg/kg干重,28d羽化半数抑制浓度(EC50)为26.1mg/kg干重.沉积物中芘对花翅羽摇蚊幼虫的羽化时间具有延滞作用,但是对雌雄个体羽化时间的延滞作用没有显著的差异.淡水单孔蚓对芘的耐受力较摇蚊幼虫强.芘对淡水单孔蚓体表损伤(包括尾部发白、尾部凹陷及自断)的14d及21d EC50分别为222mg/kg干重和106mg/kg干重,21d生长抑制的EC50为81.7mg/kg干重.比较国外已有的芘沉积物质量基准值和本文的初步评估结果发现,国外的芘沉积物质量基准值并不适合我国所用,需要更全面的沉积物中芘对底栖生物的毒性数据来对我国的芘淡水沉积物质量基准值进行推导.本研究结果对推导芘的沉积物质量基准和进行沉积物生态风险评价提供帮助.
芘;毒性效应;底栖生物;沉积物
沉积物是淡水生态系统的重要组成部分,对水环境生态功能发挥起着重要的作用.它一方面能为淡水底栖生物提供生活场所和营养物质[1],另一方面它又是很多疏水有机污染物的贮藏库和最终环境归宿[2-4].当污染物在沉积物中累积到一定程度时,就会对生活于其中的底栖生物构成直接威胁,甚至可能会通过污染物在食物链中的传递和生物放大行为而间接的威胁人类健康.因此,研究淡水沉积物中有毒物质对底栖生物的生态毒性效应具有重要的理论意义和现实意义,同时对沉积物质量基准的建立和环境风险评价具有重要的意义.
芘是一种被怀疑具有致癌性的四环多环芳烃,是美国环境保护署(USEPA)提出的需优先控制的16种多环芳烃之一.它具有较高的辛醇-水分配系数及较低的水溶性,在水环境当中它更容易蓄积吸附在沉积物中.日本Doki湾、美国南卡罗来纳州、波斯湾Hormuz海峡等地的沉积物中均有芘的检出[5-7].我国的淡水沉积物中芘也是普遍存在的[8-12].与国外沉积物中芘的残留量相比,我国淡水沉积物中芘的残留量属于中等水平.值得注意的是,虽然我国沉积物中芘残留水平并不高,但是与芘的各类沉积物质量基准值相比(表1),仍然有很多地方的残留量超过了芘的沉积物质量基准低值,有的甚至超过了基准高值.如果以Macdonald等[13]推算出的阈值效应水平(TEL)作为评判标准,上文提及的千岛湖、巢湖、京杭运河杭州段、辽河流域沉积物中的芘均有超标现象存在,而太湖梅梁湾地区更是 100%超标.这说明,我国淡水沉积物中的芘残留还是有可能带来一定的生态风险的.因此,需要对沉积物中芘可能带来的危害加以重视.
另一方面,目前报道的芘沉积物质量基准均是国外环保部门或者学者推算的,这些基准值的获取都是以国外的生态环境及物种的毒性数据为基础建立的.各个国家的水环境条件、广泛分布的底栖生物物种的情况各有不同,美国、加拿大、英国等国家都根据自己的情况提出了适合本国的芘沉积物质量基准值,而且各不相同,可见直接用国外的基准值评价我国的淡水沉积物质量是不合理的.因此,有必要用我国的毒性数据来对我国的芘淡水沉积物质量基准进行推导.目前我国关于芘毒性效应的研究并不少见,但是绝大部分的研究都是针对各种鱼类进行的,即使是针对底栖生物进行的实验也都是对上覆水进行染毒,获得的毒性数据的单位多为 mg/L或者 µg/L,这些数据并不能用于推导沉积物质量基准.目前可用于推导芘沉积物质量基准的毒性数据非常缺乏,亟待补充.因此,本文针对沉积物中芘对淡水底栖生物急慢性毒性开展研究,为淡水沉积物质量基准制定和进行沉积物生态风险评价提供基础数据.
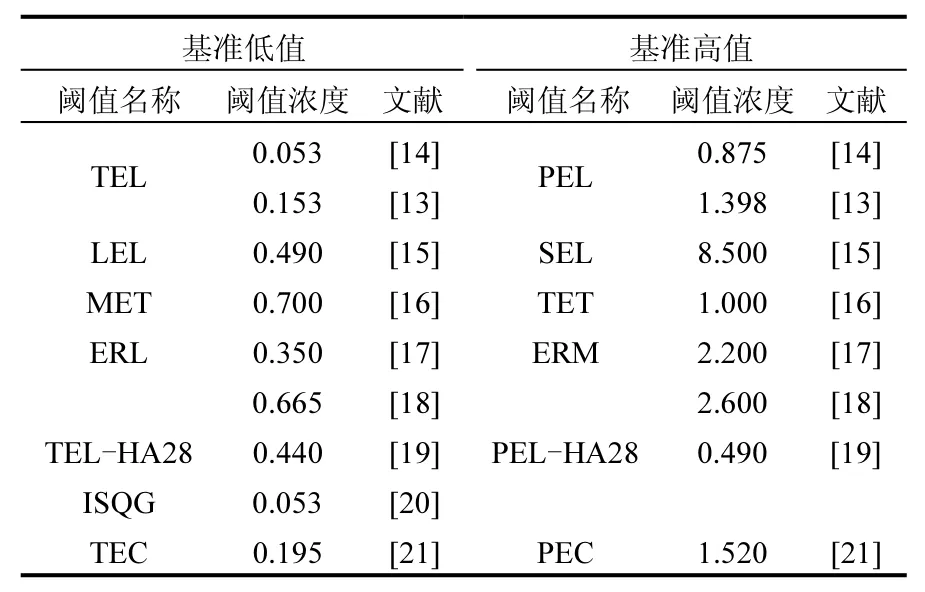
表1 芘的各类沉积物质量基准值汇总(mg/kg干重)Table 1 Sediment quality guidelines for pyrene in freshwater ecosystems (mg/kg dw)
1 材料与方法
1.1 仪器与试剂
芘标准溶液、甲醇、正己烷、乙腈、丙酮、二氯甲烷(均为色谱纯级别)均购自百灵威科技有限公司.
氮吹仪(天津恒奥科技),冷冻干燥机 FD-1A-50(北京博医康),高速离心机 TDL-5-A(上海安亭),电子天平FA2104N(上海精科),pH计(上海精科),组织捣碎机 DS-1(上海精科),恒温振荡器 THZ-C(太仓市实验设备厂),超声波清洗仪KQ5200E(昆山超生),高效液相色谱仪 1260(安捷伦科技).
1.2 沉积物染毒
采用Pasteris等[22]推荐的方法,采集天津周边地区自然保护区内相对洁净的沉积物进行加标染毒.沉积物经自然风干后,过40目筛去除粗颗粒,室温保存.洁净沉积物中未检出芘,其它理化性质如下:PH值 7.67;有机质含量 4.11%;阳离子交换量38.47cmol(+)·kg-1;含水率1.03%;机械组成为64%的粉砂、12%的沙子和24%的黏土.
将溶于丙酮的芘储备液加到少许洁净沉积物中,机械混匀 10min,然后将染毒沉积物放置在黑暗处挥发 48h.将剩余沉积物分多次逐步加入到染毒的沉积物中混匀,重复此过程直至所有的沉积物都混匀,沉积物总量为50g干重.混匀后加入200mL曝气水搅拌,沉积物和上覆水的比例为1:4,室温下避光平衡 14d,使泥水达到平衡.平衡后,测定沉积物中芘的实际浓度(方法回收率为92%~98%).暴露浓度的设置是根据预实验的结果,首先得出完全不受影响和 100%受影响的两种极端浓度,然后在两个极端浓度之间,围绕大致的半数效应浓度周围设置.芘对底栖生物急性、亚慢性和慢性毒性的实际染毒浓度如表 2所示.每组实验的每个浓度均设置 6个平行,同时设置试剂空白组(沉积物中加入与储备液体积相同的丙酮溶剂及等量曝气水)和空白对照组(沉积物中只加入等量曝气水).
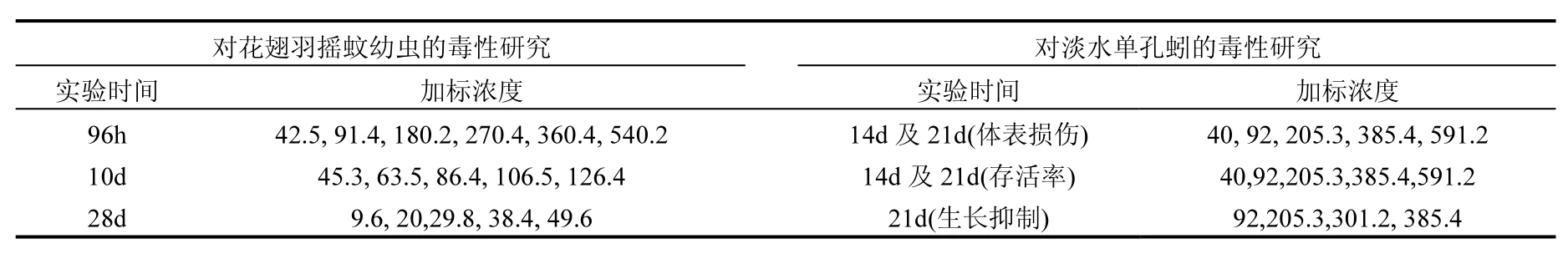
表2 沉积物中芘的实际加标浓度(mg/kg 干重)Table 2 The acutal concentrations of Pyrene in sediment (mg/kg dw)
1.3 受试生物及毒性试验
花翅羽摇蚊幼虫,属于摇蚊科、双翅目长角亚目.摇蚊科的幼虫生物量约占底栖生物量的70%~80%,是种类多、分布广、生物量大的淡水底栖动物类群之[23].同时摇蚊幼虫也是美国环保局 USEPA和欧盟推荐的生物毒性测试物种[24].淡水单孔蚓,属单孔蚓属,颤蚓科,是淡水底栖动物常见物,在我国广泛分布于陕西、长江、江苏、浙江、江西、湖北等地,对环境有较强的适应能力,既是水生食物链的重要一环,也是重要的水质等级指示生物,对沉积物污染具有良好的指示作用[25-26].因此本文选取花翅羽摇蚊幼虫和淡水单孔蚓为受试生物.
摇蚊幼虫实验选用卵孵化后10d左右、体长约为0.5cm的二龄摇蚊幼虫,根据美国EPA的底栖生物标准实验方法[27-28],进行96h、10d及28d摇蚊幼虫毒性试验.对于96h和10d实验,实验期间每天观察记录幼虫行为及形态变化,实验结束后过筛,记录存活数、个体体重及羽化个体,失踪个体计为死亡数.对于28d实验,一周后将烧杯口用纱布罩住,每天定期观察,记录摇蚊幼虫活动行为、死亡和羽化情况,死亡摇蚊个体算作未羽化个体.当有羽化蚊子出现时,将蚊子移出并分辨其性别.28d实验结束后,记录存活幼虫数量,并计算其存活率、羽化率、20%羽化时间(EMt20)和50%羽化时间(EMt50).
淡水单孔蚓实验选用 5cm左右、健康敏捷且大小一致的淡水单孔蚓进行暴露实验.实验前先将淡水单孔蚓置于盛有曝气清水的烧杯中,进行清肠处理.清肠24h后选用仍然健康的淡水单孔蚓用于后续生物测试阶段.结合 Lydy实验方法[29],进行14d 和21d毒性试验,实验期间每天观察记录幼虫行为及形态变化,实验结束后过筛,记录存活数、个体体重、体表损伤情况等,其中失踪个体计为死亡数.
实验过程中保证温度、pH、上覆水硬度等参数以及喂食次数与驯养期间环境条件一致,试剂空白与空白对照组的平均存活率均大于 80%.两种受试生物的驯养条件参见文献[30].
1.4 芘的分析检测方法
沉积物样品冷冻干燥24h后,取1g于50mL离心管中,加入30mL甲醇,将离心管在摇床上振荡30min,超声萃取1h,然后以10000r/min转速下高速离心 20min,过膜待测.样品分析在配有荧光检测器的高效液相色谱仪(安捷伦,HPLC, 1206)上进行,色谱柱为 C-18.流动相为:H2O (10%)+CH3OH(90%);激发波长:250nm,发射波长:400nm;流速:1mL/min;进样量:7.5µL.外标法进行定量分析.
1.5 统计分析
试验结果半数致死浓度(LC50)及半数效应浓度(EC50)均采用SPSS19统计软件的概率回归法计算得出,运用Origin软件作图.
2 结果与讨论
2.1 芘对花翅羽摇蚊幼虫的毒性效应
2.1.1 芘对花翅羽摇蚊幼虫的急性和亚慢性毒性效应 对于96h急性毒性试验,摇蚊幼虫死亡率随暴露浓度的增加而增加,并呈现较好的相关性(图1A,R2=0.97).当芘暴露浓度从42.5mg/kg上升到360.4mg/kg时,花翅羽摇蚊幼虫的死亡率从20%上升到 100%.观察发现:高浓度芘使沉积物中摇蚊幼虫产生剧烈反应,身躯呈“C”字型栖息在水体-沉积物界面处,并且不停的翻动,显示出对生存环境的极大抗拒.96h后沉积物表面开始出现僵硬的对机械刺激毫无反应的摇蚊幼虫躯体,死亡的摇蚊个体一般会在死亡 48h内发生解体自溶现象.未解体死亡个体的躯体由红慢慢变白,体表未发现肉眼可见损伤.
对于 10d亚慢性毒性实验,当摇蚊幼虫暴露于较高浓度组(126mg/kg)时,在第6d开始在沉积物表层发现死亡摇蚊幼虫个体.随后各个浓度组水体-沉积物界面层陆续开始出现死亡个体.比较图1A和图1B可见,芘对花翅羽摇蚊幼虫的毒性作用会随着暴露时间的延长及暴露浓度的增加而增强(图1B,R2=0.89).
用概率回归法计算芘对花翅羽摇蚊幼虫的96h和10d LC50及95%置信区间(C.I.)如表3所示.
2.1.2 芘对花翅羽摇蚊幼虫的慢性毒性效应 在研究芘对花翅羽摇蚊幼虫慢性毒性作用的 28d暴露试验中,对存活率、羽化率和羽化时间进行了观测.空白对照及溶剂对照组的平均羽化率均在14d内到达了100%,说明背景污染及溶剂效应对花翅羽摇蚊幼虫的羽化率没有显著性影响,实验结果符合毒性试验标准.花翅羽摇蚊幼虫的存活率、羽化率、EMt50和EMt20的结果如表 4所示.结果显示,当暴露浓度达到 38.4mg/kg时,花翅羽摇蚊幼虫的存活率略有下降,说明暴露浓度范围内沉积物中的芘对花翅羽摇蚊幼虫的存活没有明显影响.对于羽化率则呈现羽化率随着沉积物中芘浓度的升高而显著降低的现象(图2).根据存活率和羽化率结果,利用概率回归法获得芘对花翅羽摇蚊幼虫的28d羽化抑制EC50为26.1mg/kg.

图1 芘对花翅羽摇蚊幼虫96h和10d毒性试验结果Fig.1 The toxic effect of Pyrene to Chironomuskiiensis in 96h-test and 10d-test Chironomuskiiensis

表3 芘对花翅羽摇蚊幼虫的96h和10d LC50及95%置信区间(mg/kg 干重)Table 3 The LC50and 95% confidence interval of Pyrene to Chironomuskiiensis in 96h d-test and 10d-test (mg/kg dw)

表4 28d试验中芘对摇蚊存活率和羽化时间的影响Table 4 The survival rate and emergence time of Chironomuskiiensisin 28d-test

图2 28d暴露过程中摇蚊存活率及羽化率随芘浓度变化情况Fig.2 The survival rate and emergence rate of Chironomuskiiensis in 28d-test
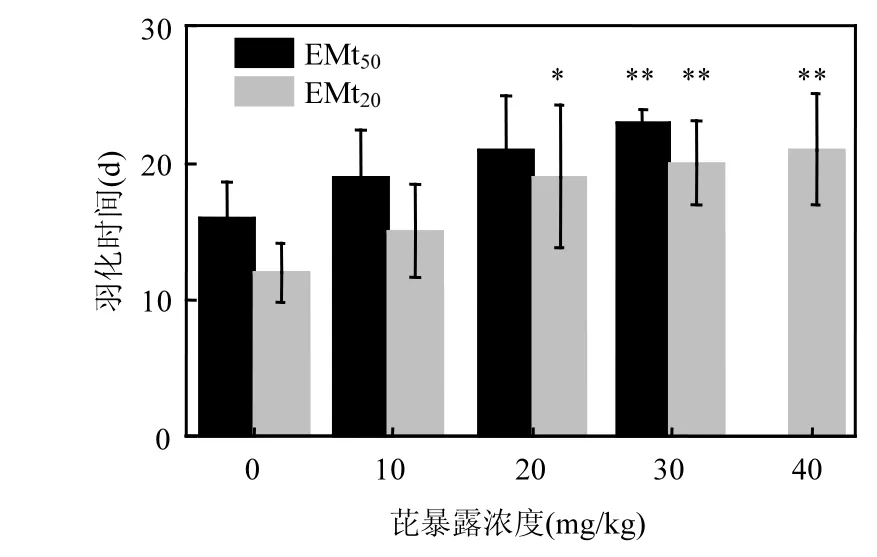
图3 28d暴露过程中花翅羽摇蚊幼虫EMt20和EMt50随芘浓度的变化Fig.3 The EMt20and EMt50of Chironomuskiiensis in28d-test
不同浓度芘对摇蚊羽化时间的影响见图 3.试剂空白组、9.6、20和29.8mg/kg浓度组摇蚊的EMt50分别为16、19、21和23d;试剂空白组、9.6、20、29.8和38.4mg/kg浓度组摇蚊的EMt20分别为12、15、19、20和21d.由此可见,尽管对照组和低浓度组的 3个试验组中摇蚊的羽化率均达到甚至大于 50%,但芘还是在一定程度上抑制了摇蚊幼虫的羽化,使羽化时间有了不同程度的延滞,EMt20也显示了类似的规律.在记录羽化时间和羽化率的同时,还记录了芘对羽化花翅羽摇蚊性别比的影响.结果发现对照组及实验组羽化的摇蚊个体性别比例几乎为 1:1,同时雌性和雄性个体的羽化时间无明显差异.说明芘会在一定程度上延长摇蚊的羽化时间,但对雌性和雄性摇蚊幼虫的影响无明显差异.
2.2 芘对淡水单孔蚓的毒性效应
研究结果显示芘对淡水单孔蚓的毒性作用较弱,当芘的浓度高达591.2mg/kg时,21d暴露的致死率仅为 20%,说明芘对淡水单孔蚓的致死效应比较弱.而真实的水体-沉积物环境中的芘污染往往达不到如此高的浓度,说明淡水沉积物中的芘对水丝蚓致死威胁较小.尽管芘不足以使淡水单孔蚓大量死亡,但是随着芘浓度的增加及暴露时间的延长,淡水单孔蚓个体会显示出不同程度的中毒症状.这些症状有些发生在尾部断裂,有些发生在头部变形,主要包括尾部自断、尾部僵化失去伸缩能力、尾部僵化分解、头部僵硬、头部肿胀等.实验过程中记录淡水单孔蚓的损伤情况,计算损伤率.实验过程中,受试生物共出现尾部发白、尾部凹陷和尾部自断 3种体表损伤.结果显示,随着沉积物中芘浓度的升高,产生个体损伤症状的淡水单孔蚓的数量具有上升趋势(图4).利用概率单位法计算得到的芘对淡水单孔蚓的14d及21d个体损伤效应的EC50见表5.

表5 芘对淡水单孔蚓的EC50值及95%置信区间(mg/kg干重)Table 5 The EC50and 95% confidence interval of Pyrene to Monopylephoruslimosusin 14d-test and 21d-test (mg/kg dw)
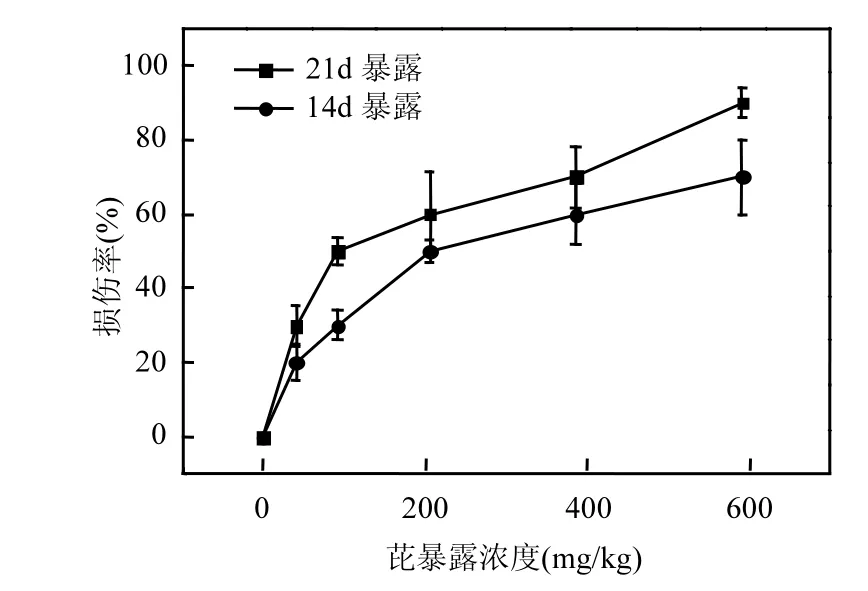
图4 14d及21d暴露实验中芘对淡水单孔蚓的损伤率Fig.4 The body-surface trauma rate of pyrene on Monopylephorus limosus in 14d and 21d-test
本研究在淡水单孔蚓慢性毒性试验中记录了暴露过程中淡水单孔蚓的存活情况及生长受抑制情况.从图 5A可以看出,芘对淡水单孔蚓的致死效应较弱.当暴露浓度低于 591.2mg/kg时,淡水单孔蚓都能够 100%存活.591.2mg/kg浓度组暴露14d后的存活率下降了10%;暴露时间延长到21d后,存活率下降20%,这说明随着暴露时间的延长,芘对淡水单孔蚓的毒性作用会有一定程度的增加.虽然芘对淡水单孔蚓的致死毒性效应较弱,但却可以不同程度的影响其生长发育,而且随着暴露浓度的增加而增强(图 5B).当芘浓度达到301.2mg/kg时,对淡水单孔蚓的生长抑制率达80%.芘对淡水单孔蚓生长抑制效应的EC50为81.7mg/kg.

图5 毒性暴露中淡水单孔蚓的存活率和生长抑制率随芘浓度变化情况Fig.5 Survival rate and growth rate of Monopylephorus limosus
2.3 本研究毒性值与现有芘沉积物质量基准的比较分析
表 1中已列出目前现有的芘沉积物质量基准值.将本研究的毒性数据与现有基准值相比,可以看出本研究的毒性数据均高于现有基准的最高值.表 1中列出的基准值大部分是建立在生物效应数据基础上.生物效应数据法基准值的推导中所用的数据要结合本国家或地区的物种分布情况及实际数据可获得情况进行选择,其中既包含敏感生物的数据,也包括耐受性高的生物的毒性数据,需要将毒性数据排序,然后获得可保护一定比例生物的基准高值和基准低值.这些数据中必然有部分数据高于基准值,而摇蚊幼虫和水丝蚓本身属于对芘的耐受能力较高的物种,所以其毒性效应值高于基准值也是合理的.另外,表1中列出的部分基准值的推导数据中包含了一部分根据水质基准用相平衡法推导而来的数据以及用其他方法推导出的芘的基准值,这些数据与实际沉积物暴露所获得的毒性效应数据相比往往处于较低水平,如果这类数据的数量较多,则有可能导致推导的沉积物基准值偏低.所以,综上所述,推测本研究的毒性数据远高于目前现有的基准值的原因可能与摇蚊幼虫和水丝蚓具有很强的耐污性以及推导基准时的数据选择有关.
表 6列出了我国多个地区沉积物中芘的残留量,将表 6中各区域沉积物中芘含量与本研究获得毒性数据和现有的基准值相比发现,虽然有部分地区的芘含量已经超过了基准,但是对于花翅羽摇蚊幼虫和淡水单孔蚓两种底栖生物暂时是安全的.摇蚊幼虫和水丝蚓是我国淡水沉积物中分布广、生物量大的物种,是我国淡水底栖生物的重要组成部分.这一结果表明,在对我国沉积物中芘的生态风险进行评估时,直接套用国外的基准可能存在过严格的现象.根据目前的结果,还不能绝对的认为国外的现有基准是否适合我国.还需要更多的相关毒性数据的支撑,来获得适合我国的芘淡水沉积物质量基准值,为更准确的评估我国淡水沉积物质量提供帮助.而目前的毒性数据还非常缺乏,亟待大量补充.本文研究结果可为推导芘沉积物质量基准和进行沉积物生态风险评价提供依据,为全面保护水环境质量提供数据支撑.在未来的研究中,还需要对我国的淡水环境沉积物中的物种分布进行调查,对更多种类的底栖生物进行驯养,对其进行沉积物暴露实验,获得更多的急慢性毒性数据,以用于推导更为适合我国的芘的沉积物质量基准.
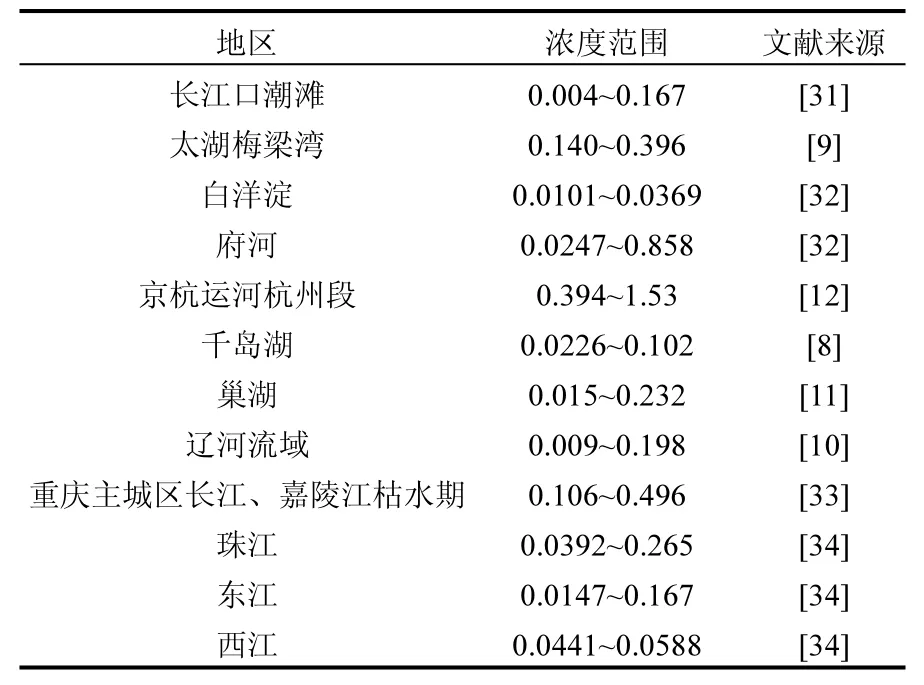
表6 我国各地区沉积物中芘含量(mg/kg 干重)Table 6 The concentrations of Pyrene in sediment in China (mg/kg dw)
3 结论
以淡水底栖生物花翅羽摇蚊幼虫和淡水单孔蚓为研究对象,研究了沉积物中芘对底栖生物的急慢性毒性效应,分别计算了芘对花翅羽摇蚊幼虫的96h和10d的LC50、28d羽化抑制效应的EC50,以及芘对淡水单孔蚓14d和21d的体表损伤EC50及21d生长抑制效应的EC50.比较芘对两种生物的毒性发现,淡水单孔蚓对芘的耐受力较摇蚊幼虫强.本研究的毒性值均高于现有的芘沉积物质量基准值,这可能与摇蚊幼虫和水丝蚓的耐污性,以及现有基准可能选择了较为敏感的物种的数据有关.将我国各区域沉积物中芘的含量与本研究的毒性值和现有基准比较发现,直接照搬国外的基准值来评估我国的沉积物质量是不合理的,需要根据我国本土生物的毒性试验数据建立适合我国的基准值.
[1] USEPA. Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates [R]. Duluth, MN: Office of Research and Development, 2000.
[2] USEPA. Sediment classification methods compendium [R]. USEPA, Washington D C, 1992.
[3] Yan Z, Na S, Cai H, et al. Enhanced degradation of phenanthrene and pyrene in freshwater sediments by combined employment of sediment microbial fuel cell and amorphous ferric hydroxide [J]. Journal of Hazardous Materials, 2011,199-200(2):217-225.
[4] Perelo L W. Review: In situ and bioremediation of organic pollutants in aquatic sediments [J]. Journal of Hazardous Materials, 2010,177(1-3):81-89.
[5] Kadokami K, Li X, Pan S, et al. Screening analysis of hundreds of sediment pollutants and evaluation of their effects on benthic organisms in Dokai Bay, Japan [J]. Chemosphere, 2013,90(2): 721-728.
[6] Weinstein J E, Crawford K D, Garner T R, et al. Screening-level ecological and human health risk assessment of polycyclic aromatic hydrocarbons in stormwater detention pond sediments of Coastal South Carolina, USA [J]. Journal of Hazardous Materials, 2010,178(1–3):906-916.
[7] Rahmanpoor S, Ghafourian H, Hashtroudi S M, et al. Distribution and sources of polycyclic aromatic hydrocarbons in surface sediments of the Hormuz strait, Persian Gulf [J]. Marine Pollution Bulletin, 2014,78(1/2):224-229.
[8] 张 明,唐访良,吴志旭,等.千岛湖表层沉积物中多环芳烃污染特征及生态风险评价 [J]. 中国环境科学, 2014,34(1):253-258.
[9] 乔 敏.区域水环境有毒有机物生态风险评价––以太湖梅梁湾为例 [D]. 北京:中国科学院生态环境研究中心, 2007.
[10] Guo W, He M, Yang Z, et al. Distribution of polycyclic aromatic hydrocarbons in water, suspended particulate matter and sediment from Daliao River watershed, China. [J]. Chemosphere, 2007, 68(1):93-104.
[11] 宁 怡,柯用春,邓建才,等.巢湖表层沉积物中多环芳烃分布特征及来源 [J]. 湖泊科学, 2012,24(6):891-898.
[12] Chen B, Xuan X, Zhu L, et al. Distributions of polycyclic aromatic hydrocarbons in surface waters, sediments and soils of Hangzhou City, China [J]. Water Research, 2004,38(16):3558-3568.
[13] Macdonald D D, Carr R S, Calder F D, et al. Development and evaluation of sediment quality guidelines for Florida coastal waters. [J]. Ecotoxicology, 1996,5(4):253-278.
[14] Smith S L, Macdonald D D, Keenleyside K A, et al. A Preliminary Evaluation of Sediment Quality Assessment Values for Freshwater Ecosystems [J]. Journal of Great Lakes Research, 1996,22(3):624-638.
[15] Persaud D, Jaagumagi R, Hayton A. Guidelines for the protection and management of aquatic sediment quality in Ontario, in, Water Resources Branch [R]. Toronto: Ontario Ministry of the Environment, 1993.
[16] EC and MENVIQ (Environment Canada and Ministere de l’Envionnement du Quebec), Interim criteria for quality assessment of St. Lawrence River sediment [R]. Ottawa: Canada Environment, 1992.
[17] Long E R, Morgan L G. The potential for biological effects of sediments-sorbed contaminants tested in the National Status and Trends Program [R]. National Oceanic and Atmospheric Admininistration, 1990.
[18] NOAA, Seditment quality guidelines developed for the national status and trend program [R]. National Ocean Service, National Oceanic Atmospheric Administration, Slier Spring, MD, 1999.
[19] Ingersoll C G, Haverland P S, Brunson E L, et al. Calculation and Evaluation of Sediment Effect Concentrations for the Amphipod Hyalella azteca, and the Midge Chironomus riparius [J]. Journal of Great Lakes Research, 1996,22(3):602-623.
[20] CCME, Environmental quality guidelines [R]. Canadian Council of Minister of Canadian Environmental Quality Guidelines, 1999.
[21] Macdonald D D, Ingersoll C G, Berger T A. Development and Evaluation of Consensus-Based Sediment Quality Guidelines for Freshwater Ecosystems [J]. Archives of Environmental Contamination and Toxicology, 2000,39(1):20-31.
[22] Pasteris A, Vecchi M, Reynoldson T B, et al. Toxicity of copper-spiked sediments to Tubifex tubifex, (Oligochaeta, Tubificidae): a comparison of the 28-day reproductive bioassay with a 6-month cohort experiment [J]. Aquatic Toxicology, 2003,65(3):253-265.
[23] Ferrington L C. Global diversity of non-biting midges (Chironomidae; Insecta-Diptera) in freshwater [J]. Hydrobiologia,2008,595(1):447-455.
[24] Lagauzère S, Terrail R, Bonzom J M. Ecotoxicity of uranium to Tubifex tubifex, worms (Annelida, Clitellata, Tubificidae)exposed to contaminated sediment [J]. Ecotoxicology &Environmental Safety, 2009,72(2):527-537.
[25] Tianjin Environmental Protection Bureau, Environmental Quality Report of Tianjin in 1996–2000, 2001.
[26] C.A.S. Database, Haitai, Monopylephorus limtosus [EB/OL].http://www.zoology.csdb.cn/.
[27] Williams K A, Green D W J, Pascoe D, et al. The acute toxicityof cadmium to different larval stages of Chironomus riparius,(Diptera: Chironomidae) and its ecological significance for pollution regulation [J]. Oecologia, 1986,70(3):362-366.
[28] OECD 218. OECD guidelines for the testing of chemicals:Sediment-Water Chironomid toxicity test using spiked sediment [R]. OECD, 2004.
[29] Mehler W T, Du J, Lydy M J, et al. Joint toxicity of a pyrethroid insecticide, cypermethrin, and a heavy metal, lead, to the benthic invertebrate Chironomus dilutus [J]. Environmental Toxicology &Chemistry, 2011,30(12):2838–2845.
[ 30 ] 钟文珏,张 瑜,韩雨薇,等.沉积物中五氯酚对底栖生物的急慢性毒性效应 [ J ].生态毒理学报, 2015 , 10 ( 1 ) : 297 -304 .
[ 31 ] 刘 敏,侯立军,邹惠仙,等.长江口潮滩表层沉积物中多环芳烃分布特征 [ J ].中国环境科学, 2001 , 21 ( 4 ) : 343 -346 .
[32] Hu G, Luo X, Li F, et al. Organochlorine compounds and polycyclic aromatic hydrocarbons in surface sediment from Baiyangdian Lake, North China: concentrations, sources profiles and potential risk [J]. Journal of Environmental Sciences, 2010,22(2):176-183.
[ 33 ] 杜 娴.重庆主城两江水体与沉积物中邻苯二甲酸酯和多环芳烃污染水平及特征 [ D ].重庆:重庆大学, 2012 .
[ 34 ] 罗孝俊,陈社军,麦碧娴,等.珠江三角洲地区水体表层沉积物中多环芳烃的来源,迁移及生态风险评价 [ J ].生态毒理学报, 2006 , 1 ( 1 ) : 17 -24 .
Acute and chronic toxic effects of pyrene on the benthic organisms in sediments.
ZHONG Wen-jue, ZHANG Yu, ZHU Ling-yan*(Tianjin Key Laboratory of Environmental Remediation and Pollution Control, Key Laboratory of Pollution Processes and Environmental Criteria of Ministry of Education, College of Environmental Science and Engineering of Nankai University, Tianjin 300350, China). China Environmental Science, 2017,37(7):2765~2772
Acute and chronic toxic effects of pyrene on Chironomus kiiensis and Monopylephorus limosus in sediment were studied in this paper. For Chironomus kiiensis, the median lethal concentrations (LC50) in 96h and 14d tests were 189mg/kg dw and 83.6mg/kg dw, and the median effect concentration (EC50) of emergence in 28d test was 26.1mg/kg dw. Pyrene could delay the emergence time of Chironomus kiiensis, while there are no significant difference in emergence time between male and female. Compared with Chironomus kiiensis, pyrene displayed lower toxicity to Monopylephorus limosus. The EC50of body-surface trauma (including white rear, depressed rear and autotomy) of pyrene on Monopylephorus limosus in 14d and 21d test were 222mg/kg dw and 106mg/kg dw, and the EC50of growth inhibition in 21d test was 81.7mg/kg dw. Comparing the Sediment quality criteria (SQC) of foreign countries with our results, we found that the existing SQC of pyrene were not suitable for China. We need much more toxicity data of pyrene on the benthic organisms in sediments to derive pyrene’s SQC. The results of this study would provide a basis for deriving SQC and assessing ecological risk of pyrene.
pyrene;toxic effect;benthic organisms;sediement
X131
A
1000-6923(2017)07-2765-08
钟文珏( 1979 -) ,女,河北石家庄人,助理研究员,博士,主要从事水环境质量基准与生态风险评价研究.
2016-12-07
公益性行业(农业)科研专项(201503108);天津市自然科学基金资助项目(16JCYBJC29800);高等学校博士学科点专项科研基金资助项目(20130031120018);中央高校基本科研业务费专项资金资助(zla2076698)
* 责任作者, Zhuly@nankai.edu.cn
