Sn-Ce-Sb/γ-Al2O3粒子电极体系降解AOII的历程与机理
2017-08-07乔启成金洁蓉南通科技职业学院环境与生物工程学院江苏南通226007南通市固体废弃物资源化利用重点实验室江苏南通226007南通大学化工学院江苏南通226007
乔启成,李 亚,金洁蓉,石 健,赵 勤(1.南通科技职业学院环境与生物工程学院,江苏 南通226007;2.南通市固体废弃物资源化利用重点实验室,江苏 南通 226007;.南通大学化工学院,江苏 南通226007)
Sn-Ce-Sb/γ-Al2O3粒子电极体系降解AOII的历程与机理
乔启成1,2*,李 亚1,2,金洁蓉1,2,石 健3,赵 勤3(1.南通科技职业学院环境与生物工程学院,江苏 南通226007;2.南通市固体废弃物资源化利用重点实验室,江苏 南通 226007;3.南通大学化工学院,江苏 南通226007)
采用自制的Nd掺杂PbO2阳极和Sn-Ce-Sb/γ-Al2O3粒子,研究了二维电极、γ-Al2O3和Sn-Ce-Sb/γ-Al2O3填充的三维电极体系对于酸性橙II(AOII)的降解性能,利用紫外可见光谱(UV-vis)、傅里叶红外光谱(FTIR)、气相色谱-质谱(GC-MS)对降解产物进行了分析.研究结果表明,Sn-Ce-Sb/γ-Al2O3粒子电极体系对AOII具有更优越的电催化氧化性能,TOC去除率相较于二维电极以及γ-Al2O3粒子电极分别提高了近1.95和1.70倍,能耗相应降低了41%和25%.根据对产物的分析,提出了Sn-Ce-Sb/γ-Al2O3粒子电极体系中AOII可能的降解路径.结合实验结果,通过羟基自由基(·OH)的形成过程分析,进一步提出了该体系中可能存在的反应机理.
粒子电极;酸性橙II;电催化氧化;降解路径;反应机理
三维电极电化学反应器是在传统二维电解槽两电极间填充粒子电极而构成,在高梯度的电场作用下,高阻抗粒子可发生感应而成为复极性粒子,每个粒子相当于一个微电解池,使得反应器有效电极面积增大,缩短了电极与有机物的接触距离,有利于提高电流效率,因此在降解有机污染物时表现出了更好的降解性能、更高的电流效率、更低的能量消耗,具有广阔的应用前景[1].从早期重金属离子的去除,逐渐延伸到各种废水的处理,如印染废水、炼油废水、含芬及其衍生物废水、烃类及其他污染物, 以及在吸附剂的再生、消毒副产物还原应用方面均有所报道[2].近年来, Ti-Sn/γ-Al2O3[3]、Cu–rare earth/Al2O3[4]、CuO-CeO2/γ-Al2O3[5]、Fe-Ni-TiO2/AC[6]等新型粒子电极,因具有高催化活性、高稳定性、低能耗等特点,已成为三维电极反应器的研究热点.
酸性橙 II(AOII)是一种通用的偶氮染料,被广泛的应用于造纸、印刷、纺织、皮革以及其他化学工业,具有“三致”作用,化学稳定性高,属于典型的难生物降解有机物[7],其有效处理一直是水处理领域的研究热点.采用传统二维电化学反应器降解AOII的电催化氧化处理技术已有较多报道[8-11],而应用三维电极的报道相对较少,特别是AOII在三维电极反应器中的降解历程和机理更是鲜有报道.本研究采用自制的Nd掺杂PbO2阳极和Sn-Ce-Sb/γ-Al2O3粒子,对比研究了二维电极、γ-Al2O3和Sn-Ce-Sb/γ-Al2O3填充的三维电极体系对于 AOII的降解性能,利用紫外可见光谱(UV-vis)、傅里叶红外光谱(FTIR)、气相色谱-质谱(GC-MS)分析了降解产物的变化,提出了可能的降解路径和反应机理,以期为三维电极反应器处理偶氮染料废水的实际应用提供理论依据.
1 试验部分
1.1 实验材料
AOII购自上海佳英化工有限公司,未经提纯.所用试剂均为分析纯,水均为去离子水.阳极材料为实验室自制的高催化活性Nd掺杂PbO2电极,阴极材料为不锈钢板.Sn-Ce-Sb/γ-Al2O3粒子电极采用Sn、Sb、Ce共存溶液的浸渍高温热分解法制成.电极性能表征和分析详见参考文献[12-13].
1.2 试验装置及流程
实验装置及流程如图1所示.反应区尺寸为55mm×35mm×65mm,电极板大小为 50mm× 50mm,间距为 35mm.在极板间填充粒子电极,高度与极板上缘持平.直流电源型号为 APS3005Si,可以提供0~ 30V的电压和0~5A的电流输出值.将模拟AOII废水置入蓄水槽中,采用BT100-2J型蠕动泵将废水引入反应器,并循环回蓄水槽,控制循环液流量为6L/h.通入空气,当电解液进入填充床底部即接通电源开始计时,每隔一段时间在蓄水槽中取样,经过滤后分析.
二维电极(记为 2D)降解实验时,不填充粒子电极;空白降解实验时,填充γ-Al2O3粒子.实验条件为:电流密度 20mA/cm2,AOII溶液浓度100mg/L(含 3%Na2SO4支持电解质),溶液体积500mL,曝气量0.5L/min.
1.3 分析方法
采用TU-1901型双光束紫外可见分光光度计(UV-vis,北京普析通用仪器有限责任公司)测定AOII的降解效果,最大吸收波长为485nm,扫描范围为200~700nm;采用TOC-L CPH型总有机碳(TOC,日本岛津公司)测定仪测定溶液中TOC的变化;采用WQF-510A傅里叶红外光谱仪(FTIR,北京瑞利分析仪器有限公司)分析产物的基团变化,扫描波长范围在 1100~3000cm-1之间;采用 5975C/7890A型气质联用仪(GC/MS,美国安捷伦科技公司)分析降解过程中可能出现的中间产物,HP-5质谱色谱柱(30m长×0.25mm内径×0.25um厚度).
AOII和TOC的降解率(RE)采用式1计算:
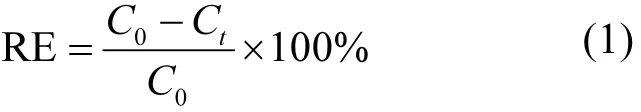
式中:C0和Ct分别为反应起始和电解时间t时对应的AOII和TOC的浓度,mg/L.
基于TOC计算有机物降解过程中的瞬时电流效率εinst[14],如式2所示:
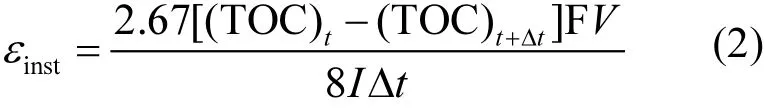
式中:(TOC)t为电解时间 t时对应的 TOC值, g/L;(TOC)t+Δt为电解时间 t+Δt时对应的 TOC值,g/L;t为降解时间,s;Δt为降解时间间隔,s;F为法拉第常数,96487C/mol;V为电解液体积,L;I为电解过程中通入的电流,A.
基于 TOC计算的电解能耗(EC, kWh/ (kgTOC))如式3所示:

式中:(TOC)0为起始时的TOC值,g/L; (TOC)t为电解时间t时对应的TOC值,g/L; t为降解时间,s; Δt为降解时间间隔,s; V为电解液体积,L;I为电解过程中通入的电流,A; U为电解过程中加入的电压,V.

图1 填充床电催化氧化AOII实验装置示意Fig.1 Schematic diagram of electro-catalytic oxidation degradation of AOII in packed-bed electrode reactor
2 结果与讨论
2.1 Sn-Ce-Sb/γ-Al2O3粒子电极对 AOII的电催化氧化性能
二维电极、γ-Al2O3和Sn-Ce-Sb/γ-Al2O3填充的三维电极反应器对AOII的降解效果如图2所示.图 2(a)表明,二维电极和 γ-Al2O3粒子电极体系在反应 3h后,对 AOII的去除率分别为89.3%和95.4%,而Sn-Ce-Sb/γ-Al2O3粒子电极体系在反应1h后对AOII的去除率即达到了100%,脱色效果迅速.同时,AOII降解均符合伪一级动力学方程,在二维电极、γ-Al2O3和 Sn-Ce-Sb/γ-Al2O3三维电极体系中的反应速率常数分别为0.0146、0.0188和0.079min-1,AOII降解半衰期分别为47.48、36.87和8.89min(见表1),进一步说明了Sn-Ce-Sb/γ-Al2O3粒子电极体系对AOII具有极快的催化降解速率.
TOC的测试结果如图2(b)所示,不同体系对于AOII的转化和TOC的降解趋势基本一致.反应3h后,二维电极、γ-Al2O3和Sn-Ce-Sb/γ-Al2O3三维电极体系中,TOC的去除效率分别为43.1%、49.6%和84.2%. Sn-Ce-Sb/γ-Al2O3粒子电极体系表现出了很强的矿化性能,对于TOC的去除率相较于二维电极以及γ-Al2O3粒子电极分别提高了近1.95和1.70倍,而填充γ-Al2O3粒子对于提高TOC的去除效果并不明显.瞬时电流效率εinst随电解时间的变化见图2(b),Sn-Ce-Sb/γ-Al2O3粒子电极体系在反应过程中电流效率显著提高,说明在该体系中电能更多的表现为对于AOII的矿化作用,这可能与Sn-Ce-Sb复合金属氧化物复极化后具有较高的析氧电位有关,相同电流密度下,该体系中槽电压为 8V,较二维电极的6.9V以及γ-Al2O3粒子电极的6.3V均有提高也证明了这一推测.能耗分析结果见表1,反应3h后,相比于二维电极以及 γ-Al2O3粒子电极的1264.51和 1002.65kWh/(kg TOC),Sn-Ce-Sb/γ-Al2O3粒子电极体系则大幅度降低至750.09kWh /(kg TOC),进一步证明了其对于AOII降解具有明显优势.

图2 二维电极、γ-Al2O3粒子电极和Sn-Ce-Sb/γ-Al2O3粒子电极对AOII的降解效果Fig.2 Effect of two-dimensional electrode, γ-Al2O3particle electrode and Sn-Ce-Sb/γ-Al2O3particle electrode on the evolution of AOII and TOC
为了进一步了解不同体系AOII降解过程中的结构变化趋势,扫描了不同反应时段溶液的紫外可见光谱如图3所示. AOII在整个扫描区内有4个特征吸收带,在紫外光区内229和310nm的吸收峰为苯环和萘环共轭体系的 Π-Π*跃迁引起,而可见光范围内485nm的吸收峰和430nm肩峰分别由AOII的两个同分异构体腙式结构和偶氮结构的 n-Π*跃迁引起[15].Sn-Ce-Sb/γ-Al2O3粒子电极对AOII降解迅速,反应30min后,AOII的特征结构对应的峰均消失,且对应的光吸收强度逐渐减弱,反应至1h后,对AOII的去除率即达100%.由图3还可以看出,各体系中在波长250nm处均出现了新的吸收峰,归属为苯胺类化合物[16],但在Sn-Ce-Sb/γ-Al2O3粒子电极体系中很快消失.由此进一步说明, Sn-Ce-Sb/γ-Al2O3粒子电极体系对AOII表现出了更好的催化活性和矿化能力.

表1 二维电极、γ-Al2O3粒子电极和Sn-Ce-Sb/γ-Al2O3粒子电极降解AOII的动力学常数(k)和能耗(EC)Table 1 The kinetic characteristic and EC of AOII degradation by two-dimensional electrode, γ-Al2O3particle electrode and Sn-Ce-Sb/γ-Al2O3particle electrode
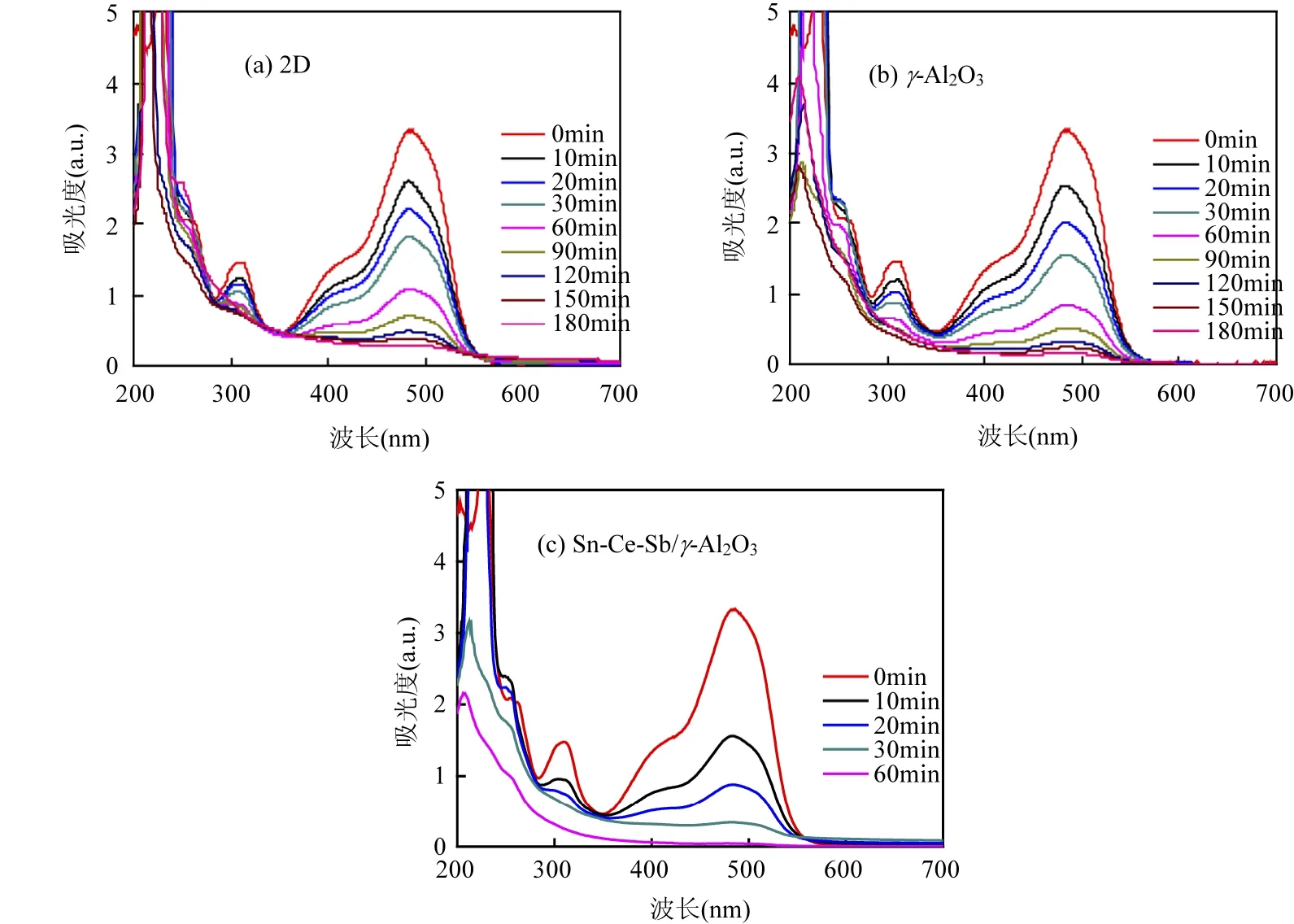
图3 二维、γ-Al2O3粒子和Sn-Ce-Sb/γ-Al2O3粒子电极电解AOII时溶液紫外可见光光谱Fig.3 UV-vis spectral changes of AOII during the electrolyses by two-dimensional electrode,γ-Al2O3particle electrode and Sn-Ce-Sb/γ-Al2O3particle electrode
2.2 Sn-Ce-Sb/γ-Al2O3粒子电极对 AOII的电 催化氧化历程分析
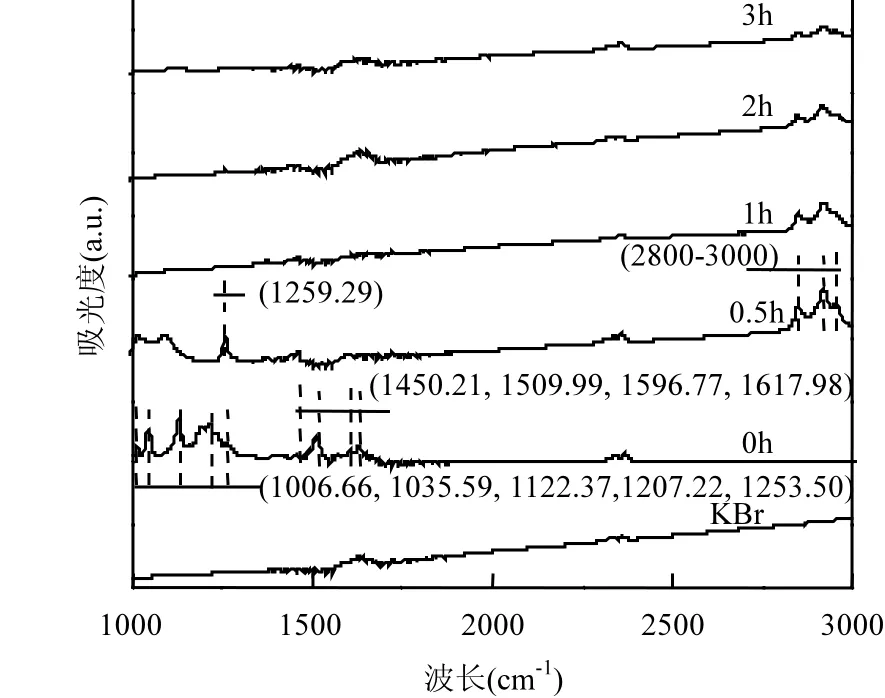
图4 AOII在Sn-Ce-Sb/γ-Al2O3粒子电极中氧化产物的FTIR吸收光谱Fig.4 FTIR spectra of AOII solution during the electrolysis process by Sn-Ce-Sb/γ-Al2O3particle electrode
Sn-Ce-Sb/γ-Al2O3粒子电极体系中AOII及其降解产物的 FTIR吸收光谱,如图 4所示.在1000~1900cm-1指纹区,AOII的FTIR吸收图谱中与其结构相关的吸收峰有1006.66cm-1(苯环的轴向振动);1207.22、1122.37、1035.59cm-1(苯环轴向振动和 SO3-基团伸缩振动的偶合); 1253.50cm-1(C-N键的伸缩振动);1450.21cm-1(腙式结构中N=N伸缩振动和苯环C=C双键的伸缩振动偶合);1509.99cm-1(腙式结构中 N-H 弯曲);1596.77cm-1(苯环中 C=C 双键的伸缩振动);1617.98cm-1(腙式结构中 C=N伸缩振动)[17].反应0.5h后,上述1509.99、1596.77、1617.98cm-1处的吸收峰消失,说明 AOII分子结构中的腙式以及苯环结构被破坏;但偶氮结构及SO3-基团对应的吸收峰仍然存在;在 1259.29cm-1处以及2800~3000cm-1区间出现了新的峰,分别对应C-O-H伸缩振动以及脂肪酸类C-H伸缩振动[17],可以判断AOII已经部分开环同时转化成小分子酸.反应1h后,除在2800~3000cm-1区间形成的脂肪酸类C-H伸缩振动以外,对比KBr空白压片,可以看出偶氮结构及 SO3-基团对应的吸收峰几乎完全消失.随着反应的进行,脂肪酸类 C-H伸缩振动逐渐减弱,说明脂肪酸类中间产物被逐渐矿化成二氧化碳和水.可见本研究构建的Sn-Ce-Sb/γ-Al2O3粒子电极体系对AOII降解迅速,矿化作用明显,与UV-vis光谱分析结果一致.
采用GC-MS分析了Sn-Ce-Sb/γ-Al2O3粒子电极体系对AOII反应1h后的溶液中主要的中间产物,检测到可能存在的中间产物主要有:乙二酸、丁二酸、丙二酸、邻苯二甲酸、2-羟基苯甲酸、苯胺、苯酚、2-萘酚、1、2-二萘酚、二氢香豆素、1,2,3,4-四氢化-2-萘酚、茚三酮、2-羧基苯甲醛、1(3H)-异苯并呋喃酮等.结合UV-vis、FTIR以及GC-MS的检测结果,推测了AOII的降解路径如图5所示.降解过程主要分为3个阶段,即(1)初期脱色阶段:由UV-vis光谱可知,反应1h后AOII几乎完全脱色,FTIR光谱及GC-MS未检测到偶氮键类物质也说明了这一点.可以判断,AOII中N=N键首先受到·OH攻击导致脱色,生成对氨基苯磺酸钠和 1-氨基-2-萘酚.由于磺酸基的存在,对氨基苯磺酸钠具有热稳定性且极易溶于水,而 1-氨基-2-萘酚很不稳定,极易被氧化转化[18].因此,未检测出对氨基苯磺酸钠和 1-氨基-2-萘酚;(2)中期中间产物降解阶段:·OH的攻击会优先在苯环上电子云密度较高的位置进行,如果这个位置被其他基团占据,·OH就会取代并占据这个位置.如果未被其他基团占据,则会发生·OH在苯环上的氢原子取代反应[19].关于对氨基苯磺酸钠的转化问题,目前报道较多的是直接转化成二氧化碳和水[20-21],但本研究中UV-vis、FTIR以及GC-MS测试均表明,产物中有苯胺类物质生成,因此认为对氨基苯磺酸钠的磺酸基被·OH攻击直接从苯环上脱落生成苯胺,苯胺上的胺基被·OH取代,生成了苯酚;另外,1-氨基-2-萘酚中的胺基一方面遭受·OH攻击而脱落生成了 2-萘酚,另一方面被·OH取代生成了1,2-二萘酚,进而进一步攻击C=C键,转化为二氢香豆素、1,2,3,4-四氢化-2-萘酚,然后再转化为茚三酮、1(3H)-异苯并呋喃酮等酮类物质,再经氧化开环生成邻苯二甲酸、2-羟基苯甲酸、2-羧基苯甲醛等产物;(3)后期有机酸形成及矿化阶段:在·OH的作用下,苯酚、邻苯二甲酸、2-羟基苯甲酸、2-羧基苯甲醛等进一步开环生成小分子的有机酸,如乙二酸、丁二酸、丙二酸等.这些小分子羧酸进一步被氧化,最终转化成二氧化碳和水.
从AOII在不同反应体系中的降解效果和反应动力学分析可看出,AOII在Sn-Ce-Sb/γ-Al2O3粒子电极体系中降解速率和矿化程度都很高,而从 UV-vis、FTIR、GC-MS进行的降解过程分析也进一步得到了验证.

图5 Sn-Ce-Sb/γ-Al2O3粒子电极电催化氧化AOII的可能降解途径Fig.5 Possible pathway for electro-catalytic oxidation of AOII by Sn-Ce-Sb/γ-Al2O3particle electrode
2.3 Sn-Ce-Sb/γ-Al2O3粒子电极对 AOII的电催化氧化机理分析
由降解结果分析可知,Sn-Ce-Sb/γ-Al2O3粒子电极体系对AOII的降解是阳极和粒子电极共同作用的结果,且由降解过程分析可知,电极表面产生·OH,进而由·OH攻击有机物.因此,本研究通过·OH的形成来分析Sn-Ce-Sb/γ-Al2O3粒子电极体系对AOII的电催化氧化机理,如图6所示. 2.3.1 阳极催生·OH 由二维电极降解结果可知,本研究采用的是具有“非活性电极”性能的Nd掺杂 PbO2阳极,借助于其催生的·OH,AOII的反应倾向于电化学燃烧过程,如式4和5所示.

2.3.2 粒子电极催生·OH Sn-Ce-Sb/γ-Al2O3粒子电极表面的复合氧化物具有半导体特性,其导电介于金属和绝缘体之间,由于Sb的渗入可使得 SnO2晶格膨胀造成缺陷,形成的空穴具有很强的俘获电子的能力,能加速电子转移的反应,同时稀土元素Ce的氧化物具有出色的氧存储能力,在氧化还原反应中 Ce4+/Ce3+的相互转化作用可以提高催化剂的氧化活性[22].在直流电场的作用下,高阻抗的Sn-Ce-Sb/γ-Al2O3粒子电极由于静电感应而复极化,每个粒子与周围的水均形成微型电解槽,进而在表面发生电解水的反应而产生·OH[23](式 6).同时,由于粒子电极具有较好的亲水性并通过极化作用极易使得羟基基团中的电子被吸附,即使得·OH加速产生(式 7).粒子电极填充大幅度增加了阳极面积从而提升了·OH产生量,提高了污染物与阳极接触并发生氧化的机会,可有效的提高电流利用率.


2.3.3 阳极与粒子电极共同催生·OH 阳极对水的电解作用会使得体系中有活性O2产生(式8),活性O2扩散到阴极极板或粒子电极阴极区,会产生 H2O2(式 9).由于在粒子电极涂层半导体中存在空位、空穴等缺陷,使得SnO2晶体可以与H2O2分子形成化学键发生吸附,并催化其迅速分解产生·OH(式10),进而对其表面的AOII进行催化降解(式11).


图6 Sn-Ce-Sb/γ-Al2O3粒子电极电催化氧化AOII的机理分析Fig.6 Schematic illustrations on the electro-catalytic oxidation of AOII by Sn-Ce-Sb/γ-Al2O3particle electrode
3 结论
3.1 对比二维电极、γ-Al2O3填充的三维电极反应体系,Sn-Ce-Sb/γ-Al2O3粒子电极体系在对AOII的降解速率、矿化效果、电流效率、能量消耗等方面均具有明显的优势.在设定反应条件下,该体系中反应 1h后即完全脱色,反应速率常数高达 0.079min-1,TOC去除率分别提高了近1.95和1.70倍,能耗相应降低了41%和25%.
3.2 UV-vis,FTIR和 GC-MS测试结果表明, AOII在Sn-Ce-Sb/γ-Al2O3粒子电极体系中的降解路径首先表现为偶氮键迅速断裂,对氨基苯磺酸钠和 1-氨基-2-萘酚,从而实现快速脱色;其次为·OH的攻击、取代、脱氢等作用使得形成的芳香化合物发生开环反应,生成小分子羧酸类化合物;最后羧酸类化合物进一步被氧化,生成二氧化碳和水,使得AOII最终被矿化.
3.3 结合实验研究结果,从阳极催生·OH、粒子电极催生·OH、阳极与粒子电极共同催生·OH等3个方面分析了 Sn-Ce-Sb/γ-Al2O3粒子电极体系对AOII的电催化氧化机理.
[1] 伍 波,李 鹏,张 波,等.负载型粒子电极电催化氧化苯酚的研究 [J]. 中国环境科学, 2015,35(8):2426-2432.
[2] Zhang C, Jiang Y H, Li Y L, et al. Three-dimensional electrochemical process for wastewater treatment:A general review [J]. Chemical Engineering Journal, 2013,228:455–467.
[3] Sun Y J, Li P, Zheng H L, et al. Electrochemical treatment of chloramphenicol using Ti-Sn/γ-Al2O3particle electrodes with a three-dimensional reactor [J]. Chemical Engineering Journal, 2017,308:1233–1242.
[4] Duan X Y, Ren F, Chang L M. Preparation and characterization of Cu–rare earth/Al2O3catalysts and their application in the electrochemical removal of p-nitrophenol [J]. RSC Advances, 2016,108(6):106387–106395.
[5] Chen F T, Yu S C, Dong X P, et al. Preparation and characterization of PbO2electrode and its application in electro-catalytic degradation of o-aminophenol in aqueous solution assisted by CuO–Ce2O3/γ-Al2O3catalyst [J]. Journal of Hazardous Materials, 2013,260:747-753.
[6] 孙玲芳,喻泽斌,彭振波,等.Fe-Ni-TiO2/AC粒子电极的制备及可见光光电催化协同降解RhB [J]. 中国环境科学, 2014,34(12): 3119-3126.
[7] Lin H, Zhang H, Hou L W. Degradation of C. I. Acid Orange 7in aqueous solution by a novel electro/Fe3O4/PDS process [J]. Journal of Hazardous Materials, 2014,276(14):182-191.
[8] Hammami S, Bellakhal N, Oturana N, et al. Degradation of Acid Orange 7by electrochemically generated •OH radicals in acidic aqueous medium using a boron-doped diamond or platinum anode: A mechanistic study [J]. Chemosphere, 2008,73(5):678-684.
[9] Fernandes A, Morão A, Magrinho M, et al. Electrochemicaldegradation of C. I. Acid Orange 7 [J]. Dyes and Pigments, 2004,61(3):287-296.
[10] Feng J X, Lan S Y, Yao C Y, et al. Electro-generation of NaOH-H2SO4and simultaneous degradation of Acid orange 7from Na2SO4-containing wastewater by Ti/IrO2electrodes [J]. Journal of Chemical Technology and Biotechnology, 2017,92(4): 827-833.
[11] 杨卫身,樊 瑞.恒电流模式下电氧化脱色降解酸性橙Ⅱ [J].福建工程学院学报, 2010,8(4):367-374.
[12] 乔启成,赵跃民,王立章,等.新型 Nd掺杂 PbO2阳极性能及对AOII的电催化氧化研究 [J]. 稀有金属材料与工程, 2017,46(1): 157-163.
[13] 乔启成,石 健,赵 勤,等.金属氧化物负载γ-Al2O3粒子电极对AOII的电催化氧化研究 [J]. 环境工程, 2017, In Press.
[14] Emmanuel E, Keck G, Blanchard J M, et al. Toxicological effects of disinfections using sodium hypochlorite on aquatic organisms and its contribution to AOX formation in hospital wastewater [J]. Environment International, 2004,30(7):891-900.
[15] Stylidi M, Kondarides D I, Verykios X E. Pathways of solar light-induced photocatalytic degradation of azo dyes in aqueous TiO2suspensions [J]. Applied Catalysis B: Environmental, 2003,40(4):271-286.
[16] 刘士姮,汪世龙,孙晓宇,等.酸性橙 7降解的微观反应机理及动力学研究 [J]. 光谱学与光谱分析, 2005,25(5):776-779.
[17] Zhang S J, Yu H Q, Li Q R. Radiolytic degradation of Acid Orange 7: A mechanistic study [J]. Chemosphere, 2005,61(7): 1003-1011.
[18] Kudlich M, Hetheridge M J, Knackmuss H J, et al. Autoxidation reactions of different aromatic o-aminohydroxynaphthalenes that are formed during the anaerobic reduction of sulfonated azo dyes [J]. Environmental Science and Technology, 1999,33(6):896-901.
[19] 刘 元.高效金属氧化物电极制备及处理水中硝基苯酚的研究[D]. 哈尔滨:哈尔滨工业大学, 2010.
[20] Muthirulan P, Devi C N, Sundaram M M.TiO2wrapped grapheme as a high performance photocatalyst for acido range 7dye degradation under solar/UV light irradiations [J]. Ceramics International, 2014,40(4):5945–5957.
[21] Djokic V R, Marinkovic A D, Mitric M, et al. Preparation of TiO2/carbon nanotubes photocatalysts: the influence of the method of oxidation of the carbon nanotubes on the photocatalytic activity of the nanocomposites [J]. Ceramics International, 2013,38(8):6123–6129.
[22] 岳 琳,王启山,石 岩,等. CuO-CeO2/γ-Al2O3粒子电极对垃圾渗滤液降解特性 [J]. 环境科学, 2008,29(6):1582-1586.
[23] 张 芳,李光明,盛 怡,等.电催化氧化法处理苯酚废水的 Mn-Sn-Sb/γ-Al2O3粒子电极研制 [J]. 化学学报, 2006,64(3): 235-239.
Reaction pathway and mechanism of the degradation of acid orange II by Sn-Ce-Sb/γ-Al2O3particle electrodes.
QIAO Qi-cheng1,2, LI Ya1,2, JIN Jie-rong1,2, SHI Jian3, ZHAO Qin3(1.School of Environment and Biological Engineering, Nantong College of Science and Technology. Nantong 226007, China;2.Nantong Key Laboratory of Solid Waste Reuse, Nantong 226007, China;3.School of Chemical Engineering and Technology, Nantong University, Nantong 226007, China). China Environmental Science, 2017,37(7):2607~2614
Nd modified PbO2anode and Sn-Ce-Sb/γ-Al2O3particle electrode, which were made in our laboratory, were used to prepare two-dimensional electrode, three-dimensional γ-Al2O3particle electrode and three-dimensional Sn-Ce-Sb/γ-Al2O3particle electrode for the degradation of acid orange II (AOII). To identify the reaction intermediate products, UV-vis, FTIR and GC-MS were applied. On the basis of the AOII degradation results and kinetics analysis, in the three-dimensional Sn-Ce-Sb/γ-Al2O3particle electrode reactor, TOC removal rate was 1.95 and 1.70 times higher than using two-dimensional electrode and three-dimensional γ-Al2O3particle electrode, and energy consumption had reduced by 41% and 25%, respectively. According to the analysis of the main reaction intermediates, a possible degradation pathway was proposed for AOII degradation by Sn-Ce-Sb/γ-Al2O3particle electrode. And finally, a reaction mechanism was also proposed based on all the experimental results.
particle electrode;Acid Orange II;electro-catalytic oxidation;degradation pathway;reaction mechanism
X703.1
A
1000-6923(2017)07-2607-08
乔启成(1983-),男,安徽枞阳人,副教授,博士,主要研究方向为环境功能材料及高级氧化技术.发表论文40余篇.
2016-11-28
国家自然科学基金资助项目(21177067);江苏省自然科学基金青年基金资助项目(BK20150402);江苏省高校“青蓝工程”资助项目(苏教师[2016]15号);江苏省333高层次人才培养工程资助项目(BRA2016195);江苏高校境外研修计划资助项目(苏教办师[2015]7号);南通市科技计划项目(GY12016055)
* 责任作者, 副教授, qqc1983@126.com
