高锰酸钾预氧化对藻活性和胞内外有机物的影响
2017-08-07张晓东乔俊莲吕丽萍高乃云同济大学污染控制与资源化研究国家重点实验室上海200092
张晓东,乔俊莲,吕丽萍,高乃云 (同济大学污染控制与资源化研究国家重点实验室,上海 200092)
高锰酸钾预氧化对藻活性和胞内外有机物的影响
张晓东,乔俊莲*,吕丽萍,高乃云 (同济大学污染控制与资源化研究国家重点实验室,上海 200092)
以实验室纯培养的铜绿微囊藻为研究对象,针对不同生长期藻的特性,采用高锰酸钾预氧化剂,研究投加量对铜绿微囊藻胞内、外有机物DOC浓度的影响;高锰酸钾氧化后铜绿微囊藻细胞及其活性的变化;预氧化对以聚合氯化铝(PAC)作为混凝剂的混凝工艺去除不同生长期铜绿微囊藻的影响.结果表明.低浓度的高锰酸钾对藻细胞光合作用有一定的抑制作用,高浓度(≥10mg/L)的高锰酸钾预氧化会使藻细胞失活并释放大量胞内有机物.当高锰酸钾投加量为 2mg/L时,投加30mg/L PAC,第9d、21d、28d、36d培养期的藻去除率分别为81%、99%、58%、35%;在不同高锰酸钾投加量下,第21d(对数期)的藻液,采用高锰酸钾预氧化强化混凝除藻效果最好,其原因可能与不同生长期胞外有机物(EOM)浓度及组分不同有关.藻处于衰亡前期和衰亡后期EOM含量显著增大,过高浓度的EOM影响了氧化剂的氧化效率,使得预氧化效果不明显.稳定期和对数期藻液中EOM含量较低,此时氧化剂与藻细胞接触,易刺激藻细胞分泌物质,而一定浓度的EOM可以起到助凝的作用,使得预氧化后强化混凝效果良好.高锰酸钾还原产物是水合MnO2,会促进混凝并可以附着在藻细胞表面提高藻细胞沉降性.
铜绿微囊藻;生长期;高锰酸钾;预氧化;混凝
藻类爆发是水体富营养化带来的一个突出问题,其产生的藻毒素严重影响水源的供水安全[1].当前应对突发的水华事件最主要、最有效、最经济的方法是混凝除藻[2-4].
高锰酸钾预氧化是水处理中常用的强化混凝除藻工艺[5],预氧化可以大大增强混凝效果,在去除受污染水源中的藻类、色度、嗅味和有机污染物等方面备受关注[6].Knappe等[7]比较系统的研究了高锰酸钾的强化混凝作用,从药剂投加量到处理时间,再到混凝剂的用量,发现高锰酸钾能有效强化混凝.高锰酸钾氧化作用对藻细胞生物活性有一定影响.Petrusevski等[8]研究认为其主要原因是高锰酸钾氧化降低了藻细胞活性,使其利于沉降.大量研究表明高锰酸钾预氧化可以降低混凝除藻过程中混凝剂的用量.El-Dars[9]研究了高锰酸钾对铝盐和铁盐混凝除藻的效果,发现高锰酸钾可以大大降低混凝剂的用量并很好的去除藻类.高锰酸钾强化混凝除藻的效果不仅来源于其氧化作用,其还原产物同样助于混凝过程.Chen等[6]在前人基础上研究认为高锰酸钾还原产物是水合 MnO2,会对混凝有促进作用,它既能吸附有机物质,同时还能附着在藻细胞表面,提高了藻细胞的沉降性.然而由于藻细胞是一种具有生命活性的微生物,其不同生长周期的生理特性与形态特征对混凝过程具有较大的影响[10-12].特别是随着生长期和代谢条件的变化,与藻细胞壁相联系的官能团(主要是羧基,偶尔也有酚基、羟基)的浓度和反应会发生波动,直接影响藻细胞的负电荷密度和等电点[13-14],由于这些官能团多存在于藻细胞的EOM中, EOM的性质及其动态变化必然影响藻类的预氧化及混凝效果[15].因此对藻类不同生长周期预氧化效果的研究为预氧化在藻类去除过程中的实际应用具有一定的指导意义.
本文以聚合氯化铝(PAC)为混凝剂,对不同生长期的铜绿微囊藻进行高锰酸钾预氧化强化混凝实验,并通过藻、浑浊度去除率及EOM、Zeta电位的变化,探究了高锰酸钾预氧化强化混凝对不同生长期铜绿微囊藻去除效率差异的机理.
1 实验材料与方法
1.1 实验仪器
总碳分析仪(TOCV-CPN,岛津),Zetasizer Nano Z型Zeta电位分析仪(英国马尔文),PAM调制叶绿素荧光仪(德国WALZ),UV-1800紫外可见分光光度计,MY3000-6智能型混凝试验搅拌仪,XSP-8C三目生物显微镜,101a-1型电热干燥箱,TGL-16C台式离心机.
1.2 药剂与材料
聚氯化铝(PAC)(市售,Al2O3,29%~32%,盐基度,50%~85%);藻种(铜绿微囊藻(Microcystis aeruginosa))购于中国科学院水生生物研究所国家淡水藻种库(FACHB),编号为FACHB-469.(接种好的水样置于玻璃瓶中,在光照生化培养箱中培养,培养温度为 25℃,光照强度为 1000lx,光暗比L:D=12:12)
1.3 实验方法
1.3.1 藻细胞生物量和藻的光合活性参数的测试方法 藻细胞生长到一定程度时,用分光光度计在 600~750nm之间每隔 5nm进行波长扫描,绘制吸收曲线,确定最大吸收峰波长.铜绿微囊藻最大吸收波长为 680nm,藻细胞的生物量即用在680nm波长处的光密度值OD680表示.然后将藻溶液稀释成不同的浓度梯度,测定 OD680数值,同时在显微镜下放大 400倍用血细胞计数板进行藻细胞计数.得到藻细胞浓度与OD680值之间的换算关系,铜绿微囊藻细胞浓度(106cells/mL)= 23.209 × OD680,R2= 0.9979.
藻的光合活性参数采用PHYTO-PAM (Walz,德国)测定.光合量子产率Φe通过式(1)计算得到:

式中:Fm为在暗适应状态下,PSII系统在打开饱和脉冲后产生的最大荧光值;Fo为在暗适应状态下,PSII系统在打开饱和脉冲前产生的荧光值.
1.3.2 DOC的测定 将藻原液和絮凝后上清液分别经过 0.45µm 的滤膜过滤后,用总碳分析仪(TOCV-CPN,日本岛津)直接测定水中DOC,以表征胞外分泌有机物(EOM).
取一定量的藻液离心,取被离心藻细胞,用纯水冲洗稀释到与胞外溶液体积相同,并采用冻融法4次后过0.45µm的滤膜,测定滤出液的DOC,为胞内有机物.
1.3.3 Zeta电位的测定 用 Zeta电位分析仪(Zetasizer Nano Z,英国马尔文)测定藻细胞表面的Zeta电位,比较随条件变化藻细胞Zeta电位的变化情况.
1.3.4 絮凝效果的测定 600mL烧杯中加入500mL藻悬液,投加一定浓度的高锰酸钾预氧化2h,紧接着投加一定浓度PAC.250r/min快速搅拌2min,30r/min慢速搅拌5min.静沉1h后,于液面下2cm处取上清液测定.
2 结果与讨论
2.1 高锰酸钾投加量对铜绿微囊藻胞内、外有机物浓度的影响
为了深入进行理论研究,投加了不同浓度的高锰酸钾.在高锰酸钾氧化过程中,铜绿微囊藻的胞外和胞内有机物的DOC浓度变化分别见图1和图2.
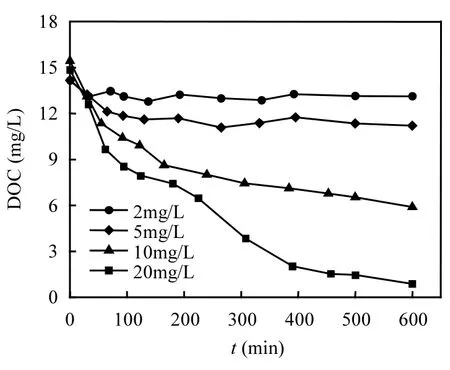
图1 不同浓度高锰酸钾氧化过程中胞外DOC的变化Fig.1 Variation of extracellular DOC during various dosages KMnO4 oxidation
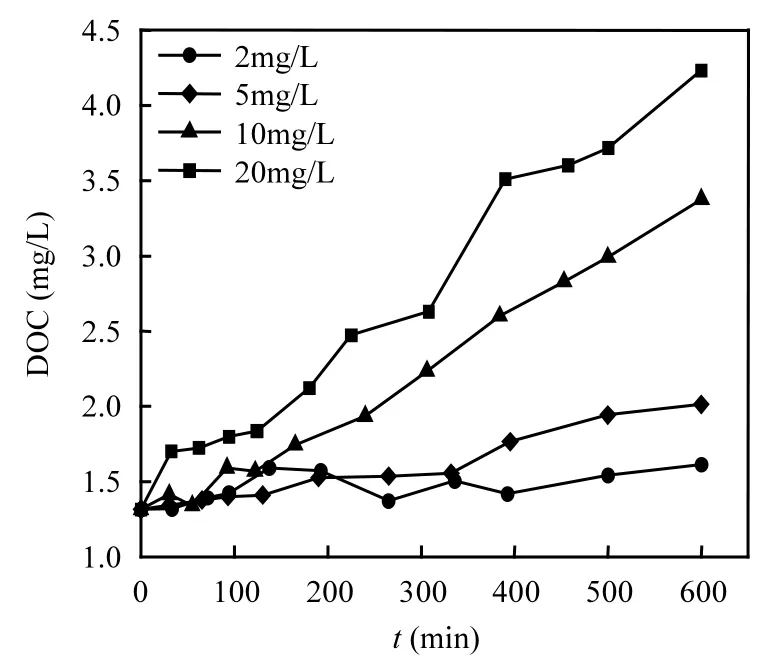
图2 不同浓度高锰酸钾氧化过程中胞内DOC的变化Fig.2 Variation of intracellular DOC during various dosages KMnO4 oxidation
由图1可见,胞外DOC随着高锰酸钾氧化时间的延长逐渐升高.高锰酸钾浓度越高,升高的幅度越大.胞外有机物的初始DOC浓度为1.31mg/L,在2mg/L的高锰酸钾氧化600min之后,胞外DOC升高到了1.61mg/L,而在10mg/L和20mg/L的高锰酸钾氧化600min之后分别升高到3.38mg/L和4.23mg/L.胞外DOC的升高可能是较高浓度的高锰酸钾引起藻细胞的破坏,从而释放胞内物质到水中所造成.为了考察高锰酸钾对细胞的破坏,同时检测了胞内DOC的浓度,结果见图2,不同浓度高锰酸钾氧化之后会引起胞内DOC不同程度的下降,可见藻细胞生物量有所减少.2mg/L高锰酸钾氧化600min之后胞内DOC从14.17mg/L降低到 13.12mg/L,而经过 20mg/L的高锰酸钾氧化600min之后胞内DOC降低到几乎为0,由于生物细胞,即藻细胞的构成基本都含有碳元素,而且基本以有机碳的形式存在,这说明高浓度的高锰酸钾能够彻底破坏藻细胞的结构和内含物.由此高锰酸钾最优投加量为2mg/L.
2.2 高锰酸钾氧化后铜绿微囊藻藻细胞及其活性的变化

图3 不同浓度高锰酸钾氧化之后培养实验中光合量子产率Фe的变化Fig.3 Variation of Фein cultivated experiment after various dosages KMnO4 oxidation
光合量子产率Фe表示的是光合作用原初反应过程中,细胞色素所吸收的光能中被传递进入后继反应的能量的比例,无量纲,该值越大表明细胞对光能的吸收能力越强,藻细胞活性越大,如图3所示,健康藻细胞的光合量子产率Фe呈现逐渐上升的趋势,在7d的培养过程中从0.45上升到0.52,说明细胞的光捕捉能力维持在一个较高的水平;经过2mg/L高锰酸钾氧化之后的藻细胞的Фe相对于健康细胞降到了0.39,但随后也逐渐上升到健康细胞的水平,说明较低浓度的高锰酸钾对细胞种群的光捕捉能力有轻微影响;随着高锰酸钾浓度上升到 5mg/L, Фe先是下降到了 0.19,之后在3d时上升到了0.41,说明细胞在氧化胁迫下光捕捉能力受到影响;而受到更高浓度高锰酸钾氧化的藻细胞则在反应完之后即Фe降到接近0的水平,在随后的培养过程中没有恢复.总之,经过高锰酸钾氧化之后铜绿微囊藻的光合活性受到不同程度的影响,特别是在中、高浓度高锰酸钾的氧化之下,细胞的光合活性几乎降低到 0,此时细胞已经基本丧失光合能力,说明一定浓度的高锰酸钾能彻底杀死藻细胞,但在短期内又不会令其细胞解体死亡.
图4中健康细胞是未经任何处理的铜绿微囊藻细胞,可见细胞呈椭圆形,结构完整,细胞质密实,细胞内所含物质按一定的规律排列和分布.经过高锰酸钾氧化以后变形,并出现褶皱,但细胞还维持着一定体形形状,只是内部结构损坏,这也证明了高锰酸钾对藻细胞的破坏作用比较缓慢与温和.

图4 健康和经过高锰酸钾处理之后铜绿微囊藻细胞的透射电镜图片Fig.4 Transmission electron microscope of healthy and KMnO4 oxidized Microcystis aeruginosa cells
2.3 高锰酸钾预氧化强化混凝对不同生长期藻的去除率
取实验室培养的不同生长期(分别为接种后9d,21d,28d,36d)藻细胞,用0.5%的NaCl溶液配制成 OD680=0.1的藻悬液,考虑到水处理的生产实际,着重研究在藻液中加入2mg/L高锰酸钾(以下同),预氧化2h后,加入不同浓度聚合氯化铝(PAC)进行絮凝实验.第9d的藻投加2mg/L高锰酸钾预氧化后与单独混凝实验后的OD680和浑浊度去除率、DOC和Zeta电位随PAC投加量变化曲线.

图5 不同生长期OD680随PAC投加量的变化Fig.5 Variation of OD680 with PAC dosages in different growth phases

图6 不同生长期浑浊度随PAC投加量的变化Fig.6 Varition of turbidity with PAC dosages in different growth phases

图7 接种第9d各指标随PAC投加量变化Fig.7 Variation of parameters with PAC dosages after inoculation 9d
由图 7(a)可知,预氧化强化混凝效果较好,预氧化后,PAC投加量仅为20mg/L时,OD680和浑浊度去除率分别由未预氧化前的 40%,35.9%提高到 79%,78.4%,去除率均增加了 40%左右.由图7(b)可知,预氧化后,DOC值均较未预氧化组高,其原因可能是氧化剂虽然将部分 DOC氧化,但同时刺激藻细胞分泌有机物质,胞外有机物(EOM)增大,使得DOC升高,这和Chen等[6]发现一致,因为高锰酸钾氧化有机物的同时也破坏藻细胞,过量的高锰酸钾使得藻胞内有机物释放到水体中,所以 DOC浓度反而上升了.预氧化前后,Zeta电位变化不大.因此高锰酸钾强化混凝可能主要是通过吸附架桥机制,由于在中性条件下,高锰酸钾为弱氧化剂,其还原产物——水合MnO2[16]增加了混凝附着点,与破碎藻细胞及胞内有机物通过吸附架桥作用,使水中细小颗粒聚集结大,提高混凝效果.
2.3.2 接种第21d(稳定期) 图8为处于接种第21d藻,投加2mg/L高锰酸钾预氧化与未预氧化混凝实验后OD680去除率和浑浊度去除率、DOC和Zeta电位随PAC投加量变化曲线.

图8 接种第21d各指标随PAC投加量变化Fig.8 Variation of parameters with PAC dosages after inoculation 21d
从图 8(a)可知,由于预氧化强化混凝的作用,使PAC投加量仅为10mg/L时,OD680和浑浊度去除率分别从 22%,24.3%提高到 76%,86.5%,去除率增加了约60%.由图8(b)可知,预氧化前后,水中DOC、Zeta电位变化不大,可见高锰酸钾对有机物的氧化作用和对藻细胞破坏释放有机物的作用基本相当,新生MnO2增加了混凝附着点,提高了混凝剂的凝聚作用.
2.3.3 接种第28d(衰亡早期) 图9为处于接种第28d藻,投加2mg/L高锰酸钾预氧化与未预氧化,OD680去除率和浑浊度去除率、DOC和Zeta电位随投加量变化曲线

图9 接种第28d各指标随PAC投加量变化Fig.9 Variation of parameters with PAC dosages after inoculation 28d
由图9(a)可知:接种第28d,预氧化有一定的强化混凝效果,预氧化后,PAC投加量仅为 30mg/L时,OD680去除率、浑浊度去除率由之前的29.6%、30.3%提高到58.2%、79.2%.由图9(b)可知,DOC、Zeta电位变化不大,然而藻液中DOC含量较第9d、第21d高,过高的DOC含量可能影响预氧化强化混凝的效果.符合余国忠等[13]的结论:EOM 应是抵抗氧化剂的第一道屏障, EOM 的多寡直接影响所需氧化剂量的大小,两者之间似乎呈正相关关系. 2.3.4 接种第36d(衰亡后期) 图10处于接种第36d藻,投加2mg/L高锰酸钾预氧化与未预氧化,OD680去除率、浑浊度去除率、DOC、Zeta电位随投加量变化曲线.
由图10(a)可以发现:接种第36d藻,预氧化并没有起到强化混凝效果,预氧化后,投加量增加到60mg/L时,OD680去除率、浑浊度去除率均不到70%,由图10(b)可知,预氧化后,DOC虽有一定下降,但DOC仍然很高,过高浓度的EOM影响了氧化剂的效果,使得预氧化效果不明显.

图10 接种第36d各指标随PAC投加量变化Fig.10 Variation of parameters with PAC dosages after inoculation 36d
2.4 高锰酸钾的助凝作用机理
高锰酸钾对于藻液有较强的助凝效果,浓度越高时助凝效果越强.高锰酸钾除了前述的能改变藻细胞的沉降性能,有助于后续混凝工艺的进行外,其自身对于铜绿微囊藻细胞也有一定的絮凝效果.研究表明,EOM 对于铜绿微囊藻的混凝去除有促进作用.判断在未投加混凝剂的藻悬浊液中高锰酸钾对于细胞的凝聚效果是二氧化锰吸附以及EOM促进的共同作用.图11为运用扫描电镜观察到的高锰酸钾预氧化前后的藻细胞形态,可以发现藻细胞在受到高锰酸钾氧化后会聚集在一起,藻细胞表面的细胞分泌物会形成一层包裹体附着在藻团外,导致氧化剂无法迅速作用至藻团内部细胞表面.高浓度下高锰酸钾的强絮凝作用可能会导致氧化剂作用至藻细胞时间的延迟,从而导致高锰酸钾暴露值临界点的后移.

图11 高锰酸钾氧化藻细胞前后SEM图Fig.11 SEM images of M. aeruginosa cells after permanganation
3 结论
3.1 最优高锰酸钾投加量为2mg/L.不同藻生长阶段高锰酸钾强化混凝除藻效果顺序为:第21d>第9d>第28d>第36d.
3.2 第21d和第9d的藻,高锰酸钾预氧化降低了藻细胞活性,有利于藻类沉降,起到强化混凝除藻作用;在培养后期,高锰酸钾强化混凝的效果越来越弱.
3.3 不同培养阶段的藻胞外有机物的浓度不同,当EOM浓度较低时(第9d、第21d),氧化剂易与藻细胞接触,导致细胞受损,促进胞外有机物分泌.高锰酸钾还原产物是水合 MnO2,会对混凝有促进作用,它既能吸附有机物质,同时还能附着在藻细胞表面,提高了藻细胞的沉降性.
3.4 高锰酸钾氧化会对细胞膜和细胞壁产生破坏作用,导致其释放胞内有机物到水中,引起胞外有机物浓度的升高.一定浓度的 EOM可以起到助凝的作用,EOM 的性质及其动态变化必然影响藻类的预氧化及混凝效果.
3.5 当EOM浓度过高时(第28d、第36d),会大量消耗氧化剂,显著影响氧化剂氧化效率,使得预氧化效果不明显.
[1] 吴 静,王玉鹏,蒋颂辉,等.某市供水藻类污染及其毒性研究[J]. 中国环境科学, 2001,21(2):131-139.
[2] 刘丽娟,汪 琳,李明玉,等.不同混凝剂强化除藻, 除浊的研究[J]. 中国给水排水, 2010,(5):80-83.
[3] 李明玉,潘 倩,王丽燕,等.不同混凝剂对流溪河水源水中藻类去除的对比 [J]. 中国环境科学, 2010,30(11):1484-1489.
[4] 向 斯,刘世昌,赵以军,等.pH值及黏土密度对壳聚糖改性絮凝剂除藻效果的影响 [J]. 中国环境科学, 2015,35(5):1520-1525.
[5] Sukenik A, Teltch B, Wachs A, et al. Effect of oxidants on microalgal flocculation [J]. Water Research, 1987,21(5):533-9.
[6] Chen J-J, Yeh H H. The mechanisms of potassium permanganate on algae Removal [J]. Water Research, 2005,39(18):4420-4428.
[7] Knappe D R. Algae detection and removal strategies for drinking water treatment plants [M]. American Water Works Association, 2004.
[8] Petrusevski B V, Van Breemen A, Alaerts G. Effect of permanganate pre-treatment and coagulation with dual coagulants on algae removal in direct filtration [J]. Aqua., 1996,45(6):316-326.
[9] El-Dars F M, Rahman M A, Salem O M, et al. Algal control and enhanced removal in drinking waters in Cairo, Egypt [J]. Journal of Water and Health, 2015,13(4):1060-1072.
[10] Henderson R, Parsons S, Jefferson B. Successful removal of algae through the control of zeta potential [J]. Separation Science and Technology, 2008,43(7):1653-1666.
[11] Beaulieu S E, Sengco M R, Anderson D M. Using clay to control harmful algal blooms: deposition and resuspension of clay/algal flocs [J]. Harmful Algae, 2005,4(1):123-138.
[12] Zhang X, Amendola P, Hewson J C, et al. Influence of growth phase on harvesting of Chlorella zofingiensis by dissolved air flotation [J]. Bioresource Technology, 2012,(116):477-484.
[13] 余国忠,刘 军.藻细胞特性对净水工艺的影响研究 [J]. 环境科学研究, 2000,13(6):56-59.
[14] Henderson R K, Parsons S A, Jefferson B. The impact of differing cell and algogenic organic matter (AOM) characteristics on the coagulation and flotation of algae [J]. Water Research, 2010, 44(12):3617-3624.
[15] Wang L, Qiao J, Hu Y, et al. Pre-oxidation with KMnO4changes extra-cellular organic matter's secretion characteristics to improve algal removal by coagulation with a low dosage of polyaluminium chloride [J]. Journal of Environmental Sciences, 2013,25(3):452-459.
[16] Chen J-J, Yeh H-H, Tseng I-C. Effect of ozone and permanganate on algae coagulation removal–Pilot and bench scale tests [J]. Chemosphere, 2009,74(6):840-846.
Pre-oxidation effects of potassium permanganate on activity of algal cells and the organics of intracellular and extracellular.
extracellular. ZHANG Xiao-dong, QIAO Jun-lian*, LÜ Li-ping, GAO Nai-yun (State Key Laboratory of Pollution Control and Resources Reuse, College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China). China Environmental Science, 2017,37(7):2708~2714
Based on different characteristics of pure-cultured Microcystis aeruginosa in different growth phases, the effect of potassium permanganate pre-oxidation, on the DOC of intracellular and extracellular, removal efficiency and changes of cells were studied, and PAC was used as coagulant for subsequent coagulation. The results showed Low concentration potassium permanganate used in pre-oxidation phase can inhibit the algal photosynthesis, and high concentration used would inactivate the algal cells and release large quantities of intracellular organic matter. When potassium permanganate dosage is 2mg/L and PAC dosage is 30mg/L, in 9d、21d、28d、36d, the removal rates of algae are 81%、99%、58.2%、35.35% respectively. In different potassium permanganate dosages, algal samples reach the best removal efficiency in 21day which is the logarithmic stage, which may be related to the content and components of Extracellular Organic Matter (EOM) in different growth phase. In early senescence phase and late senescence phase, the concentration of EOM significantly increase, which affected oxidation of potassium permanganate and thus resulted in the decrease of coagulation effectiveness. Since the concentration of EOM was low in stationary phase and logarithmic phase, oxidant could contact with algae and promoted algae to secrete EOM. The proper amount of EOM can enhance the efficiency of algae removal. The reduction product of potassium permanganate is hydrated MnO2, which will promote coagulation and can be attached to the surface of algae to improve algal cell sedimentation.
microcystis aeruginosa;growth phase;potassium permanganate;pre-oxidation;coagulation
X524
A
1000-6923(2017)07-2708-07
张晓东(1993-),男,河南鹤壁人,硕士研究生,研究方向为水处理技术.
2016-12-24
国家水体污染控制与治理重大科技专项(2012ZX07403-001);上海市科委项目(0400236036)
* 责任作者, 副教授, qiaoqiao@tongji.edu.cn
