Hes1在烟草诱导人支气管上皮细胞恶性转化过程中的作用*
2017-08-07周继红陈余清袁娜娜王效静朱茂祥杨陟华
洪 磊, 周继红, 李 伟, 陈余清△, 蒋 鹏, 袁娜娜, 王效静, 朱茂祥, 杨陟华
(1蚌埠医学院第一附属医院呼吸与危重症医学科,安徽呼吸系病临床基础省级实验室, 安徽 蚌埠 233004;2蚌埠医学院生物化学与分子生物学教研室, 安徽 蚌埠 233002; 3军事医学科学院放射与辐射研究所, 北京 100850)
·论 著·
Hes1在烟草诱导人支气管上皮细胞恶性转化过程中的作用*
洪 磊1, 周继红2, 李 伟1, 陈余清1△, 蒋 鹏1, 袁娜娜1, 王效静1, 朱茂祥3, 杨陟华3
(1蚌埠医学院第一附属医院呼吸与危重症医学科,安徽呼吸系病临床基础省级实验室, 安徽 蚌埠 233004;2蚌埠医学院生物化学与分子生物学教研室, 安徽 蚌埠 233002; 3军事医学科学院放射与辐射研究所, 北京 100850)
目的: 探讨转录因子发状分裂相关增强子1(hairy and enhancer of split,Hes1)在香烟烟气凝集物(cigarette smoke condensate,CSC)诱导永生化人支气管上皮细胞BEP2D恶性转化中的作用。方法: CSC (1L空气中点燃1支香烟)慢性染毒BEP2D细胞至第70代,软琼脂集落形成实验检测CSC诱导的细胞恶性转化表型;采用RT-PCR和Western blot法检测各代细胞的Hes1表达;MTT法、细胞集落形成实验和流式细胞术检测Notch通路阻断剂DAPT或脂质体转染Hes1-siRNA对CSC染毒BEP2D细胞增殖与凋亡的影响。检测吸烟大鼠外周小气道组织中Hes1的表达;采用免疫组化法和RT-PCR法检测非小细胞肺癌组织及正常气道组织中Hes1的表达。结果: 第70代BEP2D细胞具备恶性转化表型;Hes1在CSC染毒BEP2D细胞中的表达总体呈逐渐增高的趋势;DAPT和Hes1-siRNA均能通过下调Hes1显著抑制第70代BEP2D细胞的增殖,诱导其凋亡;Hes1在卷烟烟气暴露大鼠气道黏膜1月和6月组的表达较同期对照组显著增高;吸烟显著诱导肺癌组织和正常气道表达Hes1。结论: Hes1可能通过促进凋亡与增殖失衡,参与吸烟诱导的肺癌发生。
肺癌; 吸烟; 转录因子Hes1; 香烟烟气凝集物
肺癌是世界上发病率最高的恶性肿瘤之一,全球每年大约有1 600万新确诊肺癌患者[1]。吸烟与肺癌的发生密切相关[2],香烟烟雾中有69种致癌物,包括尼古丁、尼古丁衍生的亚硝胺酮[nicotine-derived nitrosamine ketone,NNK; 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone]和多环芳烃等[3],这些成分可通过多种途径影响肺癌的发生、侵袭及转移[4]。但烟草致癌的具体分子机制尚未阐明。转录因子发状分裂相关增强子1(hairy and enhancer of split 1,Hes1)是Notch信号通路中重要转录调控因子,参与干细胞自我更新能力的维持,可抑制干细胞的不对称有丝分裂[5],因此Hes1的异常表达会对肿瘤的生长与分化产生重要影响。Hes1在包括横纹肌肉瘤、结肠癌等多种肿瘤中异常表达[6-7]。有研究发现Hes1高表达于非小细胞肺癌细胞中[8]。但其在烟草致癌中的作用目前国内外尚无报道。
材 料 和 方 法
1 动物、细胞和组织标本
1.1 动物分组与模型的制备 清洁级雄性Wistar大鼠72只,体重(180±20)g,由中国人民解放军军事医学科学院实验动物中心提供。将大鼠随机分为2组,一组在正常呼吸空气条件下饲养,注意给予基础饲料和充足的水;另一组给予烟雾吸入,采用市售某品牌香烟(焦油量 14 mg,烟气烟碱量 1 mg),将大鼠置入70 cm×50 cm×50 cm密闭染毒装置中被动吸烟,每日2次,每次连续燃烧10支香烟,共持续约30 min,每周7 d,连续6个月。2组动物分别于饲养1、3、6月各处死12只,取肺组织标本石蜡包埋进行实验。
1.2 细胞 永生化人支气管上皮细胞BEP2D由军事医学科学院放射与辐射医学研究所朱茂祥教授馈赠。
1.3 组织标本 收集蚌埠医学院第一附属医院病理科2013年6月~2016年1月非小细胞肺癌(non-small-cell lung cancer,NSCLC)手术存档标本(石蜡包埋)50例。所有患者采集标本前均未经过放疗、化疗和靶向治疗。所有标本均有完整的临床及病理资料。男性占37例,女性占13例;年龄<60岁的14例,≥60岁的36例;肺癌的病理诊断标准参照2004年WHO肺肿瘤组织学分类标准。按组织学分级Ⅰ级占12例,Ⅱ级占22例,Ⅲ级占16例;有淋巴结转移者19例,无淋巴结转移者31例;详细记录每例患者吸烟时间、每天吸烟量(包)和戒烟时间。吸烟指数(包×年)=每天吸烟的包数(每包20支)×吸烟年数。按患者吸烟状况分类:从不吸烟者21例,重度吸烟29例(从不吸烟者定义为终生吸烟剂量少于100支;重度吸烟的定义为吸烟指数>20包×年)。筛查2013 年4 月~2015 年12 月蚌埠医学院第一附属医院呼吸内镜中心接受气管镜检查的重度吸烟人群,所有患者经过病理和随访最终确定为非肿瘤患者。最终筛选出10 例重度吸烟患者(病理证实7 例为中到重度不典型增生,3 例为鳞状化生)和10 例不吸烟患者(该20例患者中结核4例,炎症13例,间质性肺炎3例)。本实验经过蚌埠医学院第一附属医院伦理委员会批准后进行的。
2 主要试剂
RIPA裂解液和BCA蛋白浓度试剂盒(碧云天);Trizol和PCR试剂盒(北京天根);逆转录试剂盒(Thermo);抗Hes1单克隆抗体、抗Notch1及Notch的活化形式Notch胞内段(Notch intracellular domain,NICD)多克隆抗体(Abcam); HRP标记的羊抗兔IgG(博士德);DAPT(Notch阻断剂)购于Sigma;超敏即用型二步法免疫组化试剂盒和DBA显色试剂盒(中杉金桥);单通道吸烟机(型号HRH-SM120,北京慧荣和科技公司);卷烟烟气染毒柜(军事医学科学院研制)。
3 主要方法
3.1 香烟烟气凝集物(cigarette smoke condensate,CSC)的制备及细胞培养 用北京慧荣和科技公司生产的HRH-SM120型单通道吸烟机制备CSC,用LHC-8培养液稀释到实验设计浓度处理细胞直接进行细胞染毒,CSC在一定程度上代表了主流烟气中的主要成分。正常对照组(BEP2D细胞)、乙醇对照组及CSC(每升空气点燃1支香烟)处理后的P10、P20、P30、P40、P50、 P60、P70细胞组(分别代表第10~70代染毒细胞),使用LHC-8无血清培养液,在37 ℃、5% CO2、饱和湿度条件下细胞培养箱培养。
3.2 软琼脂细胞集落形成实验 采用LHC-8培养液配制1.4%的琼脂糖,高温高压灭菌后,稍冷却后放入41 ℃水浴锅中保温;加入预温的LHC-8培养液稀释至0.7%,继续保温;以每皿3 mL 0.7%琼脂糖倒进直径60 mm培养皿中,铺制底层,待其凝固后备用。将常规消化呈指数生长的9组细胞,制备相应细胞培养液悬液与保温的0.7%琼脂糖1∶1混匀,稀释为0.35%细胞琼脂混合液,加在含0.7%琼脂糖胶培养皿上(细胞密度为每皿1.5×104),待细胞琼脂混合液凝固后,每皿中加入2 mL LHC-8培养液。每组设5皿;在5% CO2、37 ℃和饱和湿度环境下培养,3 d换液1次;4周后行镜下计数,细胞多于50个为1个集落,按以下公式计算集落形成率(clony formation efficiency,CFE):CFE(%)=(集落数/接种细胞数)×100%。
3.3 Western blot实验 提取各不同染毒代数细胞蛋白,以100 ℃煮沸5 min,使蛋白充分变性,10% SDS-PAGE分离目的蛋白,并转移至PVDF膜上;裁剪后的膜用封闭液室温封闭1.5 h,加入稀释后的 I 抗(Notch1、NICD、Hes1和β-actin抗体分别用 I 抗稀释液以1∶500、1∶1 000、1∶1 000和1∶400 稀释),4 ℃孵育过夜;次日用TBST缓冲液洗膜3次,采用HRP标记的 II抗37 ℃ 孵育20 min,继而室温下孵育80 min 左右(60 r/min);再用TBST缓冲液洗膜3次,配置化学发光试剂。实验重复3次,应用AlphaView软件对目的条带进行灰度分析。数据使用目标蛋白的灰度值/内参照(β-actin)灰度值表示。
3.4 RT-PCR实验 采用Trizol法提取处理后各组细胞总RNA,根据说明书进行逆转录和扩增。实验设置3个复孔并至少重复2次。β-actin表达量作为内参照。数据使用目标基因mRNA/内参照(β-actin)灰度值表示。Hes1的上游引物序列为5′-CCCTCCTCCTAAACTCCC-3′,下游引物序列为5′-TCAAACATCTTTGGCATCA-3′。内参照β-actin的上游引物序列为 5′-TGACGTGGACATCCGCAAAG-3′,下游引物序列为 5′-CTGGAAGGTGGACAGCGAGG-3′。
3.5 MTT实验检测细胞活力 将CSC染毒的P70细胞分成4组,分别加入0 μmol/L、10 μmol/L、25 μmol/L和50 μmol/L的DAPT,分别处理24 h、48 h和72 h。收集对数生长期细胞制成细胞悬液,并调整细胞悬液浓度为1×107/L;在37 ℃、5% CO2的培养箱内培养至孔底细胞铺满单层,加入200 μL含上述浓度梯度抑制剂的培养液,毎个梯度设5个复孔,同时设置调零孔(不含细胞和药物,只添加培养基);37 ℃、5% CO2的培养箱内培养至设定时间后,每孔加入20 μL MTT溶液继续培养4 h;培养终止,轻轻吸去96孔板内培养液,每孔加入150 μL DMSO,置于低速摇床上振荡10 min,使结晶物充分溶解;测量各孔在波长490 nm处的吸光度并记录。同样方法检测Hes1干扰后的细胞活力,实验设立3组: 实验组(siRNA-Hes1组)、阴性对照组(siRNA-NC组)和空白组(control组)。siRNA合成及转染方法见3.9。
3.6 细胞集落形成检测 准备感染后的细胞,将处于对数生长期的各实验组细胞胰酶消化,完全培养基重悬,制成细胞悬液,计数。于6孔培养板中每孔接种400~1 000 个细胞(根据细胞生长情况确定),每个实验组设3个复孔。将接种好的细胞于培养箱中继续培养到14 d或绝大多数单个集落中细胞数大于50 为止,中途每隔3 d进行换液并观察细胞状态。实验终止前荧光显微镜下对细胞集落进行拍照,PBS 洗涤细胞1 次。每孔加入1 mL 4%多聚甲醛,固定细胞30~60 min,PBS 洗涤细胞1 次。每孔加入洁净、无杂质Giemsa 染液500 μL,染细胞10~20 min。ddH2O 洗涤细胞数次,晾干,集落计数。
3.7 Annexin V-PI双染法检测细胞凋亡 采用Annexin V-FITC细胞凋亡检测试剂盒检测不同浓度(10 μmol/L、25 μmol/L和50 μmol/L)DAPT及DAPT作用不同时间(24 h、48 h和72 h)后P70细胞的凋亡。操作步骤参照碧云天公司Annexin V-FITC细胞凋亡检测试剂盒说明书。同样方法检测Hes1沉默后的细胞凋亡,实验分为siRNA-Hes1组、siRNA-NC组和control组。
3.8 免疫组化实验 所有标本经4%中性甲醛固定,石蜡包埋,4 μm连续切片,HE染色。60 ℃烤箱烘片4 h,然后脱蜡至水,梯度乙醇脱水,随后水洗;采用柠檬酸抗原修复液煮沸10 min进行抗原修复,其余步骤严格按照说明书进行,DAB显色后,用苏木精复染,封片。结果判定采用双盲法,由2位病理科医师分别观察切片。Hes1阳性显色主要定位于细胞核。采用半定量积分法判定结果。首先按照着色强度评分,标本无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;再按照阳性细胞在所观察细胞中所占比例评分,阳性细胞数≤10%为1分,11%~50%为2分,51%~75%为3分,≥75%为4分。每张切片最后的得分为2次评分的乘积(1~12分)。
3.9 siRNA合成及转染 参考文献[9]并通过基因BLAST,挑选一条特异性寡核苷酸序列(由上海吉玛制药有限公司合成)。同时合成一条与目的RNA无同源性的片段作为阴性对照。Hes1序列为5′-CCGGCTTCAGCGAGTGCATGA-3′;阴性对照序列为5′-TTCTCCGAACGTGTCACGT-3′。以荧光标记的siRNA(FAM siRNA)进行优化。以1.5×108cells/L接种细胞于含无菌小圆玻片的24孔培养板中,每孔500 μL(保证在转染前细胞的汇合度在90%左右)。24 h后按照Lipofectamine 2000说明书的条件转染细胞,转染后6 h,换新鲜培养基。设立若干个siRNA浓度组,每组Opti-MEM用量为500 μL。24 h观察细胞生长情况,荧光显微镜观察转染效率。确定1 μL Lipofectamine 2000配50 nmol/L siRNA为最佳转染浓度。实验分为siRNA-Hes1组、siRNA-NC组和control 组。
3.10 实时荧光定量PCR法检测Hes1基因表达 采用实时荧光定量逆转录聚合酶链反应检测干扰效率。细胞按照上面优化的转染条件进行下一步的转染,分组同上;提取细胞总RNA;按照逆转录试剂盒提供的反应步骤及反应条件(65 ℃ 5 min, 42 ℃ 60 min, 70 ℃ 5 min)获得cDNA;荧光定量PCR使用Quantace qPCR Mix的PCR试剂盒,反应液配制按说明书操作,建立RT-qPCR反应体系,RT-qPCR反应条件为: 42 ℃ 60 min; 95 ℃ 10 min; 95 ℃ 20 s, 55 ℃ 30 s, 72 ℃ 30 s, 45次循环。Hes1上游引物序列为5′-AAGAAAGATAGCTCGCGGCAT-3′,下游引物序列为5′-CCAGCACACTTGGGTCTGT-3′;内参照GAPDH的上游引物序列为5′-TGACTTCAACAGCGACACCCA-3′,下游引物序列为5′-CACCCTGTTGCTGTAGCCAAA-3′。用2-ΔΔCt值表示 Hes1的mRNA相对表达水平。
4 统计学处理
采用SPSS 19.0统计软件进行统计学分析。实验数据采用均数±标准差(mean±SD)表示,两组之间数据比较采用独立样品t检验,多组之间数据比较采用单因素方差分析,若总体均数有差异,进行组间的两两比较的q检验,计数资料采用行×列表资料的χ2检验。以P<0.05为差异有统计学意义。
结 果
1 CSC对各代细胞形态的影响
与对照组(正常对照组和乙醇组)相比,CSC诱导P10~P70支气管上皮细胞的生长速度逐渐加快,以P50和P70细胞变化明显,细胞体积变大,开始呈复层生长,排列紊乱,细胞群体出现无序的团块状或条索状生长,无明显的密度抑制和接触性抑制,见图1。
2 CSC诱导对各代细胞软琼脂细胞集落形成的影响
软琼脂集落形成实验是检测细胞在双层软琼脂中集落形成的能力,是检测细胞是否发生恶性转化的重要指标。P10和P20细胞的集落形成率较低,P30以后细胞,软琼脂细胞的集落形成显著升高,且所形成的集落形态明显增大,以P70细胞的集落形成率最高,与对照组比较差异有统计学意义(P<0.05),见图2。
Figure 1.The images of the cells exposed to CSC in different generations.
图1 CSC诱导的各代细胞图
Figure 2.The images of the soft agar cell colony formation experiment for each group (×200).
图2 各组细胞的软琼脂细胞集落形成实验结果
3 Hes1 mRNA在CSC诱导各代细胞中的表达
乙醇组、P10、P20、P30、P40、P50、P60和P70细胞Hes1的mRNA表达量较正常对照组高(P<0.01);P20、P30、P40、P50、P60和P70细胞中Hes1的mRNA表达量较P10细胞高(P<0.05)。Hes1的mRNA表达量随着染毒代数的增加呈现逐渐增高的趋势,见图3A。
4 Hes1 蛋白在CSC诱导各代细胞中的表达
Hes1蛋白在9种不同代数细胞中的表达量之间差异有统计学意义(P<0.01)。与正常对照组相比,乙醇组、P10、P20、P30、P40、P50、P60和P70细胞中的Hes1 蛋白表达量升高(P<0.01);与P10相比,P20、P30、P40、P50、P60和P70细胞中的Hes1蛋白表达量升高(P<0.05)。Hes1蛋白表达量随着染毒代数的增加呈现逐渐增高的趋势,见图3B。
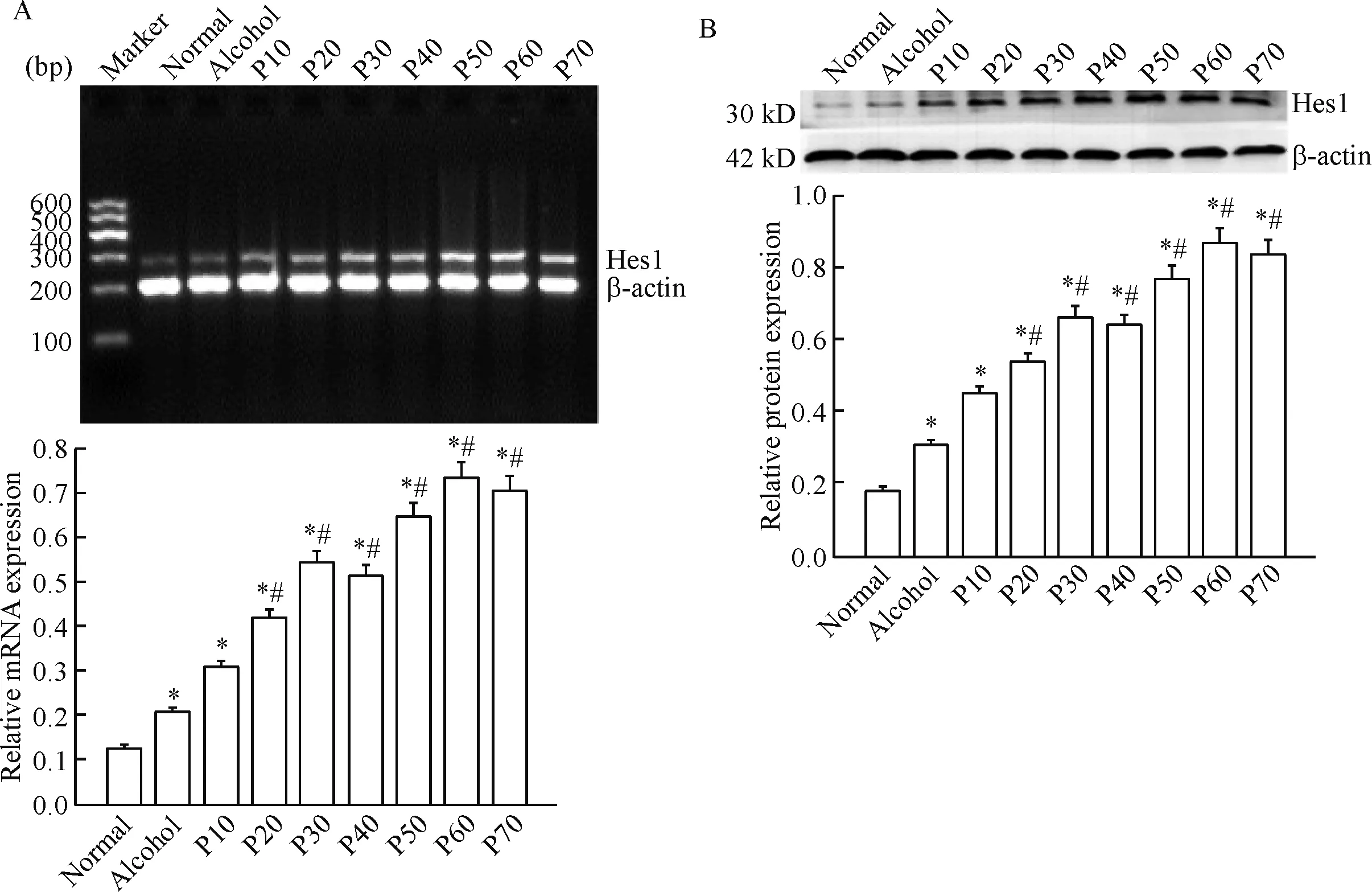
Figure 3.The expression of Hes1 at mRNA and protein levels in the BEP2D cells with the malignant transformation at different stages. A: the mRNA expression of Hes1 in the BEP2D cells; B: the results of Western blot and the quantitative analysis. Mean±SD.n=3.*P<0.05vsnormal;#P<0.05vsP10.
图3 CSC诱导BEP2D恶性转化不同阶段Hes1 mRNA和蛋白表达的变化
5 吸烟对大鼠小气道黏膜Hes1表达的影响
如图4及表1所示,正常1、3、6月组大鼠小气道组织Hes1表达阳性率的差异无统计学意义;烟熏1、3、6月大鼠Hes1表达阳性率的组间差异有统计学意义(P<0.05),Hes1表达阳性率随着大鼠烟熏时间的增加而升高。烟熏1月大鼠Hes1表达阳性率与对照组无显著性差异,而烟熏3、6月大鼠小气道组织Hes1表达的阳性率显著高于对照组(P<0.05)。
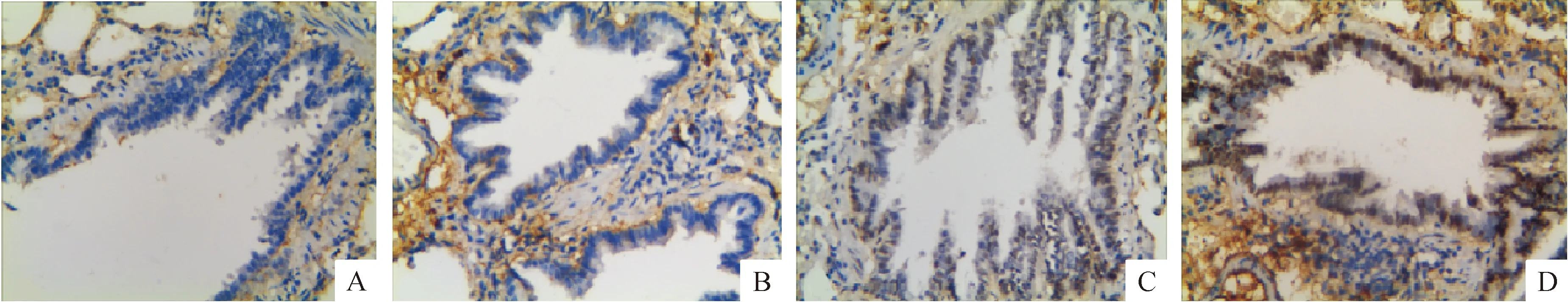
Figure 4.The protein expression of Hes1 in small airway epithelial cells of the rats with different smoking levels (×400). A: normal group; B: 1-month smoking group; C: 3-month smoking group; D: 6-month smoking group.
图4 不同烟熏程度的大鼠小气道上皮细胞Hes1表达
表1 正常及烟熏大鼠不同月份Hes1表达阳性率的比较
Table 1.The positive rate of Hes1 expression in the normal and smoking rats in different months (n=12)
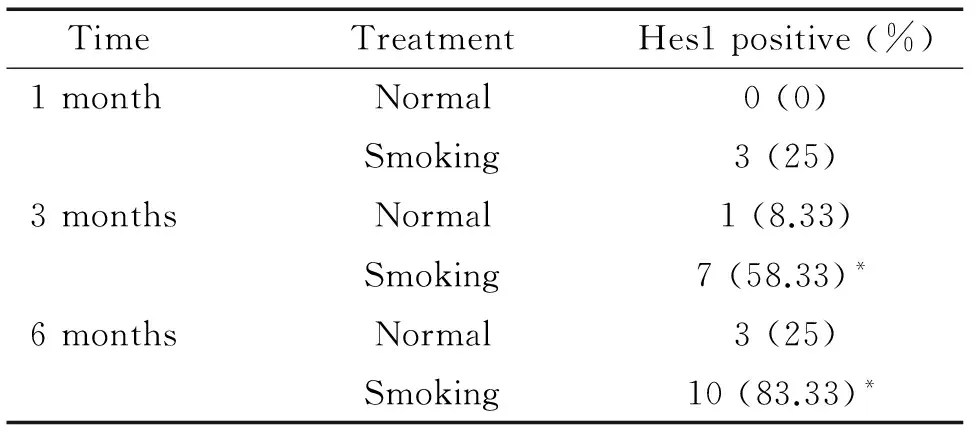
TimeTreatmentHes1positive(%)1monthNormal0(0)Smoking3(25)3monthsNormal1(8.33)Smoking7(58.33)*6monthsNormal3(25)Smoking10(83.33)*
*P<0.05vsnormal.
6 人气道黏膜中Hes1的mRNA表达水平与吸烟程度的关系
Hes1的mRNA表达在重度吸烟者明显高于非吸烟者(P<0.05),见图5。
7 Hes1蛋白表达与非小细胞肺癌患者吸烟程度的关系
非小细胞肺癌患者中重度吸烟者的Hes1蛋白表达明显高于轻度吸烟者,其表达水平与吸烟程度呈正相关(2=4.583,P<0.05),见图6。

Figure 5.The mRNA expression of Hes1 in the airway mucosa of heavy smokers and non-smokers. M: marker; 1~10: the group of never smoking; 11~20: the group of severe smoking. Mean±SD.n=20.*P<0.05vsnever smoking group.
图5 人重度吸烟者和人非吸烟者气道粘膜Hes1的mRNA表达
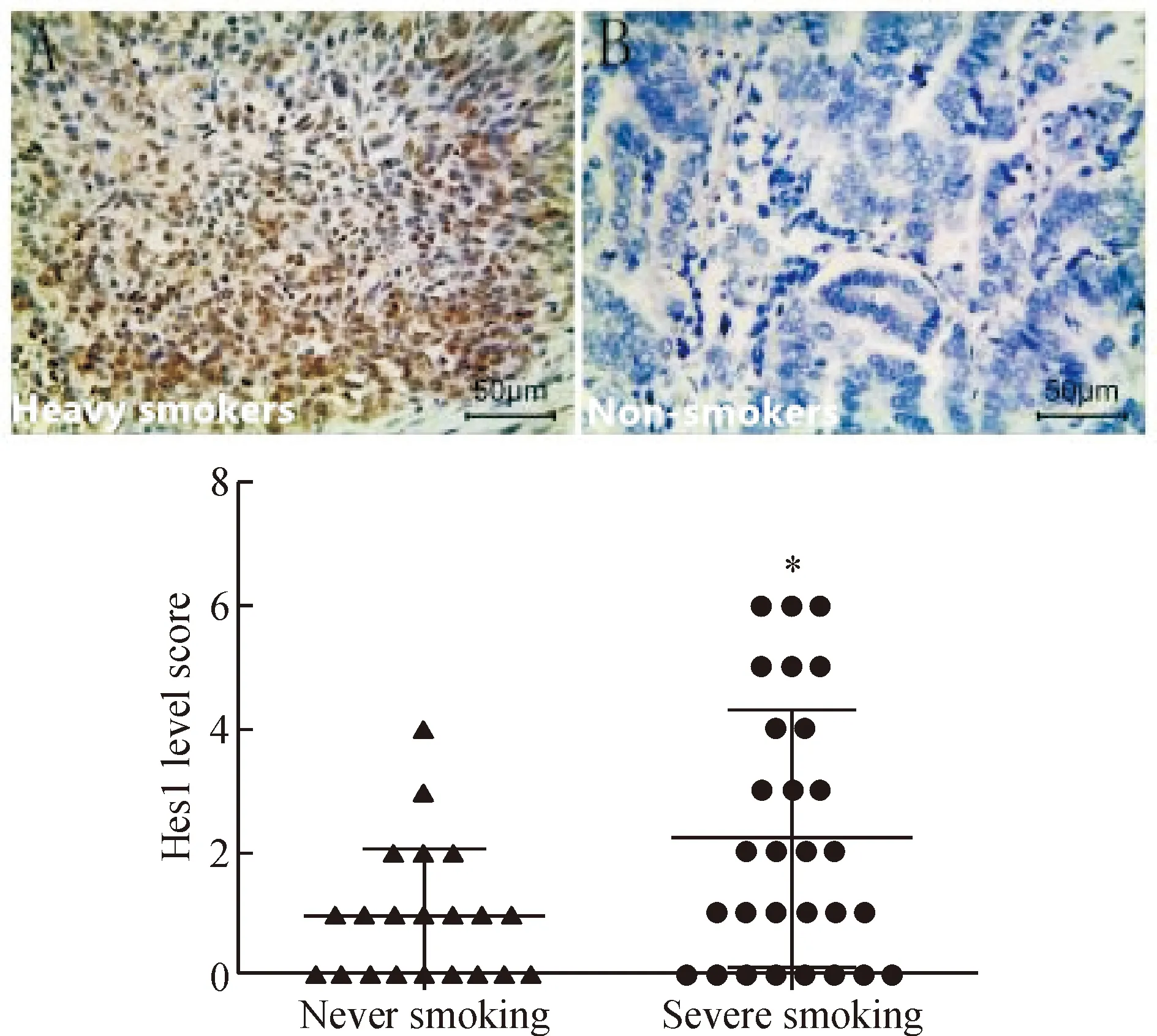
Figure 6.The protein expression of Hes1 in non-small-cell lung cancer patients detected by immunohistochemecal staining and the relationship between the expression level and the degree of smoking. Mean±SD.n=20.*P<0.05vsnever smoking group.
图6 Hes1蛋白在非小细胞肺癌组织中的表达与吸烟程度的关系
8 DAPT及Hes1-siRNA对CSC诱导的P70细胞增殖和凋亡的影响
10 μmol/L DAPT作用细胞24 h后,细胞的存活率降低(88.90%),且随着DAPT的浓度升高及作用时间延长,下降越明显,各组间差异具有统计学意义(P<0.01),50 μmol/L DAPT处理细胞72 h后,细胞的存活率仅为45.67%,见图7A;集落形成实验结果显示,25 μmol/L DAPT能够显著抑制P70细胞的集落形成能力(P<0.01),见图7B。随着DAPT浓度和作用时间的增加,P70细胞的凋亡率均逐渐增加,呈浓度和时间依赖性(P<0.05),见图8。荧光染色结果显示,1 μL Lipofectamine 2000配50 nmol/L siRNA的转染效率超过95%,见图9。MTT法检测结果显示,与control组和siRNA-NC组相比,Hes1基因沉默的BEP2D-P70细胞增殖在24~72 h范围内均受到明显抑制(P<0.05);Annexin V-PI染色结果显示,与control组和siRNA-NC组相比,Hes1基因沉默的BEP2D-P70细胞凋亡明显增加(P<0.05),见图10。
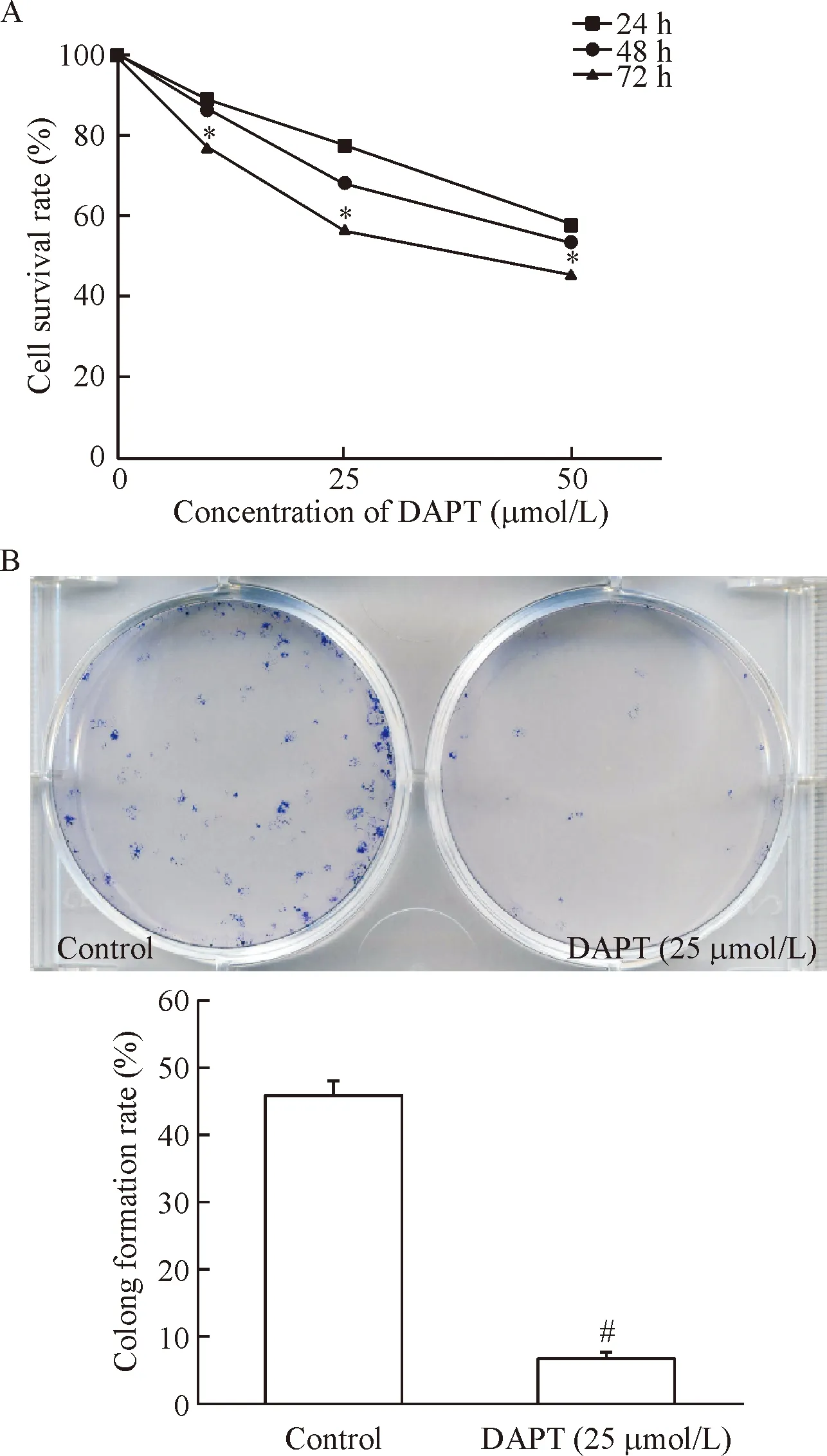
Figure 7.The effects of DAPT on the BEP2D-P70 cell viability (A) and colony formation rate (B). Mean±SD.n=3.*P<0.05vs24 h or 48 h;#P<0.05vscontrol.
图7 MTT实验和克隆形成实验检测DAPT对BEP2D-P70细胞增殖的影响
9 DAPT及Hes1基因沉默对P70细胞Notch1、Hes1和NICD表达的影响
根据上述细胞增殖及凋亡实验,为了能够保持细胞的增殖及药物作用很好的发挥,我们选择DAPT终浓度为25 μmol/L作用细胞48 h。DAPT组中Notch1蛋白的表达高于对照组(P<0.05),而Hes1和NICD蛋白的表达明显低于对照组(P<0.05),见图11。与其它处理组比较,siRNA-Hes1组Hes-1的mRNA表达量显著下降,且差异有统计学意义(P<0.01),见图12。
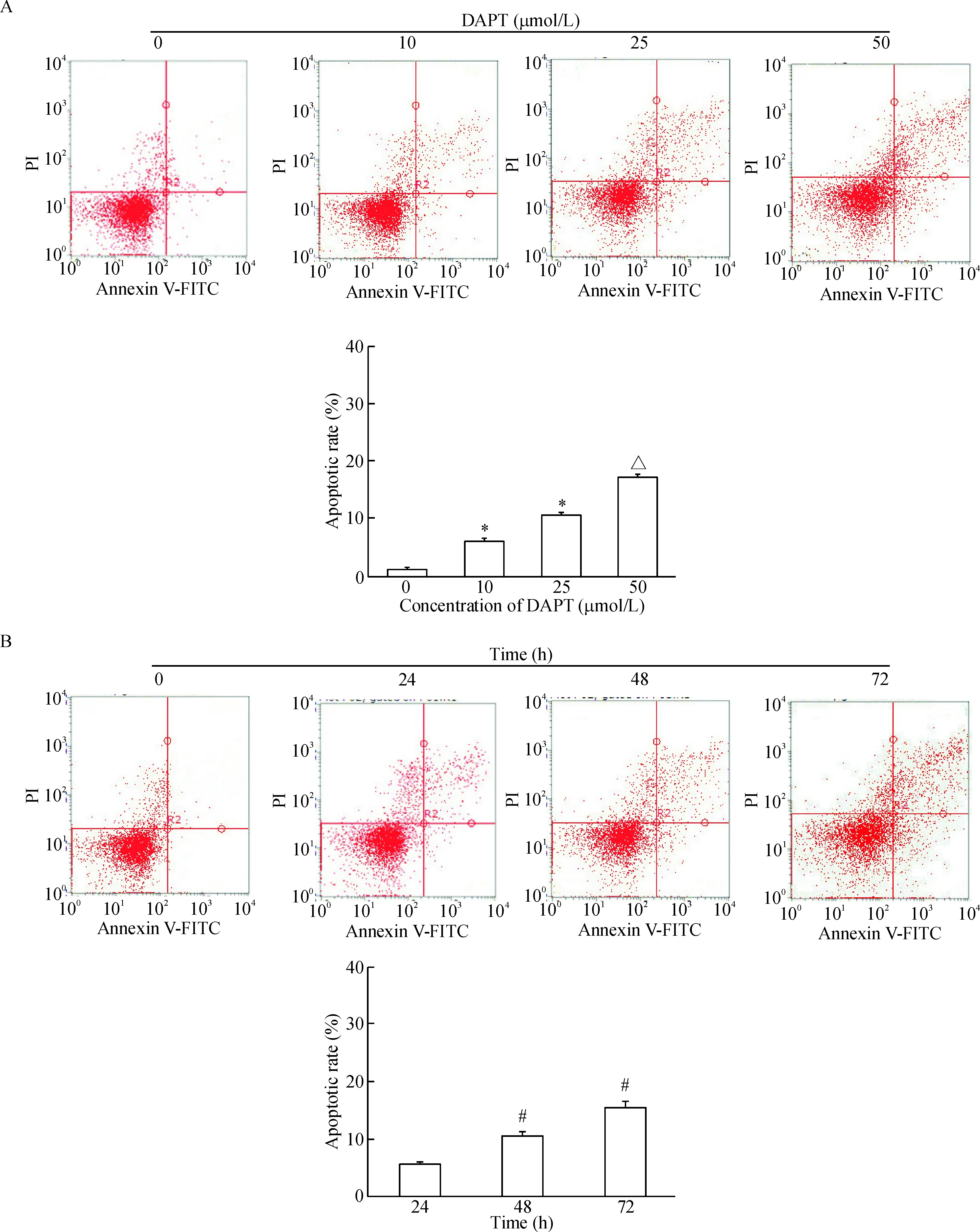
Figure 8.The effects of DAPT on the apoptosis of the BEP2D-P70 cells. A: the BEP2D-P70 cells treated with different concentrations of DAPT for 48 h and the apoptotic rates were analyzed by flow cytometry; B: the BEP2D-P70 cells were treated with DAPT at concentration of 25 μmol/L and the apoptotic rates were analyzed by flow cytometry at different time points. Mean±SD.n=3.*P<0.05vs0 μmol/L;△P<0.05vs25 μmol/L;#P<0.05vs24 h.
图8 DAPT对BEP2D-P70细胞凋亡的作用呈现浓度和时间依赖性
讨 论
香烟烟雾不仅可以通过烟碱型乙酰胆碱受体(nicotinic acetylcholine receptors,nAChRs)来调控细胞的增殖与凋亡,而且可以通过促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路、Ca2+通路、Akt信号通路等途径发挥促进增殖作用。有研究表明,CSC可诱导正常乳腺上皮细胞发生转化,增加神经纤毛蛋白1(neuropilin-1,NRP-1)的表达[10]。我们前期研究证实CSC可以诱导IκB激酶ε表达,促进支气管上皮细胞恶性转化[11],但对于烟草致肺癌的复杂分子机制目前还知之甚少。
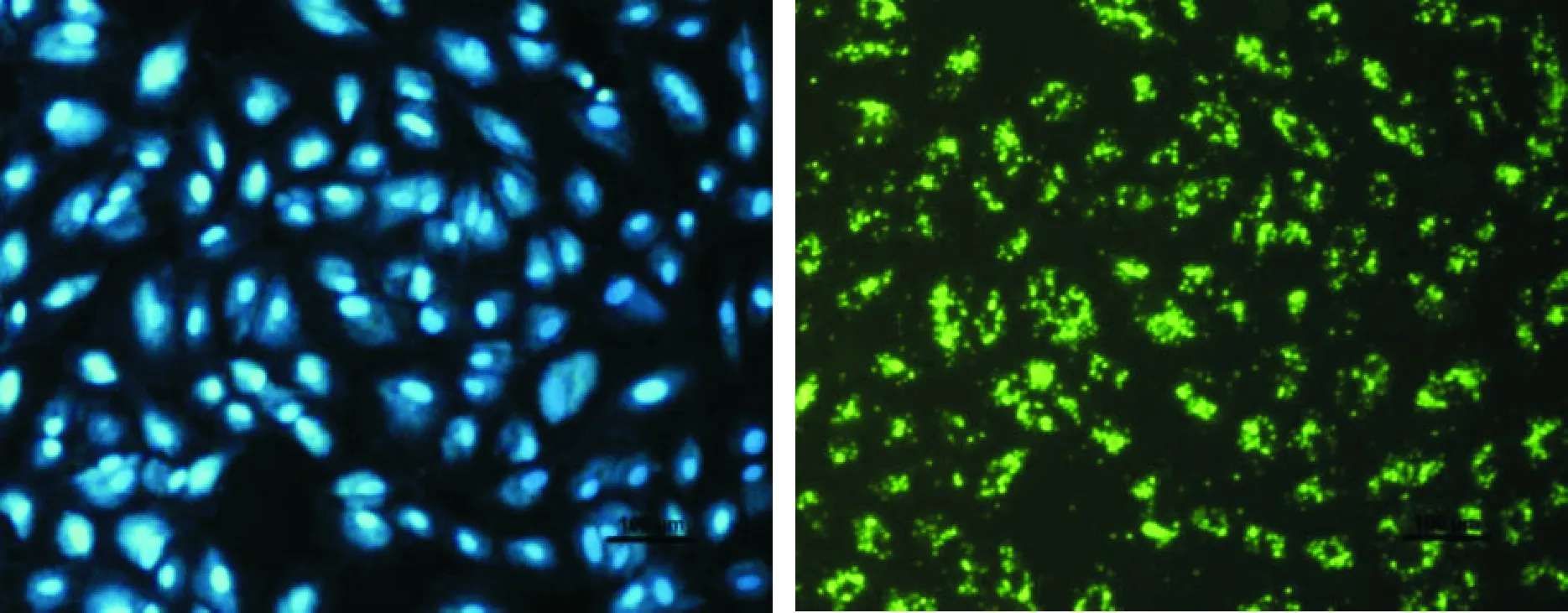
Figure 9.Transfection efficiency of siRNA (1 μL Lipo fectamine 2000, 50 nmol/L siRNA) of the cells under fluorescence microscope.
图9 荧光显微镜下细胞的siRNA转染效率
Hes1基 因 定 位 于 3q28-q29, 属于前神经元碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)基因家族,几乎表达于所有的未分化细胞中[12],与细胞的增殖和分化密切相关。有研究证实,在T 细胞急性淋巴细胞白血病中,Hes1被异常激活后可通过 PTEN/PI3K/Akt/mTOR 信号通路阻止细胞凋亡[13]。Hes1在口腔鳞癌中的表达高于癌前病变[14]。Hes1能通过抑制cyclin依赖性激酶抑制因子p27Kip1的转录而促进细胞增殖[15]。已知Hes1是Notch信号通路下游的重要转录调控因子,它与Notch信号通路相伴随共同表达于多个物种。Notch蛋白由胞外区(Notch extracellular domain,NECD)和跨膜片段(Notch transmembrane fragment,NTM)2 个亚单位组成,在通路激活时肿瘤坏死因子α转换酶切割该蛋白S2 位点,释放 Notch 蛋白的活化形式NICD,NICD 转移到细胞核内,通过连接普遍存在的转录因子、CBF1等调控Hes1基因最初的表达[16],Hes1激活后,调控肿瘤细胞的增殖、分化、迁移、侵袭过程[17]。
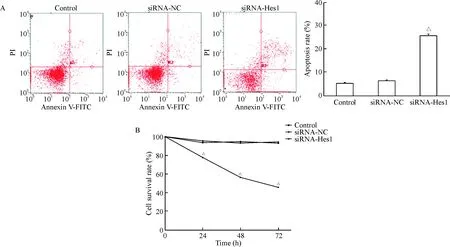
Figure 10.The apoptosis (A) and proliferation (B) of BEP2D-P70 afterHes1 gene silencing. Control: BEP2D-P70 cells without transfection; siRNA-NC: BEP2D-P70 cells were transfected with plasmid without Hes1-siRNA; siRNA-Hes1: BEP2D-P70 cells were transfected with plasmid with Hes1-siRNA. Mean±SD.n=3.△P<0.05vssiRNA-NC group.
图10Hes1基因沉默后BEP2D-P70细胞的凋亡和增殖情况
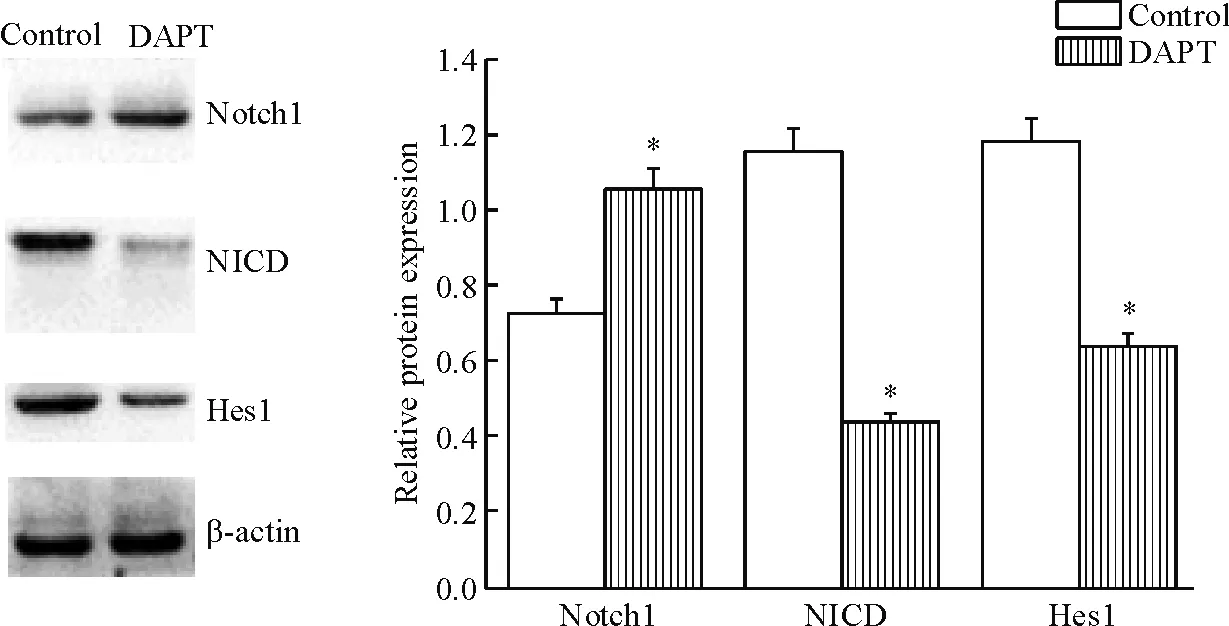
Figure 11.The protein expression of Notch1, NICD and Hes1 in the BEP2D-P70 cells before and after treated with DAPT. Mean±SD.n=3.*P<0.05vscontrol group.
图11 DAPT作用前后Notch1、NICD和Hes1蛋白表达的变化

Figure 12.The mRNA expression of Hes1 after RNA interfe-rence. Mean±SD.n=3.*P<0.01vssiRNA-NC group.
图12 RNA干扰Hes1后Hes1 mRNA表达的变化
本实验模拟了人类吸烟后支气管上皮细胞向肿瘤细胞演变的历程,更能贴近吸烟对支气管、肺长期作用的实际情况。首次探索进行CSC长期诱导实验,诱导至P70细胞。显微镜下观察到P70细胞体积变大,开始呈复层生长,排列紊乱,细胞群体出现无序的团块状或条索状生长,无明显的密度抑制和接触性抑制。经过软琼脂细胞克隆实验证实CSC诱导的永生化正常支气管上皮细胞发生了恶性转化,表明支气管上皮恶性转化细胞模型构建成功。RT-PCR和Western blot实验结果表明,烟草诱导支气管上皮恶性转化过程中存在Hes1表达上调;烟熏大鼠的气道粘膜检测证实随着大鼠烟熏时间的延长,Hes1蛋白表达呈现增高趋势;为了进一步证实吸烟对人气道Hes1表达在吸烟诱导肺癌发生中的作用,我们采用RT-PCR及免疫组化法分别检测了重度吸烟程度的正常气道黏膜组织及NSCLC组织中Hes1的表达情况,结果显示重度吸烟人群中气道黏膜Hes1的表达水平显著增高,Hes1表达可能与吸烟导致肺癌的发生密切相关。结合体内外实验结果,我们推测Hes1可能参与烟草相关肺癌的发生。
Hes1是Notch信号通路下游重要的转录调控因子,其活化可能与Notch信号通路的活化相关,本研究利用Notch通路阻断剂DAPT及Hes1-siRNA,结果均显示染毒P70细胞的增殖明显受到抑制,同时凋亡增加;进一步的功能实验证实,DAPT能够使染毒P70细胞的集落形成率明显降低,表明DAPT对细胞的恶性表型有一定的逆转作用,这种作用与下调Hes1表达,进而抑制细胞增殖、促进细胞凋亡有关。有研究表明,DAPT特异性较强,治疗结肠癌过程中发现在有效剂量范围内导致毒副作用的可能性小[18]。同时有研究证实,DAPT或Hes1-siRNA能够抑制胰腺癌肿瘤干细胞的生长[19]。本实验结果为DAPT用于肺癌高危人群的早期干预提供了实验依据,但Hes1参与吸烟诱导肺癌发生的具体分子机制尚需要进一步深入研究。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2):69-90.
[2] US Department of Health and Human Services, National Center for Chronic Disease Prevention and Health Promotion (US) Office on Smoking and Health. The health consequences of smoking—50 years of progress: a report of the Surgeon General[M]. Atlanta: Centers for Disease Control and Prevention (US), 2014.
[3] Hecht SS. Lung carcinogenesis by tobacco smoke[J]. Int J Cancer, 2012, 131(12):2724-2732.
[4] Chen RJ, Chang LW, Lin P, et al. Epigenetic effects and molecular mechanismsof tumorigenesis induced by cigarette smoke: an overview[J]. J Oncol, 2011, 2011:654931.
[5] Wall DS, Mears AJ, McNeill B, et al. Progenitor cell proliferation in the retina is dependent on Notch-independent Sonic hedgehog/Hes1 activity[J]. J Cell Biol, 2009, 184(1):101-112.
[6] 杨妙玲, 高 飞. Hes1 在结肠癌组织中的表达及对SW620细胞成瘤能力的影响[J]. 中国癌症杂志, 2014, 24(9):646-651.
[7] Sang L, Coller HA, Roberts JM. Control of the reversibility of cellular quiecence by thetranscriptional repressor HES1[J]. Science, 2008, 321(5892):1095-1100.
[8] Dang TP, Gazdar AF, Virmani AK, et al. Chromosome 19 translocation, overexpression of Notch3, and human lung cancer[J]. J Natl Cancer Inst, 2000, 92(16):1355-1357.
[9] 胡丽娜, 彭兴春, 郭显智, 等.Hes1基因沉默可抑制食管腺癌 OE33 细胞的增殖、迁移及侵袭[J]. 肿瘤, 2016, 36(7): 732-739.
[10]Narayan S, Jaiswal AS, Kang D, et al. Cigarette smoke condensate-induced transformation of normal human breast epithelial cells in vitro[J]. Oncogene, 2004, 23(35):5880-5889.
[11]Li W, Chen Y, Zhang J, et al. IKBKE upregulation is positively associated with squamous cell carcinoma of the lunginvivoand malignant transformation of human bronchial epithelial cellsinvitro[J]. Med Sci Monit, 2015, 21:1577-1586.
[12]Kageyama R, Ohtsuka T, Hatakeyama J, et al. Roles of bHLH genes in neural stem cell differentiation[J]. Exp Cell Res, 2005, 306(2):343-348.
[13]Palomero T, Sulis ML, Cortina M, et al. Mutational loss of PTEN induces resistance to NOTCH1 inhibition in T-cell leukemia[J]. Nat Med, 2007, 13(10):1203-1210.
[14]Lee SH, Hong HS, Liu ZX, et al. TNFα enhances cancer stem cell likephenotype via Notch-Hes1 activation in oral squamous cell carcinoma cells[J]. Biochem Biophys Res Commun, 2012, 424(1):58-64.
[15]Murata K, Hattori M, Hirai N, et al. Hes1 directly controls cell proliferation through the transcriptional repression of p27Kip1[J]. Mol Cell Biol, 2005, 25(10):4262-4271.
[16]Garcia A, Kandel JJ. Notch: a key regulator of tumor angiogenesis and metastasis[J]. Histol Histopathol, 2012, 27(2):151-156.
[17]Gao F, Zhang YQ, Wang SC, et al. Hes1 is involved in the self-renewal and tumourigenicity of stem-like cancer cells in colon cancer[J]. Sci Reports, 2014, 4:3963.
[18]Fender AW, Nutter JM, Fitzgerald TL, et al. Notch-1 promotes stemness and epithelial to mesenchymal transition in colorectal cancer[J]. J Cell Biochem, 2015, 116(11):2517-2527.
[19]Abel EV, Kim EJ, Wu J, et al. The Notch pathway is important in maintaining the cancer stem cell population in pancreatic cancer[J]. PLoS One, 2014, 9(3):e91983.
(责任编辑: 林白霜, 罗 森)
Role of Hes1 in malignant transformation of human bronchial epithelial cells induced by tobacco
HONG Lei1, ZHOU Ji-hong2, LI Wei1, CHEN Yu-qing1, JIANG Peng1, YUAN Na-na1, WANG Xiao-jing1, ZHU Mao-xiang3, YANG Zhi-hua3
(1DepartmentofRespiratoryandCriticalCareMedicine,TheFirstAffiliatedHospital,BengbuMedicalCollege,ProvincialKeyLaboratoryofRespiratoryDisease,Bengbu233004,China;2DepartmentofBiochemistryandMolecularBiology,BengbuMedicalCollege,Bengbu233002,China;3InstituteofRadiationMedicine,AcademyofMilitaryMedicalScience,Beijing100850,China.E-mail:bbmccyq@126.com)
AIM: To investigate the role of transcription factor hairy and enhancer of split 1 (Hes1) in the malignant transformation of human bronchial epithelial cell line BEP2D induced by tobacco. METHODS: The BEP2D cells were chronically exposed to cigarette smoke condensate (CSC) at 1 cigarette per L until the 70th generation. The phenotype of malignant transformation of the cells induced by CSC was detected by soft agar clony formation assay. RT-PCR and Western blot were used to determined the expression of Hes1 at mRNA and protein levels in each generation of the cells. The proliferation and apoptosis of the BEP2D cells exposed to CSC were analyzed with the methods of MTT assay, flow cytometry and cell colony formation assay after treatment with Notch pathway bloker DAPT or liposome transfection with Hes1-siRNA. The expression of Hes1 in the peripheral small airway tissues of the smoking rats was evaluated by immunohistochemical staining. The expression of Hes1 in non-small-cell lung cancer and normal airway tissues was also detected by the methods of immunohistochemistry and RT-PCR. RESULTS: The BEP2D cells in the 70th generation had a malignant transformation phenotype. The expression of Hes1 in the BEP2D cells exposed to CSC for different time showed an increa-sing trend. DAPT and liposome transfection with Hes1-siRNA down-regulated the expression of Hes1, inhibited the cell proliferation and induced cell apoptosis. The expression of Hes1 in the airway mucosa of the rats exposed to cigarette smoke for 1 month and 6 months was significantly higher than that in control group. Cigarette smoking induced the expression of Hes1 in lung cancer and normal airway tissues. CONCLUSION: Hes1 may be involved in smoking-induced lung cancer by promoting the imbalance between apoptosis and proliferation.
Lung cancer; Smoking; Transcription factor Hes1; Cigarette smoke condensate
1000- 4718(2017)07- 1153- 10
2016- 08- 25
2017- 04- 19
国家自然科学基金资助项目(No. 81172213);安徽省自然科学基金资助项目(No. 1408085MH14);安徽省高等学校自然科学基金重点项目(No. KJ2016A487);安徽省重点实验室绩效考核补助项目(No. 1506c085013);安徽高校自然科学研究重点项目(No. KJ2017A241)
R730.231; R734.2
A
10.3969/j.issn.1000- 4718.2017.07.001
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 18255243985; E-mail: bbmccyq@126.com
