牛磺酸对百草枯中毒大鼠肾损伤的作用及机制研究*
2017-08-07沈海涛陈之光刘振宁
沈海涛, 吴 娜, 王 煜, 陈之光, 刘振宁, 赵 敏△
(中国医科大学附属盛京医院 1急诊科, 2内分泌科, 辽宁 沈阳 110004)
牛磺酸对百草枯中毒大鼠肾损伤的作用及机制研究*
沈海涛1, 吴 娜2, 王 煜1, 陈之光1, 刘振宁1, 赵 敏1△
(中国医科大学附属盛京医院1急诊科,2内分泌科, 辽宁 沈阳 110004)
目的: 探讨不同剂量牛磺酸对百草枯中毒大鼠肾脏氧化应激和炎症反应的影响。方法: 选取48只雄性SD大鼠随机分为阴性对照组、百草枯染毒组、百草枯染毒+小剂量牛磺酸组和百草枯染毒+大剂量牛磺酸组。采用生化检测仪检测大鼠血清肌酐及尿素氮水平;比色法检测血标本中丙二醛(malondialdehyde,MDA)和超氧化物歧化酶(superoxide dismutase,SOD)水平评估氧化应激状态;另以ELISA法检测血标本中IL-6及细胞间黏附分子1(ICAM-1)水平评估炎症反应;DHE荧光探针检测肾脏活性氧簇(reactive oxygen species,ROS)水平;Western blot法检测大鼠肾脏标本丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)中p-P38 MAPK、p-JNK和p-ERK1/2的蛋白水平;并以real-time PCR法检测大鼠肾脏内TNF-α、TGF-β1及IL-6的mRNA 水平。结果: 百草枯中毒大鼠血清肌酐及尿素氮增高,牛磺酸干预后降低了中毒大鼠的肌酐及尿素氮水平,且大剂量牛磺酸组的肌酐及尿素氮水平更低。牛磺酸的干预不仅明显减轻了肾脏组织的氧化应激与炎症反应,同时也降低了百草枯中毒大鼠肾脏的MAPK活性。结论: 牛磺酸干预能减轻百草枯中毒大鼠的肾损伤,其作用机制可能与下调了肾脏MAPK活性、减轻了肾脏氧化应激及炎症反应有关。
牛磺酸; 百草枯; 肾脏; 氧化应激; 炎症因子
近年来,百草枯(paraquat,PQ)中毒因其极低的中毒浓度成为临床中常见农药中毒之一,因病程发展迅速,病情凶险,且一直没有找到特效解毒剂,所以在临床上病死率非常高[1]。百草枯除草效果好,不污染环境,因此在世界范围内广泛应用。百草枯因其性价比极高,在我国市场发展迅猛,我国作为农业大国,是目前全世界生产和使用百草枯最多的国家。百草枯中毒损伤的靶器宫包括肺脏、肾脏、肝脏等。其中,急性肾脏损伤可发生在百草枯中毒的早期,严重时可表现为急性肾功能衰竭,甚至死亡[2]。肾脏最重要的生理功能是排泄,正常情况下毒物及炎性物质可以从肾脏大量排出体外。然而百草枯中毒时,一旦损伤肾脏,会导致排泄毒物及炎性物质的能力减弱,引起百草枯及炎性物质在体内蓄积,而加重对肺脏及肝脏等器官的损伤[3]。因此,在百草枯中毒时,能否对肾脏的功能进行维护性治疗占有很重要的地位,肾脏功能的完整是保证其它脏器有效治疗的基础。
目前认为百草枯中毒与机体氧化应激反应有关[4]。近期有研究发现,百草枯中毒大鼠肾脏损伤与丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)中的c-Jun N末端激酶(c-Jun N-terminal kinase, JNK)、细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)及P38 MAPK有关[5]。本实验采用腹腔注射百草枯的方式建立百草枯中毒大鼠,同时给予抗氧化剂牛磺酸(taurine,Tau)干预,通过检测大鼠机体及肾脏的氧化应激水平,从核酸及蛋白水平检测MAPK及其下游炎症因子表达情况,来探讨牛磺酸减轻百草枯中毒大鼠肾脏损伤的机制。
材 料 和 方 法
1 试剂、仪器及动物
百草枯纯品和牛磺酸纯品(Sigma);丙二醛(malondialdehyde,MDA)及超氧化物歧化酶(superoxide dismutase,SOD)的比色法试剂盒购中国南京建成公司;白细胞介素6(interleukin-6,IL-6)及细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)的ELISA试剂盒购于Uscnlife;dihydroethidium (DHE)试剂盒购于Santa Cruz;抗磷酸化ERK1/2(p-ERK1/2)抗体、抗磷酸化JNK(p-JNK)抗体、抗磷酸化P38(p-P38)抗体及抗β-actin抗体均购于Santa Cruz; TRIzol试剂盒和定量反转录试剂盒均购于日本TaKaRa公司。荧光显微镜(BX41, Olympus)。清洁级Sprague-Dawley雄性大鼠,周龄6~8周,体重区间200~250 g,由中国医科大学附属盛京医院动物实验中心提供。大鼠适应性喂养1周,饲养的温度控制20~25 ℃,湿度控制40%~70%,昼夜节律控制12 h,自由进食水。该实验方案经过中国医科大学动物伦理委员会批准(伦理号为2015PS302K)。
2 实验方法
2.1 动物分组 选取48只雄性Sprague-Dawley大鼠按照随机分组原则分为阴性对照(negative control,Con)组、百草枯染毒组(PQ)、百草枯染毒+小剂量牛磺酸组(L-Tau组)及百草枯染毒+大剂量牛磺酸组(H-Tau组)。染毒组大鼠腹腔注射20 mg/kg百草枯溶液(配制浓度及方法为10 g/L溶于生理盐水);阴性对照组大鼠腹腔注射等量生理盐水;百草枯染毒+小剂量牛磺酸组大鼠腹腔注射20 mg/kg百草枯溶液,6 h后予小剂量牛磺酸(200 mg·kg-1·d-1)经灌胃针注入;百草枯染毒+大剂量牛磺酸组大鼠腹腔注射20 mg/kg百草枯溶液,6 h后予大剂量牛磺酸(400 mg·kg-1·d-1)灌胃。
2.2 血清中肌酐及尿素氮水平的测定 百草枯腹腔注射后72 h,大鼠禁食12 h后,麻醉大鼠,右心室取血,离心后置-80 ℃冰箱冻存。使用全自动生化学检测仪(HITACHI)检测大鼠肌酐及尿素氮水平。
2.3 血清中氧化应激及炎症因子水平的测定 将冻存血清置于室温中解冻,按试剂盒说明书步骤采用比色法检测血中MDA及SOD水平,采用ELISA法检测大鼠血标本中所含IL-6及ICAM-1的水平。
2.4 肾脏组织中活性氧簇水平的检测 通过肾脏冰冻切片的DHE荧光显像来评价肾脏组织ROS水平。百草枯腹腔注射后72 h,大鼠完全进入麻醉状态后,迅速开腹剥离并取出肾脏,经生理盐水充分洗净,置入液氮速冻完全后置于-80 ℃冰箱保存用以备检测。DHE荧光探针的操作方法参照我们之前文献中的描述[6],取一部分肾脏组织做冰冻切片,经PBS充分清洗后,将10 μmol/L的DHE荧光探针溶于PBS溶液中,之后将混匀的溶液加到之前所切的组织块上,将组织块完全覆盖住,再置于37 ℃避光孵育30 min;完成后以PBS反复冲洗切片组织3次已达到将DHE液完全洗净的程度,甘油封片后通过荧光显微镜成像对比不同组织所呈现荧光强度的差异,并留取图片。应用软件IPP 6.0检测各组图片荧光密度,荧光密度即可反映各组氧化应激水平,从而比较各组大鼠肾脏的氧化应激水平。
2.5 Western blot法检测肾脏MAPK蛋白的表达 肾脏组织匀浆,制成匀浆液,离心,测定蛋白浓度,每管50 μg蛋白分装。BCA 法进行蛋白定量后,加样品缓冲液煮沸5 min,各取20 μL加样;使用10% SDS-PAG在150 V、30 mA条件下电泳1.5 h; 50 V条件下转膜(PVDF膜)2 h;5%脱脂牛奶封闭,滴加 I 抗,4 ℃过夜; TBS冲洗5 min×3次,加入 II 抗(1∶500)室温下孵育2 h,用0.1% TBST冲洗15 min×3次,ECL显影扫描,条带灰度值以IPP 6.0测定。
2.6 Real-time PCR法检测肾脏组织IL-6、ICAM-1及TGF-β1 的mRNA水平 按TRIzol试剂盒说明书提取各组大鼠肾脏匀浆的总RNA。使用反转录试剂盒完成反转录反应,将RNA逆转录出cDNA,将合成好的cDNA置于-20 ℃冰箱保存备用。在PCR仪上进行变性、退火、扩增反应,PCR反应完毕后分析产物熔解曲线判断反应的特异性,以2-ΔΔCt法分析数据。IL-6的上游引物序列为5’-TCGAGCCCACCGGGAACGAA-3’,下游引物序列为5’-GCAACTGGACCGAAGGCGCT-3’;ICAM-1的上游引物序列为5’-CCTTCCTCACCGTGTACTGG-3’,下游引物序列为5’-AGCGTAGGGTAAGGTTCTTGC-3’;TGF-β1的上游引物序列为5’-TAATGGTGGACCGCAACAACG-3’,下游引物序列为5’-CTTGCTGTACTGTGTGTCCAG-3’;β-actin的上游引物序列为5’-GGAGATTACTGCCCTGGCTCCTA-3’,下游引物序列为5’-GACTCATCGTACTCCTGCTTGCTG-3’。
3 统计学处理
应用SPSS 16.0软件进行统计分析。采集到的计量数据以均数±标准差(mean±SD)表示。各组间数据比较采用单因素方差分析并用Tukey法进行两两比较。以P<0.05为差异有统计学意义。
结 果
1 各组大鼠血清肌酐及尿素氮水平
百草枯染毒组血清肌酐及尿素氮水平较对照组明显增高(P<0.05);小剂量牛磺酸及大剂量牛磺酸干预均使染毒大鼠血清肌酐和尿素氮水平降低,相对来说大剂量牛磺酸干预组血清肌酐和尿素氮水平的降低程度更为显著(P<0.05),见图1。

Figure 1.The changes of serum creatinine and urea nitrogen levels in the rats with different treatments. Mean±SD.n=12.#P<0.05vsCon group;*P<0.05vsPQ group;△P<0.05vsL-Tau group.
图1 大鼠肌酐及尿素氮水平的比较
2 血清中MDA、SOD、IL-6及ICAM-1水平的变化
与阴性对照组相比较,百草枯染毒组的SD大鼠血标本中MDA水平明显增高,牛磺酸干预使其降低(P<0.05)。相反,百草枯染毒组大鼠血标本中SOD水平较正常组降低,大剂量牛磺酸干预使其增高(P<0.05),但小剂量牛磺酸不影响SOD水平。我们进一步计算MDA/SOD值,发现百草枯中染毒组大鼠的MDA/SOD值明显增高(P<0.05),大剂量及小剂量牛磺酸干预后均使MDA/SOD降低,且大剂量组降低得更显著(P<0.05)。血清中IL-6及ICAM-1水平均较百草枯染毒组增高,牛磺酸干预使IL-6及ICAM-1降低,且大剂量的牛磺酸使其降低得更显著(P<0.05),见图2。

Figure 2.The levels of oxidative stress and inflammatory factors in the serum of the rats. Mean±SD.n=12.#P<0.05vsCon group;*P<0.05vsPQ group;△P<0.05vsL-Tau group.
图2 大鼠血清中氧化应激及炎症因子水平的比较
3 肾脏组织中的ROS含量
百草枯染毒使大鼠的肾脏ROS含量明显增高,牛磺酸使组织中ROS降低,且大剂量牛磺酸作用更显著(P<0.05),见图3。

Figure 3.ROS content in the kidney of the rats (×40). Mean±SD.n=12.#P<0.05vsCon group;*P<0.05vsPQ group;△P<0.05vsL-Tau group.
图3 大鼠肾脏ROS水平的比较
4 肾脏组织中MAPK蛋白表达的变化
百草枯染毒使大鼠肾脏中p-ERK1/2、p-JNK及p-P38蛋白水平明显增高,牛磺酸干预后使其蛋白水平降低。相比小剂量牛磺酸,大剂量牛磺酸干预后p-ERK1/2与p-JNK的蛋白水平下降更明显(P<0.05),但p-P38并无显著差异,见图4。
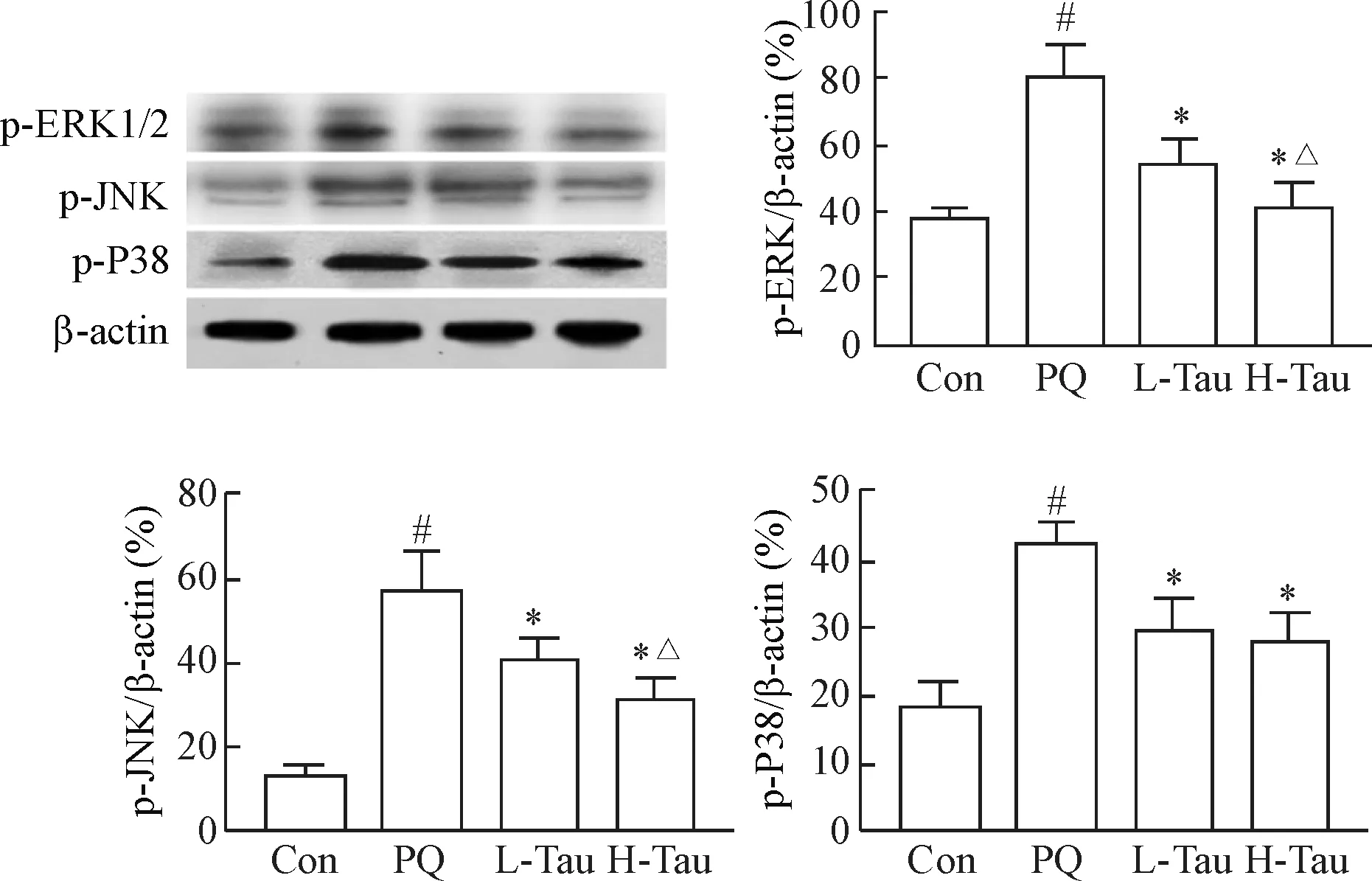
Figure 4.The changes of the MAPK protein content in the renal tissues of the rats with different treatments. Mean±SD.n=12.#P<0.05vsCon group;*P<0.05vsPQ group;△P<0.05vsL-Tau group.
图4 大鼠肾脏MAPK蛋白含量的比较
5 肾脏组织中IL-6、ICAM-1及TGF-β1的mRNA水平
百草枯中毒后,肾脏组织中IL-6、ICAM-1及TGF-β1的mRNA水平较正常时增高,牛磺酸干预后使mRNA的增高程度减弱(P<0.05),且大剂量牛磺酸作用更为明显(P<0.05),见图5。
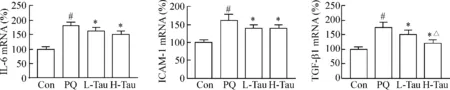
Figure 5.The mRNA levels of inflammatory cytokines in the rat kidneys. Mean±SD.n=12.#P<0.05vsCon group;*P<0.05vsPQ group;△P<0.05vsL-Tau group.
图5 大鼠肾脏炎症因子mRNA水平的变化
讨 论
在之前的实验中,我们曾给予大鼠一次性腹腔注射不同剂量的百草枯,分别为每公斤体重10 mg、20 mg、30 mg、40 mg及50 mg百草枯,结果发现每公斤体重20 mg的百草枯剂量死亡率极低,同时可以获得得满意的中毒率[7]。因此,在本实验中,我们用该剂量来构建百草枯中毒大鼠模型。我们发现牛磺酸的干预降低了百草枯中毒大鼠的肌酐,同时也抑制了中毒大鼠的JNK活化、减轻了氧化应激及炎症反应,而且在一定浓度范围内,牛磺酸的这种保护作用与其剂量成正比。
本研究发现,百草枯中毒大鼠肾脏功能受损,肌酐清除率下降,同时肾脏组织内的ROS水平升高,PCR发现IL-6及ICAM-1的mRNA水平也有所增高。ROS是线粒体在氧化还原过程中产生的具有强氧化活性的物质,是反映体内氧化应激水平的直接指标之一[8]。IL-6及TNF-α作为细胞因子,受体广泛分布于大部分细胞,在炎症反应中介导了非常重要的通路[9]。我们发现,牛磺酸的干预减轻了百草枯中毒大鼠的肾损伤,且大剂量牛磺酸效果更明显。同时牛磺酸的干预减弱了百草枯中毒大鼠肾脏ROS水平,IL-6和TNF-α的mRNA水平,本研究中牛磺酸也减轻了机体血清中的氧化应激及炎症反应。抗氧化剂牛磺酸减弱了氧化应激,同时减轻了炎症反应,说明氧化应激启动了百草枯所致的肾损伤。MAPK信号转导通路在炎症性疾病的发生和发展中具有重要调控作用,能被多种炎性刺激所激活,参与介导细胞应激反应、免疫反应和细胞生长、发育、分裂、死亡以及细胞间的功能同步等多种过程;ERK1/2可以被生长因子、细胞因子等所激活,参与细胞增殖、分化与凋亡等,有研究报道抑制ERK活性则可以抑制凋亡;而作为MAPK家族的最主要成员,JNK的作用也不容忽视,它可将细胞外刺激介导为细胞内的多种反应。激活JNK通路的主要配体是细胞因子,在某些应激刺激之下也可激活,从而起到促进或抑制细胞黏附,调节着效应细胞的增殖、分化以及凋亡进程。在未受应激刺激或细胞因子激活的细胞中,JNK主要存在于胞质内,少量存在于细胞核内。在相应的细胞因子激活或者应激反应刺激后, JNK大量活化并转运入细胞核内,与特定基因结合从而引起效应基因的表达变化[10]。本研究中大鼠百草枯中毒模型的肾脏组织内JNK尤其是磷酸化亚型的活性增加,这与陈达等[5]的研究一致。除此之外,本研究中我们还发现牛磺酸能降低百草枯中毒大鼠肾脏的JNK与ERK活性,同时减轻其机体及肾脏的氧化应激及炎症反应,且大剂量牛磺酸的作用更强。而p-P38在牛磺酸干预下有所下降,但大剂量牛磺酸并未取得类似于JNK的抑制作用,说明牛磺酸的主要作用位点可能不在于此。由此我们推断,牛磺酸能保护百草枯中毒大鼠的肾功能,主要与抑制JNK和ERK激活、下调氧化应激及炎症反应有关。而且在本实验所应用的剂量范围内,牛磺酸对百草枯中毒大鼠急性肾损伤的拮抗作用随剂量的增加而得到强化。
目前普遍认为百草枯中毒与机体氧化应激反应有关。百草枯所致的脏器损伤程度取决于氧自由基、还原物质及脏器氧含量三者之间的互相作用[11]。因此,积极探寻百草枯中毒的发病机制及抗氧化治疗药物已成为目前国际研究的热点。目前维生素C及N-乙酰半胱氨酸(N-acetylcysteine,NAC)等抗氧化剂已应用于临床。研究显示,NAC可以通过抑制MDA水平增高及GSH降低,影响肺泡上皮细胞诱导型一氧化氮合酶表达水平和NO合成,从而减轻肺组织细胞凋亡及DNA损伤[12-14]。维生素C可降低经PQ处理的小鼠胚胎干细胞的总ROS水平[15]。但NAC及维生素C对百草枯肾损伤的保护作用尚不明确。而牛磺酸广泛分布于动物组织和器官内,因此来源充足,价格便宜,如能证实此药有改善百草枯中毒肾损伤的作用,在一定程度上阻止百草枯中毒的发病和进展,将会带来巨大的经济效益。牛磺酸不仅可以通过清除氧自由基而达到抗脂质过氧化的作用,还可以通过多通路的作用从而抑制细胞凋亡并抑制细胞钙超载,并可稳定线粒体内部结构和功能从而使氧化还原反应得以正常进行[16]。目前已有研究发现牛磺酸能减轻百草枯中毒大鼠的肺损伤[17-18]。 Nagata等[19]的研究发现牛磺酸能改善百草枯中毒大鼠的肾功能,但是其机制尚未明确。牛磺酸是否能减轻肾脏的氧化应激及炎症反应尚未见相关报道。通过本研究,我们发现牛磺酸可以减轻氧化应激及炎症反应,可能与抑制JNK及ERK1/2的激活有关。
百草枯中毒的治疗目前尚无特效解毒剂,其主要治疗手段包括防止百草枯继续吸收、促进百草枯通过自体代谢或血液净化排出、激素、抗氧化药物综合治疗及支持对症等。研究不同的抗氧化剂,寻求多靶点、多层次的干预治疗,将为百草枯的药物治疗提供一定的理论依据。
[1] 杜 斌, 陈俊良, 唐筛娣, 等. 亚甲蓝对百草枯中毒大鼠胸腺T淋巴细胞亚群与氧化应激的影响[J]. 中国病理生理杂志, 2016, 32(7):1307-1311.
[2] Safaei Asl A, Dadashzadeh P. Acute kidney injury in patients with paraquat intoxication; a case report and review of the literature[J]. J Renal Inj Prev, 2016, 5(4):203-206.
[3] 王方莉, 吴晓飞, 郭 晋. 百草枯中毒患者血浆百草枯浓度与肾功能损害的相关性[J]. 蚌埠医学院学报, 2016, 41(4):455-457.
[4] Ortiz MS, Forti KM, Martinez EBS, et al. Effects of antioxidantN-acetylcysteine against paraquat- induced oxidative stress in vital tissues of mice[J]. Int J Sci Basic Appl Res , 2016, 26(1):26-46.
[5] 陈 达, 张洪颖, 贾 浩, 等. 乌司他丁保护百草枯中毒大鼠肺免受损伤的作用[J]. 中国病理生理杂志, 2015, 31(1):166-171.
[6] Na W, Shen H, Liu H, et al. Acute blood glucose fluctuation enhances rat aorta endothelial cell apoptosis, oxidative stress and pro-inflammatory cytokine expressioninvivo[J]. Cardiovasc Diabetol, 2016, 15(1):109.
[7] Liu ZN, Zhao M, Zheng Q, et al. Inhibitory effects of rosiglitazone on paraquat- induced acute lung injury in rats[J]. Acta Pharmacol Sin, 2013, 34(10):1317-1324.
[8] 戴 利, 庞庆丰, 张 鹏,等. 亚甲蓝对百草枯中毒大鼠急性肝损伤的保护作用及机制[J]. 徐州医学院学报, 2015,35(3):146-151.
[9] Sharma S, Gupta S, Khajuria V, et al. Analogues of boswellic acids as inhibitors of pro-inflammatory cytokines TNF-α and IL-6[J]. Bioorg Med Chem Lett, 2016,26(2):695-698.
[10]Choi WS, Kim HW, Xia Z. JNK inhibition of VMAT2 contributes to rotenone-induced oxidative stress and dopamine neuron death[J]. Toxicology, 2015, 328:75-81.
[11]Toygar M, Aydin I, Agilli M, et al. The relation between oxidative stress, inflammation, and neopterin in the paraquat-induced lung toxicity[J]. Hum Exp Toxicol, 2015, 34(2):198-204.
[12]Yeh ST, Guo HR, Su YS, et al. Protective effects ofN-acetylcysteine treatment post acute paraquat intoxication in rats and in human lung epithelial cells[J]. Toxicology, 2006, 223(3):181-190.
[13]Cappelletti G, Maggioni MG, Maci R. Apoptosis in human lung epithelial cells: triggering by paraquat and mo-dulation by antioxidants[J]. Cell Biol Int, 1998, 22(9-10):671-678.
[14]Mitsopoulos P, Suntres ZE. Protective effects of liposomalN-acetylcysteine against paraquat-induced cytotoxicity and gene expression[J]. J Toxicol, 2011, 2011:1687-8191.
[15]Perla V, Perrin NA, Greenlee AR. Paraquat toxicity in a mouse embryonic stem cell model[J]. ToxicolInVitro, 2008, 22(2):515-524.
[16]Na W, Yan L, Bing H, et al. Taurine prevents free fatty acid-induced hepatic insulin resistance in association with inhibiting JNK1 activation and improving insulin signalinginvivo[J]. Diabetes Res Clin Practice, 2010, 90(3):288-296.
[17]Venkatesan N, Chandrakasan G. Ameliorative effect of taurine and niacin on paraquat-induced early lung injury in rats[J]. J Clin Biochem Nutri, 1993, 15(2):127-134.
[18]Gordon RE, Heller RF, Heller RF. Taurine protection of lungs in hamster models of oxidant injury: a morphologic time study of paraquat and bleomycin treatment[J]. Adv Exp Med Biol, 1992, 315:319-328.
[19]Nagata T, Masaoka T, Akahori F. Protective effect of taurine against acute araquat intoxication in rats[J]. J Toxicol Sci, 1991, 16(1):11-27.
(责任编辑: 卢 萍, 罗 森)
Effect of taurine on kidney injury induced by paraquat poisoning in rats
SHEN Hai-tao1, WU Na2, WANG Yu1, CHEN Zhi-guang1, LIU Zhen-ning1, ZHAO Min1
(1DepartmentofEmergency,2DepartmentofEndocrinology,ShengjingHospital,ChinaMedicalUniversity,Shenyang110004,China.E-mail:zhaom@sj-hospital.org)
AIM: To study the effects of taurine at different doses on renal oxidative stress and inflammation induced by paraquat in rats. METHODS: Male SD rats (n=48) were randomly divided into 4 groups: negative control group, paraquat group, paraquat + low-dose taurine group, and paraquat + high-dose taurine group. The serum levels of creatinine and urea nitrogen were detected by a biochemical analyzer. The levels of malondialdehyde (MDA) and superoxide dismutase (SOD) were measured by colorimetry. The plasma concentrations of IL-6 and intercellular adhesion molecule (ICAM)-1 were detected by ELISA. Renal reactive oxygen species (ROS) was checked by fluorescence probe dihydroethidium (DHE). The protein levels of renal p-P38 MAPK, p-ERK1/2 and p-JNK were determined by Western blot. The mRNA expression of TNF-α, IL-6 and TGF-β1 was detected by real-time PCR. RESULTS: Serum creatinine and urea nitrogen increased after paraquat poisoning, and decreased after feeding with taurine in poisoned rats, with better result in high-dose taurine group. Taurine reduced the oxidative stress and inflammation in the renal tissue, and also reduced the protein levels of p-JNK, p-ERK1/2 and p-P38 in the kidney of paraquat-poisoned rats. CONCLUSION: Taurine attenuates renal injury induced by paraquat poisoning in rats. The mechanism may be related to reducing renal MAPK activity, oxidative stress and inflammatory response.
Taurine; Paraquat; Kidney; Oxidative stress; Inflammatory factors
1000- 4718(2017)07- 1295- 06
2016- 10- 28
2017- 02- 10
国家自然科学基金面上项目(No. 81671898);辽宁省教育厅项目(No. LK201603; No. LK201633)
R595.4; R363.1+3
A
10.3969/j.issn.1000- 4718.2017.07.023
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 18940251619; E-mail: zhaom@sj-hospital.org
