XCT-790对沉默DKK1、Sost腺病毒载体转染MG63细胞中OPG、CTGF、FGF2、TNFα的影响研究
2017-08-07李钊政万雷乔荣勤彭鹏豪肖本浩刘少津
李钊政 万雷 乔荣勤 彭鹏豪 肖本浩 刘少津
1. 广州中医药大学,广东 广州 510405 2. 广州中医药大学附属骨伤科医院骨科,广东 广州 510240
骨质疏松症是困扰老年人身体健康的一大疾病,亦是世界性前沿研究难题。Wnt信号通路是与骨代谢相关的一个重要胞内信号传导通路,DKK1和Sost是Wnt信号通路的负调控因子,在骨形成过程中起重要作用,被视为骨相关疾病如骨质疏松、骨修复的治疗靶点[1]。近年来,有研究表明雌激素受体相关受体α(estrogen receptor-related receptor alpha,ERRα)与骨代谢的调节密切相关[2]。Auld 等[3]发现,ERRα通过抑制Wnt信号靶基因表达来调控成骨细胞分化,当成骨细胞中ERRα基因沉默后,可促进Wnt通路转导。而XCT-790是ERRα的特异性抑制剂[4],可以显著降低成骨细胞的增殖能力和矿化能力[5]。本实验采用沉默DKK1、Sost腺病毒载体转染MG63细胞,并用ERRα抑制剂(XCT-790)干预转染的MG63细胞,应用Western blot检测MG63细胞中骨保护素(osteoprotegerin,OPG)、结缔组织生长因子(connective tissue growth factor,CTGF)、成纤维生长因子2(fibroblast growth factor 2,FGF2)、肿瘤坏死因子α(tumor necrosis factor α,TNFα)蛋白的表达量,现报道如下。
1 材料与方法
1.1 主要试剂和仪器
人成骨肉瘤细胞(MG63) 由中国科学院上海细胞所细胞库提供,DMEM培养基、胎牛血清、Pen/Strep和Opti-MEM培养基均购自美国Gibco公司;ERRα抑制剂(XCT-790)购自于Sigma公司;逆转录试剂盒、Lipofectamine 2000,TRIzol Reagent、Taq DNA聚合酶、荧光定量PCR试剂盒均购自美国Invitrogen 公司;质粒提取试剂盒、胶回收/纯化试剂盒购自北京天根生物有限公司;DH5α感受态细胞购自北京鼎国生物有限公司;BJ5183感受态细胞购自上海杰美基因公司;T4DNA连接酶、KpnⅠ、XhoⅠ、PmeⅠ、PacⅠ限制性内切酶购自美国NEB公司;抗Wnt信号通路抑制因子DKK1抗体购自美国CST公司;抗骨硬化蛋白(Sost) 抗体购自美国Abcam公司;抗结缔组织生长因子(CTGF)抗体、抗碱性成纤维细胞生长因子(FGF2)抗体购自美国Santa公司;抗人成骨细胞内骨保护素(OPG)抗体、抗肿瘤坏死因子α(TNFα)抗体购自美国abcam公司;蛋白Marker购自美国Fermentasa 公司;蛋白酶抑制剂/磷酸化抑制剂、ECL发光液购自德国Merck公司;RIPA 细胞裂解液、Triton 100、EGTA、MTT 购自美国Sigma 公司;Calcium OtangeTM Indicators 购自美国Molcular Probes公司。细胞培养箱(DHP-9052,中国上海一恒)、超净工作台(SWCJ-1FD,中国江苏苏净)、高速低温离心机(H1650-W/H1650W,中国湘仪)、普通PCR仪(TC-S,中国博日)、荧光定量PCR仪(ABI7500,美国Thermo)、倒置荧光显微镜(IX73,美国OLYMPUS)。电泳仪(Mini-PROTEAN Tetra,美国Bio-Rad)、蛋白转印仪(Mini Trans-Blot,美国Bio-Rad)、凝胶成像系统(ChemiDoc MP,美国Bio-Rad),微量核酸定量仪(Nanodrop-2000,美国Thermo)。
1.2 方法
1.2.1MG63细胞培养:收集对数期MG63细胞,制成细胞悬液,调整细胞浓度为1×105cells/mL。6孔板中每孔加入2 mL细胞悬液,置于37 ℃,5% CO2及饱和湿度条件下培养。培养24 h后,用沉默重组腺病毒颗粒转染MG63细胞(MOI=50)。
1.2.2目的基因沉默重组腺病毒载体的构建[6]:在NCBI数据库查询参考核苷酸序列DKK1(801bp)、Sost(642bp),采用Primer 5.0设计PCR引物,设计出特异性针对DKK1、Sost 的序列和无关对照序列(Scr),并在两端分别加入AgeⅠ、EcoRⅠ酶切位点。将连接产物转化到感受态的DH5α细胞,用质粒小提试剂盒提取转化到DH5α细胞重组质粒,对提取的重组质粒进行测序鉴定,提取测序正确的腺病毒,经培养提取无内毒素质粒,再经过筛选及病毒包装,成功构建沉默DKK1、Sost腺病毒载体。
1.2.3XCT-790处理沉默DKK1、Sost腺病毒载体转染的MG63细胞:100 μM XCT-790溶于838 μL DMSO中配制成储存液。临用时,以XCT-790储存液:含10%FBS DMEM高糖培养基=1∶1 000的比例稀释XCT-790,即配制成含100 μM XCT-790的DMEM高糖培养基(DMSO终浓度为0.1%),分别处理空载腺病毒组和DKK1、Sost沉默腺病毒载体转染组,培养24 h。
1.2.4细胞总蛋白的提取及浓度测定:消化收集细胞,1000 rpm离心5 min,尽可能弃尽上清。预冷PBS洗涤细胞沉淀两次,向细胞沉淀中加入20 μL RIPA(含有0.2 μL PMSF)裂解液,置于冰上裂解细胞30 min,期间用枪头吹打使细胞充分裂解。在4 ℃,12 000 rpm离心30 min,小心转移上清到新的预冷的EP管中,-20 ℃保存备用。900 μL Bradford加入1 μL待测蛋白和99 μL 0.9%生理盐水,混匀后在595 nm处检测吸光度,根据标准品做出的标准曲线上计算出各样本蛋白浓度。
1.2.5OPG、CTGF、FGF2、TNFα蛋白的检测:MG63细胞转染重组腺病毒48 h后,分为空白对照组、沉默DKK1组、沉默Sost组、沉默DKK1、Sost组、XCT-790处理空载腺病毒组、XCT-790处理沉默DKK1组、XCT-790处理沉默Sost组、XCT-790处理沉默DKK1、Sost组8组,弃旧培养基,消化收集细胞,提取细胞总蛋白,并测定蛋白浓度,上样、电泳、转膜、免疫反应,化学发光显色后进行图像分析。
1.3 统计学处理

2 结果
2.1 各组的MG63细胞中(OPG、CTGF、FGF2、TNFα)蛋白灰度分析(图1)
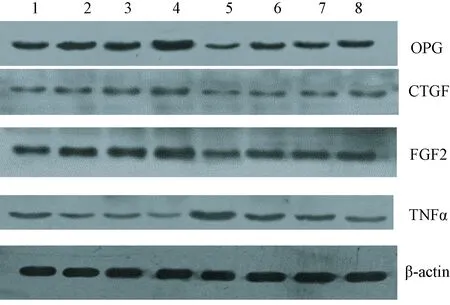
图1 各组MG63细胞中(OPG、CTGF、FGF2、TNFα)灰度分析情况(凝胶电泳法)Fig.1 Analysis of gray area of OPG, CTGF, FGF2, and TNFα in each MG63 cell group (The gel electrophoresis)注:1:空白对照组,2:沉默DKK1组,3:沉默Sost组,4:沉默(DKK1+Sost)组,5:XCT-790处理空载腺病毒组,6:XCT-790处理沉默DKK1组,7:XCT-790处理沉默Sost组,8:XCT-790处理沉默(DKK1+Sost)组。
2.2 各组MG63细胞中(OPG、CTGF、FGF2、TNFα)蛋白表达情况(表1)
表1 各组MG63细胞中(OPG、CTGF、FGF2、TNFα)蛋白表达情况Table 1 Expression of OPG, CTGF, FGF2, TNFα in each MG63 cell group
注:与空白对照组比较,*P<0.05;与沉默DKK1组比较,#P<0.05;与沉默Sost组比较,△P<0.05;与沉默(DKK1+Sost)组比较,▲P<0.05。
图1、表1结果显示:(1)与空白对照组对比,沉默DKK1、Sost、DKK1+Sost可以提高OPG、CTGF、FGF2表达量(P<0.05),降低TNFα表达量,组间比较差异有统计学意义(P<0.05);XCT-790干预MG63细胞可降低OPG、CTGF、FGF2表达量(P<0.05),增加TNFα表达量,组间比较差异有统计学意义(P<0.05)。(2)与沉默DKK1、Sost、DKK1+Sost组相比较,XCT-790处理沉默DKK1、Sost、DKK1+Sost组可降低因沉默DKK1、Sost、DKK1+Sost而增加的OPG、CTGF、FGF2表达量,增加因沉默DKK1、Sost、DKK1+Sost而降低的TNFα表达量,组间比较差异均有统计学意义(P<0.05)。
3 讨论
近年来,国内外不少研究表明Wnt/β-catenin信号通路在骨代谢过程中具有重要意义,是研究骨质疏松症治疗的新热点。其组成主要包括细胞外因子(Wnt)、跨膜受体(frizzled)、胞质蛋白(β-catenin)及核内转录因子等一系列蛋白。Wnt信号刺激成骨细胞增殖,促进骨髓间充质干细胞向成骨细胞分化,促进转录因子Osterix1(Osx1)向成骨细胞表达[7]。DKK1和Sost蛋白为Wnt信号通路的细胞外拮抗剂,与骨形成的调控密切相关。DKK1直接与低密度脂蛋白受体相关蛋白(low density lipoprotein re-ceptor related protein,LRP)受体结合,或者与其跨膜受体Kremen(Kremen-1、Kremen-2) 结合后再与LRP5/6结合形成三聚体,诱导快速的细胞内吞,减少细胞膜上的LRP5/6,由此阻断了Wnt信号向胞内的传递,使骨形成减少[8]。Sost 能竞争性结合Wnt信号通路中的共受体LRP5来抑制该信号通路,从而引起骨形成障碍[9]。雌激素受体相关受体α(ERRα)是最早发现的一种孤儿核受体,是核受体超家族中的一员。有研究表明,ERRα表达于成骨细胞分化的所有阶段,用反义寡核苷酸阻断ERRα降低了大鼠RC细胞增殖期的细胞数目,之后又抑制了骨结节形成[10]。然而,Delhon 等[11]发现,ERRα敲除小鼠股骨松质骨骨体积和密度增加,体外培养成骨细胞和骨髓间充质干细胞沉默ERRα后发现细胞增殖与骨向分化能力增强。OPG属分泌型糖蛋白,是一种可溶性肿瘤坏死因子受体,在体内以单体和同源二聚体两种形式存在。其主要功能是抑制破骨细胞的分化,抑制成熟破骨细胞的骨吸收活性并诱导其凋亡。在体外,1~40 ng/mL(ED50=4~6 ng)的OPG可抑制破骨细胞生成,在超过11 d的细胞培养时间中,有效作用时间范围是第5~11 d[12]。CTGF是一种新发现可刺激成纤维细胞增殖和胶原沉积生长因子,亦是高度保守CCN(CTGF、Cef10/cyr61和Nov缩写)多肽家族中成员。有研究表明,CTGF可抑制成骨细胞核因子Kappa B配体受体(RANKL)的表达,提示CTGF可通过抑制成骨细胞RANKL的表达,可能具有间接抑制成熟破骨细胞活化的作用[13]。FGF2是膜内成骨和软骨化成骨的主要调节因子,在成骨细胞中,FGF2激活多种信号通路包括胞外信号调节激酶(ERK)途径和蛋白激酶C(PKC)途径,进而影响成骨细胞的转录,被认为是成骨样细胞的靶基因[14]。TNFα是17kDa的细胞因子,可由破骨细胞样细胞及成骨细胞合成,是十分重要的破骨细胞激活因子,亦是一种强有力的骨吸收诱导剂,可使破骨细胞活性增强。有报道表明,基质内所含的破骨和成骨类细胞以及髓腔间充质类细胞均可以通过自分泌或者旁分泌方式获得细胞因子,并参与机体骨代谢调节[15-16]。由此可知,OPG、CTGF、FGF2、TNFα蛋白的表达量与成骨细胞的增殖分化关系密切。
本实验研究中采用沉默DKK1、Sost腺病毒载体转染MG63细胞,并使用XCT-790干预,进一步研究不同组别MG63细胞中OPG、CTGF、FGF2、TNFα蛋白在不同干预情况下的表达量。实验结果表明,沉默DKK1、Sost、DKK1+Sost可以提高在MG63细胞中OPG、CTGF、FGF2蛋白的表达量,降低TNFα蛋白的表达量,尤以DKK1、Sost二者同时沉默时影响最大,其作用机制可能是DKK1、Sost沉默后,Wnt信号通路被激活,刺激成骨细胞MG63增殖活化,促进成骨细胞形成,引起OPG、CTGF、FGF2、TNFα蛋白的变化。而使用XCT-790干预后, XCT-790可通过抑制ERRα的表达和竞争Wnt信号通路的靶基因,从而降低Wnt信号通路的活性,影响成骨细胞MG63的形成和增殖,引起OPG、CTGF、FGF2、TNFα蛋白的变化,这与杨冰等[5]的研究结果一致。 本实验结果支持ERRα促进成骨细胞分化与增殖,其抑制剂XCT-790能降低成骨细胞活性的假说。而ERRα与Wnt信号通路之间是竞争拮抗关系,抑或是协同关系,本实验结果证实二者有协同作用。Delhon 等[11]认为ERRα抑制成骨细胞分化与增殖,杨冰等[5]研究表明ERRα促进成骨细胞分化与增殖,ERRα在成骨细胞中的研究结果不一致的原因可能有3个方面:①动物成骨细胞与人成骨细胞非同一种属,故而实验结果存在分歧,本实验为人成骨细胞实验;②ERRα抑制剂XCT-790干预的时间不一致;③实验条件和环境等方面不一致。
此外,本实验中XCT-790是通过影响Wnt/β-catenin信号通路还是独立发挥作用,ERRα与Wnt/β-catenin信号通路之间的具体联系如何,仍需要进一步的研究和探讨。
