Notch1对肺纤维化小鼠肠黏膜屏障的影响及作用机制研究
2017-08-07刘学军杜毓锋郝小燕郭娜娜林白阳
郭 慧,刘学军,杜毓锋,郝小燕,张 帆,郭娜娜,林白阳
Notch1对肺纤维化小鼠肠黏膜屏障的影响及作用机制研究
郭 慧,刘学军,杜毓锋,郝小燕,张 帆,郭娜娜,林白阳
目的 探讨Notch1在肺纤维化肠黏膜屏障中的影响及其作用机制。方法 将24只健康雄性C57BL/6小鼠随机分为正常对照组(N组)、肺纤维化模型组(I组)、肺纤维化+Notch1抑制组(I+D组)。I组、I+D组气管内注入博来霉素造模,I+D组在造模后1周开始腹腔注射Notch1抑制剂DAPT。在造模后28 d全部处死小鼠,取小鼠血液、肺脏、回肠末端10 cm。血液离心后的血清用于ELISA测量丙二醛(MDA)、总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-PX)的含量。右肺、5 cm回肠石蜡包埋后采用HE、Masson染色,并测量肠黏膜、肠绒毛以及肠隐窝的高度。PCR测量左肺、5 cm回肠末端的Notch1mRNA含量。结果 小鼠肺部HE染色、Masson染色、Ashcroft评分提示I组存在明显的纤维化改变,与N组、I+D组比较差异有统计学意义(P<0.05)。I组小鼠肠黏膜厚度、绒毛高度、血清中T-SOD、GSH-PX含量明显低于N组、I+D组,肠道Chiu’s分级、血清MDA的含量明显高于N组、I+D组,差异有统计学意义(P<0.05)。表明IPF小鼠肠黏膜上皮细胞完整性被破坏、黏膜损伤。小鼠肠隐窝深度的测量结果提示I组肠隐窝细胞增生明显高于N组、I+D组,差异有统计学意义(P<0.05)。I组肺组织、肠道组织中Notch1 mRNA的表达高于N组、I+D组,差异有统计学意义(P<0.05)。结论 Notch1表达增高促进了肺纤维化的发生,小鼠肺纤维化体内存在肠黏膜的损伤、坏死脱落,Notch1同时可以通过肠上皮隐窝增生介导肠上皮损伤后修复。
肺纤维化;肠黏膜屏障;Notch1;丙二醛;总超氧化物歧化酶;谷胱甘肽过氧化物酶
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种慢性、进行性和致死性恶性间质性肺疾病[1]。一旦确诊,平均生存期3年~5年,且病死率逐年上升,目前病因尚未完全阐明。IPF典型的临床症状是逐渐加重的呼吸困难、低氧血症,而肠黏膜对缺氧十分敏感。Notch1在肺、肠的发育中呈动态表达,并在调控其细胞的分化、增殖、凋亡中起关键作用[2-3]。
1 材料与方法
1.1 实验动物以及分组 24只雄性C57BL/6小鼠,SPF级,体重20 g~25 g。将小鼠按照随机数字表获得的编号按大小分为3组,每组8只。
1.2 要试剂及仪器 博来霉素(15 mg,日本株式会社);DAPT(美国selleckchem公司);Masson染色试剂盒(北京索莱宝);丙二醛(MDA)、总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-PX)试剂盒(南京建成);引物合成(上海生工);反转录试剂盒(TAKARA,大连宝生物);扩增试剂盒(Vazyme,诺唯赞)。实验中所用的Scanscope数字病理扫描系统、基因扩增仪、荧光定量PCR仪由山西医科大学科研中心提供。
1.3 方法
1.3.1 造模及取材 I组及I+D组按5 mg/kg气管内注入博来霉素。造模1周后,每天将DAPT腹腔注入I+D组,共7 d。造模后28 d后,所有小鼠均处死取材。心脏取血,收集入紫管。离心后,将血清标记,储存于-80 ℃冰箱。取小鼠左肺、右肺、回盲部上端10 cm肠道组织。左肺、5 cm回肠标记后储存于-80 ℃冰箱,右肺、5 cm回肠于10%甲醛液中固定,石蜡包埋。
1.3.2 HE、Masson染色 肺脏、肠道的石蜡组织包埋后切片,按标准步骤进行HE染色。Masson染色测定肺部纤维化的程度,按其说明书进行操作。
1.3.3 病理性分析 肺纤维化程度采用Ashcroft评分,共8级。肠黏膜损伤以Chiu’s分级为评分标准,共6级。请两名病理学工作人员盲评,以评分的均数作为最后得分。
1.3.4 小肠黏膜形态学指标 采用Scanscope数字病理扫描系统测定回肠黏膜、绒毛以及隐窝高度,每个标本测定5个完整黏膜、绒毛以及隐窝高度,取其平均值。
1.3.5 血清MDA、T-SOD、GSH-PX测定 MDA是膜脂过氧化最重要的产物之一,肠黏膜细胞受损、坏死后,可释放入血,是反映肠黏膜上皮细胞完整性和损伤程度的可靠的生化指标[4-5]。T-SOD、GSH-PX是体内清除氧自由基的重要酶,其减少可间接反映肠黏膜的损伤。
1.3.6 PCR测定血清、肺组织、肠道组织Notch1的表达量 采用酚氯仿的方法提取RNA,利用反转录试剂盒在基因扩增仪生成c-DNA,利用扩增试剂盒在荧光定量PCR仪进行扩增,得到CT值,利用2-ΔΔCT计算Notch1在各组间的相对表达量。
2 结 果
2.1 小鼠的一般情况 N组造模后一般情况好,与造模前比较差异无统计学意义。造模后I组小鼠毛发灰暗,食欲下降,活动少,呼吸浅快,偶可闻及喘息。I+D组情况较I组稍好。
2.2 肺组织HE染色、Masson染色,肠道HE染色 N组肺泡结构基本完整,肺泡壁未增厚。I组大量肺泡结构破坏,部分肺泡塌陷融合,肺泡间隔增厚,出现大量宽带状及片状胶原纤维,呈弥漫纤维化改变。I+D组改变较I组轻。提示I组、I+D造模成功,DAPT抑制Notch1减轻肺纤维化。详见图 1、图2。
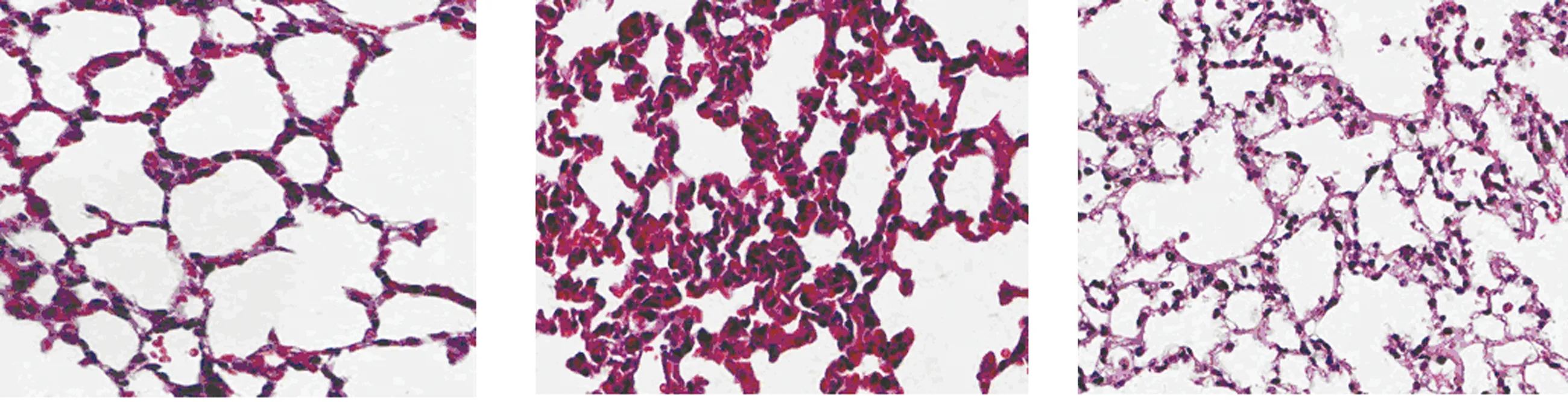
N组 I组 I+D组
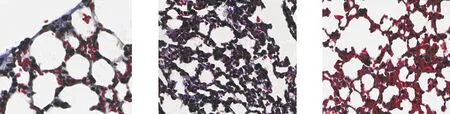
N组 I组 I+D组
N组肠黏膜连续、完好,I组大量肠绒毛及固有膜脱落,同时存在隐窝增生,I+D组改变较I组轻。提示IPF小鼠存在肠黏膜损伤,且损伤后通过隐窝增生以替代坏死的肠绒毛。详见图3。

N组 I组 I+D组
2.3 肺部、肠道的病理学分析 I组肺纤维化ashcroft评分为(6.88±0.24)分,提示存在明显的肺纤维化,伴有肺组织结构的破坏,存在纤维条带或纤维小结的形成。I组肠黏膜损伤Chiu’s分级为(3.88±0.19)分,提示大片肠黏膜上皮抬高,绒毛向两侧倒伏,部分绒毛顶端脱落。I组ashcroft评分、Chiu’s分级较N组、I+D组高,差异有统计学意义。详见表1。
表1 各组ashcroft评分、Chiu’s分级比较(±s) 分
2.4 小肠黏膜形态学指标 I组肠黏膜厚度较N组明显降低,较I+D组轻微减低,差异有统计学意义。I组肠绒毛高度较N组、I+D组降低,差异有统计学意义。结果提示IPF小鼠体内存在肠黏膜的损伤、坏死脱落。I+D组小鼠可能通过抑制Notch1表达减轻肺纤维化程度,肠黏膜缺氧较轻,从而肠黏膜损伤较I组轻。I组隐窝深度较N组、I+D组深,差异有统计学意义。I+D组隐窝细胞深度的显著降低,提示Notch1在IPF小鼠肠隐窝的增生以修复肠黏膜的损伤中起到重要作用。详见表2。
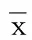
表2 各组肠黏膜厚度、绒毛高度、隐窝深度比较(±s) μm
2.5 血清MDA、T-SOD、GSH-PX测定结果 I组MDA含量较N组、I+D组高,T-SOD、GSH-PX含量较N组、I+D组低,差异有统计学意义。提示I组、I+D组存在肠黏膜损伤,I+D组较I组轻。详见表3。
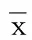
表3 各组血清MDA、T-SOD、GSH-PX比较(±s)
2.6 小鼠肺、肠道中Notch1mRNA的相对表达量 各组小鼠肺脏、肠道组织的Notch1mRNA表达呈现一致性。I组Notch1的表达较N组、I+D组升高。提示Notch1表达增高促进了IPF的发生,DAPT通过抑制Notch1的表达发挥抗纤维化作用。同时,Notch1在IPF小鼠肠道表达增高,可能介导了IPF肠黏膜损伤后的修复,DAPT也可以抑制肠隐窝细胞增生。详见表4。
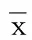
表4 各组小鼠肺、肠道中Notch1mRNA的相对表达量(±s)
3 讨 论
Notch1是Notch信号通路的受体蛋白。Notch信号通路与肺部许多常见疾病的发生相关联,例如哮喘、慢性阻塞性肺疾病(COPD)、肺动脉高压、肺癌。同时,Notch通路的激活介导肺纤维化的发生。 Aoyagi- Ikeda等[6]研究表明 Notch1通过 TGF-β1- smad3通路诱导肺泡上皮细胞分化形成肌成纤维细胞(EMT),而 EMT是肺纤维发生的一个主要环节。本实验通过博来霉素诱导小鼠肺纤维化,并通过DAPT抑制Notch1的表达,证实了Notch信号通路在IPF的发生中发挥关键作用。
肠道的机械屏障由肠道黏膜上皮细胞、细胞间紧密连接等构成,能阻挡肠内有害物质如细菌及内毒素穿透肠黏膜进入深部组织。肺部疾病的发生通常伴有肠道形态及功能的改变。Du等[7]研究认为金葡萄球菌肺炎发生时,存在肠道黏膜损伤、肠上皮细胞的凋亡。Li等[8]通过大鼠暴露于香烟烟雾诱导COPD模型中,大鼠全身存在氧化应激和炎症,通过线粒体凋亡途径增加肠上皮细胞死亡。同时肠道的氧化应激促进了缺氧诱导因子-1(HIF-1)的活化,从而破坏了肠上皮的紧密连接,增加了肠上皮的渗透性。本实验通过测量肠黏膜厚度、绒毛长度,Chiu’s评分,血清中MDA、T-SOD、GSH-PX测定,证实了肺纤维化小鼠存在肠黏膜损伤。其机制可能与肺纤维化导致全身慢性缺氧有关。小肠绒毛的解剖结构导致其氧分压远低于动脉血,对缺氧十分敏感。肠绒毛缺氧时因代谢障碍导致细胞间连接断裂、细胞水肿甚至坏死。同时缺氧可激活多种炎症介质,加剧了肠上皮的毁伤。
Notch信号通路在维持肠上皮稳态发挥关键作用。肠上皮是身体中更新最快的组织,其分裂和迁移的干细胞数量主要是隐窝底部细胞,LGR5是肠活性干细胞群体的特异性标记物[9]。Chen等[10]研究提示肠隐窝细胞通过结合Notch1基因的第二个内含子采用正反馈介导肠上皮的再生和干细胞的自我更新。Carulli等[11]研究提示在Notch1缺陷小鼠的在辐射损伤后隐窝增生受损。本实验通过测量隐窝的深度、PCR证实了Notch1介导了肺纤维化小鼠肠黏膜损伤后的修复。
肺纤维化肠黏膜的改变可能涉及许多信号分子,其组成了一个复杂的网络系统,本实验提示Notch1介导肠损伤后的修复。本实验着重探索肠黏膜机械屏障的改变,肺纤维化的肠黏膜可能存在免疫屏障中IgA分子、生物屏障中菌群的移位等众多改变,其中的机制需要更进一步的研究。
[1] Liu X,Qian L,Nan H,et al. Function of the transforming growth factor-beta1/c-Jun N-terminal kinase signaling pathway in the action of thalidomide on a rat model of pulmonary fibrosis[J]. Exp Ther Med,2014,7(3):669-674.
[2] Sander GR,Powell BC. Expression of notch receptors and ligands in the adult gut[J]. J Histochem Cytochem,2004,52(4):509-516.
[3] Zong D,Ouyang R,Li J,et al. Notch signaling in lung diseases:focus on Notch1 and Notch3[J]. Ther Adv Respir Dis,2016,10(5):468-484.
[4] Peter JV,Moran JL,Phillips-Hughes J. A metanalysis of treatment outcomes of early enteral versus early parenteral nutrition in hospitalized patients[J]. Crit Care Med,2005,33(1):213-220.
[5] Uren TK,Johansen FE,Wijburg OL,et al. Role of the polymeric Ig receptor in mucosal B cell homeostasis[J]. J Immunol,2003,170(5):2531-2539.
[6] Aoyagi-Ikeda K,Maeno T,Matsui H,et al. Notch induces myofibroblast differentiation of alveolar epithelial cells via transforming growth factor-beta-Smad3 pathway[J]. Am J Respir Cell Mol Biol,2011,45(1):136-144.
[7] Du X,Meng Q,Sharif A,et al. Surfactant proteins SP-A and SP-D ameliorate pneumonia severity and intestinal injury in a murine model of staphylococcus aureus pneumonia[J]. Shock,2016,46(2):164-172.
[8] Li H,Wu Q,Xu L,et al. Increased oxidative stress and disrupted small intestinal tight junctions in cigarette smoke-exposed rats[J]. Mol Med Rep,2015,11(6):4639-4644.
[9] Barker N,van Es JH,Kuipers J,et al. Identification of stem cells in small intestine and colon by marker gene Lgr5[J]. Nature,2007,449(7165):1003-1007.
[10] Chen KY,Srinivasan T,Tung KL,et al. A Notch positive feedback in the intestinal stem cell niche is essential for stem cell self-renewal[J].Molecular Systems Biology,2017,13(4):927.
[11] Carulli AJ,Keeley TM,Demitrack ES,et al. Notch receptor regulation of intestinal stem cell homeostasis and crypt regeneration[J]. Dev Biol,2015,402(1):98-108.
(本文编辑郭怀印)
山西省自然科学基金面上项目(No.201601D011105)
山西医科大学第一医院(太原 030001)
刘学军,E-mail:lxj20041205@sina.com
信息:郭慧,刘学军,杜毓锋,等.Notch1对肺纤维化小鼠肠黏膜屏障的影响及作用机制研究[J].中西医结合心脑血管病杂志,2017,15(13):1572-1575.
R563 R259
A
10.3969/j.issn.1672-1349.2017.13.009
1672-1349(2017)13-1572-04
2017-02-18)
