高海拔地区骨髓源神经干细胞及BDNF联合移植对大鼠脑缺血再灌注模型的治疗
2017-08-07陈晓娟肖宗宇侯倩才鼎
陈晓娟 肖宗宇 侯倩 才鼎
·论 著·
高海拔地区骨髓源神经干细胞及BDNF联合移植对大鼠脑缺血再灌注模型的治疗
陈晓娟 肖宗宇 侯倩 才鼎
目的 探讨高海拔地区大鼠骨髓源神经干细胞(bone marrow mesenchymal stem cells-derived neural stem cells,BMSCs-NSCs)及脑源性神经生长因子(Brain-derived neurotrophic factor,BDNF)联合移植对大鼠脑缺血再灌注模型的疗效及其相关机理。方法 60只Wistar雄性大鼠,置西宁地区正常饲养,制备大鼠脑缺血-再灌注损伤模型;模型制备完毕后立体定向下进行细胞移植治疗,将大鼠分为3组,即A组:大鼠骨髓源性神经球组(BMSCs-NSCs组,n=20);B组:大鼠骨髓源性神经球联合BDNF组(BMSCs-NSCs+BDNF组,n=20),注射大鼠骨髓源性神经球细胞的同时,联合注射100 ng BNDF;C组:对照组(仅注射DMEM/F12培养基,n=20);术后对其神经功能进行评定,并于术后24 d取脑组织,行Nestin、GFAP、Map2免疫荧光检测。结果 细胞移植后第3 d,各组间神经功能评分无显著性差异;细胞移植后第14 d BMSCs-NSCs+BDNF组神经功能评分显著优于BMSCs-NSCs组,BMSCs-NSCs组优于对照组;免疫组化检测发现,BMSCs-NSCS+BDNF组Nestin、GFAP、Map2的IOD值均显著高于BMSCs-NSCs组;BMSCs-NSCs+BDNF组、BMSCs-NSCs组各检测指标水平均高于对照组;Nestin、GFAP、Map2的表达主要集聚于脑梗死灶与正常脑组织交界处。结论 在西宁地区联合移植大鼠骨髓源神经干细胞及BDNF可显著促进大鼠大脑中动脉闭塞再灌注损伤模型的神经功能恢复。
骨髓基质干细胞 神经干细胞 骨髓源神经干细胞 脑源性神经营养因子 高海拔
近年来,随着神经干细胞(neural stem cells,NSCs)研究的不断深入,部分研究者将骨髓基质细胞( bone marrow mesenchymal stem cells,BMSCs)成功诱导培养出了骨髓源神经干细胞(bone marrow mesenchymal stem cells-derived neural stem cells,BMSCs-NSCs)。脑源性神经生长因子(Brain-derived neurotrophic factor,BDNF)是一种具有防止神经元死亡功能的蛋白质,在体外它可保持NSCs的活性和促进其向神经元分化[3-4]。为探讨在高海拔地区大鼠BMSCs-NSCs细胞移植对大鼠脑闭塞-再灌注损伤模型的疗效,本研究拟在西宁地区(平均海拔约2200米)制备Wistar大鼠大脑中动脉闭塞-再灌注损伤模型,并在立体定向下进行颅内细胞移植,观察BMSCs-NSCs及BDNF联合移植对大鼠脑缺血再灌注模型的疗效,并初步探讨其相关机理。
1 材料与方法
1.1 实验动物
SPF级Wistar雄性大鼠共60只,平均体重(200±20) g,购自兰州大学实验动物中心,合格证号为SCXK(甘)2013-0002。
1.2 试剂
DMEM/F12培养基、0.25%胰蛋白酶由Gibco公司购得。胎牛血清(fetal bovine serum, FBS)为Hyclone公司产品。B27添加剂购自Invitrogen公司。表皮生长因子(epidermal growth factor,EGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)及脑源性神经生长因子(BDNF)由Peprotech公司购得,小鼠抗Nestin抗体、兔抗GFAP抗体、小鼠抗Galc抗体为Chemicon公司产品,兔抗CD133抗体购自Santa Cruz公司,小鼠抗Map2抗体、兔抗β-tubulin III抗体由Abcam公司生产。Alexa Fluor 488山羊抗小鼠IgG、Alexa Fluor 594标记羊抗兔IgG和Alexa Fluor 488山羊抗兔IgG由Molecular Probes公司生产。DAPI封片剂为Vector Laboratories公司产品。
1.3 大鼠骨髓源神经干细胞的培养及鉴定
选取成年雄性Wistar大鼠,无菌条件下取双侧股骨和肱骨,反复冲洗骨髓腔,收集骨髓组织悬液,以含10%FBS的DMEM/F12进行培养;收集生长状态良好的BMSCs,经0.25%胰酶消化,制备单细胞悬液,以含20 ng/mL bFGF、20 ng/mL EGF及1∶50的B27添加剂的DMEM/F12无血清培养基重悬,接种密度为2×105细胞/ mL,隔天换半液1次并添加相应剂量生长因子;收集在无血清培养条件下形成的神经球,采用免疫荧光法检测神经干细胞特异性标志物CD133和Nestin。
1.4 大鼠大脑中动脉闭塞再灌注损伤模型的建立
参考Longa等[5]的报道,采用3.6%水合氯醛对大鼠按1mL/100g体重的剂量进行腹腔注射麻醉后取仰卧位固定于手术台上,分离右侧颈总动脉、颈内动脉及颈外动脉,结扎并剪断颈外动脉远端,经颈外动脉向颈内动脉插入线栓,阻断大脑中动脉血供,缺血2 h后拔除线栓,成功制备大脑中动脉闭塞再灌注损伤模型。
1.5 大鼠脑缺血再灌注模型的治疗
成功制备大鼠脑缺血再灌注模型后第3 d,将各大组大鼠分为3组,即A组:大鼠骨髓源性神经球组(BMSCs-NSCs组,n=20);B组:大鼠骨髓源性神经球联合BDNF组(BMSCs-NSCs-BDNF组,n=20),注射大鼠骨髓源性神经球细胞的同时,联合注射100ng BNDF;C组:对照组(仅注射DMEM/F12培养基,n=20);收集BMSCs-NSCs,并调整活细胞密度为5×105/10 μL DMEM/F12培养基;将大鼠颅平位固定于立体定向仪,选右侧大鼠脑尾状核为接种靶点,其坐标为前囟中点前1.0 mm,矢状缝右旁开3.0 mm,硬膜下5.0 mm,对各组大鼠进行颅内细胞移植治疗;分别于细胞移植治疗后第3、7、14、21 d,采用行走测试对各组大鼠进行神经功能评分,1分为能直线行走;2分为不能直线行走;3分为因瘫痪,只能原地旋转;4分为因瘫痪,不能动;细胞移植治疗后21 d,收集各组大鼠,对脑组织切片行Nestin、GFAP、Map2免疫组化检测,收集图片,利用IPP(Image Pro-Plus)对图片进行分析,测量阳性细胞的总光密度(Integrated Optical Density,IOD)值。
1.6 统计学处理
2 结 果
2.1 大鼠骨髓源神经干细胞的培养及鉴定
将大鼠BMSCs转入含20 ng/mLbFGF、20 ng/mLEGF及B27添加剂(1∶50)的DMEM/F12培养基后呈悬浮球状聚集生长。经免疫组织化学检测,所形成的细胞球呈CD133和Nesitn阳性(图1)。

图1 大鼠骨髓源神经干细胞呈Nestin(绿色、图A)、CD133(红色、图B)阳性,细胞核以DAPI复染(蓝色、图C),荧光显微镜,标尺为50μm
2.2 各组神经功能评定
细胞移植内7 d行神经功能评定,各组间无显著性差异(P>0.05);细胞移植14 d后, BMSCs-NSCs+BDNF组神经功能评分优于BMSCs-NSCs组,BMSCs-NSCs组优于对照组(P<0.05);随时间的推移,对照组的神经功能也有一定程度的恢复。
2.3 各组脑组织免疫组化检测
于颅内细胞移植术后第21 d取大鼠脑组织,行免疫荧光检测脑梗塞病灶内Nestin、GFAP、Map2表达情况,行总光密度值检测,发现BMSCs-NSCs+BDNF组Nestin、GFAP、Map2的IOD值均显著高于BMSCs-NSCs组;BMSCs-NSCs+BDNF组、BMSCs-NSCs组各检测指标水平均高于对照组。对照组中MAP2表达为阴性,且BMSCs-NSCs+BDNF组、BMSCs-NSCs组中Nestin、GFAP、Map2的表达主要集聚于脑梗死灶与正常脑组织交界处(图2~4,表2)。

表1 行走测试比较,分)
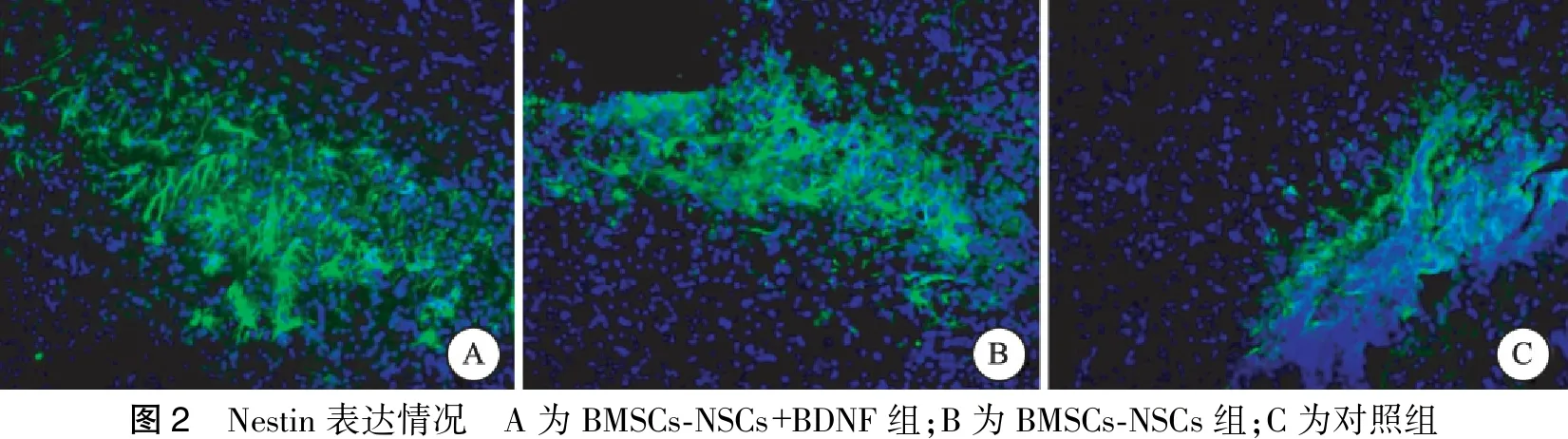
图2 Nestin表达情况 A为BMSCs⁃NSCs+BDNF组;B为BMSCs⁃NSCs组;C为对照组
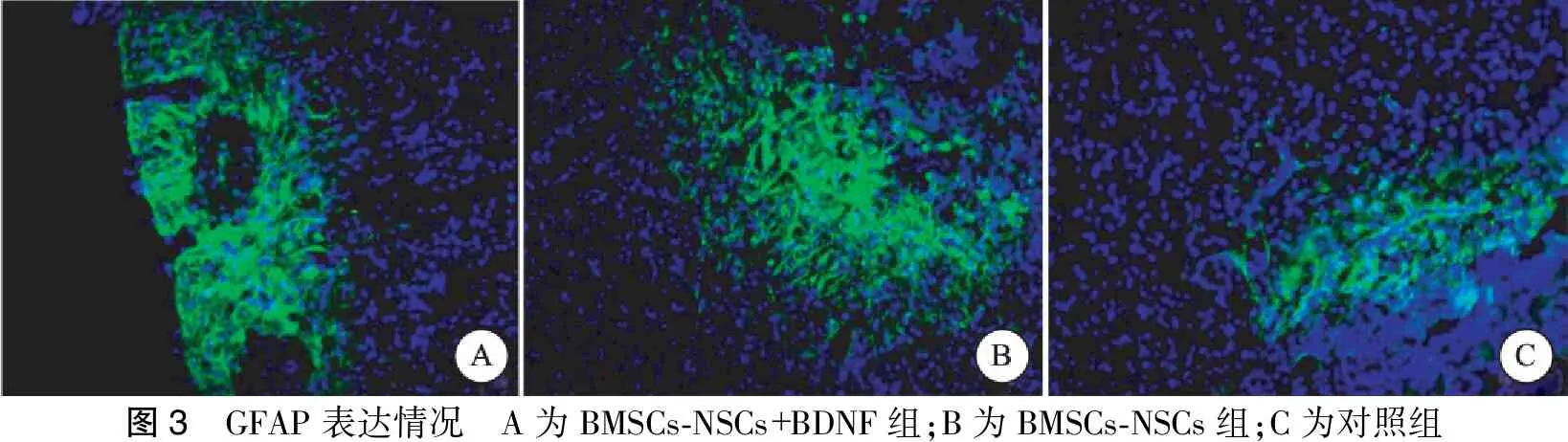
图3 GFAP表达情况 A为BMSCs⁃NSCs+BDNF组;B为BMSCs⁃NSCs组;C为对照组
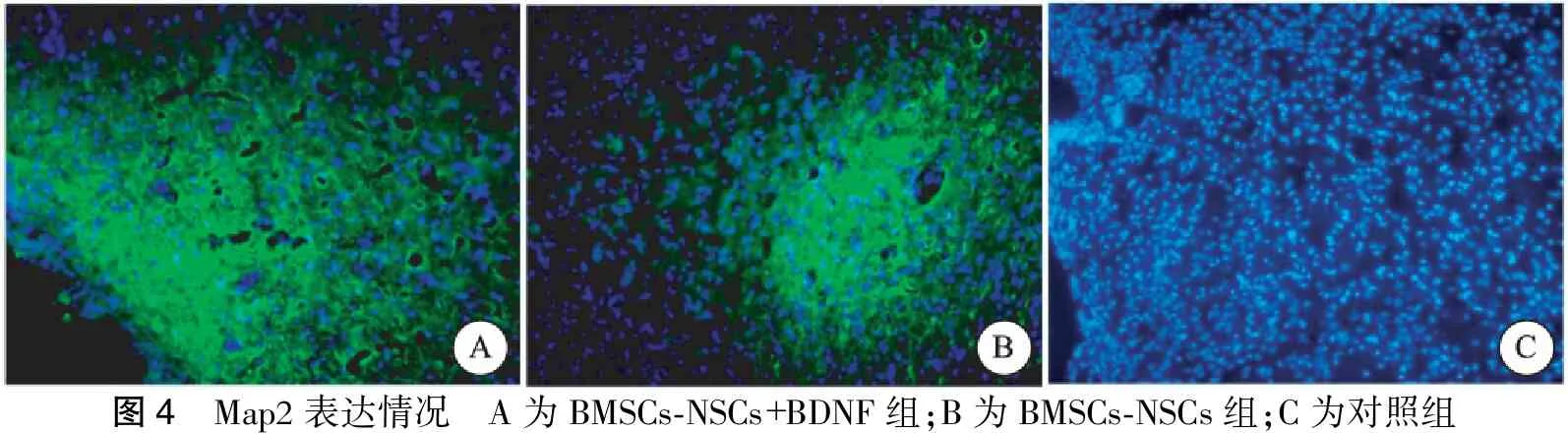
图4 Map2表达情况 A为BMSCs⁃NSCs+BDNF组;B为BMSCs⁃NSCs组;C为对照组
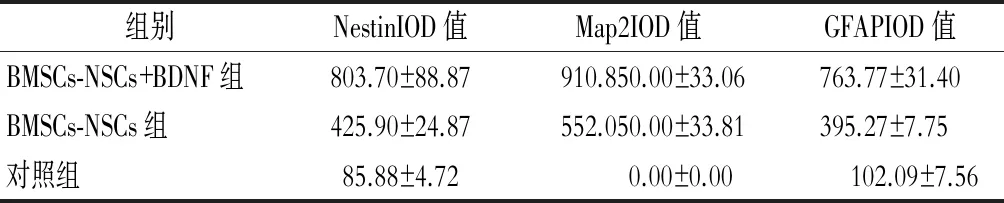
表2 细胞移植治疗后第21 d,各组中 Nestin、Map2、GFAP表达率
注:3组间Nestin、Map2、GFAP IOD值比较有明显差异(P<0.05)
3 讨 论
神经干细胞 (neural stem cells,NSCs)是指分布于神经系统的具有无限增殖、自我更新及多向分化潜能的细胞,作为一种后备储备,它在一定条件下可以进行增殖、迁移和分化并参与神经系统损伤修复或细胞正常死亡的更新。但是成体中枢神经损伤后其自我再生能力有限,远远不能完成神经功能的再生修复,特别是大面积受损的中枢神经组织仅靠自身的神经干细胞修复无法实现。如何促进颅脑损伤后神经再生和神经功能恢复是当前研究的热点和难点[6-7]。近年来,研究表明骨髓基质细胞于体外通过诱导分化可获得骨髓源性神经干细胞(bone marrow mesenchymal stem cells-derived neural stem cells,BMSCs- NSCs)[1-2]。BMSCs- NSCs的成功培养避免了神经干细胞或胚胎干细胞等其它干细胞涉及的来源有限、取材困难、免疫排斥、伦理等问题。因此,BMSCs- NSCs在应用神经干细胞治疗人类某些神经系统疾病及损伤方面具有良好的临床应用前景。
BDNF是一种具有防止神经元死亡功能的蛋白质。BDNF-mRNA广泛地存在于中枢神经系统和外周组织内。在中枢其广泛分布在大部分脑区如上丘、大脑皮层和海马等。BDNF在体外可保持NSCs的活性和促进其向神经元分化。体内外研究均表明,BDNF可显著增加神经干细胞或神经前体细胞分化为神经元的数量[8-9]。因此,本研究选用BDNF,拟通过联合移植大鼠骨髓源性神经干细胞和BDNF,增加骨髓源性神经干细胞分化为神经元的数量,改善脑梗死大鼠的神经功能。
西宁地区属于高海拔地区,市区海拔约2200米,空气稀薄,含氧量较平原地区为低,人们长期处于一个低压低氧刺激的环境,对缺血、缺氧耐受力相对较强,高海拔地区人群可能具有更强的脑保护力,在发生脑缺血再灌注损伤时可能会有更小的梗死体积和更轻的临床症状[10]。为明确在高海拔地区进行脑组织缺血再灌注损伤的细胞移植的疗效如何?本研究设计了该实验。本实验发现,在MACO/R模型细胞移植后第21 d,BMSCs-NSCs+BDNF组的神经功能恢复显著优于BMSCs-NSCs组及对照组;且颅内表达Nestin阳性细胞显著高于BMSCs-NSCs组,这些标志物的表达主要集中于细胞移植区及脑梗死病灶与正常脑组织交界处。本研究推测,骨髓源神经干细胞移植入颅内后继续增殖并分化,在细胞移植治疗后第21 d,在移植区仍有大量神经干细胞存活,且BMSCs-NSCs+BDNF组表达Nestin比例更高,表明BDNF促进了神经干细胞在体内的存活及增殖。BMSCs-NSCs+BDNF组神经元(Map2)、星形胶质细胞(GFAP)表达率均显著高于BMSCs-NSCs组,而对照组中无Map2表达,表明添BDNF后骨髓源神经干细胞显著促进了骨髓源神经干细胞向神经元及星形胶质细胞分化的比例。结合神经功能评分,联合移植治疗显著改善了大鼠脑缺血—再灌注损伤模型的神经功能。由此可见,BDNF显著增强了骨髓源神经干细胞移植治疗的疗效,其可能机制如下:①在BDNF的影响下一部分神经干细胞分化神经元,促进了神经功能的恢复;②神经干细胞或已分化的星形胶质细胞、神经元等分泌多种细胞因子,促进神经的再生;③神经干细胞分化为少突胶质细胞,参与了神经细胞髓鞘的形成,促进了神经纤维的生长,促进了神经功能的恢复。
此外,本研究发现无论细胞移植组或对照组,在脑梗死病灶及正常脑组织边界仍有部分细胞表达Nesin,由此可推测此部分神经干细胞可能来源于自体神经干细胞,在机体中枢神经系统损伤时自体神经干细胞参与了神经系统损伤的修复。虽然对照组中在脑梗死区中无Map2的表达,但在脑梗死病灶与正常脑组织边缘有大量GFAP阳性细胞表达。从神经功能评分来看,随着时间推移,对照组大鼠神经功能也有一定程度的恢复,由此本研究推测其神经功能的恢复可能来源于自体神经干细胞,也可能系脑梗死后病灶周围大量表达GFAP的胶质细胞增殖、释放神经生长因子等促进了神经功能的恢复。
综上所述,在高海拔地区联合移植大鼠骨髓源神经干细胞及BDNF可显著促进大鼠大脑中动脉脑闭塞—再灌注损伤模型的神经功能恢复,但其潜在机制仍需进一步研究。
[1] Lee Jeongwu,Elkahloun G,Messina A,et al.Cellular and genetic characterization of human adult bone marrow-derived neural stem-like cells: a potential antiglioma cellular vector[J].Cancer Res,2003,63(24):8877-8889.
[2] Tang Yue,Cui Chun,Wang Juan,et al.Neural progenitor cells derived from adult bone marrow mesenchymal stem cells promote neuronal regeneration[J].Life Sci,2012,91(19/20):951-958.
[3] Chang Jeong,Lee Nayeon,Choi Chunggab,et al.Therapeutic effect of BDNF-overexpressing human neural stem cells (HB1.F3.BDNF) in a rodent model of middle cerebral artery occlusion[J].Cell Transplant,2013,22(8):1441-1452.
[4] Yang Zhaoyang,Qiao Hui,Sun Zhiwei,et al.Effect of BDNF-plasma-collagen matrix controlled delivery system on the behavior of adult rats neural stem cells[J].J Biomed Mater Res A,2013,101(2):599-606.
[5] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[6] Banerjee Soma,Williamson Deborah,Habib Nagy,et al.Human stem cell therapy in ischaemic stroke: a review[J].Age Ageing,2011,40(1):7-13.
[7] Kokaia Zaal,Darsalia Vladimer.Neural stem cell-based therapy for ischemic stroke[J].Transl Stroke Res,2011,2(3):272-278.
[8] He Li,Ba Chun,Wang yang,et al.BDNF expression with functional improvement in transected spinal cord treated with neural stem cells in adult rats[J].Neuropeptides,2013,47(1):1-7.
[9] Darabi Shahram,Tiraihi Taki,Ruintan Atefeh,et al.Polarized neural stem cells derived from adult bone marrow stromal cells develop a rosette-like structure[J].In Vitro Cell Dev Biol Anim,2013,49(8):638-652.
[10]吴世政.缺氧预处理保护脑损伤的机制研究[J].中华医学信息导报,2014,29(15):16.
(2016-06-26收稿)
The effects of BDNF on the differentiation of bone marrow mesenchymal stem cells-derived neural stem cells in high altitude
ChenXiaojuan,XiaoZongyu,HouQian,etal.
*DepartmentofNeurology,People’sHospitalofQinghaiProvince,Xining810000
Objective To investigate the efficacy of neural stem cells derived bone marrow to repair rats MACO/R model in high altitude, and to discuss the mechanism.Methods 60 Wistar rats were prepared for MACO/R model in Xining, then neural stem cells derived from bone marrow were injected in the right striatum. And these rats were randomly divided into three groups: A: BMSCs-NSCS group (n=20), B: BMSCs-NSCS+BDNF group (n=20), C: control group (n=20). Then neurological scales were tested, the expression of Nestin, GFAP, Map2 were tested by Immunochemistry. Results There was no significance difference in neurological scales in different groups in day 3. The neurological function was recovered after cell therapy, and the neurological function was better in BMSCs-NSCs+BDNF group. The expression of Nestin, GFAP, Map2 were much higher in BMSCs-NSCS+BDNF group than BMSCs-NSCS groups and control group. And the Expression of MAP2, β-tubulin, GFAP, CD133, Nestin were gathered in the injection area and the conjunction area between the normal brain tissue and the cerebral infarction.Conclusion Transplantation of BMSCs-NSCS and BDNF could significantly promote the recovery of neurological function in MACO/R model in Xining area.
Bone marrow mesenchymal stem cells Neural stem cells Bone marrow mesenchymal stem cells-derived neural stem cells BDNF High altitude
青海省科技创新能力促进计划项目(编号为2015-ZJ-943Q)
810000 西宁,青海省人民医院神经内科(陈晓娟 侯倩 才鼎);青海大学附属医院神经外科(肖宗宇)
R743.3
A
1007-0478(2017)02-0087-05
10.3969/j.issn.1007-0478.2017.02.001
