儿童骨代谢标志物
2017-08-06崔坤华李琪
崔坤华 李琪
昆明医科大学第一附属医院儿科,云南 昆明 650032
1 概述
1.1 儿童骨骼系统疾病特点
维生素D缺乏性佝偻病是儿科最常见的疾病之一。维生素D缺乏性佝偻病占我国儿童佝偻病发病率的95%以上[1]。骨质疏松的患病率增加,所以儿童骨质疏松越来越受到重视[2]。青春期末获得的峰值骨量的高低和成年后骨量丢失的速度是在中老年后骨质疏松发病的两个重要因素。儿童和青少年时期是骨量快速增长和骨矿物作用的重要时期,在青春期末所达到的峰值骨量能够决定成年时期病理性骨折和骨质疏松的患病风险。在儿童和青少年时期未能达到适合骨量的个体,即使在成年以后没有发生骨量加速流失的现象,仍有患骨质疏松症的可能。因而,儿童青少年期获得的骨量是人体骨骼健康的重要因素。骨质疏松应当被理解为起病于儿童期,在老年期出现症状,称为“具有老年期影响的儿科疾病”[3]。因此,即使儿童期未发生骨质疏松,但青春发育期儿童获得理想的骨骼发育状态,可影响成年后骨骼的发育。
1.2 儿童骨代谢标志物的特点
在儿童时期,骨骼不断进行着生长和重塑。骨的生长在小儿时期包含骨塑造和骨再造。前者为小儿所特有,而后者终生存在。成骨细胞的骨形成作用与破骨细胞的骨吸收作用在小儿时期并不平衡,骨形成大于骨吸收,于是骨骼不断生长。儿童生长速度很快,骨代谢迅速,因而骨标浓度很高,在生理和病理状态下都可以导致骨标志物浓度的显著变化[4]。儿童期反映骨生长代谢的生化指标有其自身的变化规律,不能以成人的指标作为判断标准,而应采用儿童期的骨生长代谢指标来指导诊断和治疗[5]。
2 儿童骨代谢标志物
目前认为双能X线吸收法是测定骨密度的标准方法[2],而骨密度的下降是诊断儿童骨质疏松的必备条件[6]。但双能X线吸收法在儿童中应用的精密度和准确度仍有争议,且其测量的是局部的骨量变化,很容易高估或者低估骨密度,加之儿童骨骼处于不断增长增粗的阶段,此种差异就更明显,且其不能作为常规的检测,只有在该患者有发生骨质疏松症风险的情况下才有完善双能X线检测的适应证。而儿童处于快速生长发育中,大多数骨量的丢失都是隐性的,因此,仅凭骨密度的检测容易导致漏诊误诊[7]。在儿童骨质疏松中,继发性骨质疏松占大部分,在继发性骨质疏松特别是糖皮质激素诱导的骨质疏松中,在骨密度正常的情况下,仍有骨质疏松的发生[6]。基于以上骨密度检测的局限性,骨代谢标志物能更早地反映骨量的丢失,虽然不能诊断骨质疏松,但可以作为药物治疗的监测指标和正常人群的筛查指标,联合骨密度能更准确地评估骨量的丢失,减少骨质疏松的漏诊及误诊。骨代谢标志物之所以不能评估骨量的丢失,其局限性在于儿童的不同生长发育阶段,骨代谢标志物存在很大的差异。本文就不同儿童生长发育阶段骨代谢标志物的特点予以总结,以期能与骨密度一起提高骨质疏松的诊断与治疗[8]。
2.1 骨形成标志物
2.1.1I型前胶原肽(Type I procollagen peptide):胶原是骨组织中最主要的蛋白质,占骨全部有机质的93%,对维持骨结构的完整及骨生物力学特性非常重要。I型胶原在骨胶原中约占97%。骨I型胶原由成骨细胞产生,首先在其细胞内部合成大分子前体蛋白I型原胶原,后分泌到细胞外,在特异性肽内切酶作用下切去N末端和C末端成为胶原分子,再进一步组装成不溶性胶原纤维,最后形成交联物,以保证其结构的完整性。所切去的两端非胶原结构,即I型原胶原羧基(procollagen I C-terminal propeptide,PICP)或I型氨基末端前肽(procollagen I N-terminal peptide,PINP)。因此,原胶原前肽是骨胶原合成时的产物,且其与所形成胶原分子存在1∶1的对应关系,故可准确地反映胶原的合成及成骨细胞活性[9]。PINP的高峰在婴儿期,此后,在青春期前PINP开始下降,仅仅只有轻度的波动,当在青春期增长阶段,PINP值升高,而且男孩与女孩出现显著差异。在停止生长后,PINP值降至成人水平[10]。0~18岁欧洲中部男孩和女孩的PINP参考值见图1、2。

图1 青春期前儿童PINP参考值,上下偏差对应2.5和97.5个百分位Fig.1 PINP in prepubertal children. Lower and upper deviations correspond to 2.5 and 97.5 percentile摘自:文献[10]。

图2 9.1~18岁儿童PINP参考值(白色表示男孩,灰色表示女孩,上下偏差对应2.5和97.5个百分位)Fig.2 PINP in children of 9.1-18 years old. (White bar, boys; gray bar, girls. Lower and upper deviations correspond to 2.5 and 97.5 percentile)摘自:文献[10]。
2.1.2骨碱性磷酸酶(bone-specific alkaline phosphatase,BAP):骨碱性磷酸酶由成骨细胞在骨形成阶段大量生成,是成骨细胞增殖停止初期的特征性产物,当骨基质矿物化开始后即减低。血液中的碱性磷酸酶95%以上来自于肝脏和骨骼[11]。目前国内单独对骨碱性磷酸酶儿童的参考范围研究较少。但正常儿童血清碱性磷酸酶(alkaline phosphatase,ALP)与BAP呈显著正相关,国内常规检测ALP代替BAP,作为一个评价儿童骨代谢方便快捷又便宜的指标[12]。15岁以后的儿童BAP值比15岁以前儿童低,而且13岁以后男孩中BAP值明显比女孩高[13]。0~20岁美国男女儿童BAP的参考值见图3。

图3 美国男女儿童的骨碱性磷酸酶参考值曲线(实点代表男孩,虚点代表女孩,曲线表示第50百分位数和3、97百分位数)Fig.3 Back transformed reference curves for bone formation markers BALP in boys (filled circles) and girls (open circles). Curves represent the 50th centile (straight lines) and 3rd/97th centile (dotted lines).摘自:文献[13]。
2.1.3骨钙素(osteocalcin,OC):骨钙素又称骨依赖维生素K蛋白,是由成骨细胞在维生素D3调节下合成的多肽类物质,是骨组织中最丰富的一种非胶原蛋白质。OC是唯一在矿化组织中大量存在的骨代谢标志物,是骨形成的最直接反映。OC在血清中含量约占成骨细胞合成量的20%,两者呈正相关[9]。国际上已将血清OC的检测作为能敏感、特异、准确地反映机体成骨细胞功能的重要指标。OC没有峰值,但是儿童的参考范围比成人高。在青春期增长阶段,OC值升高,而且男孩与女孩出现显著差异。在停止生长后,OC值降至成人水平[10]。0~18岁欧洲中部男孩和女孩OC的参考值见图4、5。
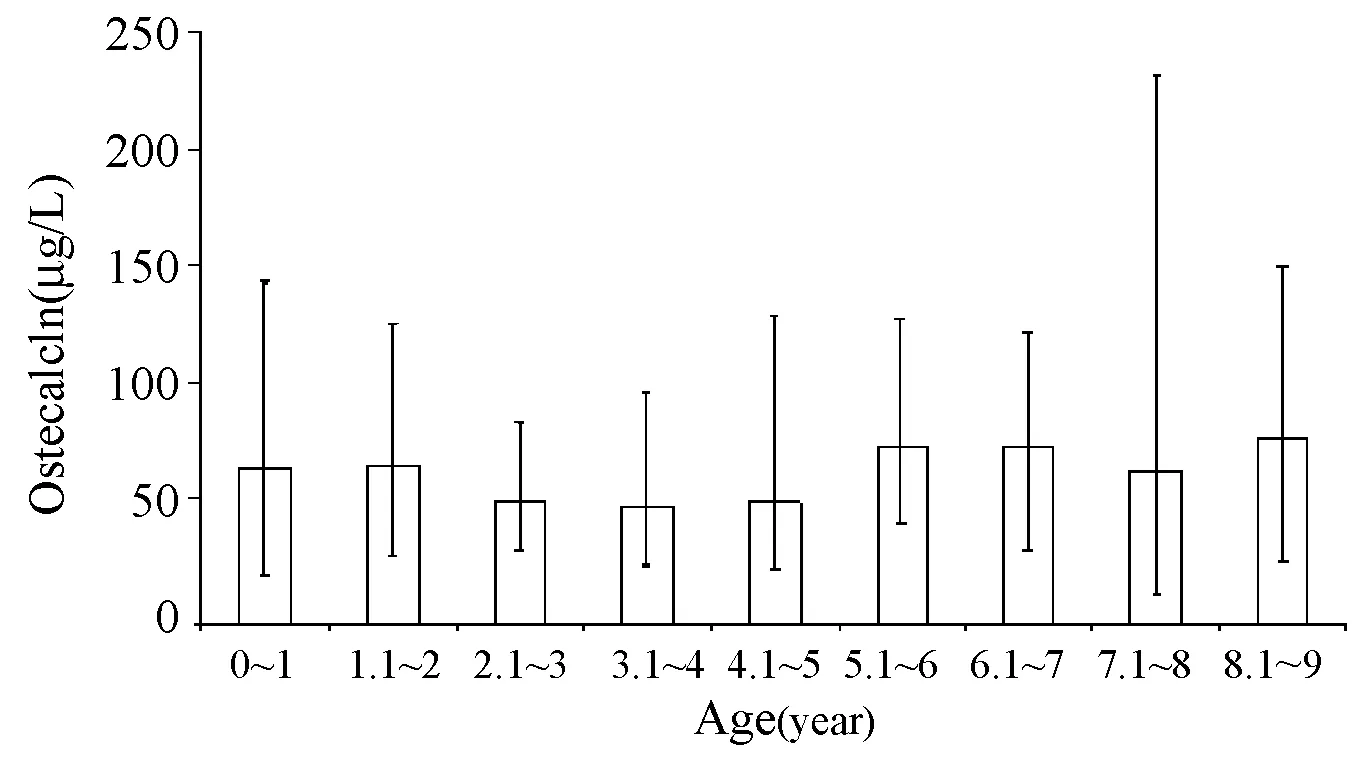
图4 青春期前儿童OC参考值,上下偏差对应2.5和97.5个百分位Fig.4 Osteocalcin in prepubertal children. Lower and upper deviations correspond to 2.5 and 97.5 percentile摘自文献[10]。

图5 9.1~18岁儿童OC参考值(白色表示男孩,灰色表示女孩,上下偏差对应2.5和97.5个百分位)Fig.5 Osteocalcin in children of 9.1-18 years old (White bar, boys; gray bar, girls. Lower and upper deviations correspond to 2.5 and 97.5 percentile)摘自:文献[10]。
2.2 骨吸收标志物
2.2.1吡啶交联物:骨组织中最多的交联物是吡啶啉和脱氧吡啶啉,当破骨细胞吸收骨基质时,它们就从胶原分子中释放出来进入血循环,并不经过肝脏代谢,在血液和尿中以游离和肽结合形成存在,直接由尿排泄。尽管吡啶啉和脱氧吡啶啉并非骨组织所特有,但两者比例在骨中与尿中均为4∶1,而软组织中则大于10∶1,提示其主要为骨源性,是反映骨吸收的可靠指标[9]。
2.2.2I型胶原交联N-末端肽(N-terminal peptides,NTX)和C-末端肽(C-terminal peptides,CTX):I型胶原羧基或氨基末端交联肽(CTX、NTX)也是胶原分子交联物的一部分,在胶原分解时产生,是特异性反映骨吸收的指标。尿NTX的稳定性、敏感性均好于传统骨吸收指标[9]。CTX值与年龄和身高成线性关系,身高对男孩的影响比女孩稍强一些[14]。与2~15岁儿童相比,17岁以后血清CTX值更低,CTX值在11~15岁儿童中的应用价值更大[13]。3~9岁男女儿童的CTX参考值见图6。

图6 欧洲儿童男孩和女孩CTX参考曲线,曲线表示第50百分位数和3、97百分位数Fig.6 CTX reference curves of boys and girls considering the 3rd, 50th and 97th age- and sex-specific height percentile摘自:文献[14]。
2.2.3抗酒石酸酸性磷酸酶5b片断(TRAP-5b):TRAP-5b是酸性磷酸酶6种同工酶(O~5型)中的一种,即第5型。在正常人血清中,TRAP-5以两种不同的糖基化形式存在,即TRAP-5 a和TRAP-5b,其中TRAp-5b主要来源于破骨细胞。血清中的TRAP-5b可间接反映破骨细胞的数量[4]。有研究表明,TRAP-5b在各年龄段分布不同,15岁后 TRAP-5b值低于3岁以下儿童,13~17岁男孩参考值相对于女孩更高[13],0~20岁美国男女儿童的TRAP-5b参考值见图7。

图7 美国男女儿童的抗酒石酸酸性磷酸酶5b片断(TRAP-Sb)参考值曲线(实点代表男孩,虚点代表女孩,曲线表示第50百分位数和3、97百分位数)Fig.7 Back transformed reference curves for bone resorption markers TRAP5b in boys (filled circles) and girls (open circles). Curves represent the 50th centile (straight lines) and 3rd/97th centile (dotted lines).摘自:文献[13]。
2.3 儿童骨代谢的调节指标
维生素D是重要的调节骨代谢的类固醇激素,其活性成分是1,25-(OH)2D3。1,25-(OH)2D3的靶器官是小肠、骨骼和肾脏,作用为升高血钙和血磷。甲状旁腺激素(parathyroid hormone,PTH)是甲状旁腺主细胞合成和分泌的,受到细胞外液钙离子浓度的负反馈调节,调控钙磷浓度。PTH作用的靶器官是骨骼、肾小管和小肠,总的作用是升高血钙、降低血磷。
2.4 新型骨代谢标志物
在传统骨代谢生化标志物中,PINP和CTX是骨形成和骨吸收的参考标志物[15]。然而,传统的骨代谢生化标志物有一些局限性,包括缺乏骨组织特异性,不能反映骨细胞的活动性及骨膜的新陈代谢。有研究表明,一种新的类型标志物,循环中小分子核糖核酸可以在骨质疏松症中代表早期生物标志物[16]。
2.4.1骨膜蛋白(periostin,POSTN):骨膜蛋白主要由骨膜成骨细胞和骨细胞表达[17],不仅能调节骨形成和骨矿物密度,而且能通过调节胶原蛋白交联增加骨骼强度[18]。血清中骨膜蛋白反映的是生物过程,而不是检测静态的骨矿物密度或者骨代谢动态指标[16]。血清中骨膜蛋白的测定是非常有用的,但是骨膜蛋白对骨骼不是特异的,肺纤维化、心脏、皮肤都有表达,目前无骨骼特异性亚型。为了提高骨折风险评估,需要把骨矿物密度和骨代谢标志物联合使用[16]。
2.4.2鞘氨醇-1-磷酸(sphingosine-1-phosphate,S1P):S1P是一种脂质介质,通过S1P受体扮演不同的作用,S1P受体是G蛋白家族受体[19]。尽管S1P可能影响成骨细胞的增殖、存活、迁移,但是在骨代谢方面最主要的作用是在破骨细胞生成方面[20]。S1P在骨折方面的作用取决于末梢循环中S1P的值与骨髓腔中S1P值的比值。末梢循环中S1P的水平和末梢循环中S1P的值与骨髓腔中S1P值的比值,是评估骨折风险的新的生化标志物[16]。
2.4.3骨硬化蛋白(Sclerostin):骨硬化蛋白是一种分泌性蛋白,通过抑制Wnt信号通路,进而影响骨的形成[21]。骨硬化蛋白也能刺激骨细胞来源的破骨细胞分化因子的分泌,从而直接激活破骨细胞的活动[22]。循环中骨硬化蛋白与骨髓腔中骨硬化蛋白呈正相关,这意味着血清中骨硬化蛋白的水平可以反映自身的骨产生[23]。血清中骨硬化蛋白与骨转换标志物呈负相关,与BMD呈正相关[16]。在青春期前,女孩中骨硬化蛋白水平略高于男孩,不管男孩还是女孩,在青春期,骨硬化蛋白都开始下降,但在青春期后男孩中骨硬化蛋白明显高于女孩[24]。在II型糖尿病患者、类风湿关节炎、慢性肾脏疾病中都有表达,所以用骨硬化蛋白来预测骨质疏松症患者骨折风险存在一定的局限性[16]。
2.4.4微小核糖核酸(MicroRNAs):微小核糖核酸不仅参与了正常成骨细胞和破骨细胞的功能,而且在一些骨骼疾病状态包括骨质疏松也会释放微小核糖核酸[25]。从诊断的角度来看,测量循环中微小核糖核酸是很有用的,因为它在骨代谢改变方面可以提供非常有价值的信息,可能比骨生化标志物更早[16]。微小核糖核酸以细胞外囊泡、高密度脂蛋白囊泡形式从细胞胞浆释放到生物液中,也可以是RNA结合蛋白以核质蛋白的形式释放到生物液中[26]。微小核糖核酸在生物液中非凡的稳定性,血液循环中微小核糖核酸是以囊泡与蛋白缔合物的形式存在,它们在外周血中可以耐核糖核酸酶活动,所以它们可以作为优秀的生物标志物[27]。但是,微小核糖核酸在骨骼系统精密医学方面建立诊断工具和提供可靠的治疗目标,还需要更进一步的研究[28]。
3 骨代谢标志物在儿科中的应用
3.1 生长发育的监测
血清P1NP值和OC值以及CTX值在学龄前期及学龄期水平较低,在儿童青春期达到峰值,并在青春期后快速降低,这与儿童生长特点相似[3]。特发性身材矮小(idiopathic short stature,ISS)儿童的血清BAP和OC与胰岛素样生长因子(insulin like growth factor 1,IGF-1)均存在显著的直线正相关关系,二者不仅能反映骨骼的生长动力,同时是骨骼生长的结果反映,并与骨骼的生长速率保持一致,因此二者可作为评价ISS儿童骨骼生长发育的监测指标。对准确判断ISS儿童现时生长状况以及监测疗效具有很大的临床实用价值[29]。生长激素缺乏症(growth hormone deficiency,GHD)儿童,尤其是完全性GHD儿童的骨形成指标BAP和骨吸收指标CTX均明显下降,同时伴有IGF-1明显下降,IGF1与CTX呈正相关,经生长激素(growth hormone,GH)治疗后,各项骨转换指标和IGF1显著升高[30]。
3.2 药物对骨代谢影响的监测
糖皮质激素(glucocorticoid,GC)在临床上应用极为广泛,且经常是长期使用。不论通过何种给药途径,长期接受GC治疗者都有发生骨质疏松的危险,称为糖皮质激素性骨质疏松[10]。并且具有剂量依赖性,在一定剂量范围内,地塞米松是有促成骨分化作用的,但达到一定高剂量后,这种作用不再增加,由于其抑制成骨细胞增殖和促细胞凋亡的作用,最终高浓度的地塞米松对骨骼的作用反而是负性的[10]。癫痫是小儿神经系统的常见疾病之一,长期服用抗癫痫药物是治疗癫痫的最常用方法。长期服用抗癫痫药物可致骨损害,主要表现为亚临床的骨代谢障碍。身材矮小、牙齿发育不全、佝偻病和骨质软化症发生率为30%~50%,严重者可致自发性骨折[31]。
3.3 疾病对儿童骨代谢的影响
3.3.1骨代谢性疾病:佝偻病患儿BAP和OC升高提示成骨细胞功能活跃,均与佝偻病的病情严重程度呈正比[32]。成骨不全是先天性骨代谢异常所致的疾病。近年来的研究表明骨形成标志物测定可能是诊断成骨不全的较好指标[11]。
3.3.2肾病综合征:肾病综合征为儿科的常见病之一,肾上腺糖皮质激素治疗是其首选措施,但治疗剂量的泼尼松对患儿的骨代谢有极大的负性影响。由于肾病综合征小儿存在骨生长发育障碍,治疗后继发性骨质疏松及骨质疏松性骨折等严重并发症更时有发生[33]。有研究发现在慢性肾脏疾病的患儿中,骨代谢标志物提示骨转换率更高[34]。糖皮质激素长期应用也会引起骨质疏松[35]。慢性肾脏疾病患者可能发展为骨质疏松和肾性骨病,抗酒石酸酸性磷酸酶5b片断和骨碱性磷酸酶不经肾脏清除,因此用于肾脏疾病的评估可能存在缺陷。骨骼组织形态学仍是慢性肾脏疾病所致骨骼疾病诊断的金标准[8]。
