雌激素缺乏上调TNF-α促发卵巢切除大鼠骨细胞程序性坏死
2017-08-06崔红旺孟志斌王挺锐祝开忠史方富唐崧杰朱永俊
崔红旺 孟志斌 王挺锐 祝开忠 史方富 唐崧杰 朱永俊
1.海南医学院第一附属医院脊柱骨病外科,海南 海口 570102 2.海南医学院第一附属医院肾病风湿科,海南 海口 570102
骨细胞的死亡在绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)发病过程中起重要的作用[1]。以往对绝经后骨质疏松症发病机制的研究主要集中在雌激素调控细胞凋亡的机制上[2]。笔者前期研究发现,在卵巢切除(ovariectomized,OVX)大鼠骨质疏松发病过程中,程序性坏死是引起骨细胞死亡的另一种重要方式[3]。然而,雌激素缺乏是如何促发骨细胞程序性坏死的发生机制,目前尚未有文献报道。
肿瘤坏死因子α(tumor necrosis factor,TNF-α)对PMOP骨代谢的调节起着重要作用[4]。研究已证实,绝经前健康妇女接受OVX术后8 w TNF-α明显增加,这与骨吸收指标密切相关[5]。TNF-α与其受体(tumor necrosis factor receptors,TNFR)作用可激活细胞程序性死亡信号转导途径进而导致细胞发生程序性坏死(necroptosis)[6]。在OVX大鼠骨量丢失过程中,骨细胞程序性坏死是否与TNF-α相关及其机制尚不清楚。本研究以OVX大鼠骨质疏松模型为研究对象,探讨雌激素缺乏骨细胞发生程序性坏死的机制,从而进一步完善绝经后骨质疏松症的发病机制,为防治绝经后骨质疏松症寻找出一条新的途径。
1 材料和方法
1.1 实验动物
成年健康雌性12 w龄的Sprague-Dawley大鼠,体重220~260 g,由重庆医科大学实验动物中心提供。动物许可证号:SCXK(渝)2012-0001。饲养场所由海南省药物安全性评价研究中心提供:标准层流SPF级动物房。饲养条件:5只/笼,12 h昼夜节律光照,室温20~24 ℃,相对湿度(55±5)%。所有动物自由活动,给予标准饮食,自由饮水。实验过程中严格执行海南医学院生物医学研究伦理委员会批准的动物保护法案。
1.2 主要试剂
E2(17β-estradiol,美国Sigma-Aldrich公司);necrostatin-1(美国Sigma-Aldrich);Z-VAD-fmk (美国MP Biomedicals公司);小鼠anti-RIP1单克隆抗体、兔RIP3多克隆抗体(美国 abcam);MLKL(美国 Santa Cruz);Drp1(美国 Cell Signaling Technology),兔抗β-actin单克隆抗体;骨组织抗原修复液(上海舜百生物科技有限公司);Access Estradiol试剂盒(美国 Beckman Coulter);Envision免疫组化染色试剂盒(北京中杉金桥生物技术有限公司);EDTA(德国巴斯夫)。
1.3 实验方法
1.3.1实验分组:实验分为5组,60只Sprague-Dawley大鼠被随机分为Control组(假手术,12只)和OVX组(卵巢切除术,48只)两组。OVX组行双侧卵巢切除术,Control组行假手术。OVX组实验大鼠再为4组:OVX+vehicle组、OVX+Nec-1组、OVX+Z-VAD组、OVX+E2组,每组12只。
1.3.2实验模型的建立及药物干预方法:大鼠适应性饲养7 d后,分别行双侧卵巢切除术或假手术[7]。从术后4 w开始,所有实验大鼠均通过腹腔注射给药,每日一次,连续给药4 w。OVX+vehicle组大鼠按1 000 μL/(kg·d)给予腹腔注射10% DMSO液;OVX+Nec-1组大鼠按1.65 mg/(kg·d)[8]给予腹腔注射Nec-1;OVX+Z-VAD组按1.0 mg/(kg·d)[9]腹腔注射Z-VAD;OVX+E2组按10μg/(kg·d)[8]腹腔注射E2[10]。Control组按1 000 μL/(kg·d)给予腹腔注射10%的DMSO液。
1.3.3标本的收集与处理:因笔者前期实验已证实大鼠骨细胞发生程序性坏死的高峰在OVX术后8 w[3],故本实验选取术后8 w处死各组大鼠。锐性剔除胫骨近端骨表面的软组织,髓腔用0.9%的生理盐水灌洗。左侧标本立即投入液氮保存,用于Western blot检测蛋白表达;右侧每组6例标本用电锯切割胫骨近端,固定于2.5%的戊二醛磷酸盐缓冲液中用于透射电镜扫描。剩余右侧6例标本固定于4%的多聚甲醛,用于Micro-CT扫描分析骨组织微结构变化,扫描完成后标本应用15%的EDTA脱钙液脱钙4 w,制作石蜡标本用于免疫组化检测。
1.3.4血清E2的测定:所有实验大鼠在行OVX手术或sham手术时和实验结束时行尾静脉穿刺采血,普通生化采血管收集静脉血,室温静置血清样本完全凝聚,3000 rpm离心10 min,吸取上清500 μL,于海南医学院学第一附属医院检验科使用Access Estradiol试剂盒在UniCel Dxi 800 Access仪进行E2的检测。
1.3.5Micro-CT扫描骨组织微结构形态:收集标本固定在4%的多聚甲醛,24 h内扫描骨组织微结构。将股骨近端放入CT扫描仪(SCANCO Medical AG 瑞士)的专用杯罩中,设置扫描参数:15 μm分辨率,70 kVp,114 μA和 250 ms 扫描速度[11]。扫描完成后保存数据,3D重建骨组织微结构,输出参数有骨密度(bone mineral density,BMD)、骨体积分数(bone volume fraction,BV/TV)、骨小梁厚度(trabecular thickness,Tb.Th)、骨小梁数目(trabecular number,Tb.N)、骨小梁间距(trabecular separation,Tb.Sp),分析阈值为245[12]。
1.3.6投射电镜观察骨细胞形态变化:电镜标本脱钙后,将骨组织修剪为1 mm3大小的组织块,送检于重庆医科大学电镜室制作电镜标本。2%的锇酸(PH为7.4)常温下固定4 h;在4 ℃下,经50%、70%、80%、90%的乙醇梯度脱水(各20 min),转入90%丙酮20 min,再转入常温下100%的丙酮(20 min×3次)。然后包埋于环氧树脂包埋剂中,放置在60 ℃恒温箱中加热48 h,聚合硬化后形成包埋块。应用超微切片机将标本切成50 nm超薄切片,放置在涂有formvar-coated的铜网格上晾干。最后用3%的醋酸铀和柠檬酸铅染色,于透射电镜下观察骨细胞超微结构。
1.3.7免疫组化染色检测TNF-α、RIP1、RIP3在骨组织中的表达:采用Envision免疫组化染色法检测TNF-α、RIP1、RIP3在骨细胞的表达情况。石蜡切片常规脱蜡至水,骨组织抗原修复液100 μL覆盖组织,放置于37 ℃恒温箱中孵育30 min,山羊血清封闭液100 μL,室温孵育10 min;在组织上滴入50 μL左右的一抗,在4 ℃冰箱中孵育过夜(一抗稀释比例为TNF-α 1∶100,RIP1 1∶200,RIP3 1∶100),按试剂盒说明书依次滴加试剂1Polymer Helper和试剂2 poly-HRP anti-Rabbit IgG 或 poly-HRP anti-Mouse IgG,DAB显色。在光学显微镜下以细胞浆中出现棕黄色为TNF-α或RIP1或RIP3阳性。采用Leica DM6000 B全自动数码成像及分析系统检测TNF-α、RIP1和RIP3蛋白表达情况,每个样本随机选6个视野计算阳性细胞百分数,进行统计分析。
1.3.8Western blot检测MLKL、Drp1蛋白的表达:从液氮中取出骨组织标本约200 mg投入研钵,加入液氮充分研磨成粉末状,加入 RIPA裂解液/PMSF混合液,使蛋白充分裂解,提取骨组织总蛋白。测定蛋白浓度,并配平;凝胶电泳分离蛋白质,转膜,5%BSA-TBST室温封闭;加一抗:RIP1、 RIP3、TNF-α、MLKL、Drp1 (稀释比例均为1∶000),β-actin(1∶2000), 4 ℃过夜;加入二抗37 ℃孵育1 h;TBST洗膜,ECL发光显色。以β-actin作为内参,采用vilber fusion fx7分析软件进行定量分析。
1.4 统计学分析
2 结果
2.1 OVX大鼠雌激素缺乏致大鼠股骨近端骨量丢失
E2的检测结果如图1。在OVX+vehicle组、OVX+Nec-1组、OVX+Z-VAD组,OVX术后8 w E2较术前明显降低 (P<0.01),而在Control和OVX+E2组术后8 w的 E2与术前比较差异无统计学意义。OVX+E2组术后8 w大鼠E2水平较OVX+vehicle组明显升高 (P<0.01)。
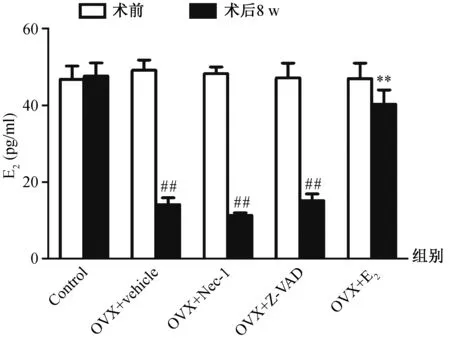
图1 各组血清E2变化注:与术前比较,##P<0.01;与术后OVX + vehicle组比较,**P<0.01。Fig.1 Changes of serum E2 in each groupNote: ##P<0.01 vs preoperative in each group; **P<0.01 vs the OVX + vehicle group after OVX.
Micro-CT扫描胫骨近端,3D重建骨组织微结构分析BV/TV、Tb.Th、Tb.N、Tb.Sp和骨密度,结果见图2、3。与Control组比较,OVX+vehicle组BV/TV、Tb.Th、Tb.N明显降低(P<0.01),而Tb.Sp显著增大(P<0.01),胫骨近端骨组织呈明显退变状态。与OVX+vehicle组比较,应用Nec-1或Z-VAD或E2治疗OVX大鼠均能有效减轻骨组织的微结构退变。与Control组比较,OVX+vehicle组BMD明显降低(P<0.01);OVX+Nec-1组和OVX+E2组的BMD比OVX+vehicle组增高(P<0.05),而OVX+Z-VAD组与OVX+vehicle组的BMD相比差异无统计学意义。
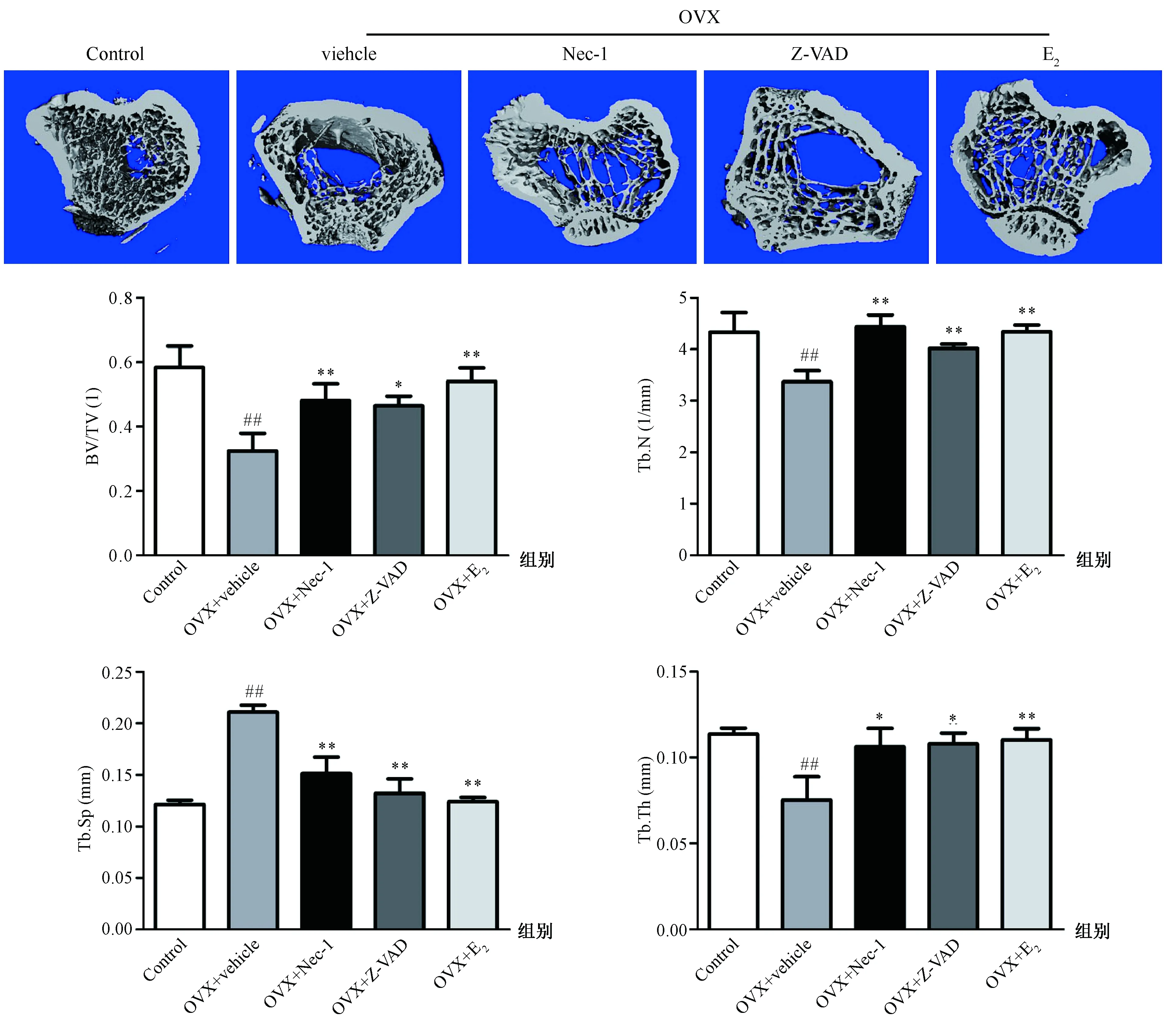
图2 雌激素缺乏对去卵巢大鼠胫骨近端微结构的影响注:与对照组比较,##P<0.01;与OVX+vehicle组比较,**P<0.01Fig.2 The effect of estrogen deficiency on bone microstructure in the proximal tibia of OVX ratsNote: ## P<0.01 vs the control group; **P<0.01 vs the OVX + vehicle group.
2.2 雌激素缺乏通过上调TNF-α促发骨细胞发生程序性坏死
免疫组化检测程序性坏死的关键信号分子RIP1和RIP3及TNF-α蛋白在胫骨近端骨细胞表达情况见图4,结果显示RIP1、RIP3及TNF-α蛋白在骨细胞均有表达,主要表达在骨细胞的胞浆。计算各个蛋白阳性细胞的百分率进行统计学分析显示,与Control组比较,OVX+vehicle组RIP1、RIP3及TNF-α阳性细胞的百分率显著增高(P<0.01);Nec-1治疗后明显降低RIP1和RIP3阳性细胞的百分率(P<0.01),而对 TNF-α蛋白表达无影响; Z-VAD治疗后对 RIP3和RIP1蛋白表达无影响;OVX+E2组的TNF-α、RIP1、RIP3阳性细胞的百分率(P<0.01)较OVX+vehicle组明显降低(P<0.01)。
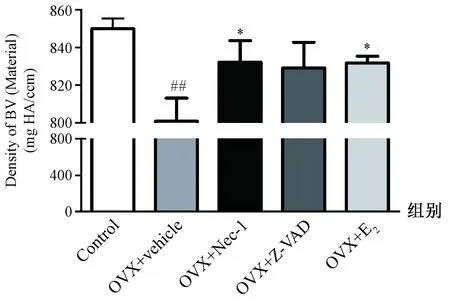
图3 雌激素缺乏对去卵巢大鼠胫骨近端骨密度的影响注:与对照组比较,##P<0.01;与OVX+vehicle组比较,*P<0.05。Fig.3 The effect of estrogen deficiency on bone mineral density in the proximal tibia of OVX ratsNote: ##P<0.01 vs the control group; *P<0.05 vs the OVX + vehicle group.
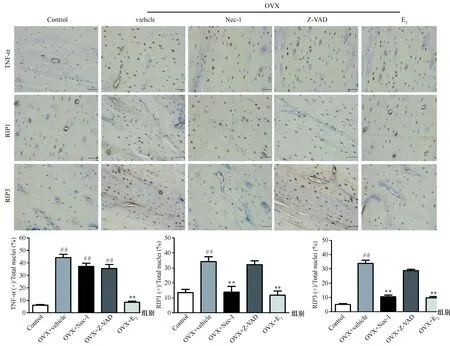
图4 雌激素缺乏对去卵巢大鼠骨细胞TNF-α、RIP1、RIP3 蛋白表达的影响(标尺25 μm)注:与对照组比较,##P<0.01;与OVX+vehicle组比较,**P<0.01。Fig.4 Effect of estrogen deficiency on the expression of TNF-α, RIP-1, and RIP-3 in osteocytes of OVX rats (Scale bar represents 25 μm)Note:## P<0.01 vs the control group; **P<0.01 vs the OVX + vehicle group.
电镜下观察骨组织发现,在OVX+vehicle组可见有骨细胞呈典型坏死形态特征,细胞器肿胀,细胞膜破裂,胞浆内容物外溢,见图5。在Control组和OVX+E2组骨细胞的结构正常,OVX+Z-VAD和OVX+Nec-1组仅可见到轻度肿胀和正常的骨细胞。
2.3 雌激素缺乏对程序性坏死下游信号分子MLKL、Drp1表达的影响
Western blot检测程序性坏死的下游信号分子MLKL和Drp1蛋白表达,结果显示,与Control组相比,OVX+vehicle组的MLKL和Drp1蛋白表达明显增高(P<0.01);Nec-1或E2均能有效抑制MLKL和Drp1蛋白表达(P<0.01);而Z-VAD对MLKL和Drp1蛋白表达无影响,见图6。
3 讨论
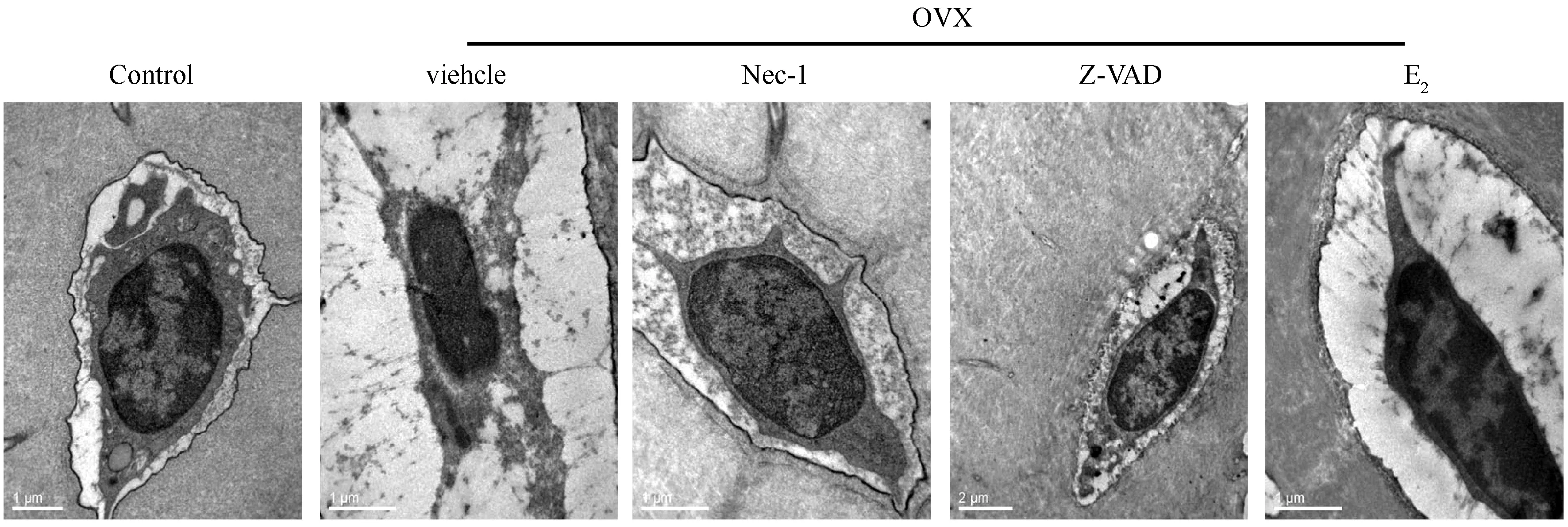
图5 透射电镜观察各组骨细胞形态学变化(标尺为1 μm)Fig.5 The morphological change of osteocytes visualized with TEM (Scale bar represents 1 μm)
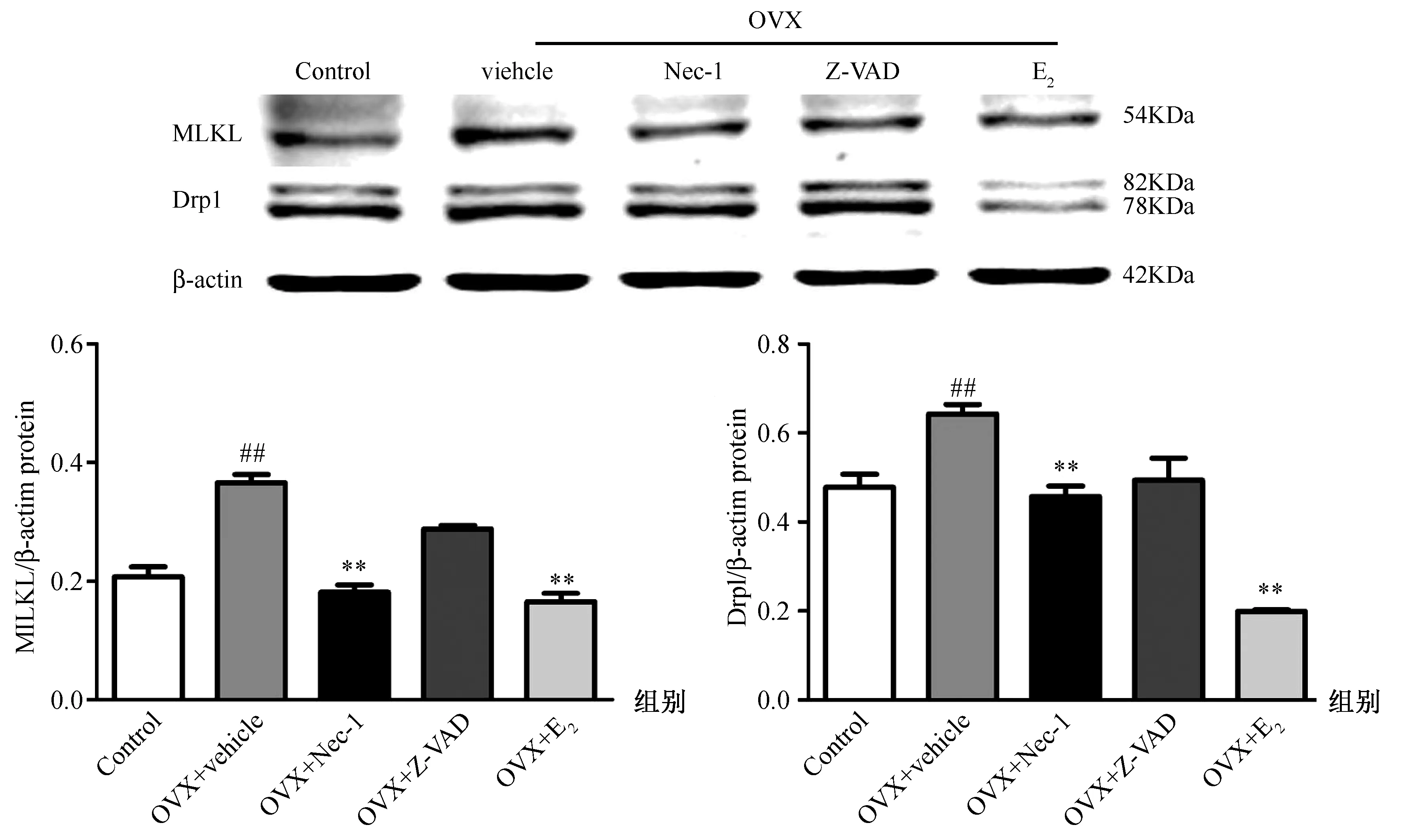
图6 Western blot分析各组骨细胞MLKL、Drp1蛋白的表达注:与对照组比较,##P<0.01;与OVX+vehicle组比较,**P<0.01Fig.6 The expressions of MLKL and Drp1 were detected using Western blottingNote: ## P<0.01 vs the control group; **P<0.01 vs the OVX + vehicle group.
PMOP是由于雌激素缺乏导致的骨量降低及骨小梁微结构退变的代谢性骨骼病变。骨细胞过度死亡在PMOP的发病过程中起着重要作用,骨细胞的大量死亡破坏了骨细胞-小管结构体系,影响了骨陷窝-小管系统里液体流动的改变,阻碍了骨组织重建的信息传递,结果形成了不可修复的骨缺损[13]。
以往研究认为,骨细胞凋亡是PMOP发病过程中骨细胞死亡的主要方式[14],而笔者前期的研究发现,OVX大鼠PMOP模型中大量骨细胞发生了程序性坏死[3]。为探讨雌激素缺乏导致骨细胞发生程序性坏死的机制,本研究应用大鼠OVX模型成功模拟了PMOP的发病过程,并首次探讨了OVX大鼠术后TNF-α变化与骨细胞程序性坏死的关系。
程序性坏死是一种caspase非依赖的、可以被调控的细胞程序性死亡方式,它可以被TNF-α、toll样受体、氧化应激等因素促发[15-16]。程序性坏死的细胞具有坏死的形态学特征[17],且可以被Nec-1特异性抑制,而不受凋亡抑制剂如Z-VAD 的影响[15]。虽然细胞程序性坏死的确切机制还未完全清楚,但是RIP1和RIP3在细胞程序性坏死的发生过程中起着关键作用[18-19],RIP1去泛素化后招募RIP3磷酸化,促使程序性坏死小体的形成[16]。本实验OVX+vehicle组中,研究发现了大量的典型坏死骨细胞,而且RIP1和RIP3阳性细胞百分率明显高于Control组;应用Nec-1或E2治疗OVX大鼠后,RIP1阳性率明显下降,骨组织中看不到坏死样的骨细胞,而Z-VAD治疗OVX大鼠后骨细胞无此变化,这些结果与程序性坏死的特征一致[15-17]。这说明由于缺乏E2,OVX大鼠骨细胞发生了程序性坏死。另外,研究还发现,OVX+vehicle组的TNF-α阳性细胞百分率明显高于Control组,而应用E2治疗后,TNF-α的阳性率明显下降,这与RIP1的变化趋势一致。由此可推测,骨细胞程序性坏死可能与骨细胞TNF-α的高表达相关,其机制有待进一步研究证实。
研究已证实RIP1和RIP3能相互磷酸化与MLKL,共同形成程序性坏死小体 “necrosome”,启动程序性坏死[16]。MLKL能把程序性坏死小体“necrosome”的死亡信号传递给线粒体,使线粒体发生功能障碍导致细胞发生程序性坏死[20]。线粒体分裂调节蛋白Drp1已被证实参与调节大多数的细胞死亡过程,如Bras等[21]研究发现,慢性淋巴细胞白血病B细胞接受刺激后引起丝氨酸蛋白酶活化,促使Drp1转位到线粒体,使线粒体分裂,导致细胞发生程序性死亡。本研究发现OVX+vehicle组MLKL和 Drp1蛋白水平显著增高,而应用Nec-1或E2治疗OVX大鼠后,MLKL和Drp1蛋白水平下降。这与文献[20-21]报道一致, MLKL和Drp1可能作为程序性坏死小体“necrosome”的下游信号分子参与了骨细胞程序性坏死的发生。然而在细胞执行程序性坏死过程中,Drp1的作用存在争议,Moujalled等[22]研究证实,Drp1并非是程序性坏死信号通路的关键因素。因此对于程序性坏死下游信号分子通路的确切调节机制有待于进一步深入研究。
综上所述,在OVX大鼠PMOP模型中,骨细胞发生程序性坏死可能是由雌激素缺乏上调TNF-α的表达所促发,MLKL和Drp1可能是骨细胞发生程序性坏死的关键下游信号分子。
