骨膜联合骨髓间充质干细胞/乳酸乙醇酸共聚物修复兔大段尺骨缺损的研究
2017-08-06张欣陶周善徐祝军谢加兵
张欣 陶周善 徐祝军 谢加兵
皖南医学院弋矶山医院创伤骨科,安徽 芜湖 241001
骨组织尽管拥有较好的自身修复能力,但是较大的骨缺损很难通过骨组织自身的能力完成修复,目前这类骨缺损的修复是临床的难点及研究的热点之一[1]。自体移植物在骨缺损修复中有许多优点,尽管是骨缺损修复的“金标准”,但是需要额外的手术时间,供体部位的并发症和有限的骨组织限制其优势[2-4]。同时,同种异体的移植可能会增加感染的风险。近年来,随着组织工程的进一步发展,人工材料修复骨缺损成为一种可供选择的新思路。在大量不断出现的各类新的组织工程支架中,聚乳酸-共-乙醇酸(poly lactic-co-glycolic acid,PLGA)是一个美国食品和药物管理局批准的具有良好生物降解性和生物相容性的骨材料[5],可以通过正常人体代谢途径降解,对细胞和组织是安全的[6]。骨髓间充质干细胞(mesenchymal stem cells,MSCs)是多能细胞,它可以被诱导分化成成骨细胞、软骨细胞、脂肪细胞等[7],它与生物支架复合已被证明可以明显改善支架的整体骨传导功能[8-9]。此外,骨和软骨的生长、发育和再生依赖于骨膜,其中骨膜的成骨细胞和软骨细胞,可通过膜内成骨的方式促进体内新骨形成[10]。鉴于此,笔者假设MSC、骨膜及PLGA有较好的成骨能力,联合使用可以充分发挥种子细胞、组织支架及骨膜各自的优势,因此,笔者研究MSCs/PLGA /骨膜对激素诱导的骨质疏松兔尺骨骨缺损修复的能力。
1 材料和方法
1.1 PLGA支架的制备
使用致孔剂浸出法制作多孔PLGA支架(丙交酯乙交酯的摩尔比50∶50,分子量75000)[11],使用明胶微粒作为致孔剂。将同样份量的PLGA和明胶加入锥形瓶,混合均匀,在搅拌状态下经过水蒸汽处理搅拌均匀后,立即置于液氮中冷冻。完全凝固后,转至-20 ℃的真空干燥器中,真空泵抽干、泡糖、干燥,裁成5 mm直径、厚1 mm、重3 mg的圆形支架,消毒保存备用。
1.2 从兔骨髓提取MSC和培养
从兔骨髓来源间充质干细胞,它的分离和培养的方法是按照以前文献报道的[12]。简言之,骨髓间充质干细胞来自抽吸的骨髓,给予梯度离心分离,并接种到含有低葡萄糖DMEM(Gibco)的培养瓶中,培养基中含有10%的胎牛血清(Gibco)和1%的抗生素(100 U/mL青霉素和100U/mL链霉素)。培养48 h后,除去培养基,更换新鲜培养基。细胞保持在37 ℃下在含有5%CO2的湿度适宜的培养箱中,每两天更换一次培养基。当生长达到80%~90%汇合时,贴壁细胞,用0.25%的胰蛋白酶-EDTA(乙二胺四乙酸;Gibco)从培养瓶壁上分离下来,并再按1∶3的比例接种在前述的生长培养基中,以允许其继续生长。第3代的骨髓间充质干细胞用于实验,同种异体骨髓间充质干细胞用于在体内植入动物实验。
1.3 细胞接种
PLGA支架通过浸渍到70%的乙醇中进行灭菌,然后用磷酸盐缓冲盐水漂洗几次。MSC悬浮液的密度为1×107cells/cm3,通过滴加体外培养扩增的骨髓间充质干细胞悬液50 μL接种到3D双层支架PLGA上。然后在细胞培养箱中(37 ℃下5%的CO2的湿润空气中)培养2 h,以便使细胞附着在支架材料上。复合支架放置在含有2 mL的新鲜培养基的35 mm的培养皿中,并静置在细胞培养箱中过夜,以备用于动物实验用。
1.4 动物及手术过程
20只健康的雄性体重2.5~3.0 kg新西兰白兔随机分成4组:PLGA组、PLGA/骨膜组、MSCs/PLGA组和MSCs/PLGA/骨膜组,用于制作双侧尺骨缺损模型。通过静脉注射3%的戊巴比妥钠(30 mg/kg)对实验动物进行麻醉,麻醉完成后,常规消毒铺巾,在双侧尺骨远端后外侧作3 cm纵行切口。钝性分离肌肉及其他的软组织并暴露骨组织。尺骨缺损的长度为1.5 cm,使用高速锯下用生理盐水冲洗的截骨方法,从截下的尺骨上完整剥离骨膜。随后PLGA组、PLGA/骨膜组、MSCs/PLGA组和MSCs/PLGA/骨膜组分别在缺损区植入PLGA、PLGA/骨膜、MSCs/PLGA及MSCs/PLGA /骨膜。手术完成后认真止血,逐层缝合肌肉皮肤组织。在术中、术后第一天,对每只兔子给予40万U青霉素肌注,以防止感染,同时所有兔子肌肉注射地塞米松,3 mg/kg,每周2次,连续12 w。在6 w和12 w两个时间段,各取一半标本,手术组(n=5)并用10%的多聚甲醛固定标本。
1.5 大体观察
观察动物术后的活动、食物摄入量和伤口愈合情况。处死动物后,通过对标本的观察,查看骨修复和骨痂组织的生长状态。
1.6 影像学检查
对术后6 w和12 w两个时间点的兔子前肢标本进行串行X线透视检测。X光片的结果由3位熟悉骨形成,联合和重塑评价技术的实验人员进行单盲评估,使用骨移植评分系统进行评估[2]。来确定在术后6 w和12 w的治疗效果,同时使用微观视角2.2软件(GE Healthcare)对数字化的数据进行分析,对新形成的骨量体积和缺损的总体积均进行评价。
1.7 组织学观察和组织形态学分析
影像学研究结束后,所有标本用10%的中性缓冲福尔马林溶液固定72 h,EDTA溶液脱钙,期间用大头针轻戳标本,至针头可轻松刺入标本中提示脱钙完成,脱钙时间约4 w,脱钙完成后经过脱水、石蜡包埋,包埋完成后以4 μm厚度连续切片,所得切片行苏木素-伊红染色(HE染色),观察各组材料与缺损修复情况,使用图像分析软件Image-Pro Plus进行图像分析,缺损的修复程度通过计算每个植入物内骨组织面积的百分比来表示。
1.8 统计分析
应用SPSS19.0统计软件分析,数据用均数±标准差表示,各组资料采用One-way ANOVA方差分析进行检验,如果差异有统计学意义,若方差齐用LSD检验、方差不齐用Dunnett T3检验作两两比较。P<0.05认为差异有统计学意义。
2 结果
2.1 大体观察
整个实验过程中,所有实验兔子饮食和行为正常,都存活了下来,并且没有明显的并发症,如切口感染或皮肤坏死等。术后6 w时,各组缺损区可见部分骨组织形成,其中以MSCs /PLGA/骨膜组缺损修复最佳;术后12 w时,各组缺损进一步被修复,其中PLGA组仍然可见大部分缺损存在,而其他组修复效果明显优于PLGA组。研究发现MSCs/PLGA/骨膜组大部分缺损已经被修复,具体修复情况如图1所示。
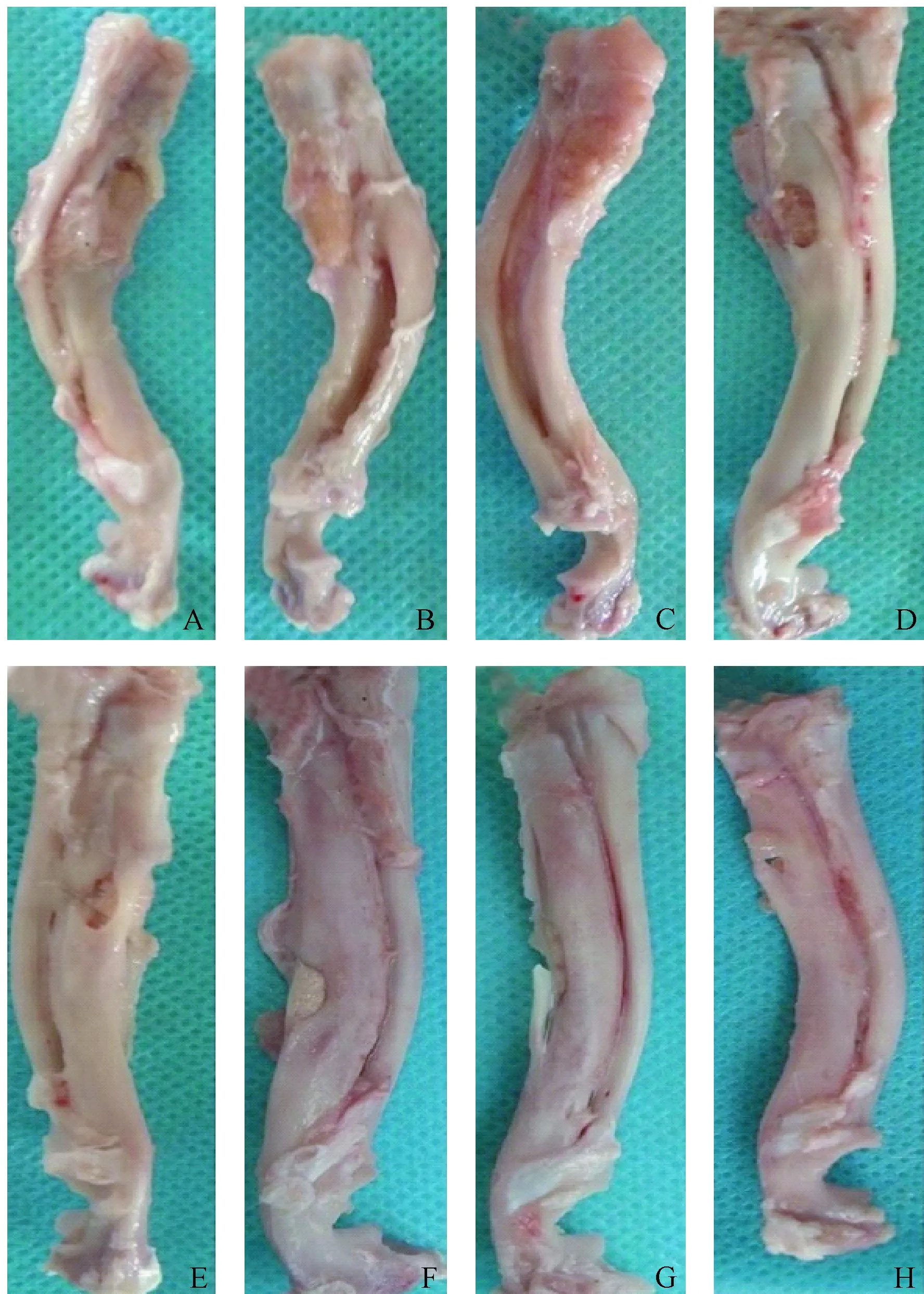
图1 大体观察术后6 w(A~D)和12 w(E~H)的兔尺骨缺损。A、E:PLGA组;B、F:PLGA /MSCs组;C、G:PLGA/骨膜组;D、H:PLGA /MSCs/骨膜组Fig.1 Gross observation of rabbit ulnar defects at 6 w (A—D) and 12 w (E—H) after surgery. A, E: PLGA group; B, F: PLGA/MSCs group; C, G: PLGA/periosteum group; D, H: PLGA/MSCs/periosteum group
2.2 影像学分析
术后6 w,PLGA组在靠近桡骨的缺损部位只有少量的骨组织形成(图2A),而PLGA/MSCs组和PLGA/骨膜组,在缺损两端及桡侧周围可见骨组织形成(图2B、2C),PLGA/MSCs/骨膜组骨缺损周围有大量的骨和骨样组织形成(图2D)。术后12 w时,PLGA组的缺损充满了骨组织(图2E),而PLGA/MSCs组和PLGA/骨膜组(图2F、2G)中有一半以上的缺损部位由骨组织填充;PLGA/MSCs/骨膜组(图2H)中缺损几乎全部由骨组织填充,并达到骨性愈合和骨重建。放射线评分结果分别见图2I、2J。PLGA/MSCs/骨膜组在术后6 w和12 w评分均最高(P<0.05)。PLGA/MSCs组和PLGA/骨膜组的得分显著高于PLGA组,差异有统计学意义(P<0.05)。PLGA /MSCs组和PLGA/骨膜组的X线评分差异无统计学意义(P>0.05),但是均高于PLGA组,且差异有统计学意义(P<0.05)。

图2 在术后6 w(A~D)和12 w(E~H)的放射学分析和各组的Lane-Sand hu X射线评分(I:6 w,J:12 w)。A、E:PLGA组;B、F:PLGA/MSCs组;C、G:PLGA/骨膜组;D、H:PLGA /MSCs/骨膜组。结果以平均值±标准差表示。#:与其他组相比,P<0.05;*:与 PLGA组相比,P<0.05Fig.2 Radiological analysis of postoperative 6 w (A to D) and 12 w (E to H) and Lane-Sand hu X ray score (I: 6w; J: 12w) in each group. A, E: PLGA group; B, F: PLGA/MSCs group; C, G: PLGA/periosteum group; D, H: PLGA/MSCs/ periosteum group. The results are expressed with mean±stand ard deviation. #P<0.05, compare to other groups; *P<0.05, compared to PLGA group
2.3 组织学分析
术后6 w时,PLGA组可以观测到少量新骨形成,大部分的缺损都由纤维组织和残留的支架填充(图3A),PLGA/MSCs组可见部分分散的编织骨形成(图3B),PLGA/骨膜组在近桡骨侧可以看到丰富的编织骨形成,并出现骨髓腔(图3C),PLGA/MSCs/骨膜组的整个缺损中可以见到编织骨的量进一步增加,且更致密,骨髓腔形成(图3D)。术后12 w时,所有原尺骨两端均由新再生的骨连接,原PLGA支架大部分已经降低。PLGA组外部区域可见部分新生骨形成(图3E)。PLGA/MSCs组和PLGA/骨膜组骨缺损的中心区可以观测到皮质骨形成,然而周围仍是疏松的编织骨(图3F、3G)填充;PLGA/MSCs/骨膜组缺损的两端可以观察到皮质骨,而骨髓腔填充有丰富的编织骨(图3H)。

图3 术后6 w、12 w时骨缺损部位再生的修复骨组织的组织学检测(b:骨组织;s:残余支架材料;m:骨髓;箭头:软骨细胞,HE×20)Fig.3 Histological examination of the repaired bone tissue after bone defect regeneration at 6w and 12 w (B: bone tissue; S: residual scaffold material; M: bone marrow; yellow arrow: cartilage cell, HE×20)
2.4 组织形态计量学分析
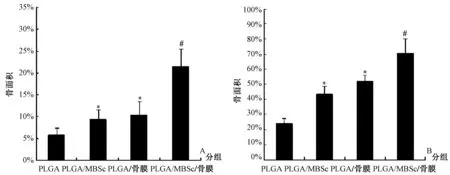
图4 在6 w和12 w后新形成的骨量用新生骨面积与原始骨缺损面积的百分比表示(柱状图表示平均值±SD)。#:与其他组相比,P<0.05;*:与PLGA组相比,P<0.05Fig.4 After 6 w and 12 w, the newly formed bone mass is expressed by the percentage of the new bone area and the area of the original bone defect area (histogram, mean±SD). #P<0.05, compare to other groups; *P<0.05, compared to PLGA group
术后6 w,在PLGA组中新骨形成的部分为(6.6±1.5)%,PLGA/MSCs组中为(9.4±1.1)%,PLGA/骨膜组中为(11.6±3.3)%,均显著低于PLGA/MSCs/骨膜组(23.5±2.7)%(图4A)(P<0.05)。术后12 w,PLGA/MSCs/骨膜组的新骨形成面积增加至(74.3±9.7)%,显著高于PLGA组(24.7±3.1)%、PLGA/MSCs组(45.3±5.1)%和PLGA/骨膜组(51.1±4.6)%(图4B)(P<0.05)。研究发现在PLGA/MSCs组和PLGA/骨膜组之间新形成骨量差异无统计学意义(P>0.05),而两组均明显优于PLGA组(P<0.05)。
3 讨论
本研究通过制作尺骨缺损,植入PLGA、PLGA/MSCs、PLGA/骨膜及PLGA /MSCs/骨膜,实验结果通过大体、X线及HE评估,表明通过在缺损部位植入多孔PLGA 结合MSCs联合包裹自体骨膜的方法,可以快速修复兔的尺骨节段性骨缺损。同时发现骨膜联合骨髓间充质干细胞的再生效果优于单纯的骨髓间充质干细胞。
MSCs是多能细胞,其分化成骨源性的成骨细胞的能力是众所周知的。已有报告显示MSCs有很强的诱导血管生成作用,它们通过旁分泌作用来吸引宿主来源的血管内皮细胞聚集,同时诱导新血管的形成增强了成骨细胞的浸润,进而推动其随后的矿化和骨形成[13-14]。因此,PLGA/MSCs组比PLGA组新生更多的骨体积和更好的骨质量,这与先前的研究一致[14]。有趣的是,在PLGA/MSCs中骨缺损的中心由骨组织填充,而外部区域由纤维组织包裹。这种结果的原因可能是,骨髓间充质干细胞主要附着在植入物的内侧,而移植物的外侧主要缺乏骨髓间充质干细胞和其他成骨诱导物,如骨膜。
骨膜由含有间充质干细胞的成骨层、含有成纤维细胞和内皮细胞的纤维血管中间层、和含胶原的外层组成,这些层可以促进成骨和血管化。此外,这些层中包含一个胶原基质层,这对骨移植的成功是至关重要的。以往的研究表明,带血管蒂的骨膜瓣在合成支架材料上能够诱导骨生长[15-16]。骨膜皮瓣也已表明,能够促进人类同种异体移植物和自体骨之间骨不连的修复[17]。此外,骨膜可用于刺激和提高在腱-骨界面的愈合[18],也用于软骨再生[19]。因此,在本研究中,PLGA/骨膜组的新生骨组织的量明显大于PLGA组。另外,其外部的缺损区域由骨组织再生填充。MSCs可能是通过软骨内和膜内成骨形成为广大的愈合,并直接诱导血管生成,使移植物血管化[20]。因此,骨膜促进新骨形成和再生的作用是通过提供间充质干细胞的来源,和通过促进血管的生长和再生。
在本研究中,MSCs和骨膜的组合显著增加了骨形成和产生了较大体积的骨组织。在PLGA/MSCs/骨膜组大部分达到了骨性愈合和骨重建。在先前的研究中,结合脂肪干细胞、rhBMP-2和骨膜,连同结构性硬骨移植物,产生了大量的有良好血供的新骨[21]。这样的研究结果表明,为种植MSCs的合成材料准备骨膜移植物的重要性。接种的细胞可以在体内植入的早期阶段存活,由于这样的事实,膜状的构造将通过体液扩散的方式提供营养物质以维持细胞的活力[22]。如果可用,骨膜将用作移植物或保存在植入部位,以提高移植物的血管化和成骨。PLGA组修复效果较差主要是由于缺乏成骨和移植物血管化较少。但是,获取自体骨膜会造成供区并发症,骨膜替代物为合成材料和同种异体移植物较差的血管化提供了可供选择的解决途径。同种异体移植物和合成材料可以作为骨膜替代物,从而有益于改善其血管化[23]。已有研究结果证明MSCs薄片都表达血管源性和成骨细胞的基因,增强了骨愈合[24]。
总之,本研究表明,植入复合有MSCs的PLGA和骨膜对节段性骨缺损的骨再生修复有协同效应,并强调骨膜在此过程中发挥的关键作用。制作的骨膜替代物对骨组织工程的成功是非常重要的。使用骨膜包被PLGA/MSCs的复合材料可以明显促进兔尺骨骨缺损的修复,在骨组织工程中具有广阔的应用前景。
