静水压力对蒽和多环芳烃二元混合物三维荧光光谱的影响
2017-08-02孙志娟蔡晨鑫蒋春跃
孙志娟, 蔡晨鑫, 王 杰, 蒋春跃*
(1. 浙江工业大学 海洋学院, 浙江 杭州 310014; 2. 浙江工业大学 化学工程学院, 浙江 杭州 310014)
静水压力对蒽和多环芳烃二元混合物三维荧光光谱的影响
孙志娟1, 蔡晨鑫2, 王 杰2, 蒋春跃2*
(1. 浙江工业大学 海洋学院, 浙江 杭州 310014; 2. 浙江工业大学 化学工程学院, 浙江 杭州 310014)
利用荧光分光光度计对处于常温、压力范围为0.1~60 MPa、浓度为10-6mol·L-1的蒽的三维荧光光谱及浓度比为1∶1的蒽-芴、蒽-萘、蒽-菲、蒽-苊、蒽-荧蒽的三维荧光光谱进行了测定,并通过分析不同压力下蒽的荧光峰位置和峰强度的变化来探讨压力对荧光光谱的影响。结果显示,随着压力升高,蒽的荧光峰并未发生漂移,但是荧光强度发生了显著变化。峰位置为250/382 nm的荧光峰在60 MPa时荧光强度达到最大值,相较于常压下,荧光强度增加了13.6%。其他多环芳烃的加入会改变蒽的高压荧光特性,当蒽中加入了萘,峰位置为250/382 nm的荧光峰强度在10 MPa时达到最大值,相较于常压下,荧光强度增加了9.35%。
三维荧光光谱; 激发发射矩阵; 静水压力; 多环芳烃
1 引 言
荧光光谱技术以其独特的优势(高灵敏度、高效、低价)已成为检测领域的一种有效的检测方法。近几年来,一种新型的名为三维荧光光谱(Three-dimensional fluorescence spectra,3DFS)的检测方法取得了巨大的发展。区别于传统的二维荧光检测技术,3DFS能够同时测定荧光强度随着激发波长和发射波长的变化,因此,在一次3DFS检测中,能够得到一个被测物质的完整荧光光谱,这对物质的分析具有十分重要的意义,使得复杂荧光物质的分析成为了可能。基于这个原因,3DFS在许多研究领域得到了应用,例如环境污染物的检测[1-2]、多组分荧光物质的定量检测[1-3]、生物分析[3]等。
由于多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)及其衍生物具有较高的荧光量子产率,因此经常被用于研究电子激发态的弛豫。研究表明,PAHs具有高荧光量子产率是因为PAHs分子中含有较大的共轭π电子体系,较大的共轭π电子体系使得PAHs更易从基态跃迁到激发态。近几十年来,研究人员系统地研究了环境因子对PAHs的发光机理的影响,这方面的研究主要集中在研究温度、溶剂、粘度、极性、折射率等因素对荧光光谱的影响。与此同时,由于压力会对溶剂的粘度、极性及折射率产生影响,并且这些溶剂的物理性质随着压力的升高连续性变化,因此,在不改变溶剂种类的前提下,改变压力是一种常用的改变溶剂性质的方法[4]。Tanaka[5-6]研究了在常温下不同溶剂中,压力对蒽及其衍生物的荧光量子产率的影响,他提出溶剂和压力对系间窜越速率的影响可以用第一激发单重态和第二激发三重态之间的能垒(S1-T2)随着溶剂和压力的改变而变化来解释。但是,由于该实验的研究方法局限于传统的二维荧光检测技术,完整的三维荧光光谱变化无法得到。同时,该实验也未探究压力对混合物质3DFS的影响。
在本实验中,三维荧光光谱技术被用于测定拥有不同芳香环数目或具有不同芳香环排列结构的多环芳烃在常压下的3DFS,同时还测定了纯蒽、蒽与其他5种PAHs混合时在不同压力下的3DFS,通过分析不同实验条件下的实验结果,推测在不同的静水压力下蒽的荧光机理,并推测其他PAHs的存在对蒽发光机理的影响。
2 实 验
萘、荧蒽、苊、菲、蒽、芴(分析纯,麦克林)分别溶解于50%(质量分数) 的乙醇-水中,得到6种溶度为1×10-4mol·L-1的PAHs储存液,并将其保存于阴凉处。使用50%乙醇-水溶液,将6种储存液稀释到浓度为10-6mol·L-1的工作液,所有的工作液静置12 h后再进行荧光检测。另外,本实验所需的混合样是由浓度同为10-6mol·L-1的蒽和另外一种PAHs混合制备而成。实验所需的高压设备由浙江大学提供[7],该高压在线检测装置主要由一个高压泵和钛合金高压比色皿组成(压力设计范围为0.1~60 MPa)。另外,50%乙醇-水溶液同时也充当压力的传导介质。
本实验3DFS是由一系列二维发射光谱组合而成,发射光谱由F-2500荧光分光光度计(Hitachi,日本)扫描得到,得到一个完整的3DFS所需的扫描时间小于10 min。荧光分光光度计参数设置如下:光栅(左:10 nm,右:10 nm);PMT电压400 V;扫描速度为3 000 nm·min-1;发射波长220~600 nm;6种PAHs的激发波长相互有所区别:230~320 nm(萘),220~380 nm(荧蒽),220~330 nm(苊),220~390 nm(蒽),220~330 nm(芴)。3DFS中的散射峰用背景扣除法消除。为了衡量压力变化对蒽荧光强度的影响,引入了相对荧光效率,相对荧光效率表示为IP/I(0.1 MPa),其中IP代表蒽的荧光峰在不同静水压力下的荧光强度,I(0.1 MPa)代表蒽的荧光峰在0.1 MPa 时的荧光强度。
3 结果与讨论
3.1 常压下PAHs的3DFS
图1为蒽、芴、萘、菲、苊、荧蒽的3DFS。如图所示,各个PAHs的三维荧光光谱的特征峰的数量和荧光峰出现的位置各不相同,与文献对比,发现和文献中的结果基本吻合[8-12]。荧光峰的数量从2个到12个不等,其中萘的荧光峰数量最少,蒽的荧光特征峰数量最多。另外,萘的激发波长最小(λEx/λEm=225/330 nm);蒽的激发波长最大(λEx/λEm=380/425 nm);芴的发射波长最小(λEx/λEm=225/310 nm),荧蒽的发射波长最大(λEx/λEm=350/465 nm)。蒽的Stokes位移最小(λEm-λEx=382 nm-380 nm=2 nm),荧蒽的Stokes位移最大(λEm-λEx=464 nm-240 nm=224 nm)。
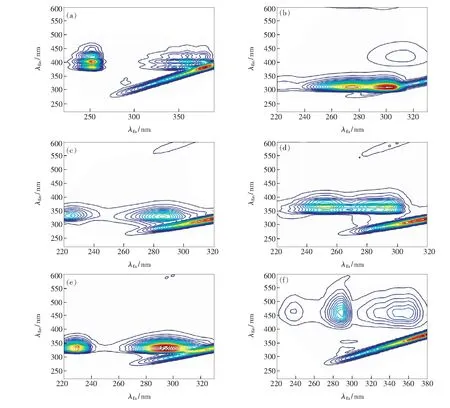
图1 6种PAHs溶液在0.1 MPa时的3DFS。(a)蒽;(b)芴;(c)萘;(d)菲;(e)苊;(f)荧蒽。
Fig.1 3DFS of PAHs (P=0.1 MPa). (a) Anthracene. (b) Fluorine. (c) Naphthalene. (d) Phenanthrene. (e) Acenapthene. (f) Fluoranthrene.
造成上述PAHs的3DFS存在巨大差别的主要原因是不同结构PAHs的共轭π体系的大小不同。当荧光团中的共轭π体系增大时,荧光物质的摩尔消光系数和荧光量子产率都会产生不同程度的增长,进而导致荧光物质发光能力增强[10]。影响PAHs的共轭π电子体系大小的因素主要有两个:(1)组成PAHs的芳环数量和芳环的排列方式不同;(2)PAHs的分子共平面性。通常来说,当两个PAHs的芳环排列方式相同时,拥有更多的芳环的PAHs具有更大的摩尔消光系数和荧光量子产率(例如,蒽>萘),当两个PAHs具有相同芳环数量时,芳环呈直线排布的PAHs较非直线排布的具有更大的摩尔消光系数和量子产率(例如,蒽>菲)。就分子共面性对PAHs荧光的影响而言, 通常分子的共平面性越高,摩尔消光系数和荧光量子产率越大(例如蒽>荧蒽)。另外,增加共轭π电子体系的大小也会减小分子中最低未占轨道和最高已占轨道的能级差,这会导致荧光物质吸收光谱的红移[13]。
3.2 静水压力对蒽的二元混合溶液3DFS的影响
图2和图3分别为蒽、蒽-芴、蒽-萘、蒽-菲、蒽-苊、蒽-荧蒽在0.1 MPa和60 MPa时的3DFS。从图2中可以看出,当蒽和其他的PAHs混合之后,相较于PAHs单独存在时,无论是蒽的荧光峰还是其他PAHs的荧光峰都未发生漂移。由此可以推测,蒽和其他PAHs混合时,不同结构的PAHs并未产生相互作用。当压力上升到60 MPa时,PAHs的荧光峰位置与压力为0.1 MPa时相同,但是各个PAHs的荧光峰的荧光强度发生了显著的变化。图4显示了在不同压力下,蒽的相对荧光效率的变化。从图中可以看出,蒽的相对荧光效率-压力曲线随着加入的PAHs的不同而显著不同(例如,图4(c)中,当在蒽中加入了萘之后,曲线250/382 nm从单调增长变成了先增大、后减小、再增大)。但是,从图4中可以发现一个共性:激发波长为250 nm的3个荧光峰的相对荧光效率-压力曲线趋势相似;激发波长为345,360,380 nm的相对荧光效率-压力曲线趋势相似。
在荧光物质的发光机理的研究中,许多研究者发现PAHs的荧光效率(或荧光量子产率)的确会随着压力升高而增加或者减小[5,6,14-16]。但是,如图4所示的复杂型增长曲线极少出现。Tanaka[5]
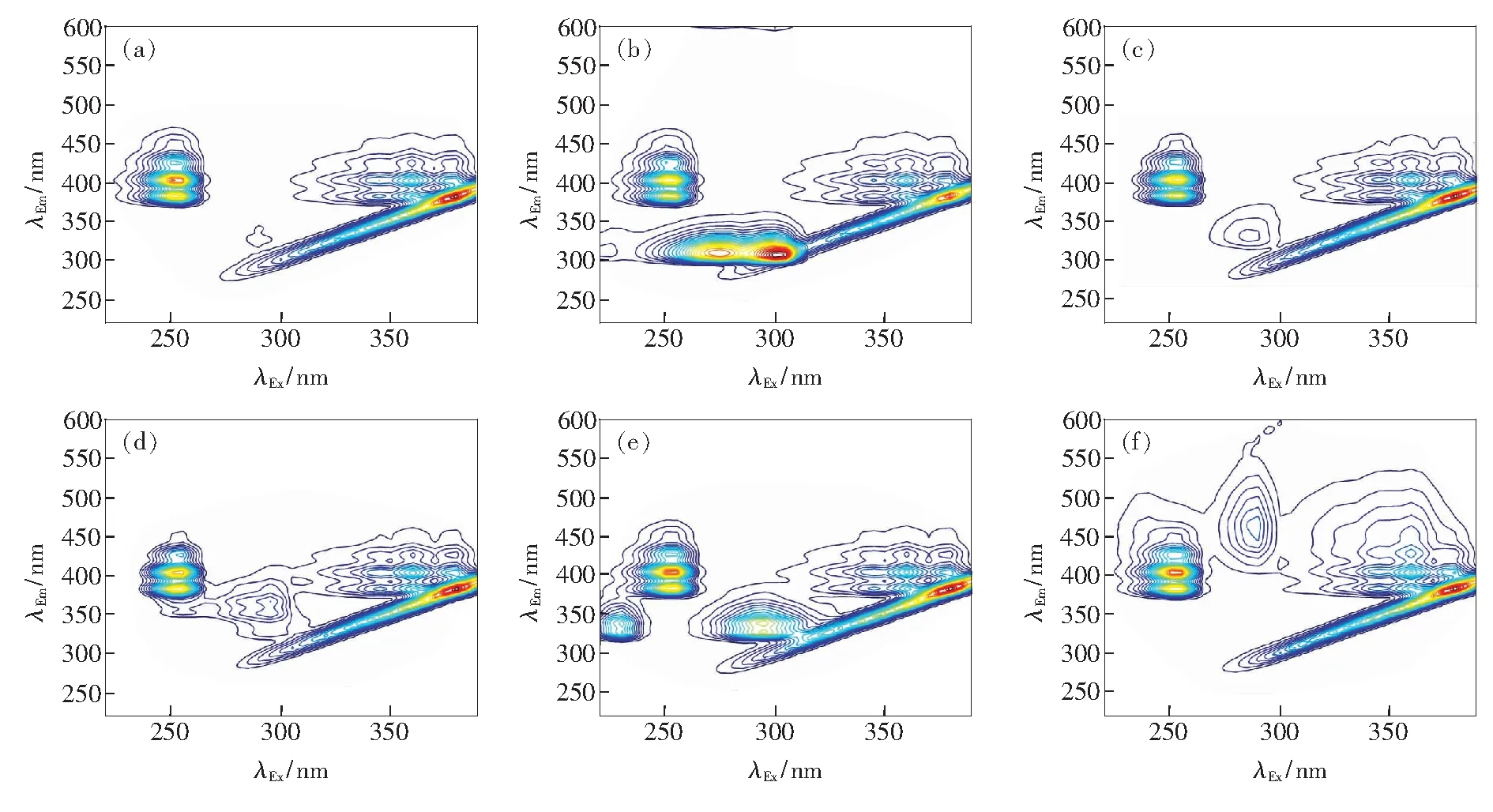
图2 蒽、蒽和其他PAHs组成的混合物在0.1 MPa时的3DFS。
(a)蒽;(b)蒽-芴;(c)蒽-萘;(d)蒽-菲;(e)蒽-苊;(f)蒽-荧蒽。
Fig.2 3DFS of PAHs mixtures (P=0.1 MPa).
(a) Anthracene. (b) Anthracene-fluorene. (c) Anthracene-naphthalene. (d) Anthracene-phenanthrene. (e) Anthracene-acenapthene. (f) Anthracene-fluoranthrene.

图3 蒽、蒽和其他PAHs组成的混合物在60 MPa时的3DFS。(a)蒽;(b)蒽-芴;(c)蒽-萘;(d)蒽-菲;(e)蒽-苊;(f)蒽-荧蒽。
Fig.2 3DFS of PAHs mixtures (P=60 MPa). (a) Anthracene. (b) Anthracene-fluorene. (c) Anthracene-naphthalene. (d) Anthracene-phenanthrene. (e) Anthracene-acenapthene. (f) Anthracene-fluoranthrene.
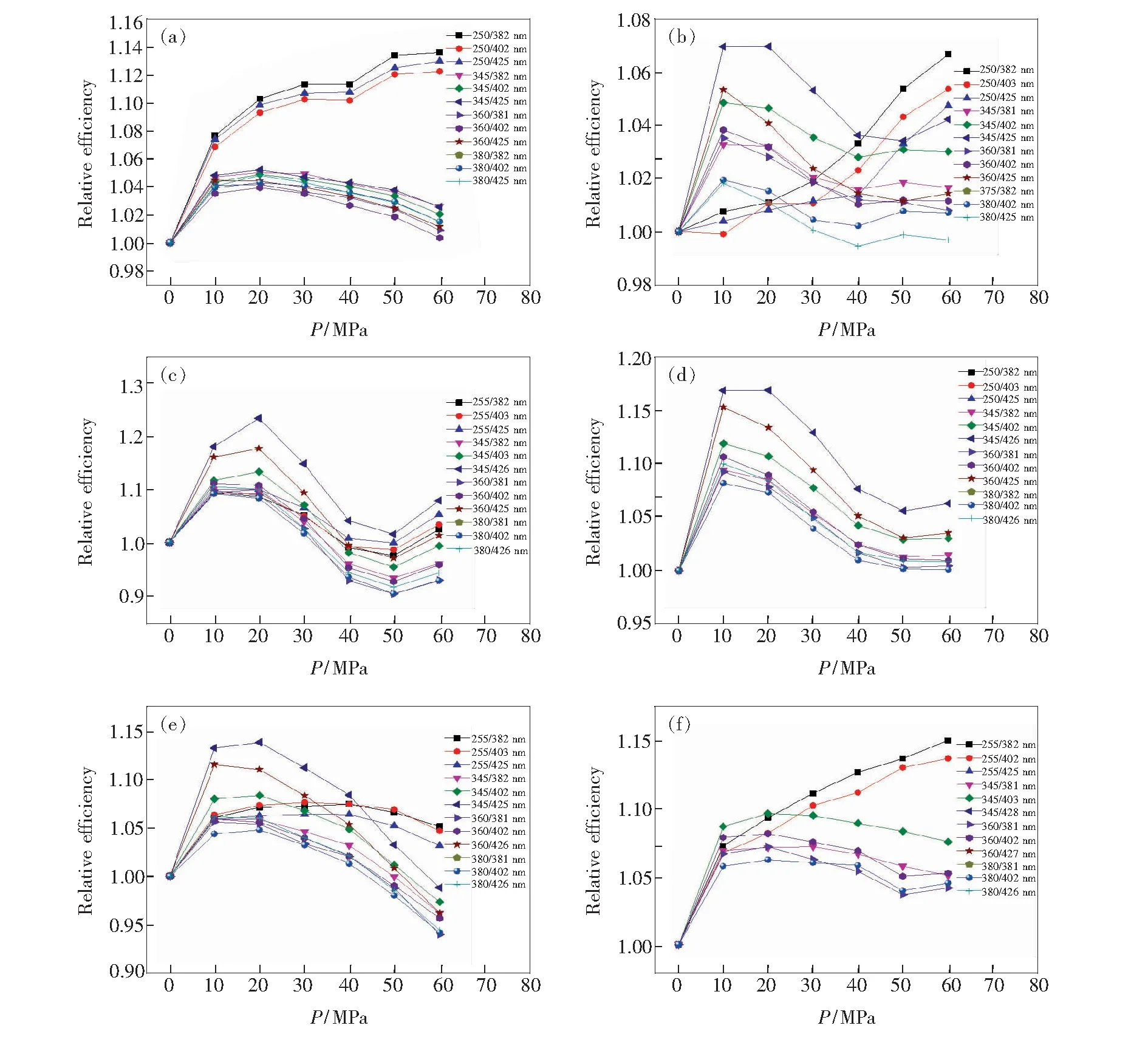
图4 蒽的相对荧光效率随压力的变化曲线。(a)蒽;(b)蒽-芴;(c)蒽-萘;(d)蒽-菲;(e)蒽-苊;(f)蒽-荧蒽。注:由于部分蒽的3DFS与菲或荧蒽的3DFS重合,图4(d)和4(f)有部分荧光峰的相对荧光效率-压力曲线并未呈现。
Fig.4 Relative fluorescence efficiencies of anthracene as a function of hydrostatic pressure. (a) Anthracene. (b) Anthracene-fluorene. (c) Anthracene-naphthalene. (d) Anthracene-phenanthrene. (e) Anthracene-acenapthene. (f) Anthracene-fluoranthrene. Some curves in Fig.4(d) and 4(f) are not displayed because of the existence of spectra overlapping.
在研究蒽的高压荧光特性时,发现了先减、后增型曲线的存在,他将这一特殊的荧光强度-压力曲线归因于第一激发单重态与第二激发三重态之间的能量间隔(S1-T2)随着压力的升高不断变化。
本实验的压力范围为0.1~60 MPa,在该实验条件下,并没有发现荧光峰峰位置的漂移。由此可以断定,当压力升高时,PAHs分子基态和第一激发单重态的能量间隔(S0-S1)、第一激发单重态与第二激发单重态的能量间隔(S1-S2)未发生变化。相对荧光效率-压力曲线的特殊变化,可以解释为:在高压下,第一激发三重态(T1)、第二激发三重态(T2)和第三激发三重态(T3)与激发单重态(S)的相对位置发生了变化。如图4(a)所示,蒽的相对荧光效率-压力曲线具有2种不同类型的增长特性,为了解释其机理,提出了一个假设(见图5(a)):蒽拥有12个荧光峰,这12个峰的激发波长分别为250,345,365,380 nm(250 nm远小于345,360,380 nm),推测蒽分别被激发到了第一激发单重态S1和第二激发单重态S2。Tanaka[5-6]提出在蒽激发态分子弛豫过程中,内转化速率(kic)可以忽略不计,激发态的弛豫速率主要由荧光速率(kr)和系间窜越速率(kisc)确定,并且当kisc增大(或减小)都相应地导致kr减小(或增大)。且压力升高时,S1和T2都会向下移动,但是S1的下降速率比T1大,为了简单起见,我们假设S1固定不动,T2随压力增加不断升高。因此,图4(a)中蒽的相对荧光效率-压力曲线可以解释为:(1)当P=0.1 MPa时,T3>S2>T2>S1>T1,T2-S1 如前所述(图4(c)),当蒽中加入了萘之后,蒽的相对荧光强度-压力曲线呈现一种相对复杂的S型增长趋势(相对荧光强度随着压力先增大、后减小、再增大),同样可以用上述的激发三重态移动理论解释(图5(b)):(1)当P=0.1 MPa时,T3>S2>T2>S1>T1,S2-T2>T3-S2,S1-T1> 图5 蒽的能级图。(a)蒽中未添加其他PAHs;(b)蒽中添加了萘。 Fig.5 The Jablonski diagram of anthracene. (a) Pure anthracene. (b) Anthracene mixed with naphthalene. T2-S1,因此,根据假设,S1系间窜越到T2,S2系间窜越到T3。(2)当0.1 本文研究了蒽的高压荧光特性。实验结果显示,压力对蒽的荧光峰位置没有影响,但是压力的改变对蒽的荧光强度产生了显著影响。我们将这一现象归因于激发单重态和激发三重态随着压力的相对移动。并且在实验中还发现,当在蒽中加入了其他PAHs后,相较于蒽单独存在时,蒽的高压荧光特性发生了改变。其原因可能是加入了其他PAHs后,蒽在常压下的激发单重态和激发三重态的相对位置发生了改变。并且,随着压力的不断增加,相较于蒽单独存在时,激发三重态相对移动速度也增加。本实验结果验证了激发单重态和三重态相对移动理论,并且对于研究高压下PAHs电子激发态的弛豫提供了有效的数据,同时本实验也证明了三维荧光光谱技术在研究荧光物质的高压特性时具有独特优势。 [1] BUGDEN J B C, YEUNG C W, KEPKAY P E,etal.. Application of ultraviolet fluorometry and excitation-emission matrix spectroscopy (EEMS) to fingerprint oil and chemically dispersed oil in seawater [J].Mar.Pollut.Bull., 2008, 56(4):677-685. [2] ZHOU Z Z, LIU Z F, GUO L D. Chemical evolution of Macondo crude oil during laboratory degradation as characterized by fluorescence EEMs and hydrocarbon composition [J].Mar.Pollut.Bull., 2013, 66(1-2):164-175. [3] GUO L, LU M M, LI Q Q,etal.. Three-dimensional fluorescence excitation-emission matrix (EEM) spectroscopy with regional integration analysis for assessing waste sludge hydrolysis treated with multi-enzyme and thermophilic bacteria [J].Bioresour.Technol., 2014, 171:22-28. [4] HIRAYAMA S, YASUDA H, OKAMOTO M,etal.. Effect of pressure on the natural radiative lifetimes of anthracene derivatives in solution [J].ChemInform, 1991, 22(30), doi: 10.1002/chin.199130054 . [5] TANAKA F. Pressure effect on intersystem crossing from the first excited singlet state of anthracene and its derivatives in solution [J].Rev.Phys.Chem.Jpn., 1975, 44(2):65-76. [6] TANAKA F, OKAMOTO M, HIRAYAMA S. Pressure and temperature dependences of the rate constant for S1-T2 intersystem crossing of anthracene compounds in solution [J].J.Phys.Chem., 1995, 99(2):525-530. [7] BAO C M, YE S M, LOU K K,etal.. High-pressure optical cell system for online luminescence spectrum research [J].HighPress.Res., 2010, 30(1):190-197. [8] TEDETTI M, GUIGUE C, GOUTX M. Utilization of a submersible UV fluorometer for monitoring anthropogenic inputs in the Mediterranean coastal waters [J].Mar.Pollut.Bull., 2010, 60(3):350-362. [10] FERRETTO N, TEDETTI M, GUIGUE C,etal.. Identification and quantification of known polycyclic aromatic hydrocarbons and pesticides in complex mixtures using fluorescence excitation-emission matrices and parallel factor analysis [J].Chemosphere, 2014, 107:344-353. [11] JIJI R D, BOOKSH K S. Mitigation of Rayleigh and Raman spectral interferences in multiway calibration of excitation-emission matrix fluorescence spectra [J].Anal.Chem., 2000, 72(4):718-725. [13] DABESTANI R, IVANOV I N. Invited review a compilation of physical, spectroscopic and photophysical properties of polycyclic aromatic hydrocarbons [J].Photochem.Photobiol., 1999, 70(1):10-34. [14] JIANG C Y, SUN Z J, PAN H Y,etal.. Hydrostatic pressure effects on the fluorescence of tyrosine solution with different concentrations of copper ion [J].J.Lumin., 2012, 132(9):2228-2231. [15] JIANG C Y, YUAN Y, SUN Z J,etal.. Effect of hydrostatic pressure and pH value on the three-dimensional fluorescence spectrum of tyrosine solution with various concentrations of copper ion [J].J.Lumin., 2013, 135:42-46. [16] RUAN K C, TIAN S M, LANGE R,etal.. Pressure effects on tryptophan and its derivatives [J].Biochem.Biophys.Res.Commun., 2000, 269(3):681-686. 孙志娟(1980-),女,安徽桐城人,博士,副教授,2007年于华南理工大学获得博士学位,主要从事荧光分析及溶解氧监测方面的研究。 E-mail: sunzj@zjut.edu.cn蒋春跃(1958-),男,浙江诸暨人,博士,教授,1997年于浙江大学获得博士学位,主要从事绿色化工与材料科学、生化反应工程、极端环境下的过程技术及其应用方面的研究。 E-mail: zjjcy@zjut.edu.cn Effects of Hydrostatic Pressure on Three-dimensional Fluorescence Spectra of Mixtures of Anthracene and PAHs SUN Zhi-juan1, CAI Chen-xin2, WANG Jie2, JIANG Chun-yue2* (1.OceanCollege,ZhejiangUniversityofTechnology,Hangzhou310014,China; 2.CollegeofChemicalEngineering,ZhejiangUniversityofTechnology,Hangzhou310014,China) *CorrespondingAuthor,E-mail:zjjcy@zjut.edu.cn The effects of hydrostatic pressure on the three-dimensional fluorescence spectra (3DFS) of pure anthracene (10-6mol·L-1) and its mixtures (anthracene-fluorene, anthracene-naphthalene, anthracene-phenanthrene, anthracene-acenaphthene, anthracene-fluoranthrene, and the concentration ratios are 1∶1) were investigated in a pressure range of from 0.1 MPa to 60 MPa at room temperature. The variation of 3DFS under high pressure was revealed by analyzing the positions and intensities of fluorescence peaks with the increase of hydrostatic pressure. It is found that the fluorescence peak shifts are not detected, however, the changes of fluorescence intensities are observed (e.g. anthracene, the fluorescence intensity of peak of 250/382 nm reached its maximum when the pressure was increased to 60 MPa, and the intensity increases 13.6% compared with that of 0.1 MPa). Otherwise, the high pressure fluorescence properties of anthracene are changed profoundly with the addition of other PAHs (e.g. anthracene) is mingled with naphthalene, the fluorescence intensity of peak of 250/382 nm reaches its maximum when the pressure increases to 10 MPa, and the intensity increases 9.35% compared with that of 0.1 MPa. three-dimensional fluorescence spectra; emission-excitation matrix; hydrostatic pressure; polycyclic aromatic hydrocarbons (PAHs) 1000-7032(2017)08-1102-07 2016-12-06; 2017-05-12 国家自然科学基金(21104066); 浙江省自然科学基金(LY15B060006)资助项目 Supported by National Natural Science Foundation of China(21104066);Zhejiang Provincial Natural Science Foundation(LY15B060006) O521; O433.4 A 10.3788/fgxb20173808.1102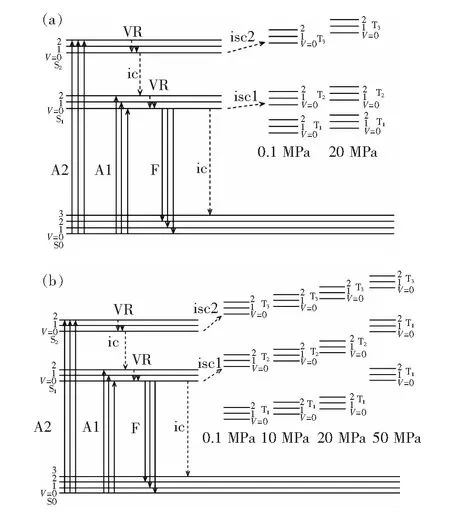
4 结 论


