灵芝菌丝体液态发酵中生物质组分定量的研究
2017-08-02邓伟伟丁重阳夏海锋顾正华张梁石贵阳江南大学生物工程学院工业生物技术教育部重点实验室江苏无锡214122江南大学粮食发酵工艺与技术国家工程实验室江苏无锡214122
邓伟伟,丁重阳,夏海锋,顾正华,张梁,石贵阳(1.江南大学生物工程学院工业生物技术教育部重点实验室,江苏无锡214122; 2.江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡214122)
灵芝菌丝体液态发酵中生物质组分定量的研究
邓伟伟1,2,丁重阳1,2,夏海锋1,2,顾正华1,2,张梁1,2,石贵阳1,2
(1.江南大学生物工程学院工业生物技术教育部重点实验室,江苏无锡214122; 2.江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡214122)
灵芝全基因组的解析为灵芝代谢网络模型构建提供了分子生物学基础,为了获取灵芝代谢网络模型所必需的代谢与生物质组分详细数据,在200 L发酵罐条件下对灵芝进行液体发酵,并对发酵过程中多种物质进行检测。结果表明:发酵第6天,胞内多糖、胞外多糖及生物量达到最大值,分别为(2.57±0.08)g/L、(0.55±0.01)g/L和(8.45±0.23)g/L。同时确定了不同生物质组成的含量,其中总蛋白(34.02±2.34)%、粗纤维(8.33±0.10)%、总脂质(10.10±0.20)%、DNA(1.11±0.01)%、RNA(3.76±0.01)%、灰分(9.35±0.10)%。通过HPLC和GC-MS完成了氨基酸和脂肪酸绝对定量。在已有的数据基础上,结合灵芝基因组计算预测出Gln、Asn及8种核苷酸含量,为后续的基于生物信息学的灵芝全局代谢网络模型的构建、完善与分析以及以此为基础的灵芝生物活性物质代谢调控的新策略等基础研究提供有利的数据支撑。
灵芝菌丝体;多糖;生物质组分;液态发酵
灵芝属于多孔菌目,灵芝科,担子菌属,是重要的白腐真菌[1],含有抗肿瘤、免疫调节和抑制HIV/AIDS等药理功能的活性物[2]。其中,多糖是灵芝的重要活性成分[3],早在1989年就有首次提取出灵芝多糖的报道[4]。由于液态发酵更适用于现代生产方式,因此有较多学者关注与利用控制发酵成分和发酵条件提高灵芝多糖的产量[5]。但文献检索结果显示,截止日前尚未有化学合成培养基的灵芝液态发酵放大的报道。生物质组分是微生物重要的组成部分,对于提高灵芝多糖产量和控制多糖活性等方面具有重要意义。目前已有对灵芝生物质的检测见于报道,如Lv等[6]定量比较灵芝和紫芝子实体中的自由甾醇和自由脂肪酸的含量以及Stojkovic'等[7]详细地分析了西班牙灵芝和中国灵芝的化学和生物活性特征,但已有报道只是针对灵芝生物质中的一类或者几类进行测定,并未有对灵芝生物质全面检测结果的报道,且灵芝液态发酵菌丝体中生物质组分在实验室水平和工业化大罐发酵水平方面存在一定的差异。目前关于灵芝多糖生物合成途径尚不清晰,随着灵芝基因组注释的解析[8],为灵芝多糖生物合成代谢网络模型构建提供了分子生物学基础,但是缺乏灵芝在化学成分明确培养基条件下的发酵特性数据以及生物质组分等详尽实验数据。
基于以上原因,采用200 L通风搅拌发酵罐,在化学合成培养基条件下探究灵芝液态发酵产胞内多糖和胞外多糖的发酵特性,对灵芝液态发酵中菌丝体的氨基酸、脂肪酸、灰分、粗纤维和总核酸等生物质组分进行定量分析,并结合灵芝基因组信息,对不稳定与不易测定的生物质组分预测,以期为基于生物信息学的灵芝全局代谢网络模型的构建、完善与分析以及以此为基础的灵芝生物活性物质代谢调控的新策略等基础研究提供有利的数据支撑,并为灵芝菌丝体营养价值在化学成分差异方面的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株
灵芝(Ganoderma lucidum)菌株,保存于江南大学粮食发酵工艺与技术国家工程实验室。
1.1.2 主要试剂
NaOH、浓H2SO4、三氟化硼乙醚、丙酮(分析纯),国药集团化学试剂有限公司;Trans Zol Plant试剂盒,TaKaRa公司;十九烷酸甲酯、甲醇、氯仿、正己烷(色谱纯),Sigma公司。
1.1.3 主要仪器
电热恒温水浴锅,医用恒温设备厂;超净工作台,苏净集团安泰公司;台式高速离心机,德国Sigma公司;全自动高压蒸汽灭菌锅,日本SANYO公司;电子分析天平,瑞士梅特勒-托利多公司;回转式恒温调速摇床,上海新星自动化控制设备成套厂;SHI-D(Ⅲ)型循环水式真空泵,巩义市英峪予华仪器厂;真空冷冻干燥机,美国LABCONCN公司;氮吹仪,上海安谱实验科技股份有限公司;Agilent100型高效液相色谱系统,Agilent公司;气相色谱-质谱联用仪,美国Themo公司;15 L发酵系统(Bio Bench 15ltr),捷克TENEZ公司;ABEC 200-1型200 L发酵罐系统,美国ABEC公司。
1.2 方法
1.2.1 液态发酵
一级培养基(g/L):葡萄糖20,胰蛋白胨5,无氨基酵母氮源5,KH2PO43,MgSO4·7H2O 2。灭菌前将培养基调至pH 6.0,种子及发酵培养基灭菌条件为110℃灭菌20 min,葡萄糖单独灭菌后加入培养基。
二级、三级培养基以及放大发酵培养基同上,后两者进行原位灭菌。
从斜面上活化的种子在250 mL三角瓶培养得一级种子,一级种子转接至500 mL三角瓶培养得二级种子,再转接到15 L发酵系统培养得三级种子,最后转入200 L发酵罐系统中发酵,每天取样测定发酵液中还原糖浓度、胞外多糖(EPS)与胞内多糖(IPS)的产量以及生物量。
1.2.2 还原糖、EPS、IPS和生物量的测定
还原糖测定:采用二硝基水杨酸(DNS)法测定[9]。
EPS提取与测定:将发酵液与95%乙醇以体积比1∶4充分混匀,于4℃冰箱静置过夜沉降,除弃澄清液,再将其置于烘箱中除去残余乙醇,沉淀用蒸馏水溶解并定容,最后取一定量的灵芝胞外多糖水溶液,采用苯酚-H2SO4法测定[10]。
IPS提取与测定:将1.0 g样品加入含有100.0 mL蒸馏水的试管内,于沸水浴中提取3 h,经抽滤后得胞内多糖浸取液。按照EPS的处理方法提取IPS,采用苯酚-H2SO4法测定[10]。
生物量测定:采用冷冻干燥法,将灵芝菌丝体发酵液减压抽滤,低温冷冻干燥至恒质量,称取干燥的灵芝菌丝体质量。
1.2.3 灰分、粗纤维、总核酸、总蛋白和总脂质的测定
灰分测量采用灰分测定国标法[11]。
粗纤维测定采用粗纤维测量国标法[12]。
总DNA测定参照文献[13],分光光度法测定DNA含量。
总RNA用Trans Zol Plant试剂盒提取,分光光度法测定RNA含量。
总蛋白采用凯氏定氮法测定[14]:称取一定质量的干菌丝体置于消化管中,加入消化剂高温消化至澄清,消化完后加入水混匀。将含2%硼酸溶液三角瓶和消化管置于半自动凯氏定氮仪蒸馏,待三角瓶内溶液冷却后,用盐酸标准溶液进行滴定,计算总蛋白所占的比例。
总脂质采用索氏提取法[15]测定:用液氮充分研磨一定质量的干菌丝体成粉末,迅速称质量后加入三氯甲烷和甲醇溶液(体积比1∶1),摇匀超声,静置、加水混匀、离心,吸取三氯甲烷萃取液,重复上述提取步骤3次,合并粗脂质提取液,提取液中的三氯甲烷用氮气吹干,低温冷冻干燥至恒质量,计算粗脂质占菌丝体干质量的比例。
1.2.4 氨基酸的测定
酸水解:称取一定干质量的灵芝菌丝体加入至水解管中,加入盐酸溶液充入氮气后封管于烘箱内酸水解,冷却至室温后,加入NaOH溶液中和酸解液,然后加入水定容。过滤离心后的澄清液用于测定灵芝菌丝体酸水解液中17种氨基酸(除色氨酸、谷氨酰胺和天冬酰胺外)的含量。
碱水解:步骤同酸水解,加NaOH溶液水解,加入盐酸溶液中和水解液,用于测色氨酸。
OPA柱前衍生反相高效液相色谱-紫外检测法:Agilent100高效液相色谱系统,Agilent Hypersil ODS柱(5μm,4.0 mm×250 mm)。采用梯度洗脱法,洗脱程序为进液量为1μL,0 min,8%流动相B (80.9 mmol/L醋酸钠-甲醇-乙腈,体积比1∶2∶2)+ 92%流动相A(27.6 mmol/L醋酸钠-三乙胺-四氢呋喃,体积比500∶0.11∶2.5);17 min,50%流动相B+ 50%流动相A;20.1 min,100%B;24 min,100%流动相A;流动相流速为1.0 mL/min;柱温为40℃;紫外检测器(VWD)检测波长338 nm,脯氨酸以262 nm检测,氨基酸含量以外标法定量。
1.2.5 脂肪酸的测定
将得到的粗脂质用脂肪酸甲酯制备[16]处理得甲酯化脂肪酸,加入十九烷酸甲酯做内标,用于气相色谱-质谱(GC-MS)联用仪分析。
色谱条件:色谱柱为FAME wax石英毛细管(30 m×0.32 mm×0.25μm),检测器为氢火焰离子检测器(FID)。进样量1μL,进样口温度225℃,检测器温度250℃,分流比为10∶1,线速为30 cm/min,衰减16。程序升温条件为维持柱温190℃1 min后,以0.3℃/min升至191℃,再以4℃/min升至225℃,维持15 min。采集质量数范围为50~600 m/z。
2 结果与讨论
2.1 发酵产多糖的代谢特性
为了获取灵芝在化学合成培养基条件下的代谢特性,在200 L发酵罐中进行液态发酵,其残糖、生物量和灵芝多糖代谢参数变化见图1。由图1可知,从发酵第2天至第6天,灵芝迅速消耗碳源且残糖消耗速率逐渐增大,灵芝菌丝体的生长速率也随之增大,发酵第6天生物量达到最大,为(8.45± 0.23)g/L。发酵初期,灵芝胞内多糖出现了下降的情况(见图1(b)),其原因是灵芝菌丝体处于生长适应期,胞内多糖以及胞外多糖基本不合成,且消耗自身的多糖,导致胞内多糖产量下降;进入发酵第2天,灵芝IPS和EPS随着菌丝体的快速生长不断被合成,其合成速率也随之增大,在发酵第6天时,EPS和IPS均达到最大产量,分别为(0.55± 0.01)g/L和(2.57±0.08)g/L,均低于Tang等[17]对灵芝在200 L发酵罐中培养时的多糖产量。
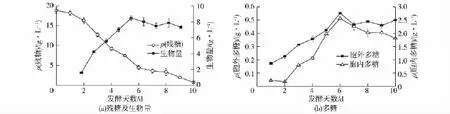
图1 灵芝菌丝体发酵过程中参数Fig.1 Parameters variation during the fermentated process of G.lucidum mycelium
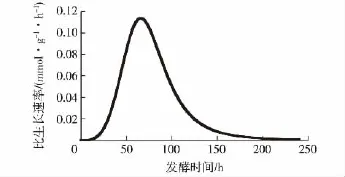
图2 灵芝菌丝体液体发酵生长拟合曲线Fig.2 Fitting curve of mycelial growth during the fermentated process of G.lucidum
为进一步了解灵芝的生长代谢特性,对残糖消耗和生物量进行非线性生长拟合,结果见图2。由图2可知,在发酵第65小时时,灵芝的比生长速率μ达到最大值0.113 6 mmol/(g·h),此时对应的糖消耗速率为7.1 mmol/(g·h),与李平作等[18]对灵芝液态发酵时的最大比生长速率(μmax=0.12 mmol/(g·h))基本一致。此外,在发酵后期(第6天至结束),发酵液中的酸度逐渐增大,灵芝生长缓慢甚至受到阻碍。此外,研究还发现,在发酵结束时发酵液的pH很低,灵芝菌丝体发生自溶现象,与Tang等[17]的灵芝液态发酵现象相一致。
2.2 灵芝菌丝体生物质组成定量分析
生物质组分是灵芝重要的物质组成,通常是一些基本的代谢物,如组成蛋白质的20种基本氨基酸,组成核酸的8种核苷酸等,是基于生物信息学的灵芝基因组代谢模型构建的关键元素,因此对灵芝在200 L发酵罐培养的发酵菌丝体进行生物质组分定量。
2.2.1 菌丝体粗成分含量分析
菌丝体粗成分含量分析结果如表1所示。表1结果表明,灵芝菌丝体中蛋白质的含量最高,其次为碳水化合物,其含量分别为(34.02±2.34)%和(33.33±2.17)%。Chan等[19]定量检测灵芝(Ganoderma tsugae var.jannieae CBS-120304)菌丝体中的总蛋白和碳水化合物的含量分别为37%和50%。与之相比,本研究检测到的灵芝菌丝体中总蛋白和碳水化合物均稍微偏低。Beluhan等[20]检测了10种药食用真菌的总蛋白含量为27.95%~38.89%,总碳水化合物含量42.62%~66.78%,总脂质含量1.34%~6.45%,可以看出,灵芝菌丝体总蛋白和脂质的含量与其测定值接近,而灵芝菌丝体中总碳水化合物含量则明显偏低。Pedneault等[21]同样检测了10种药食用真菌的脂质谱,含量为3.1%~16.0%,本研究测定的脂质含量也处于该范围内。Stojkovic'等[7]测得来自中国的灵芝子实体总蛋白(9.93±0.26)%、脂质(3.72±0.00)%和总碳水化合物(78.16±0.21)%,后者含量远高于灵芝菌丝体。由此可以得出,灵芝与其他药食用真菌主要在总碳水化合物的含量上存在较大的差异。此前已有药食用真菌菌丝体生物质组分测定的类似报道,Hadar等[22]定量测定平菇菌丝体中总蛋白含量为(23.30±0.08)%,总脂质(1.50±0.05)%,总碳水化合物为(13.3±0.2)%,总RNA为(1.20±0.06)%,灰分为(5.80±0.14)%。与本研究测定的结果相比,灵芝菌丝体在总蛋白、脂质、总碳水化合物方面明显高于平菇菌丝体。

表1 灵芝菌丝体中生物量成分Table 1 Biomass composition of G.lucidum mycelium
2.2.2 氨基酸组成分析
在药食用真菌中,氨基酸是主要的功能化合物,灵芝菌丝体中18种氨基酸含量如表2所示。由于谷氨酰胺和天冬酰胺化学性质不稳定。通过灵芝基因组计算氨基酸比例并结合蛋白质含量进行预测[8],结果显示谷氨酰胺和天冬酰胺的含量分别占菌丝体的0.9%和1.18%。许多研究者将一些重要的的氨基酸作为灵芝的营养价值参数,如亮氨酸、缬氨酸、苏氨酸、赖氨酸、蛋氨酸和色氨酸[23],本研究中灵芝菌丝体中这些重要氨基酸含有相对较高的含量。
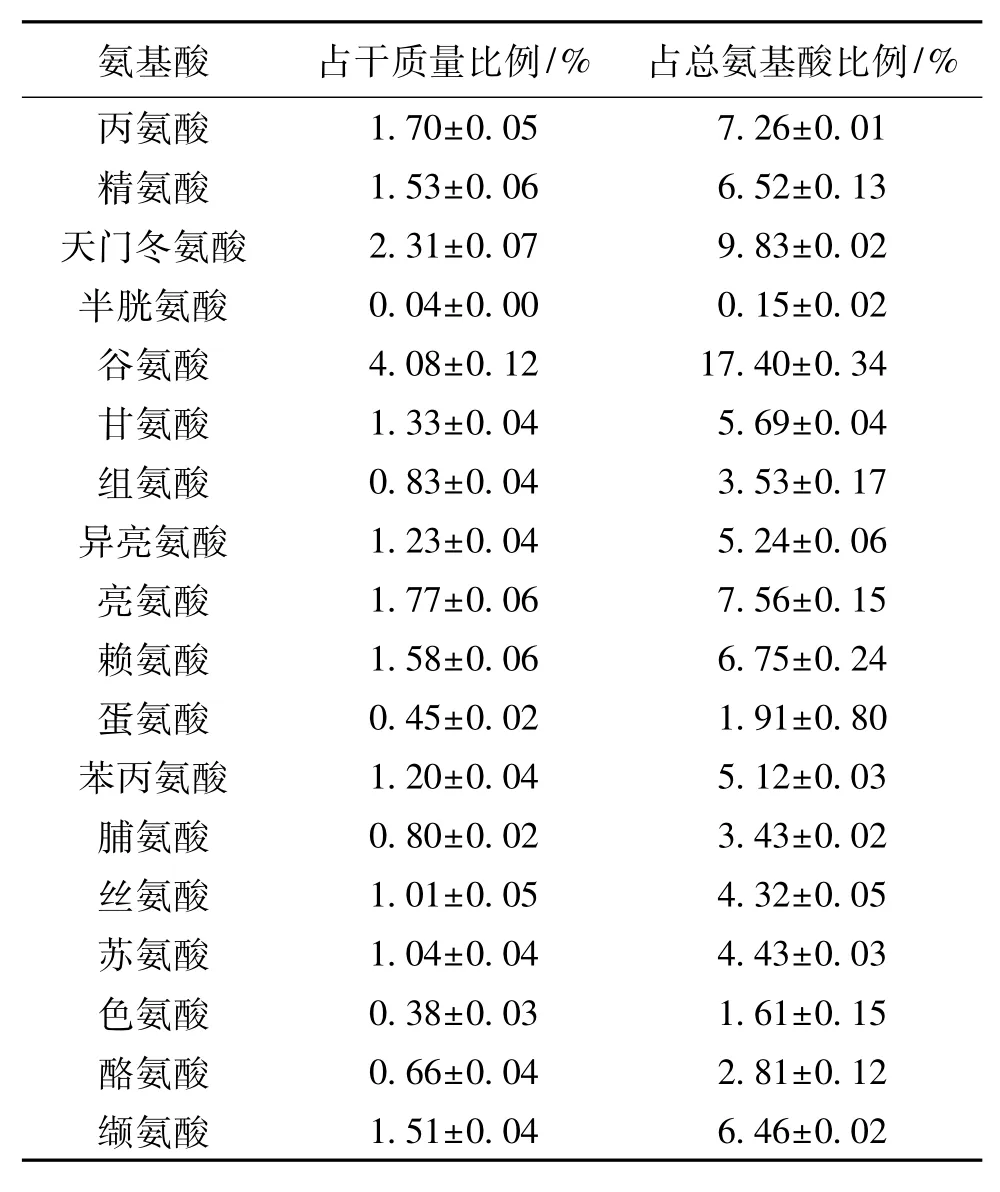
表2 灵芝菌丝体氨基酸组分含量Table 2 Composition and content of amino acids in G.lucidum mycelium
由表2可知:每克灵芝菌丝体中(以干质量计),必需氨基酸的含量为(91.59±0.93)mg,占总蛋白质含量的39.07%,与Chan等[19]测定的结果接近(39.9%),然而各氨基酸的含量与之相比却较低,但明显高于Beluhan等[20]测得食用真菌氨基酸含量。在各氨基酸组成中,谷氨酸的含量最高,为(40.77±1.17)mg/g,占总蛋白质含量的(17.40± 0.34)%,是其他氨基酸含量的2倍以上。其次是同为酸性氨基酸的天冬氨酸,中性氨基酸总的含量虽高,但各氨基酸的含量却低。由此可知,灵芝菌丝体中酸性氨基酸组分含量偏高。
2.2.3 脂肪酸组成分析
由前面的实验结果可知,灵芝菌丝体中脂质的含量较低。有研究报道,在担子菌中,棕榈酸(C16∶0)、油酸(C18∶1)和亚油酸(C18∶2)为主要的脂肪酸组分[24]。本研究测定灵芝菌丝体中的脂肪酸,结果见表3。由表3可知:在每克灵芝菌丝体中(以干质量计),多不饱和脂肪酸亚油酸(C18∶2)含量高达(16.64±0.20)μg,占总脂肪酸的(65.81±0.45)%,为主要的脂肪酸组分,是其他所测脂肪酸组分总含量的2倍,与Lv[6]、Stojkovic'[7]和Chan[19]所测结果一致,而Liu等[25]研究发现油酸(C18∶1)为灵芝脂肪酸的主要成分。其次是棕榈酸(C16∶0)和油酸(C18∶1),含量分别为(3.19±0.02)μg/g和(2.61± 0.05)μg/g,其他脂肪酸含量则很低。

表3 灵芝菌丝体脂肪酸组分含量Table 3 Constituent and content of FAs in G.lucidum mycelium
由表3可知,在碳原子数为20和22的脂肪酸尚未检测到,Liu等[25]研究结果显示,灵芝菌体中可能含有更多脂肪酸成分,可能是由于组分含量较低因而难于检测。
2.2.4 核酸组分分析
核苷酸是核酸的主要组成物质,是生物质中不可或缺的部分。通过灵芝基因组[8]计算,对灵芝菌体中8种核糖核苷酸含量进行预测,结果见表4。由表4可知,在DNA组分中鸟嘌呤(C)和胞嘧啶(G)含量最高,在细胞干质量中G含量最高,而RNA组分中C和G的含量最高。核酸组成的预测结果为灵芝基因组代谢模型提供了重要数据支持。

表4 基因组计算预测灵芝菌丝体核酸组分Table 4 Nucleic acid composition of G.lucidum mycelium estimated by genome
3 结论
为了获取灵芝代谢网络模型所必需的代谢与生物质组分等实验数据,在化学合成培养基条件下,对灵芝在200 L通风搅拌式发酵罐液态发酵过程中发酵液残糖、EPS、IPS含量及生物量变化规律进行了研究,结果表明,在发酵第6天,EPS、IPS及生物量达到最高,分别为(0.55±0.01)g/L、(2.57± 0.08)g/L和(8.45±0.23)g/L;对灵芝发酵菌丝体中氨基酸、脂肪酸和粗纤维等化学组分进行了绝对定量,其中谷氨酸和亚油酸分别在蛋白质和脂肪酸组分中具有较高的含量。此外,还结合灵芝基因组预测出了2种化学性质不稳定的氨基酸和8种核苷酸的含量,为后续的基于生物信息学的灵芝全局代谢网络模型的构建、完善与分析,以及以此为基础的灵芝生物活性物质代谢调控的新策略等基础研究提供了有利的数据支撑。
[1]林志彬.灵芝的现代研究[M].北京:北京医科大学出版社,2001.
[2]PATERSON R R M.Ganoderma:a therapeutic fungal biofactory[J].Phytochem,2006,67(18):1985-2001.
[3]XU Z T,CHEN X P,ZHONG Z F,et al.Ganoderma lucidum polysaccharides:immunomodulation and potential anti-tumor activities[J].Am J Chin Med,2011,39(1):15-27.
[4]KINO K,YAMASHITA A,YAMAOKA K,et al.Isolation and characterization of a new immunomodulatory protein,Ling Zhi-8(LZ-8),from Ganoderma lucidium[J].J Biol Chem,1989,264 (1):472-478.
[5]WAGNER R,MITCHELL D A,SASSAKI G L.Currenttechniques for the cultivation of Ganoderma lucidum for the production of biomass,ganoderic acid and polysaccharides[J].Food Technol Biotechnol,2003,41(4):371-382.
[6]LV G P,ZHAO J,DUAN J A,et al.Comparison of sterols and fatty acids in two species of Ganoderma[J].Chem Cent J,2012,6 (1):10.
[8]CHEN S L,XU J,LIU C,et al.Genome sequence of the model medicinal mushroom Ganoderma lucidum[J].Nat Commun,2012,3(2):177-180.
[9]DUBOIS M,GILLES K A,HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Anal Chem,2002,28(3):350-356.
[10]DUBOIS M,GILLES K A,HAMILTON J K,et al.A colorimetric method for the determination of sugars[J].Nature,1951,168:167.
[11]中华人民共和国卫生部.食品中灰分的测定:GB/T5009.4—2010[S].北京:中国标准出版社,2010.
[12]中华人民共和国卫生部.植物类食品中粗纤维的测定:GB/ T5009.10—2003[S].北京:中国标准出版社,2003.
[13]LICHTENSTEIN C P,DRAPER J.DNA clonning:a practical approach[M].U K:IRL Press,1985.
[14]中华人民共和国卫生部.食品中蛋白质的测定:GB/T5009.5—2003[S].北京:中国标准出版社,2004.
[15]BLIGH E G,DYER W J.A rapid method of total lipid extraction and purification[J].Can J Biochem Physiol,1959,37(8): 911-917.
[16]中华人民共和国卫生部.动植物油脂脂肪酸甲酯制备脂:GB/ T17376—1998[S].北京:中国标准出版社,2006.
[17]TANG Y J,ZHANG W,LIU R S,etal.Scale-up study on the fedbatch fermentation of Ganoderma lucidum for the hyperproduction of ganoderic acid and Ganoderma polysaccharides[J].Process Biochem,2011,46(1):404-408.
[18]李平作.灵芝深层发酵生产生物活性物质的研究[D].无锡:无锡轻工大学,1997.
[19]CHAN J S,ASATIANI M D,SHARVIT L E,et al.Chemical composition and medicinal value of the new Ganoderma tsugae var.jannieae CBS-120304 medicinal higher basidiomycete mushroom[J].Int J Med Mushrooms,2015,17(8):735-747.
[20]BELUHAN S,RANOGAJEC A.Chemical composition and nonvolatile components of Croatian wild edible mushrooms[J].Food Chem,2011,12(3):1076-1082.
[21]PEDNEAULT K,ANGERS P,GOSSELIN A,et al.Fatty acid profiles of polar and neutral lipids of ten species of higher Basidiomycetes indigenous to eastern Canada[J].Mycol Res,2008,112:1428-1434.
[22]HADAR Y,COHEN-ARAZI E.Chemical composition of the edible mushroom Pleurotus ostreatus produced by fermentation[J].Appl Environ Microbiol,1986,51(6):1352-1354.
[23]WANG X,ZHANG J,WU L,et al.A mini-review of chemical composition and nutritional value of edible wild-grown mushroom from China[J].Food Chem,2014,151:279-285.
[24]MAU J L,LIN H C,CHEN C C.Non-volatile components of several medicinal mushrooms[J].Food Res Int,2001,34(6): 521-526.
[25]LIU X,XU S P,WANG J H,et al.Characterization of ganoderma spore lipid by stable carbon isotope analysis:implications for authentication[J].Anal Bioanal Chem,2007,388(3):723-731.
(责任编辑管珺)
Determination of compounds in mycelium of Ganoderma lucidum in submerged fermentation
DENG Weiwei1,2,DING Zhongyang1,2,XIA Haifeng1,2,GU Zhenghua1,2,ZHANG Liang1,2,SHI Guiyang1,2
(1.Key Laboratory of Industrial Biotechnology of the Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.National Engineering Laboratory for Cereal Fermentation Technology,Jiangnan University,Wuxi 214122,China)
The annotation of whole genome from Ganoderma lucidum provides the molecular basis for the establishment of its genome-scale metabolic network.In order to obtain the detailed data of the metabolic and biomass components necessary for constructing metabolic network of G.lucidum,different biomass compounds were analyzed during submerged fermentation of G.lucidum in a 200-L fermentor.The highest production of endopolysaccharides(IPS)(2.57±0.08)g/L,exopolysaccharides(EPS)(0.55±0.01) g/L and biomass(8.45±0.23)g/L were obtained on day 6.Meanwhile,various compounds in myceliumof G.lucidum were determinated and showed as follows:total protein(34.02±2.34)%,crude fibre (8.33±0.10)%,total lipid(10.10±0.20)%,RNA(3.76±0.01)%,DNA(1.11±0.01)%,and ash (9.35±0.10)%.The quantitation of amino acids and fatty acids(FAs)were done by HPLC and GCMS,respectively.Based on obtained data,the contents of Gln,Asn and eight nucleotides were predicted after combining with G.lucidum genome.Gln,Asn and eight nucleotides content were predicted and the results in this study will be beneficial to provide favorable data support for the subsequent construction,refining and analysis of global metabolic model based on systems bioinformatics,and for new strategies for metabolic control of bioactive substances in G.lucidum.
G.lucidum mycelium;polysaccharide;biomass composition;submerged fermentation
TS219
A
1672-3678(2017)04-0015-07
10.3969/j.issn.1672-3678.2017.04.003
2016-04-04
国家自然科学基金(31271918)
邓伟伟(1989—),男,江西抚州人,研究方向:发酵工学;丁重阳(联系人),教授,E-mail:zyding@jiangnan.edu.cn;夏海锋(联系人),副教授,E-mail:hfxia@jiangnan.edu.cn
