葡萄糖-1-磷酸对灵芝多糖合成的影响
2017-08-02张奇茹丁重阳周哲敏顾正华张梁石贵阳江南大学生物工程学院工业生物技术教育部重点实验室江苏无锡2422江南大学粮食发酵工艺与技术国家工程实验室江苏无锡2422
张奇茹,丁重阳,周哲敏,顾正华,张梁,石贵阳(.江南大学生物工程学院工业生物技术教育部重点实验室,江苏无锡2422; 2.江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡2422)
葡萄糖-1-磷酸对灵芝多糖合成的影响
张奇茹1,2,丁重阳1,2,周哲敏1,顾正华1,2,张梁1,2,石贵阳1,2
(1.江南大学生物工程学院工业生物技术教育部重点实验室,江苏无锡214122; 2.江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡214122)
在以葡萄糖为唯一碳源进行灵芝液态发酵时,通过添加不同浓度的代谢中间产物葡萄糖-1-磷酸,研究其对灵芝胞外多糖产量、单糖组成、合成途径相关酶的影响,从而确定影响灵芝多糖单糖组成的关键酶。结果显示,添加葡萄糖-1-磷酸对灵芝多糖产量和多糖的单糖组成并无明显影响。在检测的3种灵芝多糖合成关键酶中,葡萄糖-1-磷酸的添加抑制磷酸葡萄糖变位酶(PGM)、磷酸葡萄糖异构酶(PGI)的酶活,对磷酸甘露糖异构酶(PMI)无明显影响。此外,通过相关性分析后发现,发酵过程中半乳糖和甘露糖比例的变化分别与PGM和PGI、PMI具有相关性。本文结果对实现灵芝多糖代谢的灵活调控提供有益的参考。
灵芝;胞外多糖;液态发酵;葡萄糖-1-磷酸
灵芝(Ganoderma lucidum)是一种名贵的食药用真菌,具有重要的保健功能和对多种疾病的预防效果,卫生部已经批准其为食品新资源,并成为研究和开发的热点药食用真菌之一。灵芝多糖是其主要的活性成分,可以从液体发酵的发酵液、菌丝体及子实体中获得,具有抗肿瘤、降血压、增强免疫力和抗氧化等活性[1-4]。
2012年,单核灵芝菌株(G.lucidum strain 260125-1)全基因序列[5]的公开,为灵芝主要活性物质如多糖等的合成途径及其调控机制的研究提供基础。由于固体栽培受到诸多条件的限制,而液体发酵具有不受季节影响、培养周期短、成本低、有效活性成分相对更容易提取等优点,使得液体发酵成为获取真菌多糖的主要手段[6-8]。近十年来,通过液态发酵技术获得生物活性物质,已经被广泛应用于保健品的开发与制备[9-10]。目前,国内外侧重于多糖的分离提取、结构的鉴定、生物活性和发酵优化等方面的研究[11-15]。利用不同碳源进行灵芝液态发酵时,灵芝胞外多糖的主要单糖组分为甘露糖、半乳糖和葡萄糖,随着发酵的进行,各组分的比例随之发生改变,葡萄糖的比例不断减少。此外,灵芝合成途径的相关酶酶活可影响多糖中单糖的比例[16-17]。因此,本文通过添加葡萄糖代谢途径中的代谢中间产物葡萄糖-1-磷酸(G-1-P),研究其对灵芝多糖单糖组成的影响,从而考察灵芝多糖合成过程中影响单糖比例的关键酶。
1 材料与方法
1.1 实验材料
1.1.1 菌株
灵芝(G.lucidum),购买于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),保藏于江南大学粮食发酵工艺与技术国家工程实验室。
1.1.2 培养基
种子培养基(g/L):葡萄糖20,无氨基酵母(YNB)5,胰蛋白胨5,MgSO4·7H2O 2,KH2PO43; pH 6.0。
发酵培养基(g/L):葡萄糖20,无氨基酵母(YNB)5,胰蛋白胨5,MgSO4·7H2O 2;实验组在种子培养基的基础上分别添加0.3、0.6 g/L的G-1-P,对照组不添加;pH 6.0。
培养基灭菌条件:110℃、20 min,其中葡萄糖单独灭菌,条件相同。
1.1.3 主要试剂
常用的基本试剂均为市售国产分析纯,培养基所用胰蛋白胨(tryptone)为英国Oxoid公司产品,无氨酵母蛋白(YNB)为拜尔迪公司,检测酶活所用药品均购自Sigma公司。
1.1.4 主要仪器
气相色谱仪,日本岛津公司;酶标仪,美国Bio-Rad公司;冷冻干燥机,日本日立公司;UV2100型紫外可见光分光光度计,上海医用恒温设备厂。
1.2 实验方法
1.2.1 液体发酵培养
种子培养:向装有80 mL培养液的250 mL三角瓶中接入4块0.5 cm×0.5 cm大小的活化菌种,在150 r/min、30℃条件下培养10 d。发酵培养:向装有150 mL培养液的500 mL三角瓶中接入湿质量大约为0.5 g的菌体,在150 r/min、30℃下培养10 d。
1.2.2 胞外多糖的测定
发酵液离心后取上清,与4倍体积95%乙醇充分混匀,置于4℃冰箱中过夜,10 000 r/min离心10 min,去上清液,加适量的水溶解,苯酚-H2SO4法[18]测定。
1.2.3 还原糖的测定
取发酵液上清,适当稀释后,用3,5-二硝基水杨酸(DNS)法[19]测定。
1.2.4 胞外粗多糖的提取
将发酵液经旋转蒸发仪适当浓缩后,加0.45倍体积工业酒精,充分搅拌20 min,目的是除去蛋白;然后加2.25倍体积工业酒精,搅拌20 min,静置于4℃冰箱过夜,目的是醇沉粗多糖;除去酒精,待酒精挥发完全后加入适量的去离子水溶解,10 000 r/min离心10 min,上清冷冻干燥后即为灵芝胞外粗多糖粉。
1.2.5 单糖组成的测定
水解:称取40 mg灵芝粗多糖于水解管中,加1 mol/L的H2SO42 mL,置于105℃下水解8 h,用0.8 g BaCO3中和至中性,离心洗涤2次,收集上清液冷冻干燥,即为游离单糖样品。
衍生化:称取上述干燥单糖样品10 mg,加入10 mg的盐酸羟胺,并加入肌醇内标1 mg,再加0.5 mL吡啶,于90℃恒温水浴锅保持30 min,冷却后加入乙酸酐0.5 mL,再在水浴锅保持30 min,冷却后即可进行气相(GC)分析。
气相色谱条件:检测器为氢火焰离子鉴定器(FID);气化室温度260℃;检测器温度250℃; OV1701毛细管柱起始温度120℃,保持3 min后以10℃/min速度升温至195℃,保留0.1 min,然后以3℃/min速度升温至240℃,保留10 min。
单糖组分分析:以内标法计算出各单糖含量,见式(1)。
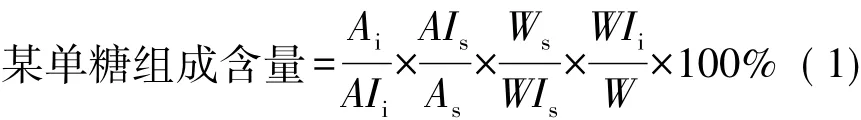
式中:Ai为单糖样品峰面积;AIi为样品中加入肌醇内标峰面积;AIs为标样中加入肌醇内标峰面积;As为某单糖标样峰面积;Ws为某单糖标样的质量(mg); WIs为标样中加入的肌醇内标的质量(mg);WIi为样品中加入的肌醇内标的质量(mg);W为称取糖样品的质量(mg)。
1.2.6 多糖代谢途径相关酶的测定
粗酶液的提取:液氮充分研磨灵芝菌体后,加入pH 6.5细胞提取缓冲溶液(20 mmol/L的K3PO4缓冲液,其中含有1 mmol/L二硫苏糖醇、10 mmol/L MgCl2和50 mmol/L NaCl)充分混匀后低温离心,上清液用来测定灵芝多糖合成途径的关键酶酶活。
蛋白浓度的测定:采用考马斯亮蓝法测定酶液中的蛋白浓度。
酶活的测定:在反应温度为30℃、波长为340 nm的条件下用酶标仪检测。以反应体系中每分钟增加或减少1 nmol的NAD(P)H定义为1个酶活单位(U)。各相关酶的总反应体系均为250μL,以向体系中加入30μL的粗酶液作为反应开始。酶活计算见式(2)。
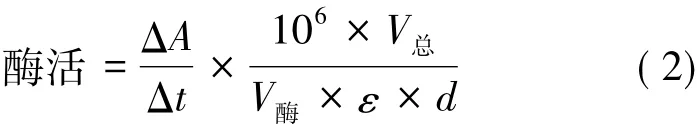
式中:ΔA/Δt为每分钟吸光值的变化率;V总为反应体系总体积(250μL);ε为NAD(P)H的摩尔消光系数,6.22×103L/(mol·cm);d为吸收光径(1 cm); V酶为反应体系中酶液体积(30μL)。
磷酸葡萄糖变位酶(phosphoglucomutase,PGM)测定体系:50 mmol/L三乙醇胺缓冲液(pH7.2)、5 mmol/L MgCl2、4 U葡萄糖-6-磷酸脱氢酶、0.4 mmol/L NADP+、1.4 mmol/L葡萄糖-1-磷酸。
磷酸葡萄糖异构酶(phosphoglucose isomerase,PGI)测定体系:50 mmol/L磷酸钾盐缓冲液(pH6.8)、5 mmol/L MgCl2、4 U葡萄糖-6-磷酸脱氢酶、0.4 mmol/L NADP+、5 mmol/L果糖-6-磷酸。
磷酸甘露糖异构酶(phosphomannose isomerase, PMI)测定体系:50 mmol/L MOPS(pH7.0)、10 mmol/L甘露糖-6-磷酸、1 mmol/L CoCl2、1 mmol/L NADP+、4 U磷酸葡萄糖异构酶、4 U葡萄糖-6-磷酸脱氢酶。
2 结果与讨论
灵芝具有多种功能性成分,而多糖是其中最为重要的一种。在不同的调控条件下,决定多糖性质的关键因素是酶,在多糖的合成中,由PGM催化葡萄糖-6-磷酸(glucose 6-phosphate,G-6-P)生成葡萄糖-1-磷酸(glucose 1-phosphate,G-1-P),在G-1-P的基础上,经过相关酶的催化,从而形成多糖单糖组成中的半乳糖、葡萄糖等,由此说明G-1-P是多糖合成中的中心代谢产物。因此,本实验在以葡萄糖为唯一碳源液态发酵灵芝的过程中,添加了中心代谢产物G-1-P,以此考察其对灵芝多糖产量、单糖组成及合成途径关键酶的影响。
2.1 G-1-P对灵芝产多糖的影响
G-1-P对灵芝产多糖的影响如图1所示。图1 (a)为葡萄糖与不同浓度的G-1-P混合,此条件下灵芝胞外多糖的产量先增加后减少,多糖产量的下降可能是由于培养基中的营养匮乏导致消耗自身生成的多糖。在发酵的第6天,对照组胞外多糖产量为0.416 g/L,而添加0.3 g/L和0.6 g/L的G-1-P条件下,灵芝多糖产量分别为0.379 g/L和0.359 g/L。与对照组相比,G-1-P的添加对产量并无明显影响。在发酵过程中对碳源的消耗如图1(b)所示,在不同的培养条件下对碳源的利用并无差异。
2.2 G-1-P对灵芝多糖单糖组成的影响
G-1-P的添加没有提高胞外多糖的产量,同时对单糖组成中各组分的比例没有明显影响。Lee等[20]在不同条件下培养裂蹄木层孔菌(Phellinus linteus),发现培养基的变化使多糖单糖组成发生改变。以某一单糖为唯一碳源液态发酵灵芝时,该种单糖在灵芝多糖的单糖组成中所占的比例均超过80%[16],以混合碳源培养灵芝时,培养基中的初始碳源为灵芝多糖的主要组分[17]。本文中,笔者以葡萄糖和不同浓度的G-1-P发酵灵芝,并研究其对胞外多糖单糖组成影响,结果如表1所示。由表1可以发现,多糖中的单糖组成并未发生明显变化,其中甘露糖、葡萄糖和半乳糖是其主要单糖组分。随着发酵的进行,灵芝胞外多糖中葡萄糖的比例不断下降,而甘露糖和半乳糖的比例不断提高,阿拉伯糖和木糖比例较少且在发酵中变化不大,此结果与之前的研究一致[16-17]。在之前的研究中发现,不同的转速和温度条件下葡萄糖的比例始终在80%以上[21],这与本实验的结果相符。
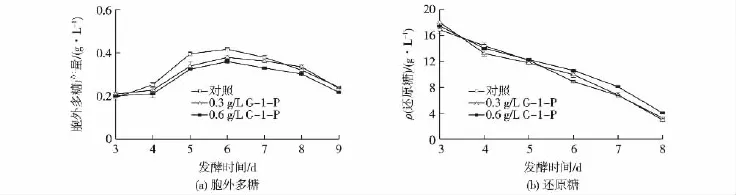
图1 灵芝液体深层发酵过程中的胞外多糖、还原糖含量Fig.1 Content of exopolysaccharrides and reducing sugar during submerged fermentation of G.lucidum
表1 G-1-P对灵芝胞外多糖单糖组成的影响
Table 1 Effects of G-1-P on the monosaccharide composition of exopolysaccharide during submerged fermentation of G.lucidum

发酵条件发酵时间/ d w(单糖)/%阿拉伯糖木糖甘露糖葡萄糖半乳糖对照3 0.14±0.01 0.09±0.02 0.56±0.02 98.45±0.40 0.77±0.16 4 0.12±0.03 0.16±0.04 1.50±0.10 97.27±0.28 0.12±0.09 5 0.11±0.01 0.12±0.01 4.96±0.32 90.41±0.60 4.40±0.30 6 0.04 0.08±0.02 4.34±0.41 91.97±0.36 3.56±0.04 7 0.23 0.52±0.08 8.06±0.30 86.94±0.50 4.25±0.01 0.3 g/L G-1-P 3 0.13±0.03 0.09 0.74±0.09 97.87±0.50 1.17±0.11 4 0.75 0.09 1.42±0.07 95.58±0.09 2.15±0.06 5 0.32±0.10 0.08 4.05±0.10 92.20±0.70 3.35±0.41 6 0.14±0.08 0.07 7.05±0.16 87.10±0.41 5.64±0.21 7 0.31±0.06 0.06 8.69±0.25 84.06±0.38 6.87±0.27 0.6 g/L G-1-P 3 0.29±0.06 0.11 0.63±0.08 98.87±0.29 0.50±0.10 4 0.25±0.01 0.11 2.24±0.11 94.32±0.38 3.43±0.08 5 0.16 0.11 3.22±0.20 94.03±0.40 2.74±0.20 6 0.09 0.09 8.27±0.49 86.10±0.16 5.45±0.60 7 0.22±0.02 0.20 9.61±0.15 84.05±0.91 5.93±0.18
2.3 G-1-P对灵芝多糖合成途径关键酶比酶活的影响
在不同的调控条件下决定多糖性质的关键因素是酶,发酵条件的变化可能导致灵芝多糖中单糖比例的变化,而这一变化主要是通过调节多糖合成酶的酶活实现。在之前的研究中发现,PGM酶活的变化与灵芝多糖中半乳糖比例正相关,PGI和PMI酶活与单糖组成中甘露糖比例正相关[17,21]。因此,本文中笔者通过添加不同量的G-1-P检测发酵过程中PGM、PGI和PMI酶活的变化,结果如表2所示。表2结果表明,在不同的发酵条件下,PGM、PGI、PMI的比酶活随着发酵的进行而提高,当培养基中加入G-1-P后PGM、PGI的比酶活略低于对照组,对PMI的影响不大,而PGM与多糖的产量间正相关[22-23],因此,G-1-P的添加对灵芝胞外多糖的产量无显著影响。

表2 G-1-P对多糖合成途径关键酶的影响Table 2 Effects G-1-P on phosphoglucomutase and phosphoglucose isomerase and phosphomannose isomerase activities during submerged fermentation of G.lucidum
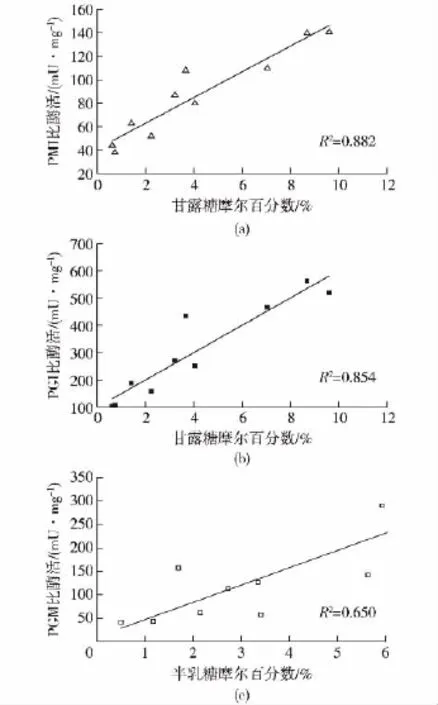
图2 G-1-P对灵芝多糖的单糖比例与相关酶比酶活的相关性的影响Fig.2 Relationship between mole percentages of mannose and galactose of EPS and activities of related enzymes under the addition of G-1-P
2.4 G-1-P对灵芝多糖的单糖比例与合成途径相关酶的相关性的影响
Li等[24]在研究微生物产碱杆菌(Alcaligenes)多糖产量与相关酶的比酶活关系时,认为二者之间的相关系数超过0.5时,就说明两者之间具有相关性,因此可以通过相关系数的分析确定灵芝多糖合成过程中影响多糖中单糖比例变化的酶。在不同的pH、温度、转速条件下,PGM和PGI的比酶活分别与半乳糖和甘露糖的摩尔比例具有相关性[21]。在利用混合碳源发酵灵芝时,葡萄糖和半乳糖混合作为碳源条件下,灵芝多糖的单糖组成中甘露糖的摩尔百分数与PMI、PGI相关,而葡萄糖和甘露糖作为碳源条件下,半乳糖的摩尔百分数与PGM相关[17]。在本文中,G-1-P对灵芝多糖的单糖比例与合成途径相关酶的相关性如图2所示。由图2可知:以葡萄糖为唯一碳源,添加一定浓度的G-1-P后,单糖组成中甘露糖的摩尔百分数与PMI、PGI比酶活的相关系数分别为0.882、0.854,表明PMI、PGI与灵芝多糖中甘露糖的比例相关,半乳糖的摩尔百分数与PGM的比酶活的相关系数为0.650,说明PGM与灵芝多糖中半乳糖比例相关。从单糖比例与相关酶相关性的研究中,得出PGI、PMI、PGM是影响单糖组成和比例的关键酶。
3 结论
灵芝多糖是灵芝主要活性物质之一,发酵过程中,培养条件细微的变化都会对灵芝菌体生长和多糖的合成产生影响。在以葡萄糖为唯一碳源液态发酵灵芝的过程中,不同浓度G-1-P的添加对灵芝多糖产量和单糖组成并无明显影响;检测多糖合成途径的3种关键酶酶活时发现,G-1-P的添加抑制PGM、PGI的表达,对PMI无明显影响;通过相关性分析发现,PGM、PGI、PMI是影响单糖组成的关键酶。此结果对实现灵芝多糖代谢的灵活调控提供了有益的参考。
[1]HARHAJI T L M,MIJATOVIC S A,MAKSIMOVIC-LVANIC D D,et al.Anticancer properties of Ganoderma lucidum methanol extracts in vitro and in vivo[J].J Nutr Cancer,2009,61(5): 696-707.
[2]GAO Y,GAO H,CHAN E,et al.Antitumor activity and underlying mechanisms of ganopoly,the refined polysaccharides extracted from Ganoderma lucidum in mice[J].Immunol Invest,2005,34(2):171-198.
[3]SHIAO M S.Natural products of the medicinal fungus Ganoderma lucidum:occurrence,biological activities,and pharmacological functions[J].Chem Record,2003,3(3):172-180.
[4]ZHU X L,CHEN A,LIN Z.Ganoderma lucidum polysaccharides enhance the function of immunological effector cells in immunosuppressed mice[J].J Ethnopharm,2007,111(2): 219-226.
[5]CHEN S,XU J,LIU C,et al.Genome sequence of the model medicinal mushroom Ganoderma lucidum[J].Nat Commun,2012,3(2):177-180.
[6]CHANG M Y,TSAIG J,HOUNG J Y.Optimization ofthe medium composition for the submerged culture of Ganoderma lucidum by Taguchi array design and steepest ascent method[J].Enzyme Microb Technol,2006,38(3):407-414.
[7]FANG Q H,ZHONG J J.Submerged fermentation of higher fungus Ganoderma lucidum for production of valuable bioactive metabolites:ganoderic acid and polysaccharide[J].Biochem Eng J,2002,10(1):61-65.
[8]TANG Y J,ZHANG W,LIU R S,et al.Scale-up study on the fedbatch fermentation of Ganoderma lucidum for the hyperproduction of ganoderic acid and Ganoderma polysaccharides[J].Process Biochem,2011,46(1):404-408.
[9]NG T B,WANG H X.Pharmacological actions of Cordyceps,a prized folk medicine[J].J Pharm Pharmacol,2005,57(12): 1509-1519.
[10]TANG Y,ZHU L,LIU R,et al.Quantitative response of cell growth and tuber polysaccharides biosynthesis by medicinal mushroom Chinese truffle Tuber sinense to metal ion in culture medium[J].Bioresour Technol,2008,99(16):7606-7615.
[11]BABITSKAYA V G,SHCHERBA V V,PUCHKOVA T A,et al.Polysaccharides of Ganoderma lucidum:factors affecting their production[J].Appl Biochem Microbiol,2005,41(2):169-173.
[12]HSIEH C,TSENG M H,LIU C J.Production of polysaccharides from Ganoderma lucidum(CCRC 36041)under limitations of nutrients[J].Enzyme Microb Technol,2006,38(1/2):109-117.
[13]TANG Y J,ZHANG W,ZHONG J J.Performance analyses of a pH-shift and DOT-shift integrated fed-batch fermentation process for the production of ganoderic acid and Ganoderma polysaccharides by medicinal mushroom Ganoderma lucidum[J].Bioresour Technol,2009,100(5):1852-1859.
[14]范卫强,尹鸿萍,周长林.虫草多糖的分离、纯化和初步药效活性研究[J].生物加工过程,2008,6(1):69-73.
[15]顾华杰,沈晨斌,严志舟,等.灰树花多糖的提取及抗氧化活性[J].生物加工过程,2012,10(1):19-24.
[16]王琼.灵芝菌丝体培养中多糖组分的变化与相关酶活性分析[D].无锡:江南大学,2013.
[17]PENG L,LI J,DING Z Y,etal.Effectof mixed carbon sources on galactose and mannose content of exopolysaccharide and related enzyme activities in Ganoderma lucidum[J].RSC Adv,2016(6): 39284-39291.
[18]DUBOIS M,GILLES K A,HAMILTON J K,et al.A colorimetric method for the determination of sugars[J].Nature,1951,168:167.
[19]DUBOIS M,GILLES K A,HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Anal Chem,1956,28:350.
[20]LEE J H,CHO S M,KIM H M,et al.Immunostimulating activity of polysaccharides from mycelia of Phellinus linteus grown under differentculture conditions[J].J Microb Biotechnol,1997,7(1): 52-55.
[21]乔双逵.液态发酵过程发酵条件对灵芝形态及灵芝多糖合成影响的研究[D].无锡:江南大学,2014.
[22]TANG Y J,ZHONG J J.Exopolysaccharide biosynthesis and related enzyme activities of the medicinal fungus,Ganoderma lucidum,grown on lactose in a bioreactor[J].Biotechnol Lett,2002,24(12):1023-1026.
[23]YANG H,MIN W,BIP,etal.Stimulatory effects of Coix lacrymajobi oil on the mycelialgrowth and metabolites biosynthesis by the submerged culture of Ganoderma lucidum[J].Biochem Eng J,2013,76:77-82.
[24]LI H,XU H,XU H,et al.Biosynthetic pathway of sugar nucleotides essential for welan gum production in Alcaligenes sp.CGMCC2428[J].Appl Microb Biotechnol,2009,86(1): 295-303.
(责任编辑管珺)
?
Effects of glucose-1-phosphate on the biosynthesis of Ganoderma lucidum polysaccharide
ZHANG Qiru1,2,DING Zhongyang1,2,ZHOU Zhemin1,GU Zhenghua1,2,ZHANG Liang1,2,SHI Guiyang1,2
(1.Key Laboratory of Industrial Biotechnology of the Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.National Engineering Laboratory for Cereal Fermentation Technology,Jiangnan University,Wuxi 214122,China)
Effects of glucose-1-phosphate(G-1-P)on the biosynthesis of Ganoderma lucidum polysaccharide(GLP)were studied with glucose as carbon source and differentconcentrations ofglucose-1-phosphate.Polysaccharide production,monosaccharide composition and GLP synthesis related enzymes were analyzed to determine key enzymes that influenced the monosaccharide composition of GLP.Results showed that the addition of G-1-P had no influence on polysaccharide production and monosaccharide composition of GLP.The addition of G-1-P inhibited the activities of phosphate glucose mutase(PGM) and glucose phosphate isomerase(PGI),but had no obvious effect on the activity of mannose phosphate isomerase(PMI).Correlation analysis show that activity of PGM was correlated with the mole percentage of galactose,whereas activities of PGI and PMI were correlated with the mole percentage of mannose.This study provided the reference to the regulation of the metabolism of GLP.
Ganoderma lucidum;exopolysaccharide;submerged fermentation;glucose-1-phosphate
TS219
A
1672-3678(2017)04-0009-06
10.3969/j.issn.1672-3678.2017.04.002
2016-03-31
国家自然科学基金(31271918);国家高技术研究发展计划(863计划)(2012AA021505)
张奇茹(1991—),女,河南南阳人,研究方向:发酵工学;丁重阳(联系人),教授,E-mail:zyding@jiangnan.edu.cn;周哲敏(联系人),教授,E-mail:zhmzhou@jiangnan.edu.cn
