一种增加毕赤酵母生产胰岛素前体的方法
2017-08-01梁晨晨王立罗秋玲吴静
梁晨晨,王立,罗秋玲,吴静
一种增加毕赤酵母生产胰岛素前体的方法
梁晨晨1,2,王立1,2,罗秋玲2,吴静1
1 江南大学药学院,江苏无锡 214122 2 江南大学食品科学与技术国家重点实验室,江苏无锡 214122

梁晨晨,王立, 罗秋玲, 等. 一种增加毕赤酵母生产胰岛素前体的方法. 生物工程学报, 2017, 33(7): 1178–1189.Liang CC, Wang L, Luo QL, et al. A method to increase the production of insulin precursor in Pichia pastoris. Chin J Biotech, 2017, 33(7): 1178–1189.
为了提高胰岛素前体 (PI) 的产量,构建了pPIC9K-PI表达载体并电转化至毕赤酵母菌株GS115中,在浓度为4.0 mg/mL的G418抗性平板上筛选到了1株拷贝数为12的菌株CL012。将SNAREs (可溶性N-乙基马来酰亚胺敏感因子受体蛋白) 组分中的SNC2和SNC2-SSO2分别转入菌株CL012中,并在摇瓶和5 L发酵罐水平上检测SNAREs对PI产量的影响。结果表明:摇瓶水平上,甲醇诱导96 h后,菌株CL012的PI产量为1.53 mg/L;表达SNC2和SNC2-SSO2的菌株的PI产量分别为1.89 mg/L和2.21 mg/L,分别比菌株CL012提高了23.53%和44.44%。在5 L发酵罐上进行高密度发酵,甲醇诱导96 h后菌株CL012的PI产量为53 mg/L,是摇瓶水平的34.64倍;表达SNC2和SNC2-SSO2的菌株的PI产量分别达到64 mg/L和78 mg/L,分别比菌株CL012提高了20.75%和47.17%。由此得出结论SNAREs可以促进胰岛素前体的分泌,从而提高在毕赤酵母中的异源表达。
毕赤酵母,胰岛素前体,SNAREs,异源表达
作为重要蛋白表达宿主,毕赤酵母广泛应用于不同来源 (人、动物、植物、真菌和病毒) 和不同类型(分泌型和非分泌型) 重组蛋白的高效生产[1-2]。但是,并不是所有的重组蛋白都能有效地分泌,这是因为重组蛋白的高水平表达面临着基因剂量[3]、mRNA的转录水平、蛋白质在内质网中的加工折叠[4]以及在胞质中的运输等诸多制约其产量的关键瓶颈。其中,重组蛋白的分泌运输是制约其高效生产的关键因素之一。重组蛋白在毕赤酵母中的分泌过程主要包括新生蛋白从核糖体上合成后到内质网的运输、蛋白质在内质网中的折叠、蛋白质从内质网到高尔基体的运输[5]以及蛋白从高尔基体到质膜的运输。分泌路径中的每一步都可能成为蛋白分泌的限速步骤,从而影响目标蛋白的有效分泌。其中新生蛋白到内质网的运输分为两种:共翻译运输[6]和翻译后运输[7];运输到内质网的新生肽链在内质网中折叠蛋白的作用下进行折叠加工[8];紧接着蛋白质从内质网运输到高尔基体进行进一步加工,加工成熟的蛋白质离开高尔基体运输到细胞质膜。蛋白质从内质网到高尔基体以及高尔基体到细胞质膜的运输需要运输囊泡的作用[9-11]。运输囊泡和靶膜之间的相互作用需要SNAREs的作用,SNAREs (可溶性N-乙基马来酰亚胺敏感因子附着型蛋白受体)是一种Ⅱ型膜蛋白,在运输囊泡和靶膜的膜融合过程中促使膜融合[12],促进蛋白的运输。
SNAREs分为两种:一种存在于靶膜上,被称为v-SNAREs;另一种存在于运输囊泡上,被称为t-SNAREs。v-SNAREs和特定靶膜上的t-SNAREs相互作用形成复合体SNAREs,称为SNAREpin[13]。SNAREpin由3种成分组成:Sso1/2、Sec9和Snc1/2。其中SNAREs复合体由Snc1/2和Sso1/2的各一个α螺旋区域和Sec9的两个螺旋区域组成。SNAREs已经被确定存在于内质网膜、高尔基体膜、液泡/溶酶体、质膜以及从这些膜衍生出的运输囊泡的膜上[14]。在促进蛋白运输的过程中,SNAREs在不同的囊泡和质膜之间的膜融合运输中扮演着重要的角色。van Zyl等[15]通过过表达酿酒酵母中SNC1将来自埃默森篮状菌的纤维二糖水解酶的产量提高71%,过表达SSO1将来自扣裹腹膜酵母的β-葡糖苷酶的产量提高43.8%。Xu等[16]发现在酿酒酵母中过表达SSO1可以将来自里氏木霉的纤维二糖水解酶的产量提高10%。Gasser等[17]通过在毕赤酵母中过表达SSO2将人免疫抗体Fab的产量提高20%。Hou等[11]发现过表达SNAREs蛋白的辅助蛋白SM蛋白中的组分SEC1可以使α-淀粉酶的产量提高16%。
除了优化毕赤酵母中高尔基体到质膜的分泌路径,人们还常常使用以下策略用来提高毕赤酵母中异源蛋白的生产,如:增加拷贝数[18]、优化密码子[19]、使用强启动子[20]、选择利于分泌的信号肽[21],以及共表达内质网中帮助新生蛋白的正确折叠的分子伴侣PDI[22]和BiP[7]等。Zhu等[23]通过将猪胰岛素前体基因的拷贝数增加到12,使得猪胰岛素前体的产量提高12.5倍,达到181 mg/L。Ben等[1]利用密码子优化的序列使得狂犬病毒糖蛋白的产量增加了2.1倍。Ben等[24]利用组成型启动子GAP替换AOX1启动子将狂犬病毒糖蛋白的产量增加了1.22倍。Vadhana等[25]利用自身信号肽代替α信号肽将南极假丝酵母脂肪酶B的产量提高了2倍。Shen等[26]在毕赤酵母中共表达PDI使得白细胞介素-1受体拮抗剂 (IL1ra) 的产量增加了2.4倍。Damasceno等[8]在毕赤酵母中共表达BiP使A33单链抗体 (A33scFv) 的产量提高了3倍。
本研究中为了提高胰岛素前体的产量,以胰岛素前体作为模式蛋白检测SNAREs对胰岛素前体从高尔基体到细胞质膜运输的作用。单独与同时共表达来自酿酒酵母的SNAREs,增加胰岛素前体的分泌。本实验中,首先在毕赤酵母中成功表达并分泌胰岛素前体基因 (PI),然后通过整合SNARE组分的SNC2和SSO2,提高胰岛素前体的表达。
1 材料与方法
1.1 材料
1.1.1 菌株与载体
pMD19-T-simple (TakaRa公司);pPICZα载体,pPIC9K载体,大肠杆菌JM109,毕赤酵母GS115,本实验室保存。pPIC6α载体,军事医学科学院放射与辐射医学研究所高新老师惠赠。
1.1.2 主要试剂和仪器
限制性内切酶Ⅰ、Ⅰ、RⅠ、Ⅰ、Ⅱ、Ⅰ、Ⅱ、DNA marker DL10000、DNA marker DL2000,购自大连宝生物工程公司;蛋白marker、蛋白质浓度测定试剂盒、Lyticase、引物合成、胶回收试剂盒、质粒提取试剂盒、DNA产物纯化试剂盒,购自上海生工生物工程公司;博莱霉素 (Zeocin)、遗传霉素 (G418)、杀稻瘟菌素(Blasticidin),购自Invitrogen公司;酵母基因组试剂盒,购自天根公司;iUniversal SYBR Green Supermix,购自Bio-rad 公司;PCR、QPCR扩增仪、全自动凝胶成像系统、电穿孔仪Green Pulser、核酸电泳仪、蛋白电泳仪,购自Bio-rad公司;Diode Array Bio Photometer U-0080D核酸浓度测定仪,购自HITACHI公司;5 L发酵罐,购自上海保兴生物设备工程有限公司。
1.1.3 培养基
低盐LB、YPD、YPDS、MD、BMGY、BMMY、BSM基础盐培养基、PTM1微量元素液的组成与配置参见Invitrogen公司毕赤酵母操作手册。
1.2 表达载体的构建
将含胰岛素前体基因PI的质粒pUC57-PI经RⅠ和Ⅰ双酶切连接至相同双酶切的pPIC9K质粒上,转化JM109后,进行菌落PCR验证。根据伴侣蛋白SNC2、SSO2基因序列设计寡核苷酸链,合成引物 (表1),通过PCR技术利用引物SNC2-F和SNC2-R、SSO2-F和SSO2-R分别以酿酒酵母的基因组为模板扩增出SNC2和SSO2基因序列,两端均分别含有Ⅱ和Ⅰ酶切位点。PCR产物纯化后将SNC2和SSO2的成熟片段与pMD19-T载体连接,转化JM109感受态,涂布于含氨苄抗性的LB固体培养基平板,将长出的单菌落进行PCR验证,验证正确的菌株送测序,将测序正确的菌株提取质粒后使用Ⅱ和Ⅰ双酶切后进行胶回收,与使用同样酶切的毕赤酵母表达载体pPICZα、pPIC6α相连接,构建克隆载体 (α信号肽已除) pPICZ-SNC2、pPICZ-SSO2和pPIC6-SSO2。
1.3 重组毕赤酵母的构建
用Ⅱ线性化的表达载体pPIC9K-PI电转化入毕赤酵母GS115后,涂布到MD固体平板上,将长出的单菌落接入YPD培养基,30℃培养至对数期,提取酵母基因组,以5′AOX1和3′AOX1为引物 (表1),PCR条件:95 ℃2 min;95 ℃ 30 s,55℃ 30 s,72 ℃ 1 min,30个循环;72 ℃延伸5 min,检测表达载体pPIC9K-PI是否整合进酵母基因组中。
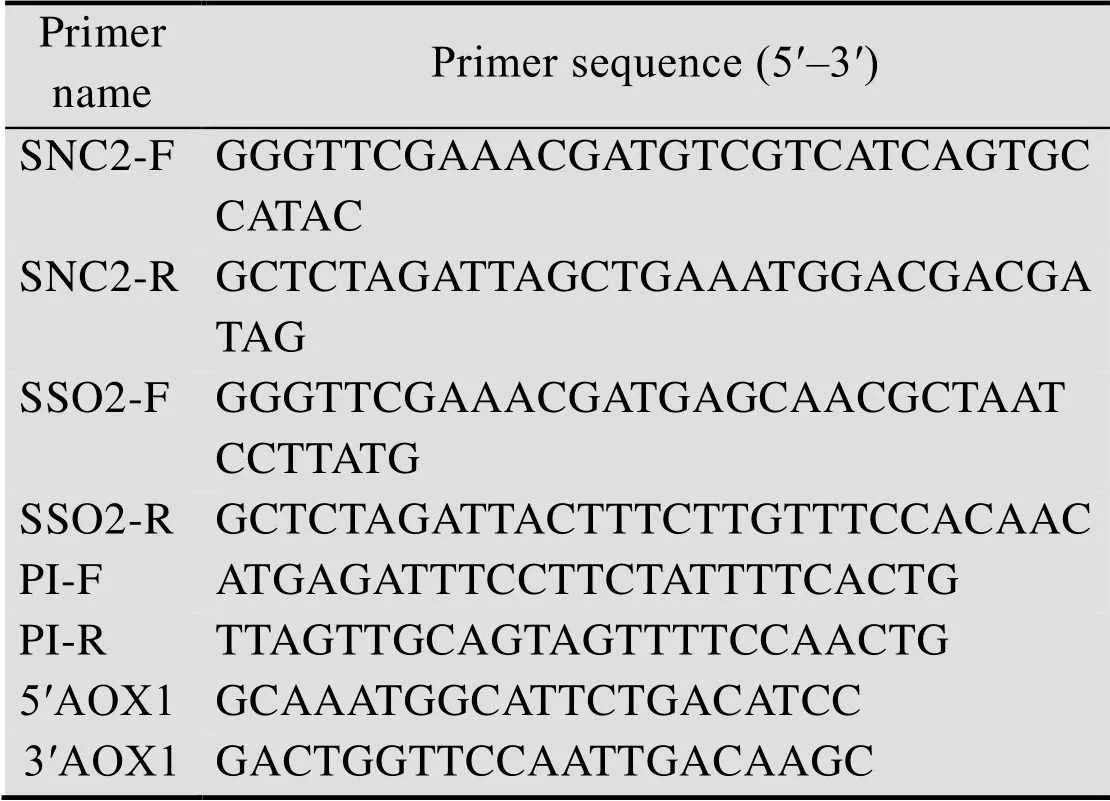
表1 PCR引物序列列表
1.4 重复电转化制备不同拷贝数的重组毕赤酵母
将MD平板上长出并且验证正确的菌株作为出发菌株,进行下一轮电转化。以选出的出发菌制作酵母感受态细胞,利用Ⅰ线性化的pPIC9K-PI对其再次电转化,将转化的菌液涂布到含不同浓度的G418的YPDS平板上,30 ℃倒置培养2–5 d,G418的浓度梯度为1.0、1.5、2.0、3.0和4.0 mg/mL,将长出的菌落再次划线于含相同浓度G418的YPDS 平板上,并以出发菌作对照,以5′AOX1和3′AOX1为引物,验证制备的不同拷贝数的重组毕赤酵母。
1.5 定量PCR确定PI基因拷贝数
质粒的构建:提取X-33菌株基因组,以GAP-F和GAP-R为引物 (表2) 从X-33基因组中扩增出GAP基因片段,将扩增出的GAP片段连接pMD19-simple-T载体,送测序,将测序正确的T载体命名为pMD19-GAP,制作内参的标准曲线;含有PI序列的表达载体pPIC9K-PI制作目的基因的标准曲线。
PI基因拷贝数的测定:待测酵母菌株接种于YPD中,30 ℃培养至对数期,收集约1×107个细胞,先用酵母细胞壁裂解酶 (Lyticase) 进行破壁处理30 min,再按照酵母基因组提取试剂盒说明进行操作。使用Beacon Designer 软件设计定量PCR引物 (表2)。反应体系:10 μL 2×SYBR Premix Ex,1 μL 10 μmol/L正向和反向引物,2 μL质粒 (制作标准曲线) 或待测重组毕赤酵母基因组为模板,6 μL水;反应条件:95 ℃ 2 min;95 ℃ 5 s,55 ℃ 30 s,72 ℃ 30 s,40个循环。荧光信号在每个循环延伸结束时采集,扩增后,融解曲线按仪器默认程序进行,即65–95 ℃,0.5 ℃/s,测定待测重组毕赤酵母PI基因的拷贝数[27]。
1.6 含SNAREs毕赤酵母菌株的构建
以Ⅰ线性化表达载体pPICZ-SNC2、pPICZ-SSO2 后电转化含PI拷贝数最高的毕赤酵母,分别涂布在100 μg/mL的含博莱霉素的抗性平板,30 ℃倒置培养2–5 d,将长出的菌落再次划线于含相同浓度博莱霉素的YPDS平板上,将长出的菌落进行基因组验证,以5′AOX1和3′AOX1为引物,验证含伴侣蛋白的重组毕赤酵母菌株的构建。将基因组验证正确的含SNC2的重组毕赤酵母菌株制作感受态,以Ⅰ线性化表达载体pPIC6-SSO2后电转化之,涂布在400 μg/mL含杀稻瘟菌素的抗性平板上。30 ℃倒置培养2–5 d,将长出的菌落再次划线于含相同浓度杀稻瘟菌素的YPDS平板上,将长出的菌落进行基因组验证,验证含两个SNAREs组成的SNC2、SSO2的重组毕赤酵母菌株的构建。
1.7 重组蛋白的诱导表达和Tricine-SDS-PAGE检测
将重组菌株GS115/pPIC9K-PI和分别整合分子伴侣的SNC2、SSO2、SNC2-SSO2的GS115/pPIC9K-PI的单菌落接种于50 mL生长培养基BMGY/500 mL三角瓶中,30 ℃、200 r/min培养24 h;将上述生长培养基中的菌液以4 000 r/min离心10 min后弃掉上清液,用30 mL BMMY培养基重新悬浮菌体,加入100%甲醇至终浓度为1% (/),30 ℃、200 r/min培养,每隔24 h补加100%甲醇至终浓度为1% (/) 进行诱导;甲醇诱导96 h后,12 000 r/min离心5 min,保留上清液,进行Tricine-SDS-PAGE或RP-HPLC。
1.8 重组毕赤酵母的高密度发酵
接1 mL重组毕赤酵母甘油管菌液于100 mL YPD/500 mL三角瓶中,200 r/min、30 ℃培养20 h;然后以10%接种量接入到2 L BSM培养基/5 L罐中进行发酵,用30%的氨水维持pH 5.5,当甘油耗尽后,溶氧陡然上升,开始流加甘油(控制溶氧大于10%),6 h后停止,待甘油再次耗尽并饥饿菌体2 h后,开始流加甲醇,并通过调节其流速维持培养基中的甲醇浓度在 2 g/L[28]。
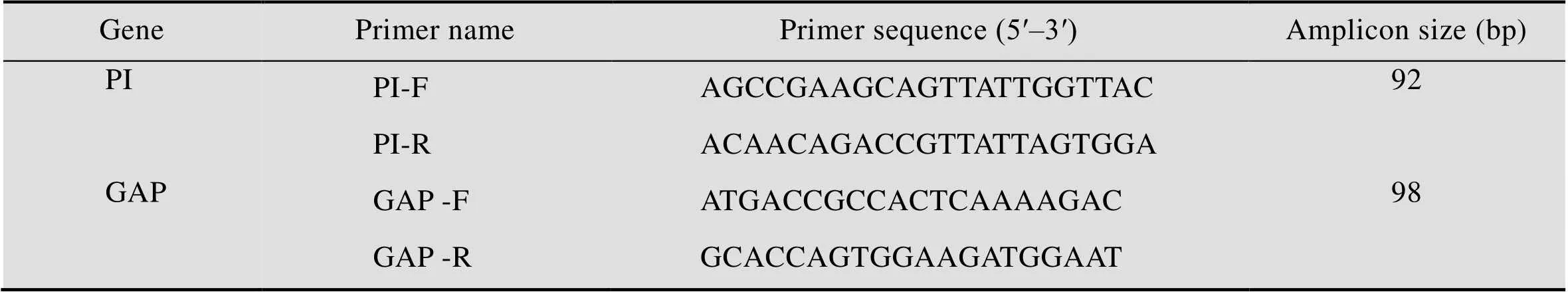
表2 定量PCR引物序列
胰岛素前体浓度的测定:发酵液于12 000×离心10 min,保留上清液,将上清用0.45 μm的微孔滤膜过滤后,利用液相进行分析。使用Dionex UltiMate 3000 system,色谱柱为Vydac Grace C18 (4.6 mm×250 mm) 色谱柱,柱温30 ℃,检测波长214 nm,进样量20 μL,采用梯度洗脱进行分析,流动相A为0.1% TFA水,B为0.1% TFA乙腈,梯度为20%–35% B (0–30 min),35%–70% B (30–35 min),70%–20% B (35–36 min),20%–20% B (36–46 min)。
2 结果与分析
2.1 多拷贝重组毕赤酵母菌株的构建和表达
用Ⅱ线性化表达载体pPIC9K-PI后电转化毕赤酵母GS115,涂布到MD平板上,将MD平板上长出并且验证正确的菌株作为出发菌株,进行下一轮电转化:以选出的出发菌株制作酵母感受态细胞,利用Ⅰ线性化的pPIC9K-PI对其再次电转化,转化液涂布到含有1.0、1.5、2.0、3.0和4.0 mg/mL G418的YPDS固体平板上 (图1A)。将不同浓度G418平板上筛选出的突变株进行基因组PCR验证,验证结果发现所有的菌株都可以扩增出2.2 kb (醇氧化酶基因) 和927 bp (表达载体上目的片段) 的片段 (图1B)。GAP (3′-磷酸甘油醛脱氢酶基因) 在酵母基因组中拷贝数为1,通过计算待测重组毕赤酵母基因组中目的基因总拷贝数与GAP总拷贝数的比值,确定出目的基因的拷贝数。对pMD19-GAP和表达载体pPIC9K-PI进行系列稀释,从而获得目的基因PI和内参基因GAP的标准曲线。然后将从1.0、1.5、2.0、3.0和4.0 mg/mL G418平板上筛选获得的突变菌株进行拷贝数测定,测定的拷贝数分别为2、3、6、7、12,将对应的菌株分别命名为CL002、CL003、CL006、CL007和CL012 (表3)。进一步将5株菌株分别进行甲醇诱导表达,胞外上清进行Tricine-SDS-PAGE分析 (图2),结果表明在6.7 kDa处有一明显条带,其中菌株CL012的条带最为明显。
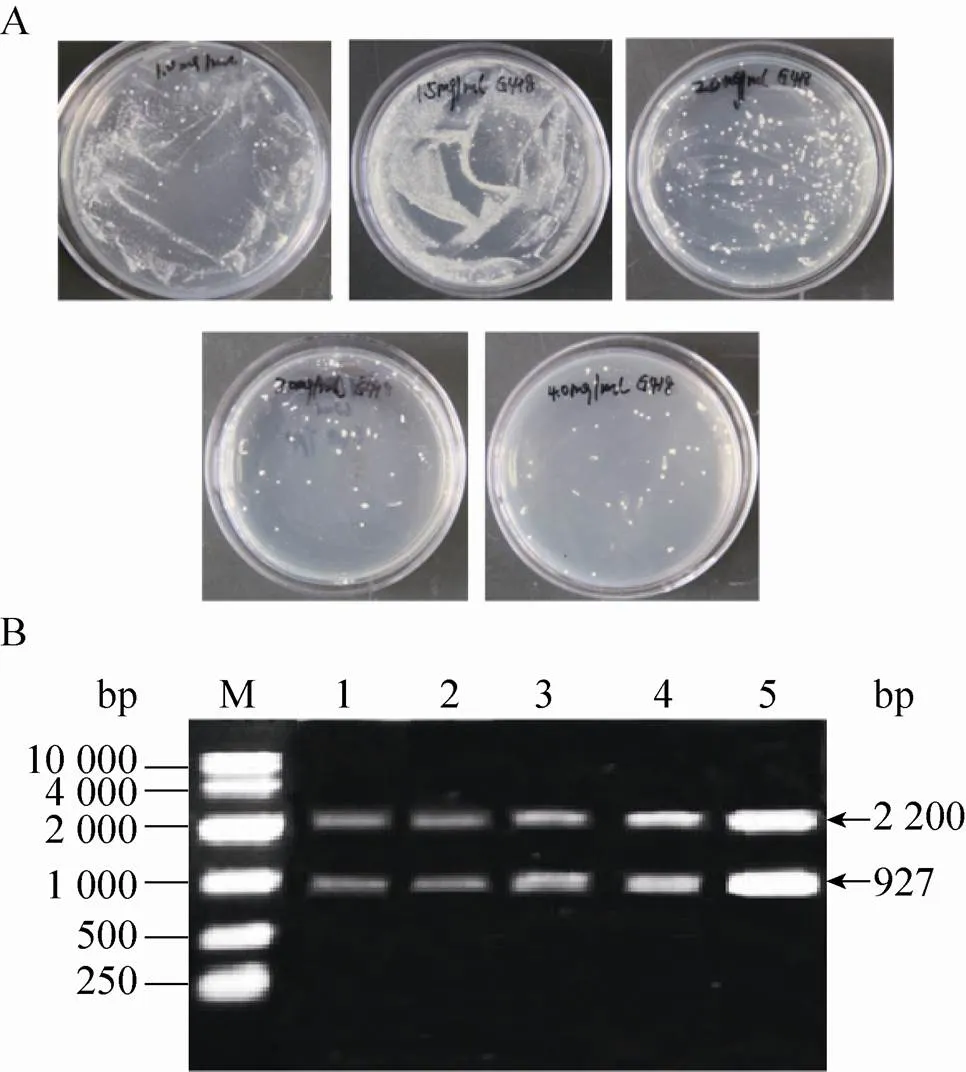
图1 多拷贝重组毕赤酵母的构建
2.2 含SNAREs重组毕赤酵母菌株的构建
将Ⅰ线性化的表达载体pPICZ-SSO2、pPICZ-SNC2电转化毕赤酵母CL012,涂布在100 μg/mL的含博莱霉素的抗性平板上,将长出的菌落进行基因组验证,将验证正确的菌株分别命名为CL0121和CL0122。以Ⅰ线性化表达载体pPIC6-SSO2后电转化毕赤酵母CL0122,涂布在400 μg/mL的含杀稻瘟菌素的抗性平板上,将长出的菌落进行基因组验证,将验证正确的菌株命名为CL0123。表达载体的构建过程如图3A所示。以5′AOX1和3′AOX1为引物进行基因组验证 (图3B),结果表明:菌株CL0121、CL0122和CL0123中都含有大小为2.2 kb (醇氧化酶基因) 和927 bp (表达载体pPIC9K-PI上的目的片段) 的片段,由于毕赤酵母表达载体pPICZα/pPIC6α自身可以扩增出588 bp (醇氧化酶基因) 大小的片段,而pPICZα/pPIC6α中信号肽的大小为266 bp且已经被切除,所以pPICZα/pPIC6α应该扩增出322 bp大小的片段,由于SNC2片段大小为348 bp,SSO2的大小为888 bp,所以表达载体pPICZ-SNC2、pPICZ-SSO2和pPIC6-SSO2扩增出的大小分别为670 bp、1 210 bp和1 210 bp的片段。
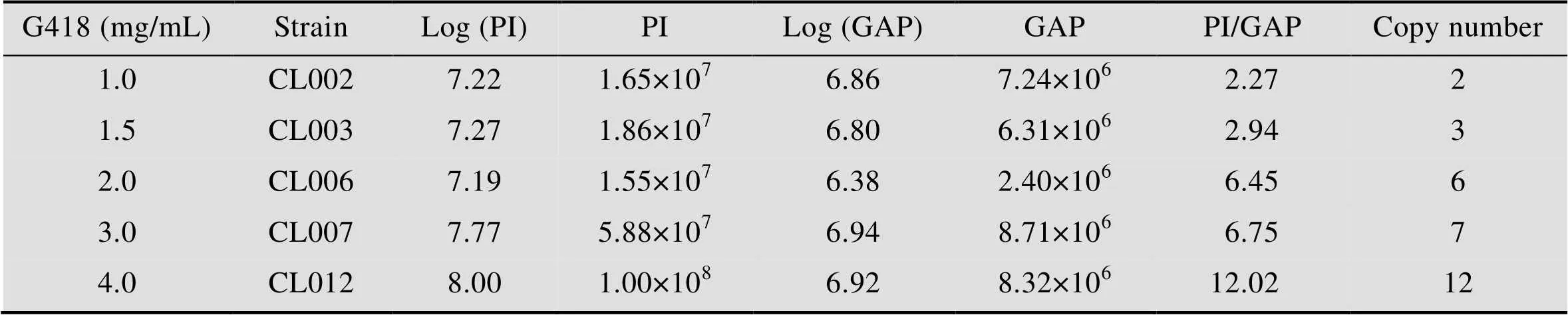
表3 不同浓度G418平板上筛选出的菌株PI基因拷贝数的测定
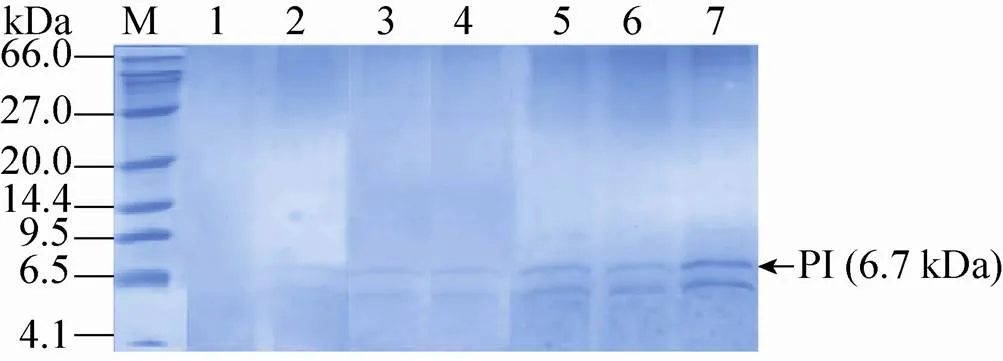
图2 不同拷贝数重组蛋白PI表达上清的Tricine-SDS-PAGE分析
2.3 摇瓶水平检测SNAREs对PI表达的影响
将菌株CL012、CL0121、CL0122和CL0123经甲醇诱导96 h后,保留上清液,进行Tricine-SDS-PAGE (图4A) 和RP-HPLC。其中CL012菌株作为对照菌株,发现对照菌株CL012的产量为1.53 mg/L,菌株CL0121、CL0122和CL0123的产量分别为1.58 mg/L、1.89 mg/L和2.21 mg/L,比对照菌株CL012提高了3.27%、23.53%和44.44% (图4B)。菌株CL012的生产能力为0.015 mg/(L·h),CL0121、CL0122和CL0123的生产能力分别为0.016 mg/(L·h)、0.019 mg/(L·h) 和0.023 mg/(L·h)(图4C),比对照菌株CL012提高了6.67%、26.67%和53.33%。
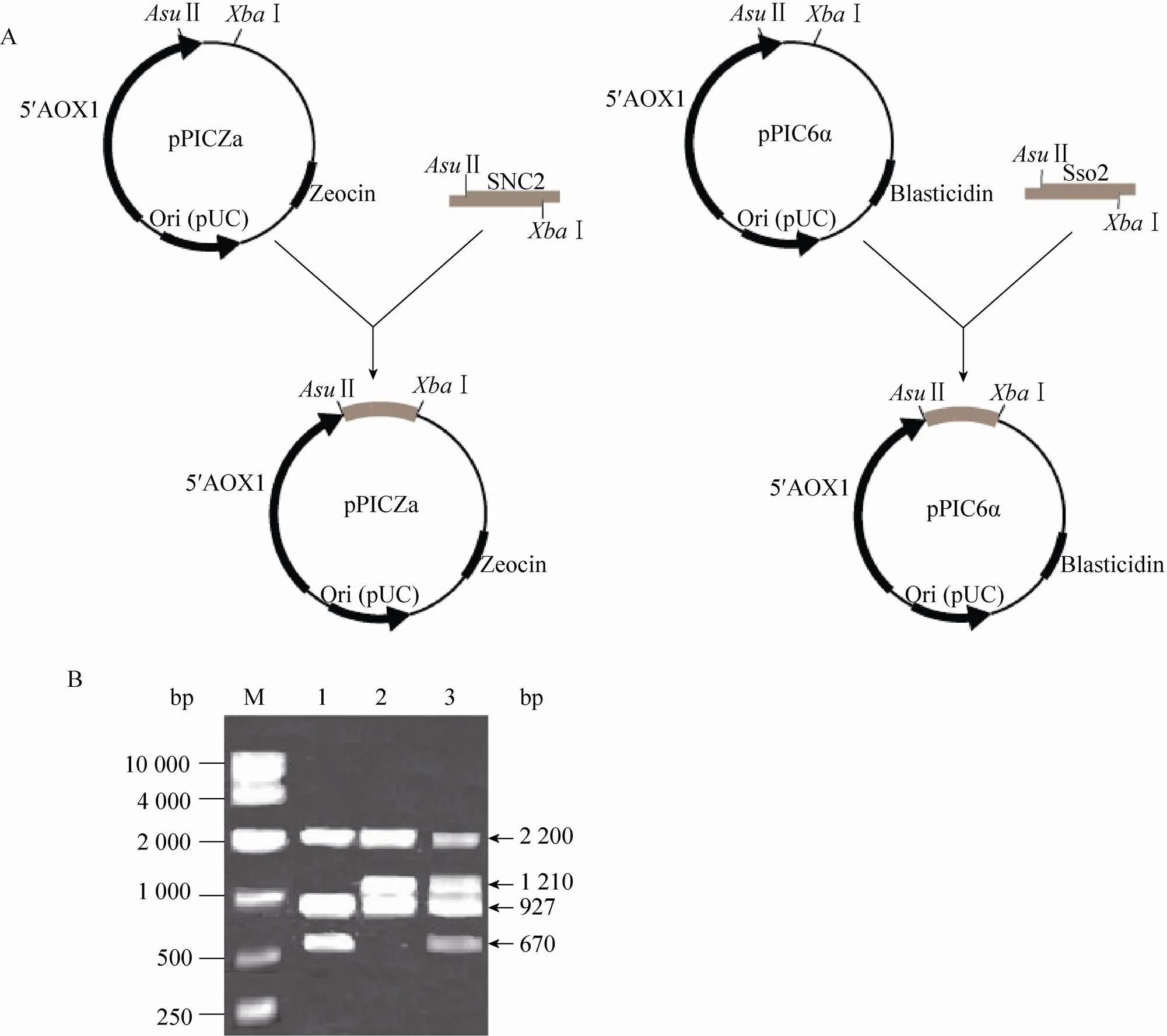
图3 含SNAREs的重组毕赤酵母的构建
2.4 高密度发酵水平检测SNAREs对PI表达的影响
选取重组毕赤酵母CL012、CL0121、CL0122和CL0123在5 L发酵罐上以甘油为碳源进行分批补料发酵,20 h甘油耗尽,继续流加甘油6 h,待溶氧陡然升高后再饥饿菌体2 h,然后流加甲醇开始诱导培养,并维持培养液中甲醇浓度为2 g/L,共诱导96 h。发酵液上清进行Tricine-SDS-PAGE分析 (图5),高密度发酵数据如图6所示,相关发酵参数计算并总结于表4。其中CL012是对照菌株,结果表明:在 5 L发酵罐上进行高密度发酵,甲醇诱导96 h后菌株CL012的600达到567,甲醇诱导96 h后菌株CL0121、CL0122和CL0123的600分别为502、460和470,比菌株CL012分别降低了12.95%、23.26%和20.64% (图6A)。对照菌株CL012的产量为53 mg/L,菌株CL0121、CL0122和CL0123的产量分别为54 mg/L、64 mg/L和 78 mg/L (图6B),比对照菌株CL012提高了1.89%、20.75%和47.17%。5 L发酵罐上进行高密度发酵,CL012的600达到567,产量为 53 mg/L,是摇瓶水平的34.64倍。CL0121、CL0122和CL0123的罐上产量分别是摇瓶水平的34.18倍、33.86倍和35.29倍。高密度发酵可以大幅度提升菌体的密度,增加胰岛素前体的产量。5 L发酵罐的发酵周期是124 h,对照菌株CL012单位时间内生产胰岛素前体的生产能力为0.43 mg/(L·h),菌株CL0121的生产能力也是0.43 mg/(L·h),CL0122和CL0123的生产能力分别为0.52 mg/(L·h)和0.63 mg/(L·h),比对照菌株CL012提高了20.93%和46.51%。
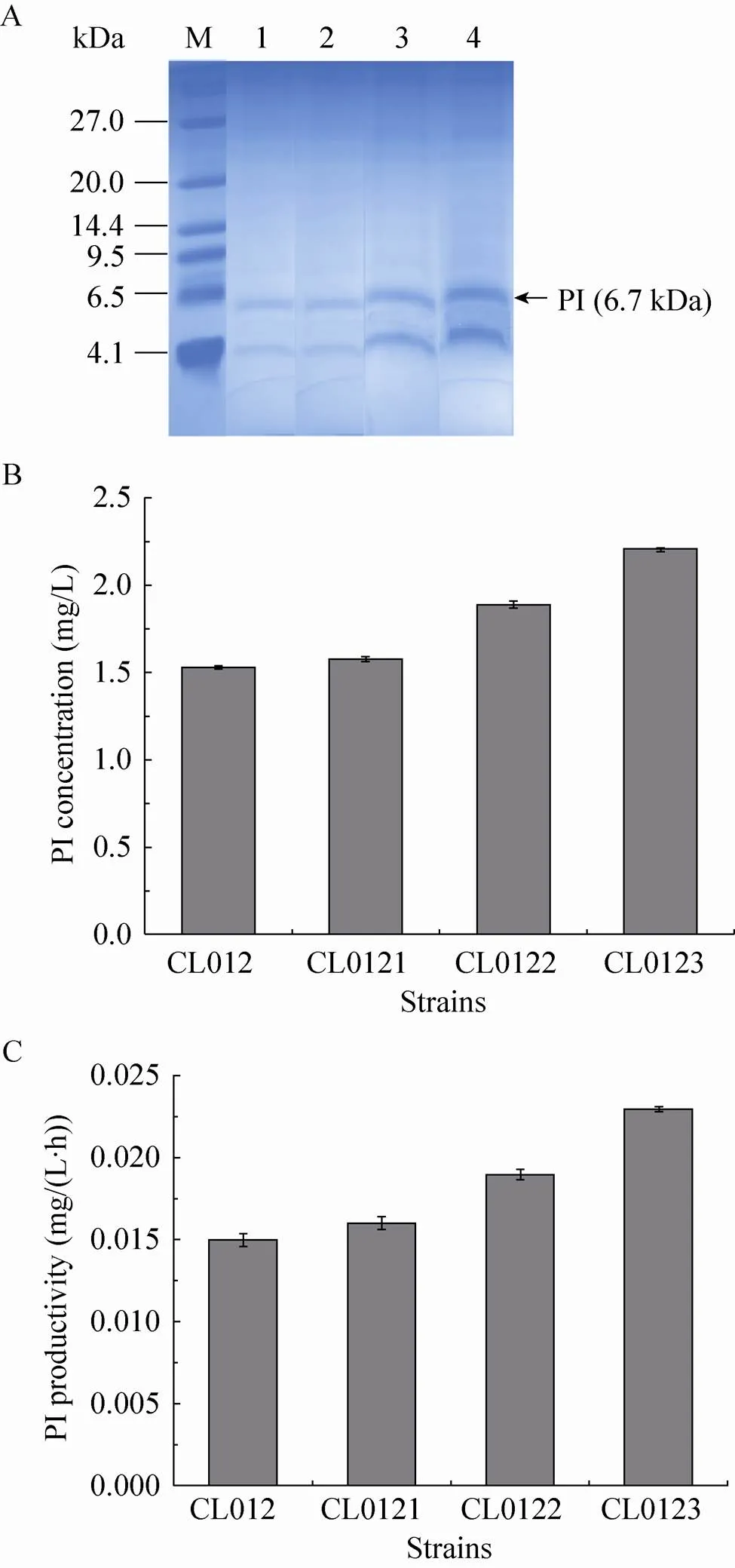
图4 摇瓶水平检测SNAREs对PI表达的影响
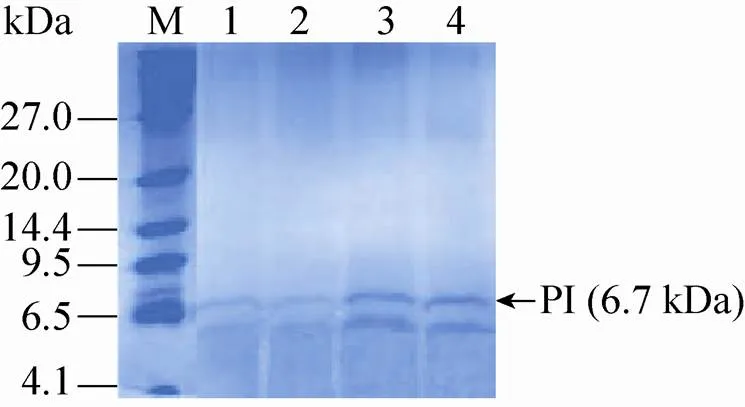
图5 Tricine-SDS-PAGE分析发酵罐水平上SNAREs对PI的影响
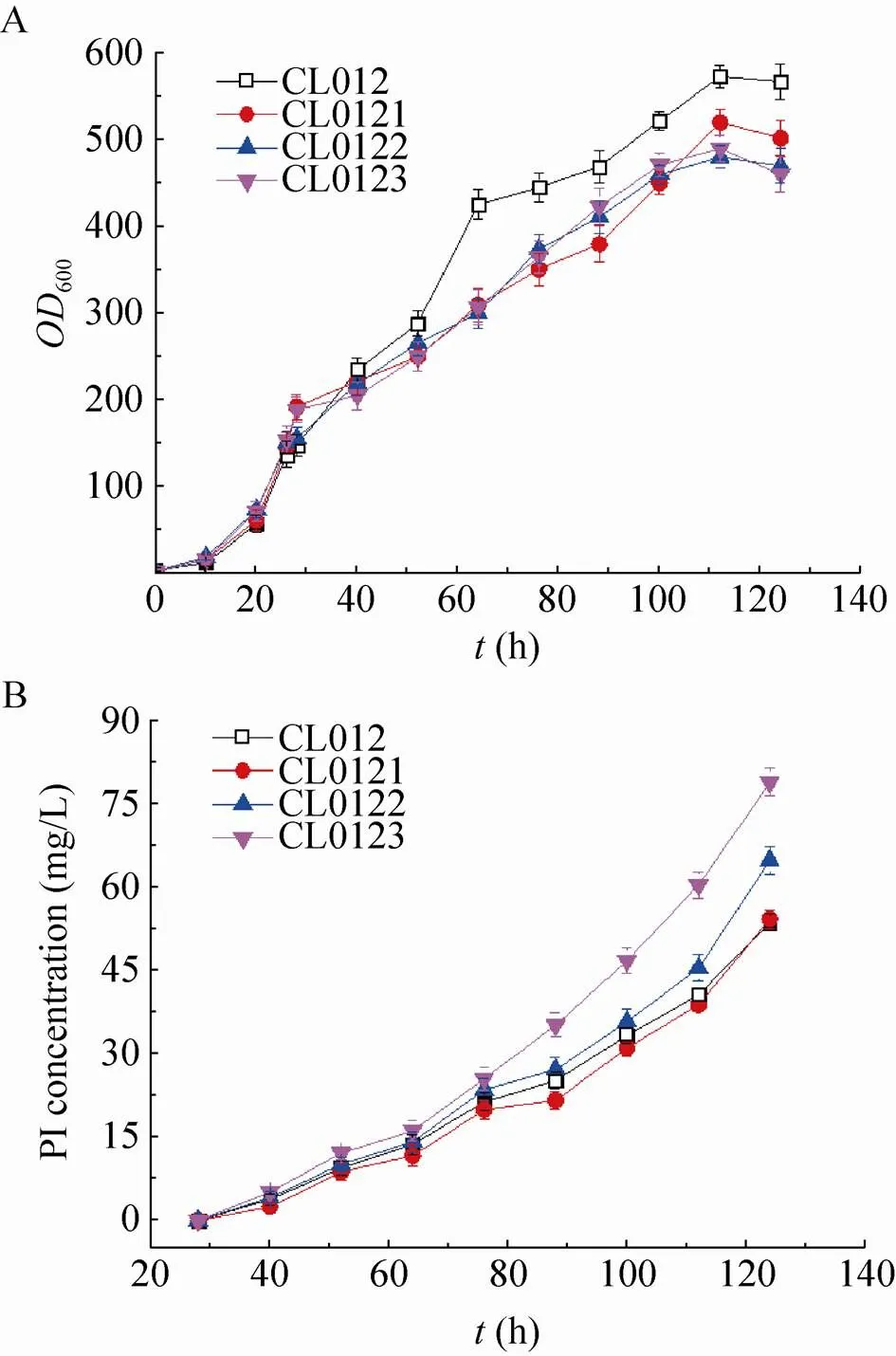
图6 高密度发酵检测SNAREs对胰岛素前体产量的影响
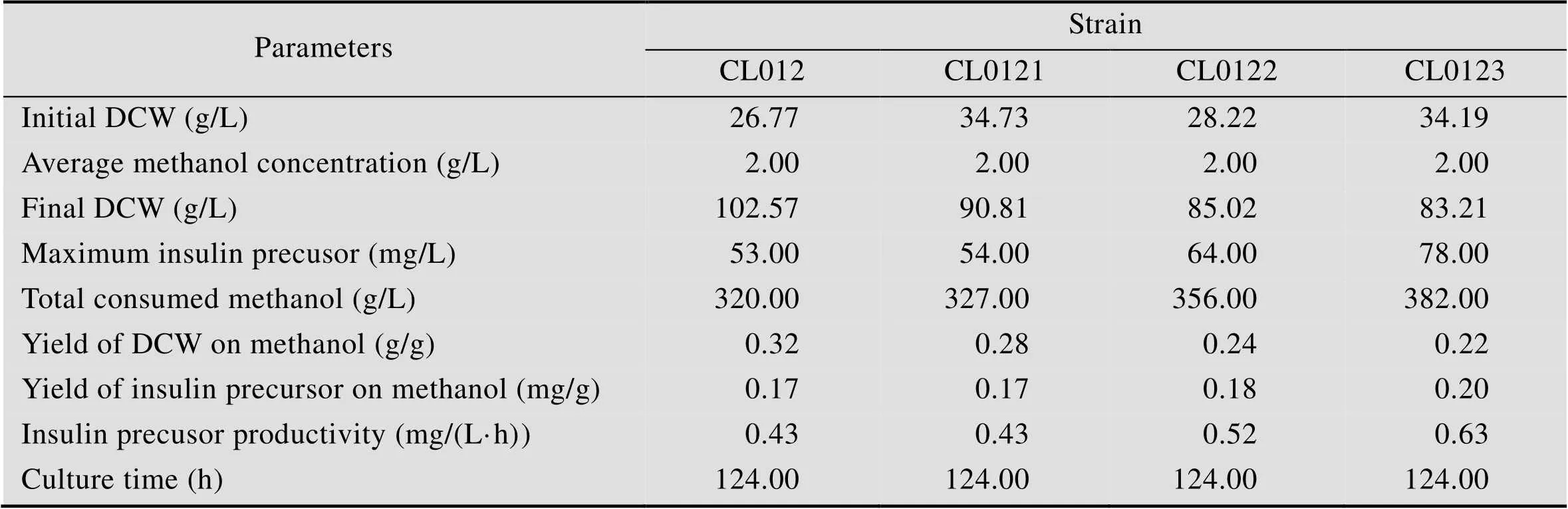
表4 甲醇诱导阶段重组毕赤酵母细胞生长和PI的合成情况
3 讨论
毕赤酵母表达系统已经是一种成熟的外源蛋白表达系统,由于分泌路径的瓶颈导致很多外源蛋白留在胞内,不能有效地运输到胞外[9]。本文通过共表达SNAREs中的组分SNC2和SSO2希望可以增加目的蛋白从高尔基体到细胞质膜的运输,增加目的蛋白的分泌。本文以胰岛素前体 (PI) 作为模式蛋白,研究SNAREs在毕赤酵母中促进异源蛋白从高尔基体到细胞质膜的运输作用。SNAREs通过和其辅助蛋白SM相互作用,SM蛋白结合到t-SNARE的突触区域,促进t-SNARE和运输囊泡上的v-SNARE结合,t-SNARE和v-SNARE结合后就会引起构型改变,在靶膜上形成融合孔,促进目的蛋白的释放[13]。在5 L发酵罐上单独表达SNC2可以使PI的产量提高20.75%,同时PI的生产能力也增加了20.93%,说明表达SNC2可以促进胰岛素前体更多释放,也和SNC2本身可以促进目的蛋白从高尔基体到细胞质膜的运输作用相一致。单独表达SSO2对PI的产量没有影响,不能促进更多的胰岛素前体从高尔基体到细胞质膜的运输。但是同时共表达SNC2和SSO2可以进一步提高胰岛素前体的产量,使PI的产量提高47.17%,对PI的生产能力提高46.51%。SNC2属于v-SNARE,SSO2属于t-SNARE,说明SNC2和SSO2在促进PI于毕赤酵母中的运输过程中具有协同作用,将两者共表达时可以进一步促进胰岛素前体的运输,提高胰岛素前体的产量。蛋白伴侣之间经常存在着这种协同作用,如陈飞等[22]利用PDI和Ero1之间的协同作用将灰盖鬼伞过氧化物酶的酶活提高2.62倍。Shusta等[29]利用PDI和BIP之间的协同作用将单链抗体片段的产量提高了8倍。
本文通过共表达促进高尔基体到细胞质膜的SNAREs组分,提高了毕赤酵母分泌异源蛋白的能力,寻找到了一种可以提高异源蛋白在毕赤酵母中表达的方法,为促进其他外源蛋白在毕赤酵母中的分泌提供了新的方法和思路,同时也找到了一种可以提高胰岛素前体产量的新方法。
REFERENCES
[1] Ben AS, Belhaj AE, Göngrich R, et al. Molecular optimization of rabies virus glycoprotein expression in. Microb Biotechnol, 2016, 9(3): 355–368.
[2] Damasceno LM, Huang CJ, Batt CA. Protein secretion inand advances in protein production. Appl Microbiol Biotechnol, 2012, 93(1): 31–39.
[3] Nordén K, Agemark M, Danielson JÅ, et al. Increasing gene dosage greatly enhances recombinant expression of aquaporins in. BMC Biotechnol, 2011, 11(1): 47.
[4] Sha C, Yu XW, Zhang M, et al. Efficient secretion of lipase r27RCL inby enhancing the disulfide bond formation pathway in the endoplasmic reticulum. J Ind Microbiol Biotechnol, 2013, 40(11): 1241–1249.
[5] van Zyl JHD, den Haan R, van Zyl WH. Overexpression of nativeER-to-Golgi SNARE genes increased heterologous cellulase secretion. Appl Microbiol Biotechnol, 2016, 100(1): 505–518.
[6] Bui N, Strub K. New insights into signal recognition and elongation arrest activities of the signal recognition particle. Biol Chem, 1999, 380(2): 135–145.
[7] Zhang W, Zhao HL, Xue C, et al. Enhanced secretion of heterologous proteins infollowing overexpression ofchaperone proteins. Biotechnol Progr, 2006, 22(4): 1090–1095.
[8] Damasceno LM, Anderson KA, Ritter G, et al. Cooverexpression of chaperones for enhanced secretion of a single-chain antibody fragment in. Appl Microbiol Biotechnol, 2007, 74(2): 381–389.
[9] Marizela D, Rebecca G, Diethard M, et al. Engineering of protein folding and secretion-strategies to overcome bottlenecks for efficient production of recombinant proteins. Antioxid Redox Sign, 2014, 21(3): 414–437.
[10] Delic M, Valli M, Graf AB, et al. The secretory pathway: exploring yeast diversity. FEMS Microbiol Rev, 2013, 37(6): 872–914.
[11] Hou J, Tyo K, Liu ZH, et al. Engineering of vesicle trafficking improves heterologous protein secretion in. Metab Eng, 2012, 14(2): 120–127.
[12] Malsam J, Kreye S, Söllner TH. Membrane fusion: SNAREs and regulation. Cell Mol Life Sci, 2008, 65(18): 2814–2832.
[13] Jahn R, Scheller RH. SNAREs-engines for membrane fusion. Nat Rev Mol Cell Bio, 2006, 7(9): 631–643.
[14] Burri L, Lithgow T. A complete set of SNAREs in yeast. Traffic, 2004, 5(1): 45–52.
[15] van Zyl JHD, den Haan R, van Zyl WH. Over-expression of nativeexocytic SNARE genes increased heterologous cellulase secretion. Appl Microbiol Biotechnol, 2014, 98(12): 5567–5578.
[16] Xu LL, Shen Y, Hou J, et al. Secretory pathway engineering enhances secretion of cellobiohydrolase I fromin. J Biosci Bioeng, 2014, 117(1): 45–52.
[17] Gasser B, Sauer M, Maurer M, et al. Transcriptomics-based identification of novel factors enhancing heterologous protein secretion in yeasts. Appl Environ Microb, 2007, 73(20): 6499–6507.
[18] Gong XY, Ding CY, Liu LM, et al. Enhancement of human insulin precursor production by increasing the copy number in. Acta Microbiol Sin, 2013, 53(6): 545–552 (in Chinese).龚香艺, 丁重阳, 刘立明, 等. 一种增加重组毕赤酵母拷贝数提高胰岛素前体产量的策略. 微生物学报, 2013, 53(6): 545–552.
[19] Zhao HL, Blazanovic K, Choi Y, et al. Gene and protein sequence optimization for high-level production of fully active and aglycosylated lysostaphin in. Appl Environ Microb, 2014, 80(9): 2746–2753.
[20] Vogl T, Glieder A. Regulation ofpromoters and its consequences for protein production. New Biotechnol, 2013, 30(4): 385–404.
[21] Yarimizu T, Nakamura M, Hoshida H, et al. Synthetic signal sequences that enable efficient secretory protein production in the yeast. Microb Cell Fact, 2015, 14(1): 20.
[22] Chen F, Hu MR, Jiang XZ, et al. Enhancement of Coprinus cinereus peroxidase inby co-expression chaperone PDI and Ero1. Chin J Biotech, 2015, 31(12): 1682–1689 (in Chinese).陈飞, 胡美荣, 江贤章, 等. 共表达分子伴侣PDI和Ero1对灰盖鬼伞过氧化物酶在毕赤酵母中表达的影响. 生物工程学报, 2015, 31(12): 1682–1689.
[23] Zhu T, Guo M, Tang Z, et al. Efficient generation of multi-copy strains for optimizing secretory expression of porcine insulin precursor in yeast. J Appl Microbiol, 2009, 107(3): 954–963.
[24] Ben AS, Belhaj AE, Kallel H. Rabies virus glycoprotein enhanced expression inusing the constitutive GAP promoter. Biochem Eng J, 2016, 113: 77–85.
[25] Vadhana AKP, Samuel P, Berin RM, et al. Improved secretion oflipase B with its native signal peptide in. Enzyme Microb Technol, 2013, 52(3): 177–183.
[26] Shen Q, Wu M, Wang HB, et al. The effect of gene copy number and co-expression of chaperone on production of albumin fusion proteins in. Appl Microbiol Biotechnol, 2012, 96(3): 763–772.
[27] Lee C, Kim J, Shin SG, et al. Absolute and relative QPCR quantification of plasmid copy number in. J Biotechnol, 2006, 123(3): 273–280.
[28] Gurramkonda C, Polez S, Skoko N, et al. Application of simple fed-batch technique to high-level secretory production of insulin precursor usingwith subsequent purification and conversion to human insulin. Microb Cell Fact, 2010, 9(1): 31.
[29] Shusta EV, Raines RT, Plückthun A, et al. Increasing the secretory capacity offor production of single-chain antibody fragments. Nat Biotechnol, 1998, 16(8): 773–777.
(本文责编 郝丽芳)
A method to increase the production of insulin precursor in
Chenchen Liang1,2, Li Wang1,2, Qiuling Luo2, and Jing Wu1
1 College of Pharmacy, Jiangnan University, Wuxi 214122, Jiangsu, China 2 State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122,Jiangsu,China
To improve the yield of insulin precursor (PI), we constructed a recombinant expression vector pPIC9K-PI and transformed it intoGS115 using electroporation. After screening, a mutant strain CL012 with 12 copies was obtained on the YPDS plate containing 4.0 mg/mL G418. Then, the components of SNAREs (Soluble-ethylmaleimide-sensitive factor attachment receptor proteins), SNC2 and SNC2-SSO2, were expressed in the strain CL012 to explore the effect of SNAREs on the yield of PI. In shake flask culture, the strains expressing SNC2 and SNC2-SSO2 yielded PI of 1.89 mg/L and 2.21 mg/L after methanol induction for 96 h, which were improved by 23.53% and 44.44% compared to that of strain CL012 (1.53 mg/L), respectively. Further, in a 5-L bioreactor, the yield of PI with strain CL012 was 53 mg/L for high-density fermentation, after 96 h of methanol induction, which was 34.64-fold higher than that of shake culture. The strains expressing SNC2 and SNC2-SSO2 yielded the PI of 64 mg/L and 78 mg/L, which were respectively increased by 20.75% and 47.17%, compared to that of strain CL012. This work indicated that SNAREs components promoted the secretion of PI to improve its heterologous expression in.
, insulin precursor, SNAREs, heterologous expression
January 11, 2017; Accepted:March 24, 2017
Jing Wu. Tel: +86-510-85197873; E-mail: wujing@jiangnan.edu.cn
Supported by:Key Technologies R&D Program of Jiangsu Province (No. BE2014652), National Natural Science Foundation of China (No. 21576117), Natural Science Foundation of Jiangsu Province (Nos. BE2015307, BK20131103).
江苏省科技支撑计划社会发展项目 (No. BE2014652),国家自然科学基金 (No. 21576117),江苏省自然科学基金 (Nos. BE2015307, BK20131103) 资助。
