两种新型席夫碱-Mn(Ⅱ)配合物-壳聚糖复合材料的合成表征及其SOD活性
2017-08-01瞿隽申潘志权
瞿隽申,周 红,潘志权
(武汉工程大学化学与环境工程学院,湖北 武汉 430073)
两种新型席夫碱-Mn(Ⅱ)配合物-壳聚糖复合材料的合成表征及其SOD活性
瞿隽申,周 红*,潘志权
(武汉工程大学化学与环境工程学院,湖北 武汉 430073)
以二乙烯三胺、三乙烯四胺分别与间苯二醛反应合成二乙烯三胺-间苯二醛席夫碱(L1)、三乙烯四胺-间苯二醛席夫碱(L2),然后与醋酸锰反应合成了两种席夫碱-Mn(Ⅱ)配合物,进而与壳聚糖凝胶反应合成了两种席夫碱-Mn(Ⅱ)配合物-壳聚糖复合材料L1-Mn(Ⅱ)-壳聚糖和L2-Mn(Ⅱ)-壳聚糖,对其结构进行了傅立叶变换红外光谱(FTIR)、扫描电子显微镜(SEM)及X-射线光电能谱(XPS)表征,采用氯化硝基四氮唑蓝(NBT)法测定两种复合材料的SOD活性,并对它们的重复利用性进行了测试。FTIR、SEM及XPS表征结果表明,配合物与壳聚糖成功交联;L1-Mn(Ⅱ)-壳聚糖、L2-Mn(Ⅱ)-壳聚糖的IC50分别为3.40 μg·mL-1、6.15 μg·mL-1,都具有较好的SOD活性;两种材料稳定且具有较好的重复利用性。
席夫碱配合物;壳聚糖;SOD活性
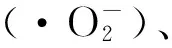

而人体细胞由于某些原因如老化等,可能无法分泌足够多的SOD与CAT。而外源性摄入SOD与CAT非常困难。因酶类属于蛋白质,它们难以通过细胞膜且对储存环境要求极高,这使得研究酶模拟物显得愈发重要[8-9]。
根据中心金属离子不同,天然的SOD可以分为铜锌SOD[10]、铁SOD[11]、镍SOD[12-13]与锰SOD。其中锰SOD因具有高活性与低毒性而受到广泛关注,含锰配合物可能具有很高的SOD潜力以及相对的低毒性。壳聚糖具有天然的低毒性、高生物相容性,被广泛应用于生物标记[14]、伤口愈合[15]以及作为药物载体[16],干粉状的壳聚糖也被应用于药物领域[17]。而许多金属配合物在水溶液环境中并不稳定,基于以上考虑,作者结合锰配合物的高SOD活性和壳聚糖的高生物相容性与低毒性,设计并合成了两种不同的席夫碱配合物,将它们与醋酸锰配合并与壳聚糖结合合成复合材料,并考察了它们的SOD活性和重复利用性。复合材料的合成路线如图1所示。

图1 两种复合材料的合成路线
1 实验
1.1 试剂与仪器
二乙烯三胺、三乙烯四胺、间苯二醛、乙醇、甲醇、N,N-二甲基甲酰胺(DMF)、磷酸二氢钠、磷酸氢二钠、核黄素(维生素B2)、乙二胺四乙酸二钠(EDTA)、蛋氨酸(Met),均为分析纯,国药集团化学试剂有限公司,其中二乙烯三胺与三乙烯四胺减压重蒸后使用,其它试剂均直接使用;三聚磷酸钠(TPP),分析纯,麦克林;壳聚糖(脱乙酰度95%),武汉格奥化学试剂有限公司;氯化硝基四氮唑蓝(NBT),阿法埃莎;来源于牛肝的SOD,Sigma公司,保存于-20 ℃冰箱中。
EL204型分析天平,梅特勒-托利多(上海)仪器有限公司;DF-101S型恒温磁力油浴锅,巩义予华仪器厂;DZF-6050型真空干燥箱,上海精宏实验设备有限公司。
1.2 二乙烯三胺-间苯二醛席夫碱(L1)/三乙烯四胺-间苯二醛席夫碱(L2)的合成
二乙烯三胺先用钠丝处理数日,至摇晃时没有明显气泡出现。小心地滤除二乙烯三胺中的钠丝,加入40 g(每500 mL)无水氢氧化钠颗粒,搅拌加热2 h。减压蒸馏,取沸点为156 ℃(0.05 atm下)的馏分作为备用试剂。重蒸后二乙烯三胺颜色明显变淡,为透明略带淡黄色液体。
三乙烯四胺处理方法与二乙烯三胺相似,其沸点略高,0.05 atm下约为165 ℃,重蒸后颜色明显变淡,为透明澄清淡黄色液体。
取重蒸过的二乙烯三胺0.01 mol(1.031 g)溶于20 mL无水乙醇中,将其缓缓滴入40 mL溶有0.021 mol(2.82 g)间苯二醛的乙醇中,于1 h内滴完。滴加完成后继续反应5 h,期间可见淡黄色沉淀缓缓生成。反应结束后收集沉淀并用甲醇多次洗涤,于40 ℃真空干燥24 h,所得淡黄色粉末即配体L1,备用。
取重蒸过的三乙烯四胺0.01 mol(1.462 g)同法合成配体L2。
1.3 壳聚糖凝胶的制备[18]
将1.5 g 壳聚糖溶于500 mL 1%(m/V)乙酸溶液中,搅拌至完全溶解后静置1 h使之稳定。后经蠕动泵(100 mL·min-1)将壳聚糖溶液泵入500 mL 0.5 mg·mL-1TPP溶液中,并剧烈磁力搅拌。泵完后继续剧烈搅拌1 h,所得象牙白悬浊液静置24 h后,经高速离心(9 000 r·min-1,15 min)分离,并用超纯水洗涤5次,保存于水中备用。
1.4 L1-Mn(Ⅱ)-壳聚糖/L2-Mn(Ⅱ)-壳聚糖复合材料的合成
取L1 0.0025 mol(0.836 g)于40 mL无水DMF中,加热搅拌使之溶解,再将20 mL溶有0.0026 mol(0.6372 g)二水合醋酸锰的DMF缓缓滴入其中,滴完后继续搅拌反应5 h。将约1 g壳聚糖凝胶超声分散于20 mL DMF中,倾倒入上述溶液中,反应24 h。所得固体离心收集,并用乙醇与水各洗涤5次,每次洗涤时固体至少在乙醇或水中浸泡2 h,最终得到红棕色凝胶,于 40 ℃真空干燥24 h,所得固体仔细研磨,得L1-Mn(Ⅱ)-壳聚糖复合材料。
取L2 0.0025 mol(0.9425 g)同法合成L2-Mn(Ⅱ)-壳聚糖复合材料。
分别用傅立叶变换红外光谱(FTIR)、扫描电子显微镜(SEM)、X-射线光电能谱(XPS)对复合材料进行表征。
1.5 L1-Mn(Ⅱ)-壳聚糖/L2-Mn(Ⅱ)-壳聚糖复合材料的SOD活性及重复利用性测试

实验步骤如下:首先称取12 mg复合材料分散在50 mL PBS溶液中,依照逐级稀释法配制多种不同浓度的样品溶液,备用。在测试时,精确量取1 mL样品溶液以及4.99 mL 0.05 mol·L-1蛋氨酸、1 mL 1.16×10-3mol·L-1NBT、1 mL 8.50×10-5mol·L-1核黄素以及0.01 mL 2.55×10-6mol·L-1EDTA(反应液中添加EDTA是为了掩蔽可能存在的微量金属离子,避免对测试结果的干扰)。在反应前,先向混合液中鼓入空气并在黑暗条件下搅拌5 min,之后在光照条件下反应10 min,测定样品溶液吸光度Asample。用1 mL PBS溶液代替样品溶液进行空白实验,测定吸光度Ablank。样品的抑制率按下式计算:

对两种复合材料进行重复利用性测试。实验步骤如下:首先进行空白实验,配制溶液I(总体积为4 mL的PBS溶液中包括0.05 mol·L-1蛋氨酸、1.16×10-3mol·L-1NBT、8.50×10-5mol·L-1核黄素以及2.55×10-6mol·L-1EDTA),向溶液Ⅰ中投入约2 mg样品,在反应开始前,向混合液中通入空气在黑暗条件下搅拌5 min,接着在光照条件下反应10 min。测定光照前(Aa)和光照后(Ab)混合液在560 nm处的吸光度,计算抑制率。然后将上述光照后的混合液标记为溶液Ⅱ,向溶液Ⅱ中加入新制得的溶液Ⅰ,重复如上所述的实验步骤,循环5次。
2 结果与讨论
2.1 L1-Mn(Ⅱ)-壳聚糖/L2-Mn(Ⅱ)-壳聚糖复合材料的表征
2.1.1 红外光谱分析(图2)
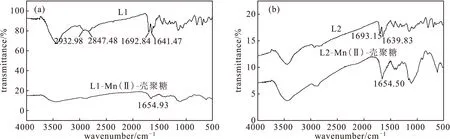
图2 L1-Mn(Ⅱ)-壳聚糖(a)/L2-Mn(Ⅱ)-壳聚糖(b)复合材料的红外光谱Fig.2 FTIR spectra of L1-Mn(Ⅱ)-chitosan(a) and L2-Mn(Ⅱ)-chitosan(b)
由图2可知,在未与壳聚糖交联前,配体在1 641 cm-1与1 639 cm-1处可见明显的吸收峰,为C=N振动吸收峰,该峰的存在表明在合成L1与L2时形成了C=N。同时,在1 692 cm-1与1 693 cm-1处可见清晰吸收峰,该吸收峰为C=O振动吸收峰,说明在合成席夫碱的同时,L1与L2分子中仍存在未反应的醛基,后续反应是可以进行的。在与壳聚糖交联后,L1的1 692 cm-1处与L2的1 693 cm-1处的吸收峰消失,只剩下1 654 cm-1处的吸收峰,该吸收峰为C=N振动吸收峰,表明L1、L2成功与壳聚糖交联。
2.1.2 XPS分析(图3)
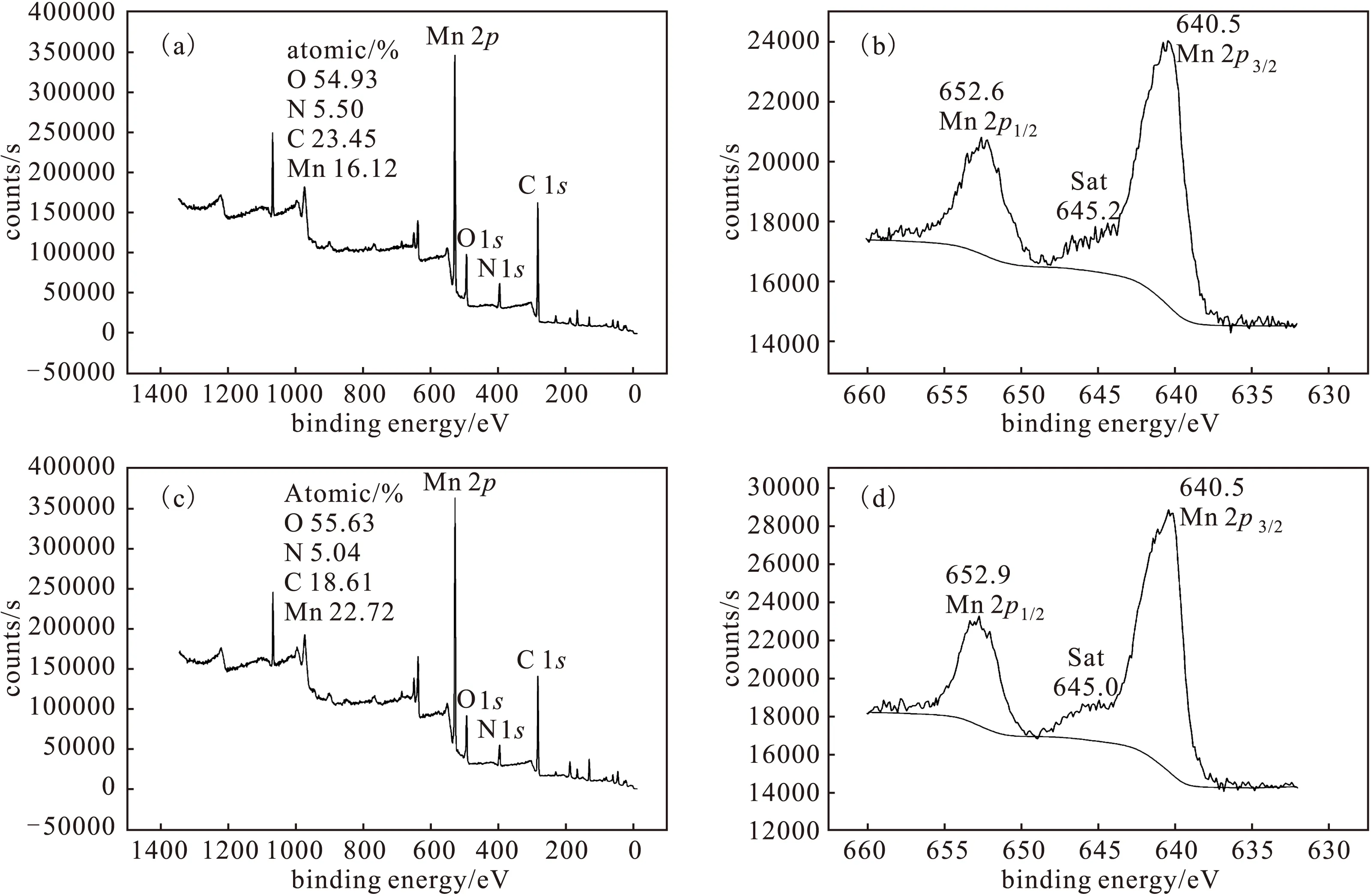
图3 L1-Mn(Ⅱ)-壳聚糖(a,b)/L2-Mn(Ⅱ)-壳聚糖(c,d)复合材料的XPS全扫描和Mn 2p分峰图Fig.3 XPS full scan and Mn 2p core-level spectra of L1-Mn(Ⅱ)-chitosan(a,b) and L2-Mn(Ⅱ)-chitosan(c,d)
由图3a可知,L1-Mn(Ⅱ)-壳聚糖复合材料中含Mn、C、O、N 4种元素,其表层原子含量分别为Mn 16.12%、C 23.45%、N 5.50%、O 54.93%。进一步对Mn元素进行分峰,可见Mn的结合能裂分为2p1/2与2p3/2两个峰(图3b),其能量分别为652.6 eV与640.5 eV。
由图3c可知,L2-Mn(Ⅱ)-壳聚糖复合材料中也含Mn、C、O、N 4种元素,其表层原子含量分别为Mn 22.72%、C 18.61%、N 5.04%、O 55.63%。Mn 2p分峰图(图3d)中,Mn的结合能裂分为2p1/2与2p3/2两个峰,其能量分别为652.9 eV与640.5 eV。
与文献报道的醋酸锰中Mn元素的结合能2p1/2653.7 eV、2p3/2641.8 eV相比,两种复合材料中Mn元素的结合能均有明显的不同。L1的2p1/2与2p3/2的结合能分别减少了1.1 eV和1.3 eV,L2的2p1/2与2p3/2的结合能分别减少了0.8 eV与1.3 eV,这种结合能的减少是由N与Mn的配位引起的。在制备过程中样品经过多次超声、离心、洗涤、浸泡,表面不含游离的金属离子,可以初步判断Mn与配体发生了配合。
2.1.3 SEM分析(图4)

a.壳聚糖凝胶 b.干燥并研磨的壳聚糖凝胶 c.未干燥的L1-Mn(Ⅱ)-壳聚糖 d.干燥并研磨的L1-Mn(Ⅱ)-壳聚糖
Fig.4 SEM images of chitosan gel and composites
由图4可见,干燥前,壳聚糖呈单个颗粒凝胶状且每个凝胶颗粒由多个更小的颗粒聚合而成(图4a);干燥并研磨后,壳聚糖表面呈粗糙且富有裂痕的状态(图4b)。而未干燥的复合材料呈明显的交联状态,壳聚糖不再是一颗颗单独的胶粒状态而是被交联成一种不规则的凝胶状(图4c、e);在干燥后,复合材料的表面均呈光滑且较少龟裂的状态(图4d、f)。这种形态上的明显不同可进一步说明配体对壳聚糖的交联作用。表明,已成功合成L1-Mn(Ⅱ)-壳聚糖/L2-Mn(Ⅱ)-壳聚糖复合材料。
2.2 L1-Mn(Ⅱ)-壳聚糖/L2-Mn(Ⅱ)-壳聚糖复合材料的SOD活性(图5)

图5 L1-Mn(Ⅱ)-壳聚糖(a)/L2-Mn(Ⅱ)-壳聚糖(b)复合材料的SOD活性Fig.5 SOD like activities of L1-Mn(Ⅱ)-chitosan(a) and L2-Mn(Ⅱ)-chitosan(b)
由图5可知,L1-Mn(Ⅱ)-壳聚糖的IC50为3.40 μg·mL-1,而L2-Mn(Ⅱ)-壳聚糖的IC50为6.15 μg·mL-1。
在相同条件下测定了不添加EDTA时天然酶(1 500 U·mg-1)的IC50,为0.7015 μg·mL-1。所合成复合材料的酶活性可达到天然酶的约20%与10%。相比于其它复合材料,如一种席夫碱金属配合物-白蛋白氨基酸复合材料,其IC50报道为0.1 μmol·L-1,换算结果约为6.643 μg·mL-1。与之相比,所合成的复合材料SOD活性明显较优。
2.3 重复利用性结果(表1)
表1 L1-Mn(Ⅱ)-壳聚糖/L2-Mn(Ⅱ)-壳聚糖复合材料的重复利用性结果
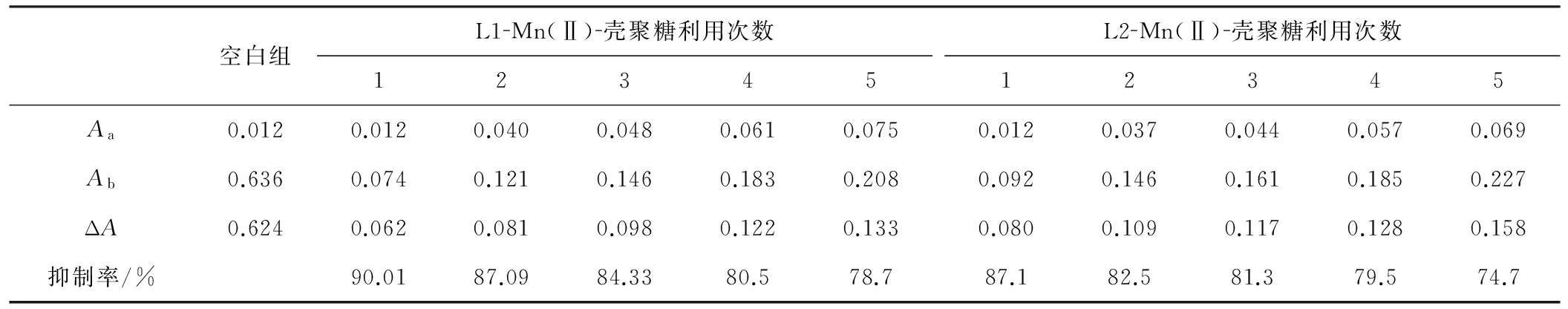
Tab.1 Reusability data of L1-Mn(Ⅱ)-chitosan and L2-Mn(Ⅱ)-chitosan
由表1可看出,L1-Mn(Ⅱ)-壳聚糖/L2-Mn(Ⅱ)-壳聚糖复合材料均有良好的重复利用性,在重复利用5次后仍保持较高的SOD活性。
2.4 壳聚糖与可能存在的游离金属离子对实验结果的影响
因壳聚糖本身就具有良好的染料吸附性能,而甲瓒是一种蓝色染料。故为排除壳聚糖自身吸附对结果造成的影响,进行如下实验。取0.2 g新鲜制备的壳聚糖凝胶,超声分散于10 mL PBS溶液中,取1 mL作为样品,测定SOD活性。结果表明,浓度为20 μg·mL-1的壳聚糖凝胶因其吸附所产生的SOD 活性(以抑制率表示)为4.25%,而所合成的复合材料在达到50%抑制率时浓度均小于20 μg·mL-1,所以可以排除壳聚糖凝胶吸附甲瓒对实验结果的影响。
因Mn(Ⅱ)本身就具有很强的SOD活性,为了排除实验中可能存在的游离Mn(Ⅱ)对结果造成的影响,进行如下实验。分别取2 mg L1-Mn(Ⅱ)-壳聚糖与L2-Mn(Ⅱ)-壳聚糖,超声45 s分散于10 mL PBS溶液中,所得悬浊液静置24 h后于9 000 r·min-1离心15 min,共计3次,所得上清液视为0.2 mg·mL-1溶液。小心取出上清液,将其稀释至20 μg·mL-1、10 μg·mL-1与1 μg·mL-1,测定SOD活性,结果均未检出SOD活性。表明复合材料中没有游离Mn(Ⅱ),复合材料的SOD活性均来源于复合材料本身。
3 结论
以二乙烯三胺、三乙烯四胺分别与间苯二醛反应合成二乙烯三胺-间苯二醛席夫碱(L1)、三乙烯四胺-间苯二醛席夫碱(L2),然后与醋酸锰反应合成了两种席夫碱-Mn(Ⅱ)配合物,进而与壳聚糖凝胶反应成功合成了L1-Mn(Ⅱ)-壳聚糖/L2-Mn(Ⅱ)-壳聚糖复合材料。XPS结果表明Mn(Ⅱ)与配体生成了配合物,FTIR、 SEM结果表明,配合物与壳聚糖产生了交联。NBT法测定L1-Mn(Ⅱ)-壳聚糖与L2-Mn(Ⅱ)-壳聚糖的IC50分别为3.40 μg·mL-1与6.15 μg·mL-1,均具有良好的SOD活性和重复利用性。两种复合材料合成简单,在医药及化妆品领域具有应用潜力。
[1] HE J,JIANG B H.Interplay between reactive oxygen species and microRNAs in cancer[J].Current Pharmacology Reports,2016,2(2):1-9.
[2] ERBAS M,SEKERCI H.Importance of free radicals and occurring during food processing[J].Gida,2011,36(6):349-356.
[3] RAHAL A,KUMAR A,SINGH V,et al.Oxidative stress,prooxidants,and antioxidants:the interplay[J].BioMed Research International,2014,2014:761264.
[4] KANG K A,MEI J P,KIM K C,et al.Fisetin attenuates hydrogen peroxide-induced cell damage by scavenging reactive oxygen species and activating protective functions of cellular glutathione system[J].Vitro Cellular & Developmental Biology Animal,2014,50(1):66-74.
[5] CHATTERJEE S K,MAJI R C,BARMAN S K,et al.Hexacoordinate nickel(Ⅰ)/(Ⅲ) complexes that mimic the catalytic cycle of nickel superoxide dismutase[J].Angewandte Chemie,2014,126(38):10348-10353.
[6] 岳爱国,刘纲勇.SOD在食品和化妆品行业中的应用研究进展[J].广东化工,2014,41(19):117-118.
[7] ISAACS E J,GREGORY E.Antioxidant for use in cosmetic,medicated and pharmaceutical preparations:US 8221746[P].2012-07-17.
[8] HU X,LIU J,HOU S,et al.Research progress of nanoparticles as enzyme mimetics[J].Science China Physics,Mechanics and Astronomy,2011,54(10):1749-1756.
[9] LU Q,LI X,WANG Y,et al.Catalytic activities of dismution reactions of Cu(bpy)Br2compound and its derivatives as SOD mimics:a theoretical study[J].Journal of Molecular Modeling,2009,15 (11):1397-1405.
[10] PELMENSCHIKOV V,SIEGBAHN P E M.Copper-zinc superoxide dismutase:theoretical insights into the catalytic mechanism[J].Inorganic Chemistry,2005,44:3311-3320.
[11] MILLER A F.Redox tuning over almost 1 V in a structurally conserved active site:lessons from Fe containing superoxide dismutase[J].Accounts of Chemical Research,2008,41:501-510.
[12] PELMENSCHIKOV V,SIEGBAHN P E M.Nickel superoxide dismutase reaction mechanism studied by hybrid density functional methods[J].Journal of the American Chemical Society,2006,128:7446-7475.
[13] BARONDEAU D P,KASSMANN C J,BRUNS C,et al.Nickel superoxide dismutase structure and mechanism[J].Biochemistry,2004,43:8038-8047.
[14] LIN Y,ZHANG L,YAO W,et al.Water-soluble chitosan-quantum dot hybrid nanospheres toward bioimaging and biolabeling[J].ACS Applied Materials & Interfaces,2011,3(4):995-1002.
[15] KIM J Y,JUN J H,KIM S J,et al.Wound healing efficacy of a chitosan-based film-forming gel containing tyrothricin in various rat wound models[J].Archives of Pharmacal Research,2015,38 (2):229-338.
[16] NAGPAL K,SINGH S K,MISHRA D N.Chitosan nanoparticles:a promising system in novel drug delivery[J].Chemical & Pharmaceutical Bulletin,2010,58(11):1423-1430.
[17] YU H,TRAN T T,TEO J,et al.Dry powder aerosols of curcumin-chitosan nanoparticle complex prepared by spray freeze drying and their antimicrobial efficacy against common respiratory bacterial pathogens[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2016,504:34-42.
[18] GAN Q,WANG T,COCHRANE C,et al.Modulation of surface charge,particle size and morphological properties of chitosan-TPP nanoparticles intended for gene delivery[J].Colloids and Surfaces B:Biointerfaces,2005,44(2/3):65-73.
Synthesis,Characterization of Two Novel Schiff Base Manganese(Ⅱ) Complex-Chitosan Composites and Their SOD Like Activity
QU Jun-shen,ZHOU Hong*,PAN Zhi-quan
(SchoolofChemistryandEnvironmentalEngineering,WuhanInstituteofTechnology,Wuhan430073,China)
Using diethylenetriamine,triethylenetetramine,andp-phthalaldehyde as raw materials,we synthesized two novel Schiff base ligands(L1,L2),then synthesized L1/L2-manganese(Ⅱ) complexes with manganese acetate,and further synthesized L1/L2-manganese(Ⅱ)-chitosan composites with chitosan through sol-gel reaction.Moreover,we characterized the structures of the composites by Fourier transform infrared spectroscopy(FTIR),scanning electron microscopy(SEM),and X-ray photoelectron spectroscopy(XPS),and measured their SOD like activities by a nitrobluetetrazolium (NBT) method and reusability.The results showed that the crosslinking of complexes and chitosan were successful,L1/L2-manganese(Ⅱ) complex-chitosan composites had good SOD like activities with IC50of 3.40 μg·mL-1and IC50of 6.15 μg·mL-1,respectively.Two composites were stable,and had good reusability.
Schiff base complex;chotisan;SOD like activity
国家自然科学基金项目(21171135)
2017-03-22
瞿隽申(1989-),男,湖北武汉人,硕士研究生,研究方向:功能配合物合成与性质,E-mail:625797595@qq.com;通讯作者:周红,教授,E-mail:hzhouh@126.com。
10.3969/j.issn.1672-5425.2017.07.005
O625.632
A
1672-5425(2017)07-0024-07
瞿隽申,周红,潘志权.两种新型席夫碱-Mn(Ⅱ)配合物-壳聚糖复合材料的合成表征及其SOD活性[J].化学与生物工程,2017,34(7):24-30.
