炔烃碳硼化反应研究进展
2017-08-01张佳成
王 拓,张佳成,常 静*
(1.天津大学理学院,天津 300350;2.天津医科大学药学院,天津 300070)
炔烃碳硼化反应研究进展
王 拓1,张佳成2,常 静1*
(1.天津大学理学院,天津 300350;2.天津医科大学药学院,天津 300070)
有机硼化合物是一类重要的有机合成砌块,在有机合成领域具有重要的研究意义和应用,以金属催化的炔烃碳硼化反应是构建烯基硼化合物的有效方法。从炔烃碳硼化反应催化剂(金属催化剂与非金属催化剂)出发,综述了炔烃碳硼化反应的研究进展,对相关反应的反应机理进行了详细阐述,同时对该研究领域进行了展望。
烯基硼化合物;金属或非金属催化剂;碳硼化反应
众所周知,有机硼化合物具有良好的反应活性和稳定性,易于贮存且毒性较低,在有机合成领域有着广泛的应用[1-5],许多医学药物均含硼元素(图1)。随着应用范围的扩展,对于有机硼化合物的官能团多样化的需求也在逐渐提高。因此,探寻更为有效的合成方法来实现有机硼化合物的高立体选择性和多官能团化具有重大的研究价值,同时兼具更大的挑战性。作为有机硼化合物中重要的一员,烯基硼化合物在碳碳键、碳杂键构建的反应中具有广泛的应用[6-9],有关烯基硼化合物的研究也因此一直备受研究者的重视,而以金属催化的炔烃碳硼化反应是合成烯基硼化合物的最有效且选择性最高的方法之一。近年来,化学工作者的研究重点集中在过渡金属催化的含硼单键加成到碳碳不饱和键上的同时也会生成新的碳碳键的反应,这种反应方式为合成其它途径不易合成的高官能团化的有机硼化合物提供了新的方法。
作者针对金属或非金属催化的炔烃碳硼化反应进行了较详细的介绍,反应催化体系涉及钯、镍、铜等金属催化剂以及膦、酒石酸等非金属催化剂,并对相关反应的反应机理进行了阐述。

图1 含硼化合物的合成、衍生及相关药物Fig.1 Synthesis and derivation of compounds containing boron and corresponding drugs
1 钯催化的炔烃碳硼化反应
2008年,Suginome课题组[10]发现了一种新的钯催化的硼烷、炔烃以及有机锆试剂三组分的碳硼化偶联反应,且能够得到较高收率的顺式碳硼化产物,如图2所示。

图2 钯催化的氯代硼烷和有机锆试剂的炔烃碳硼化反应Fig.2 Pd-catalyzed carboboration of alkynes using chloroborane and organozirconium reagent
针对这个反应体系,该小组给出了其反应机理(图3):首先,B-Cl对金属钯进行氧化加成,生成硼氯代双磷的钯中间体,此中间体随后对炔烃进行迁移插入,生成β-硼烯基氯代钯中间体,该烯基钯中间体没有经历还原消除,而是与有机锆试剂反应生成双金属的钯中间体,再进行还原消除得到目标产物。
2008年,Suginome课题组[11]在此基础上继续报道了一种更有创造性的钯催化环化碳硼化反应体系,即氯硼烷取代的炔烃、有机锆试剂和钯催化剂进行的二组分反应,如图4所示。
Pd/Zr体系显示出广泛的底物适用性,可通过四、五或六元环化反应催化端炔和内炔生成烯基、芳基或烷基取代的烯基硼化合物,且产物的选择性很高。但钯催化剂较昂贵,反应成本略高,不利于推广应用。
2 镍催化的炔烃碳硼化反应
2009年,Cheng课题组[12]在镍催化下首次使用双金属试剂用于阻止π键的连续偶联反应。通过对配体和溶剂的筛选得到最佳条件如下:乙烷基乙烯基酮、1-苯基-1-丙炔与联硼酸频那醇酯在Ni(cod)2催化剂(5 mol%)、PnBu3配体(10 mol%)、甲苯/甲醇(3∶1)下反应,收率达到80%以上。该反应条件比较温和,且镍属于相对廉价且环境友好型的催化剂。反应通式如图5所示。

图3 钯催化的氯代硼烷和有机锆试剂进行炔烃碳硼化反应的可能机理Fig.3 The possible mechanism for Pd-catalyzed carboboration of alkynes using chloroborane and organozirconium reagent
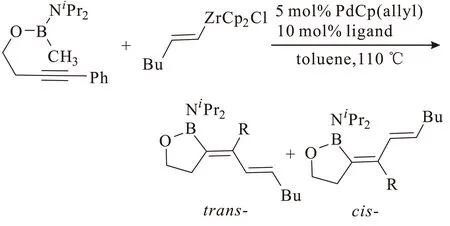
图4 钯催化的二组分的炔烃碳硼化反应Fig.4 Pd-catalyzed two-component carboboration of alkynes
此方法的底物适用范围较广,扩展了关于其它双金属试剂与2种不同的π键进行偶联反应合成烯基硼化合物的方法学。其机理(图6)为:首先炔烃与α,β-不饱和羰基化合物高选择性地配位到中心Ni0上,随后特定选择性地经历氧化环金属化生成含镍的环戊烯中间体,并与MeOH选择性地发生质子化作用,生成烯基-甲氧基镍中间体,接着与联硼酸频那醇酯经历转金属化生成烯基镍硼化合物和硼化物,此烯基镍硼化合物经过还原消除生成目标产物,并释放出Ni0,完成催化循环。

图5 镍催化的三组分的炔烃碳硼化反应Fig.5 Ni-catalyzed three-component carboboration of alkynes

图6 镍催化的炔烃碳硼化反应的可能机理 Fig.6 The possible mechanism for Ni-catalyzed carboboration of alkynes
3 铜催化的炔烃碳硼化反应
自2000年Nozaki课题组[13-14]提出铜硼化合物可作为碳硼化反应中间体以来,其种类不断扩大。2011年,该课题组[15]设计合成并分离出了一种新的铜硼化合物用于氢硼化和碳硼化反应,如图7所示。
该反应体系条件温和(室温)、反应速率快,但存在局限性:硼源需要特殊制备,硼锂中间体高度敏感、不稳定,增大了反应体系的应用难度,并且当量铜催化剂用量过大时,更削弱了其应用性。
为克服以上缺点,同时研究合成甲基烯烃类化合物的新方法。2012年,Tortosa课题组[16]首先将关注点放到了顺式异构的甲基取代的烯基硼化合物的合成上,这类化合物是顺式加成的甲基取代的烯基化合物的直接前体,常见于天然产物[17]、药物以及具有生物活性的化合物中[18-20]。然而选择性合成此类化合物的方法却很有限,尤其是C-B和C-Me在同一体系内同时生成,于是该课题组使用苯乙炔为底物与联硼酸频那醇酯进行碳硼化反应,如图8所示。

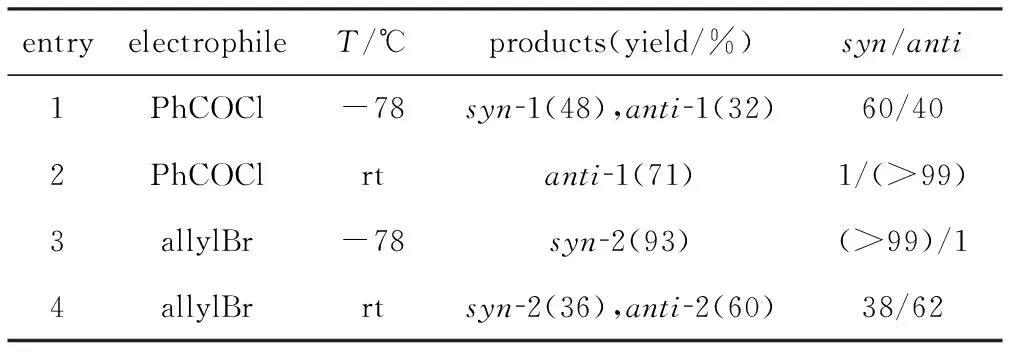
entryelectrophileT/℃products(yield/%)syn/anti1PhCOCl-78syn1(48),anti1(32)60/402PhCOClrtanti1(71)1/(>99)3allylBr-78syn2(93)(>99)/14allylBrrtsyn2(36),anti2(60)38/62
图7 铜硼化合物与炔烃的碳硼化反应
Fig.7 Cu-catalyzed carboboration of borylcopper compounds with alkynes

图8 铜催化的端炔的甲基硼化反应Fig.8 Cu-catalyzed methylboration of terminal alkynes
最后,该课题组探究了更具挑战性的1,3-烯炔的甲基硼化反应,收率较高,但区域选择性较差,如图9所示。
2013年,Yoshida课题组[21]在三组分的内炔碳硼化反应基础上进行进一步的优化,用廉价的金属铜作为催化剂,利用联硼酸频那醇酯与合适的亲电体合成多种多样的多取代烯烃硼化物,如图10所示。
其可能机理(图11)为:铜催化剂与配体进行络合,所得化合物与联硼酸频那醇酯进行金属交换,生成铜硼化合物,随后对炔烃进行迁移插入,生成碳铜和碳硼键,即生成烯基铜硼化合物,此化合物与碱经过络合生成一种两性离子化合物,然后捕捉亲电体生成目标产物,释放出铜叔丁醇金属盐与配体的络合物,随后此化合物与联硼酸频那醇酯进行转金属化释放出铜配体硼络合物,完成催化循环。

图9 铜催化的1,3-烯炔的甲基硼化反应Fig.9 Cu-catalyzed methylboration of 1,3-enynes
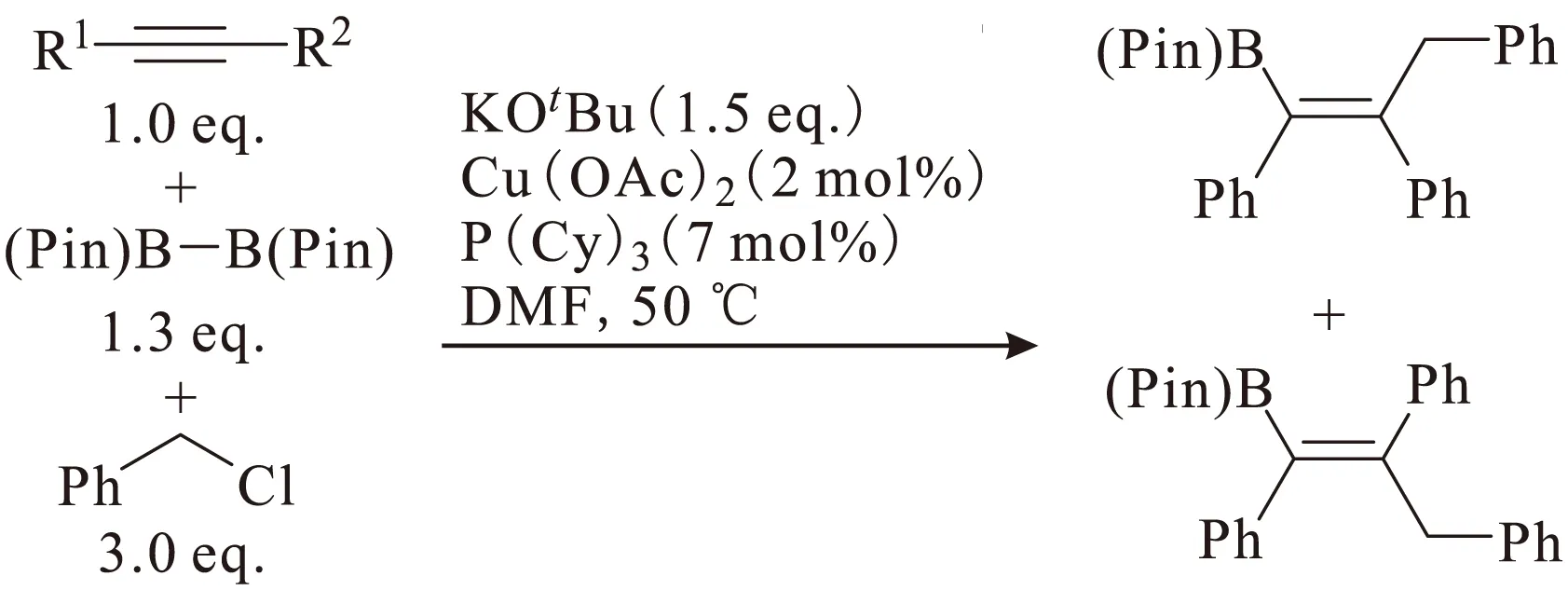
图10 铜催化的三组分的炔烃碳硼化反应Fig.10 Cu-catalyzed three-component carboboration of alkynes

图11 铜催化炔烃碳硼化反应的可能机理Fig.11 The possible mechanism for Cu-catalyzed carboboration of alkynes
自从铜可催化炔烃碳硼化反应被报道以来,铜催化已成为催化炔烃碳硼化反应的主流催化体系,但此反应体系对水和氧气比较敏感,很多都需要进行无水无氧操作,很多参与反应的溶剂均需无水处理,大大增加了操作难度。2014年,Cazin课题组[22]在铜催化炔烃碳硼化反应领域提出了更具创新性的反应体系(图12),即在空气中进行甲基硼化反应,且生成单一产物。该反应最优条件也适用于不同种类的芳基或芳基上连有取代基的内炔。
碘甲烷作为亲电体被加入到此反应体系中,扩大了此反应体系的底物适用范围。此反应体系只需要很少量的催化剂,且使用较廉价的碱和相对绿色的溶剂CMPE,对空气不敏感,操作简便,属于经济、环境友好型反应体系。
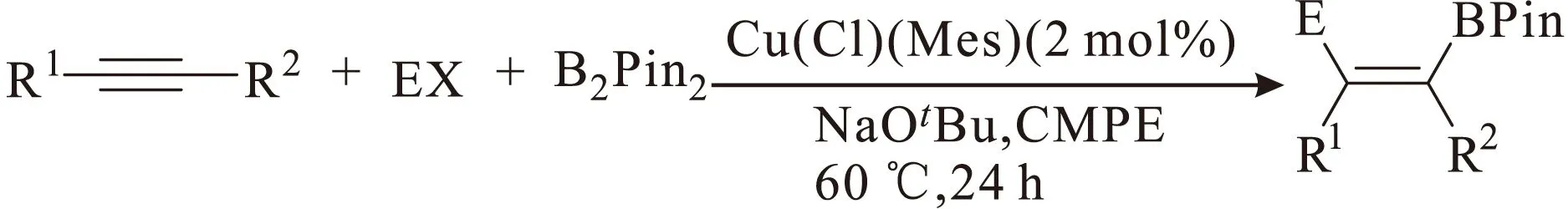
图12 铜催化的炔烃甲基碳硼化反应Fig.12 Cu-catalyzed methylboration of alkynes
化学工作者也一直致力于探索烯基硼化合物作为片段在全合成中的应用。比如1,4-二烯的框架在具有生物活性的天然产物中是一个普遍存在的片段[23-26],基于此,2015年Zhong课题组[27]报道了一种新的铜催化联硼酸频那醇酯、炔烃和烯丙基磷酸盐三组分偶联反应合成硼基取代的1,4-二烯烃类化合物的新方法,收率可达90%,4E/4Z达99∶1,化学选择性很高,如图13所示。
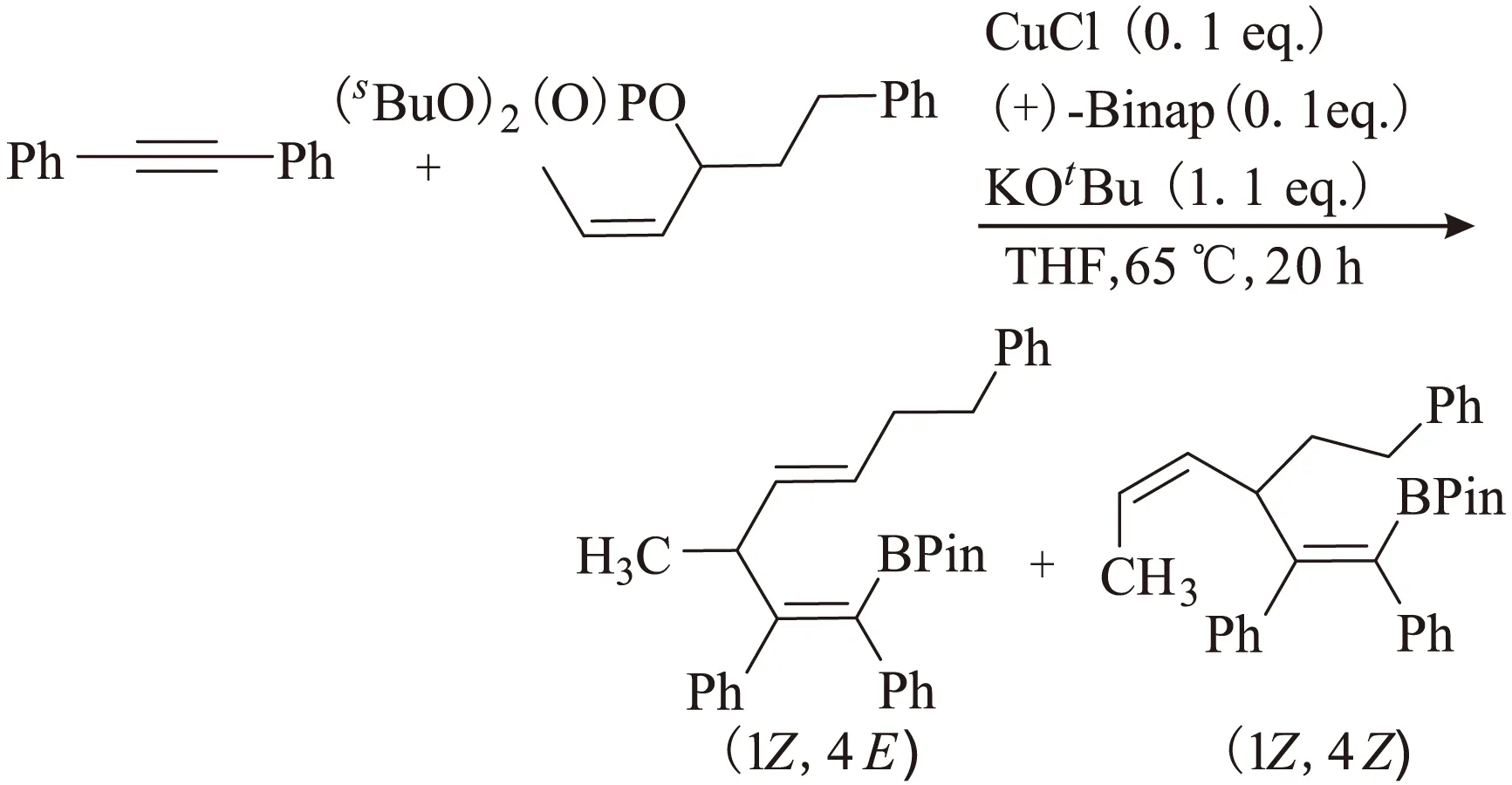
图13 硼基取代的1,4-二烯烃类化合物的合成方法Fig.13 Synthesis of broyl substituted 1,4-diene hydrocarbon compound
迄今为止,参与偶联反应的炔会有1~2个芳基取代基,但是在某些天然产物中的一些多烯片段则全部只连有烷基链,因此,二烷基乙炔也会用来和二级或一级烯丙基磷酸盐反应用于制备多烷基取代的烯基硼化合物,如图14所示。

图14 二级烯丙基磷酸盐与二丁基乙炔的碳硼化反应Fig.14 Carboboration of secondary allyl phosphate with dibutylacetylene
2016年,Kanai课题组[28]报道了新的反应体系,采用较廉价的铜催化炔烃碳硼化反应,直接高化学选择性地合成了三取代的烯基硼化合物(图15),此类化合物为含4个烷基基团的四取代烯基化合物的前体物质,是有机合成中的重要模块。
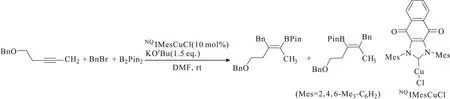
图15 烷基取代的炔烃与烷基卤代物的碳硼化反应Fig.15 Carboboration of alkyl-substituted alkynes and alkyl halide
研究发现,此反应体系高区域高立体选择性地调控主要受配体支配,其调控机制正在研究。
4 非金属催化的炔烃碳硼化反应
2014年,Sawamura课题组[29]发现了三烷基膦可空前地催化炔烃与烷基、烯基、芳基硼化物发生反式碳硼化反应,生成β-硼丙烯酸酯化合物。尽管很多硼试剂被用于碳硼化反应,比如之前报道的氰基硼化物、炔基硼化物和硼酸化合物,但烷基、烯基、芳基硼化物作为硼试剂扩大化地用于炔烃碳硼化却很少见。作者在研究金属催化对有机硼化合物的转化作用时,出人意料地发现了烷基硼化物与炔烃在催化剂三丁基膦催化作用下,会经历碳硼化反应生成β-硼丙烯酸酯,且B与O进行了配位[10-11,17],如图16所示。

图16 膦催化的炔烃与烷基、烯基、芳基硼化物的反式碳硼化反应Fig.16 Phosphine-catalyzed anti-carboboration of alkyne and borides with alkyl-,alkenyl-,aryl-
该反应过程中非常有意思的是:碳硼化反应关于区域选择性表现出不同于之前的完全相反电子要求,而这种反式碳硼化是之前未报道过的;另一个有意思的特征是:C-B反式加成的立体选择性。催化剂的中心原子磷加成到炔的碳碳三键上,引发了烷基膦的催化反应,其反应机理(图17)为:在路易斯酸活化羰基基团的辅助下,PBu3与硼化合物Ⅰ对炔烃Ⅱ进行共轭加成,生成了一个两性离子的连烯中间体Ⅲ,Ⅲ中硼的取代基转移到丙烯部分sp杂交的中心碳上,形成磷的内鎓盐Ⅳ;随后Ⅳ转化为其几何异构体Ⅴ,内鎓盐的碳和邻近的碳成键,从而形成环状硼化物Ⅵ;最后,B3P发生消除,B-O断裂生成烯基硼Ⅶ,Ⅵ中B-O相互作用协同最后的消除反应是为了最终生成反式立体选择性的目标产物。
尽管碳硼化反应中使用过不同种类的硼源,但以硼酸作为硼源尚属首次。硼酸低毒,对空气和水稳定,无需低温操作、氮气保护及使用重蒸无水溶剂,操作简单,增强了其在化学合成中的实用性。

图17 膦催化的炔醇的反式碳硼化反应的可能机理Fig.17 The possible mechanism for phosphine-catalyzed anti-carboboration of alkynol
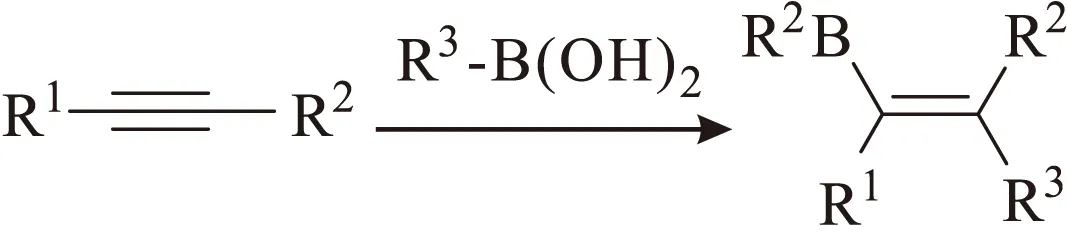
图18 内炔与硼酸的碳硼化反应Fig.18 Carboboration of internal alkynes with boronic acids
该反应机理(图19)为:首先乳酸或酒石酸与硼酸相互作用,生成二氧硼环状化合物Ⅰ,使得硼原子的路易斯酸度增强,这种硼被放大的亲电性导致硼原子与取代基芳香环上的亚胺氮原子上未共用的电子对配位生成Ⅱ,或者与羟基上的氧原子配位生成Ⅲ,四配位的硼化合物很可能会发生Petasis-like反应[31],从Ⅲ直接转化为Ⅶ,但Ⅱ中氮的配位有助于增强芳香环的吸电子能力,这可以解释加成时单一区域选择性的原因:硼负离子更倾向于进攻β碳,生成Ⅳ,Ⅳ与Ⅴ是一对共振式。决定立体选择性的关键是中间体Ⅵ的sp-C与硼部分的加成,也可能是整个反应的驱动步骤,该加成反应生成的新sp2碳硼键与羟基在烯烃的同一侧,继而发生类似于水解的环化反应,最后生成的化合物Ⅷ因分子内氢键作用而稳定存在。
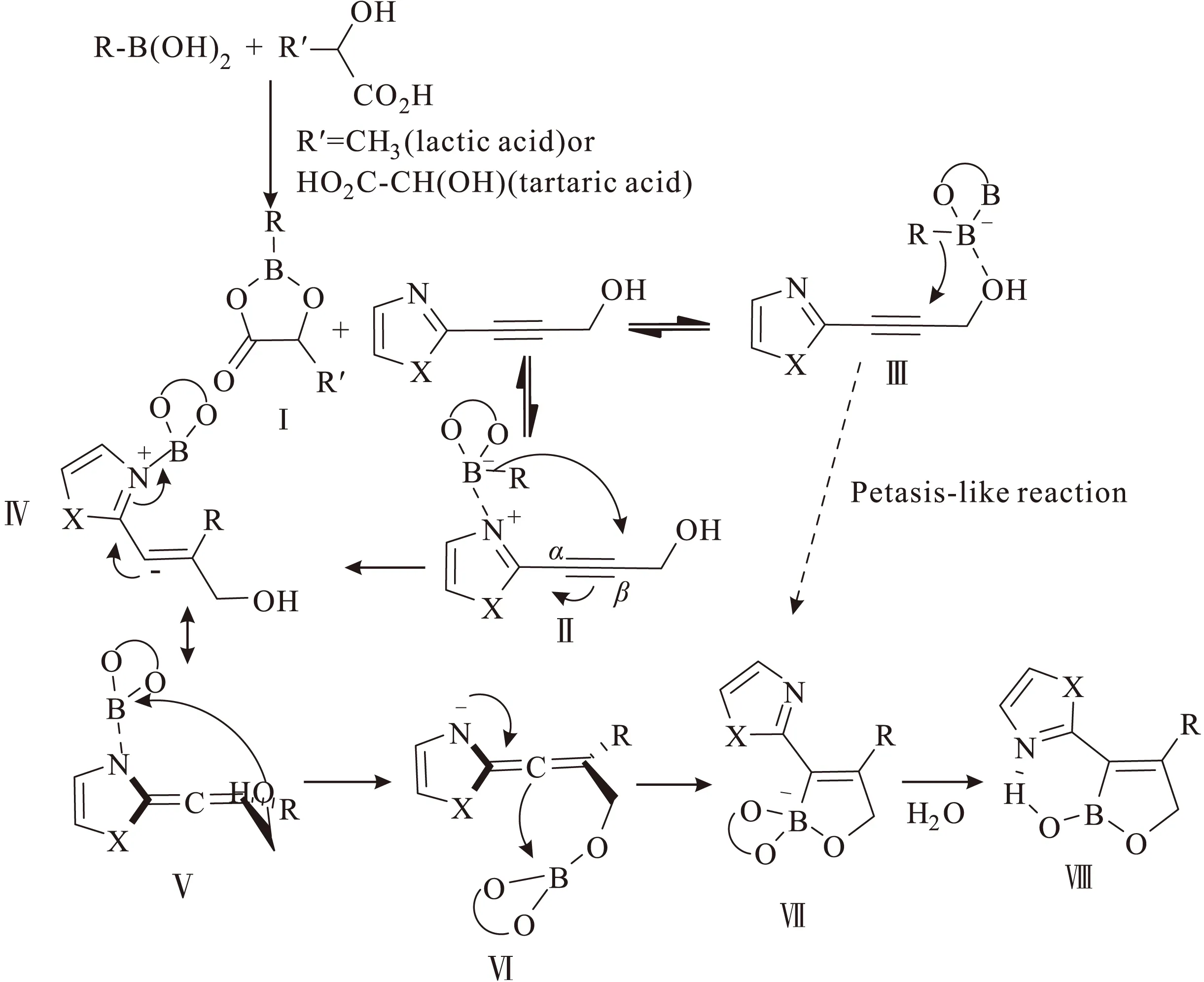
图19 内炔与硼酸的碳硼化反应的可能机理Fig.19 The possible mechanism for carboboration of internal alkynes with boronic acids
5 展望
各种金属催化以及无需金属催化的碳硼化反应已被大量报道和研究,并取得了一定成果;产物的区域选择性和立体选择性的合成也有所研究,实现了生成单一构型产物的碳硼化反应,并成功与开环反应、合环反应结合;实现了各种取代基取代的炔烃碳硼化,取代基包括炔基、烯基、芳基以及烷烃基,并成功合成了三烷基链取代的烯基硼化合物,作为四取代烯基化合物的前体,为某些天然产物的全合成作出了很大的贡献。碳硼化反应中,操作对水、氧要求极高,虽说有直接暴露于空气的环境友好型新颖反应体系,但还很少,有待开发;而无金属催化、极简的反应体系和实验操作的开发和研究无疑将会促进新概念、新机理的反应模式的出现,更好地应用于天然产物的全合成领域。
[1] SUGINOME M,YAMAMOTO A,MURAKAMI M.Palladium-and nickel-catalyzed intramolecular cyanoboration of alkynes[J].Journal of the American Chemical Society,2003,125(21):6358-6359.
[2] SUGINOME M,YAMAMOTO A,MURAKAMI M.Palladium-catalyzed addition of cyanoboranes to alkynes:regio- and stereoselective synthesis ofα,β-unsaturatedβ-boryl nitriles[J].Angewandte Chemie,International Edition,2005,44(16):2380-2382.
[3] SUGINOME M,YAMAMOTO A,MURAKAMI M.Intramolecular cyanoboration of alkynesviaactivation of boron-cyanide bonds by transition metal catalysts[J].Journal of Organometallic Chemistry,2005,690(23):5300-5308.
[4] SUGINOME M,SHIRAKURA M,YAMAMOTO A.Nickel-catalyzed addition of alkynylboranes to alkynes[J].Journal of the American Chemical Society,2006,128(45):14438-14439.
[5] FLYNN A B,OGILVIE W W.Stereocontrolled synthesis of tetrasubstituted olefins[J].Chemical Reviews,2007,107(11):4698-4745.
[6] MIYAURA N,SUZUKI A.Palladium-catalyzed cross-coupling reactions of organoboron compounds[J].Chemical Reviews,1995,95(7):2457-2483.
[7] SUZUKI A.Recent advances in the cross-coupling reactions of organoboron derivatives with organic electrophiles,1995-1998[J].Journal of Organometallic Chemistry,1999,576(1/2):147-168.
[8] TOBISU M,CHATANI N.Devising boron reagents for orthogonal functionalization through Suzuki-Miyaura cross-coupling[J].Angewandte Chemie,International Edition,2009,48(20):3565-3568.
[9] WU T R,CHONG J M.Asymmetric conjugate alkenylation of enones catalyzed by chiral diols[J].Journal of the American Chemical Society,2007,129(16):4908-4909.
[10] DAINI M,SUGINOME M.Palladium-catalyzed carboboration of alkynes using chloroborane and organozirconium reagents[J].Chemical Communications,2008(41):5224-5226.
[11] DAINI M,YAMAMOTO A,SUGINOME M.Palladium-catalyzedtrans- andcis-carboboration of alkynes tethered to chloroborane with organozirconium reagents:ligand-dependent complementary stereoselectivity[J].Journal of the American Chemical Society,2008,130(10):2918-2919.
[12] MANNATHAN S,JEGANMOHAN M,CHENG C H.Nickel-catalyzed borylative coupling of alkynes,enones,and bis(pinacolato)diboron as a route to substituted alkenyl boronates[J].Angewandte Chemie International Edition,2009,48(12):2192-2195.
[13] ITO H,YAMANAKA H,TATEIWA J I,et al.Boration of anα,β-enone using a diboron promoted by a copper(Ⅰ)-phosphine mixture catalyst[J].Tetrahedron Letters,2000,41(35):6821-6825.
[14] TAKAHASHI K,ISHIYAMA T,MIYAURA N.Addition and coupling reactions of bis(pinacolato)diboron mediated by CuCl in the presence of potassium acetate[J].Chemistry Letters,2000(9):982-983.
[15] OKUNO Y,YAMASHITA M,NOZAKI K.Borylcyanocuprate in a one-pot carboboration by a sequential reaction with an electron-deficient alkyne and an organic carbon electrophile[J].Angewandte Chemie,International Edition,2011,50(4):920-923.
[16] ALFARO R,PARRA A,ALEMN J,et al.Copper(Ⅰ)-catalyzed formal carboboration of alkynes:synthesis of tri- and tetrasubstituted vinylboronates[J].Journal of the American Chemical Society,2012,134(37):15165-15168.
[17] NEGISHI E I,WANG G W,RAO H H,et al.Alkyne elementometalation-Pd-catalyzed cross-coupling.towards synthesis of various types of acyclic alkenes in high yields,efficiently,selectively,economically,and safely—“Green” way[J].Journal of Organic Chemistry,2010,75(10):3151-3182.
[18] HOFLE G,BEDORF N,STEINMETZ H,et al.Epothilone A and B-novel 16-membered macrolides with cytotoxic activity:isolation,crystal structure,and conformation in solution[J].Angewandte Chemie,International Edition,1996,35(13/14):1567-1569.
[19] VEZINA C,KUDELSKI A,SEHGAL S N.Rapamycin(AY-22,989),a new antifungal antibiotic.I.taxonomy of the producing streptomycete and isolation of the active principle[J].Journal of Antibiotics,1975,28(10):721-726.
[20] SUGANUMA M,FUJIKI H,FURUYA-SUGURI H,et al.Calyculin an inhibitor of protein phosphatases,a potent tumor promoter on CD-1 mouse skin[J].Cancer Research,1990,50(12):3521-3525.
[21] YOSHIDA H,KAGEYUKI I,TAKAKI K.Copper-catalyzed three-component carboboration of alkynes and alkenes[J].Organic Letters,2013,15(4):952-955.
[22] BIDAL Y D,LAZREG F,CAZIN C S J.Copper-catalyzed regioselective formation of tri- and tetra-substituted vinylboronates in air[J].ACS Catalysis,2014,4(5):1564-1569.
[23] ANDREY O,GLANZMANN C,LANDAIS Y,et al.1,3-Asymmetric induction in electrophilic addition onto homoallylsilanes.an approach towards the total synthesis of(+/-)-kumausyne[J].Tetrahedron,1997,53(8):2835-2854.
[24] OKETCH-RABAH H A,DOSSAJI S F,CHRISTENSEN S B,et al.Antiprotozoal compounds fromAsparagusafricanus[J].Journal of Natural Products,1997,60(10):1017-1022.
[25] BAE E A,PARK E K,YANG H J,et al.Hinokiresinol inhibits IgE-induced mouse passive cutaneous anaphylaxis reaction[J].Planta Medica,2006,72(14):1328-1330.
[26] LIM H,NAM J,SEO E K,et al.(-)-Nyasol(cis-hinokiresinol),a norneolignan from the rhizomes ofAnemarrhenaasphodeloides,is a broad spectrum inhibitor of eicosanoid and nitric oxide production[J].Archives of Pharmacal Research,2009,32(11):1509-1514.
[27] BIN H Y,WEI X,ZI J,et al.Substrate-controlled regio- and stereoselective synthesis of boron-substituted 1,4-dienesviacopper-catalyzed boryl-allylation of alkynes with allyl phosphates and bis(pinacolato)diboron[J].ACS Catalysis,2015,5(11):6670-6679.
[28] ITOH T,SHIMIZU Y,KANAI M.Ligand-enabled,copper-catalyzed regio- and stereoselective synthesis of trialkylsubstituted alkenylboronates from unactivated internal alkynes[J].Journal of the American Chemical Society,2016,138(24):7528-7531.
[29] NAGAO K,OHMIYA H,SAWAMURA M.Phosphine-catalyzedanti-carboboration of slkynoates with alkyl-,alkenyl-,and arylboranes[J].Journal of the American Chemical Society,2014,136(30):10605-10608.
[30] ROSCALES S,CSKA G.Transition-metal-free directanti-carboboration of alkynes with boronic acids to produce alkenylheteroarenes[J].Organic Letters,2015,17(6):1605-1608.
[31] CANDEIAS N R,MONTALBANO F,CAL P M S D,et al.Boronic acids and esters in the petasis-borono Mannich multicomponent reaction[J].Chemical Reviews,2010,110(10):6169-6193.
Research Progress in Carboboration of Alkynes
WANG Tuo1,ZHANG Jia-cheng2,CHANG Jing1*
(1.SchoolofScience,TianjinUniversity,Tianjin300350,China;2.SchoolofPharmacy,TianjinMedicalUniversity,Tianjin300070,China)
Organic boron compound is an important organic synthetic block,which has important research significance and application in the field of organic synthesis.At present,metal-catalyzed carboboration of alkynes is an effective method to construct vinylboronates.Starting from different types of metal catalyst and nonmetal catalyst,we summarized the research progress of carboboration of alkynes,and reviewed the reaction mechanism of correlative reaction in detail.Meanwhile,we pointed out the development directions of carboboration of alkynes in the future.
vinylboronate;metal or nonmetal catalyst;carboboration
2017-03-02
王拓(1991-),女,河北廊坊人,硕士研究生,研究方向:金属有机化学,E-mail:wangtuo1991@tju.edu.cn;通讯作者:常静,助理工程师,E-mail:jing_chang@tju.edu.cn。
10.3969/j.issn.1672-5425.2017.07.004
O643.36 O627.31
A
1672-5425(2017)07-0017-07
王拓,张佳成,常静.炔烃碳硼化反应研究进展[J].化学与生物工程,2017,34(7):17-23,30.
