替格瑞洛与氯吡格雷对NSTE-ACS患者PCI术后血小板反应性及炎性因子的影响
2017-08-01魏玉杰刘惠亮
丁 鹏,魏玉杰,刘惠亮
替格瑞洛与氯吡格雷对NSTE-ACS患者PCI术后血小板反应性及炎性因子的影响
丁 鹏,魏玉杰,刘惠亮
目的 比较替格瑞洛和氯吡格雷对非ST段抬高型急性冠脉综合征(non-ST-segment elevation acute coronary syndrome,NSTE-ACS)患者经皮冠状动脉介入术(percutaneous coronary intervention,PCI)后血小板反应性和炎性因子影响。 方法 将122例NSTE-ACS患者随机分为替格瑞洛组(n=60)和氯吡格雷组(n=62),在行 PCI 术前,替格瑞洛组和氯吡格雷组分别给予负荷剂量的替格瑞洛(180 mg)及氯吡格雷(300 mg),术后继续口服维持剂量的药物。比较两组患者治疗前及术后2 h、24 h、7 d的血小板反应指数(platelet reactivity index,PRI)和1 d、7 d、30 d炎性因子水平及随访30 d后的缺血率和出血率。结果 替格瑞洛组术后2 h、24 h、7 d的PRI均低于氯吡格雷组,差异具有统计学意义(P<0.01);术后1 d、7 d、30 d替格瑞洛组的炎性因子水平均低于氯吡格雷组,差异具有统计学意义(P<0.01);两组患者缺血和出血事件无明显差异。 结论 替格瑞洛较氯吡格雷更能够有效降低NSTE-ACS患者术后PRI和炎性因子水平,并且可能有降低不良心血管事件的趋势。
替格瑞洛;氯吡格雷;非ST段抬高型急性冠脉综合征;炎性因子
非ST段抬高型急性冠脉综合征(non-ST-segment elevation acute coronary syndrome,NSTE-ACS)包括不稳定心绞痛和非ST段抬高型心肌梗死(non-ST-segment elevation myocardial infarction,NSTEMI),其长期预后很差[1,2]。全球NSTE-ACS每年的发病率超过0.5%,成为医疗保健系统的一个巨大负担[3]。NSTE-ACS通常是由于动脉粥样硬化引起的冠状动脉主支的不完全闭塞或分支的完全闭塞,其常见机制是动脉粥样硬化斑块破裂或侵蚀触发的血小板聚集,血小板活化是血栓形成和栓塞的一个关键环节[4]。炎性反应是动脉粥样硬化疾病和急性冠脉综合征形成中的关键因素[5,6]。炎性反应和血管内皮细胞功能紊乱的共同作用导致了动脉粥样硬化斑块的破裂,从而诱发血小板聚集、血栓形成并引起了急性心肌梗死的发生,炎性标志物的浓度与动脉粥样硬化斑块的进展及不稳定程度密切相关。经皮冠状动脉介入术(percutaneous coronary intervention,PCI)是NSTE-ACS的主要治疗手段,PCI术以及缺血再灌注都可能加重血管炎性反应,而后者对于PCI术后再发缺血事件有着重要的作用。阿司匹林和氯吡格雷双重抗血小板治疗是ACS患者PCI术后预防缺血事件的基石,但是氯吡格雷起效较慢,不同个体间差异性较大,对于氯吡格雷反应性差的患者具有较高的再发支架内血栓和心肌梗死的风险[7]。替格瑞洛是第一种口服可逆的选择性P2Y12受体拮抗剂,已广泛用于临床。本研究旨在比较替格瑞洛与氯吡格雷在NSTE-ACS患者中抗血小板及抗炎作用。
1 对象与方法
1.1 研究对象 选取2015-05至2016-06武警总医院符合研究方案并拟行PCI术的NSTE-ACS患者共122例。根据既往研究,假设替格瑞洛组术后2 h 血小板反应指数(platelet reactivity index,PRI)较氯吡格雷组低0.2,两组标准差分别为0.2和0.3,要达到90%的把握度且双侧α=0.05,考虑到10%的退出率,总共至少需要80例患者。将符合标准的NSTE-ACS患者随机分配为氯吡格雷组(对照组)和替格瑞洛组(试验组)。随机方法采用随机区组设计,每个区组包含4个研究对象,采用随机信封的方法实现分组的隐匿。本研究为单盲试验,研究者知道不同试验组所用药物而受试者不了解该情况。本试验遵守赫尔辛基宣言,并经武警总医院伦理委员会审核通过,所有患者在均签署知情同意书。
1.2 纳入与排除标准 纳入标准:(1)已签署知情同意书;(2)年龄为18~80岁;(3)计划行PCI的NSTEACS患者。排除标准:(1)对阿司匹林、氯吡格雷或替格瑞洛过敏;(2)活动性出血或出血倾向;(3)近期短暂脑缺血发作;(4)近7 d服用过氯吡格雷、替格瑞洛或普拉格雷;(5)已知血液异常或具有抗血小板治疗禁忌证或近期拟行外科手术者;(6)瓣膜病、心肌病、心肌炎、先心病、周围血管病、感染性心内膜炎;(7)近30 d参加了其他临床研究;(8)怀孕或哺乳期妇女;(9)左室射血分数≤30%,血肌酐≥3 mg/dl的肾功能衰竭,有肝脏病史,心动过缓的风险增加,合并应用干扰CYP3A4代谢的药物。
1.3 方法 氯吡格雷组:口服氯吡格雷300 mg负荷量,随后服用75 mg 1次/d。替格瑞洛组:口服替格瑞洛180 mg负荷量,随后服用90 mg 2次/d。此外,所有患者每天服用阿司匹林75~100 mg,除非不能耐受。以前未服用过阿司匹林的患者,先给予300 mg负荷量,随后服用75~100 mg 1次/d。糖蛋白Ⅱb/Ⅲa受体拮抗剂、低分子肝素和其他额外的药物根据临床情况由心血管专科医师使用。所有入选患者均在给予负荷量后2~72 h之内经桡动脉途径按照标准技术操作完成药物涂层支架植入。
1.3 标本采集 由专业护士于NSTE-ACS患者服用负荷剂量P2Y12受体拮抗剂前和术后2 h、1 d、7 d、30 d,采集肘前静脉血2 ml。其中(1)3.2%枸橼酸钠抗凝真空采血管采集标本,用于检测PRI,标本保存室温,并于采血后48 h内检测;(2)用于检测炎性因子的血标本于3 h内低温离心(4 ℃,3000 r/min,15 min)后取血清,并将血清标本标号后保存于-80 ℃冰箱待测。
1.4 术后随访 患者出院后30 d采用电话或门诊随访,记录所有患者出院后30 d内的主要不良心血管事件和出血事件。
1.5 观察指标 ( 1)比较两组用药物前及术后2 h、24 h、7 d的PRI,PRI采用血管扩张刺激磷酸蛋白(vasodilator-stimulated phosphoprotein, VASP)磷酸化水平检测[8,9],血小板VASP磷酸化状态采用法国BD(Becton Dickinson)公司生产的FACS Calibur流式细胞仪进行定量分析;(2)比较两组用负荷量P2Y12受体拮抗剂前,术后1 d、7 d、30 d的炎性因子C反应蛋白(c-reactive protein, CRP)、肿瘤坏死因子(tumor necrosis factor, TNF-α)、可溶性CD40L受体(CD40 ligand , CD40L)及白介素8(interleukin-8, IL-8)水平;(3)观察两组30 d主要不良心血管事件(包括心源性死亡、卒中、再发性心肌梗死等)和出血事件发生率,出血事件采用出血学术研究会(bleeding academic research consortium, BARC)定义标准。
1.6 PRI及炎性因子水平的测定 VASP的磷酸化水平测定由实验室技术人员采用PLT VASP/P2Y12流式检测试剂盒(法国Stago公司),并按照操作说明进行检测分析。以PRI>50%定义为血小板高反应性(high on-treatment platelet reactivity,HPR)。流式细胞仪计数分析之后,测定试管T1、T2的平均荧光强度(mean fluorescence intensities,MFI),经减去同型阴性对照得到校正后的MFIc。MFIc(PGE1)=MFI(T1)c=MFI(T1)-MFI(T3),MFIc(PGE1+ADP)=MFIc(T2)=MFI(T2)-MFI(T3)根据静息态(PGE1)和激活态(PGE1 + ADP)时矫正的MFIc 计算PRI。VASP-PRI =[(MFIPGE1-MFIPGE1 + ADP)/ MFIPGE1]×100%。炎性因子CRP、TNF-α、CD40L、IL-8水平采用双抗夹心酶联免疫吸附法(enzyme linked immunosorbent assay, ELISA)测定。试剂盒购自北京晶美生物工程有限公司。
1.7 统计学处理 采用SPSS 20.0统计软件分析数据,计量资料以表示,计数资料以频数或百分比表示;计量资料组间比较使用独立样本t检验,计数资料组间比较使用Pearson χ2或Fisher确切概率法,以P<0.05为差异有统计学意义,术后两组间PRI与炎性因子整体比较比较采用重复测量方差分析,同时点组间及各时间点两两比较采用成组或配对t检验,对应检验水准调整为P<0.05/4。
2 结 果
2.1 两组一般资料比较 两组患者一般资料及吸烟、高血压、糖尿病及高脂血症等冠心病的危险因素比较,差异无统计学意义;两组在冠心病二级预防用药、冠脉病变特征及患者植入支架数目比较,差异无统计学意义,见表1。
2.2 两组PRI与HPR比较 两组治疗前PRI与HPR基线比较,差异无统计学意义;两因素重复测量方差分析发现PCI术后氯吡格雷组PRI整体高于替格瑞洛组,PCI术后2 h、24 h、7 d,氯吡格雷组PRI高于替格瑞洛组,差异有统计学意义(P<0.01);氯吡格雷组术后各时间点HPR发生率均高于替格瑞洛组(P<0.01,表2)。组别及时间整体分析采用两因素重复测量方差分析,两组术后PRI与服药前相比均降低(P<0.013),组内时间与分组无交互作用(P=0.142,表2)。
2.3 两组术前及术后炎性因子比较 两组患者CRP、TNF-α、CD40L、IL-8等炎性因子水平在术前比较无统计学差异,在术后1 d达到最高,随后下降。术后替格瑞洛组各炎性因子水平整体均低于氯吡格雷组,替格瑞洛组术后各时间点炎性因子均低于氯吡格雷组,两组炎性因子术后1 d、7 d、30 d比较,差异有统计学意义(P<0.01,表3)。组别及时间整体分析采用两因素重复测量方差分析,两组及各时间点各炎性指标均存在明显差异(P<0.01),时间与组别存在交互作用(P<0.01)。
2.4 随访 所有NSTE-ACS患者随访30 d,共有8例发生出血事件,均为BARC1或BARC2出血(5例为替格瑞洛组,3例为氯吡格雷组),两组间出血事件发生率无明显差异(P=0.677)。1例发生支架内血栓(氯吡格雷组),两组缺血性事件发生率无差异(P=0.981)。
3 讨 论
血小板在动脉粥样硬化、不稳定性心绞痛、血栓形成等病理过程中发挥重要作用。在过去的10年里,双联抗血小板治疗(阿司匹林和P2Y12受体拮抗剂)已经成为ACS患者及PCI术后抗栓治疗的基石[10],阿司匹林与氯吡格雷联合使用的抗血小板治疗大大降低了PCI术后心血管事件的发生率。然而仍有相当一部分人在抗血小板治疗后表现为HPR[11],而HPR与PCI术后复发血栓事件密切相关。替格瑞洛作为一种新型P2Y12 受体拮抗剂,研究证实替格瑞洛比氯吡格雷具有更加明显的抗血小板作用和更好的临床预后[12]。

表1 两组患者一般资料的比较
研究表明,血小板参与动脉粥样硬化斑块的形成和扩展也是炎性的一个来源介质[13]。血小板活化和炎性反应在ACS的发生和发展过程中起重要作用,早期有效的抗血小板治疗对于改善ACS患者临床预后有重要意义。抗血小板药物除了有抑制血小板聚集产生血栓的作用外,包括阿司匹林和P2Y12受体拮抗剂在内的多种抗血小板药物还有抗炎和保护内皮的作用[14]。

表2 两组患者治疗前后PRI和HPR发生率比较
ACS患者血液中炎性细胞因子增高,细胞因子间通过合成分泌的相互调节、受体表达的相互调控及生物学的相互效应而形成复杂的调控网络,影响炎性反应过程。其中炎性因子CRP、CD40L、IL-8、TNF-α与PCI术后缺血事件显示了较强的相关性[15]。CRP是冠心病炎性反应的“金标志物”[16],能促进血管炎性反应和血栓形成,对于冠心病发病率、病死率、预后具有重要的独立预测价值。循环中IL-8可阻止中性粒细胞游走、黏附,而迁移到缺血心肌组织,释放溶酶体酶、毒性氧化反应物质导致心肌组织损伤。TNF-α来源广泛,体内多种细胞均可产生和释放TNF-α,可导致性反应、细胞坏死,并可引起血管壁的损伤,促进动脉硬化和血栓形成。sCD40L可以促进炎性介质IL-1、TNF-α的表达,诱导一系列黏附分子如E-选择素、人血管细胞生长因子等的表达,诱导趋化因子如巨噬细胞炎性蛋白-1、间质细胞来源因子-1等表达和释放,抑制炎性细胞凋亡,上调基质金属蛋白酶表达,并促进粥样斑块中新生血管形成,因此sCD40L可能是导致血栓形成更为特异的炎性介质之一。
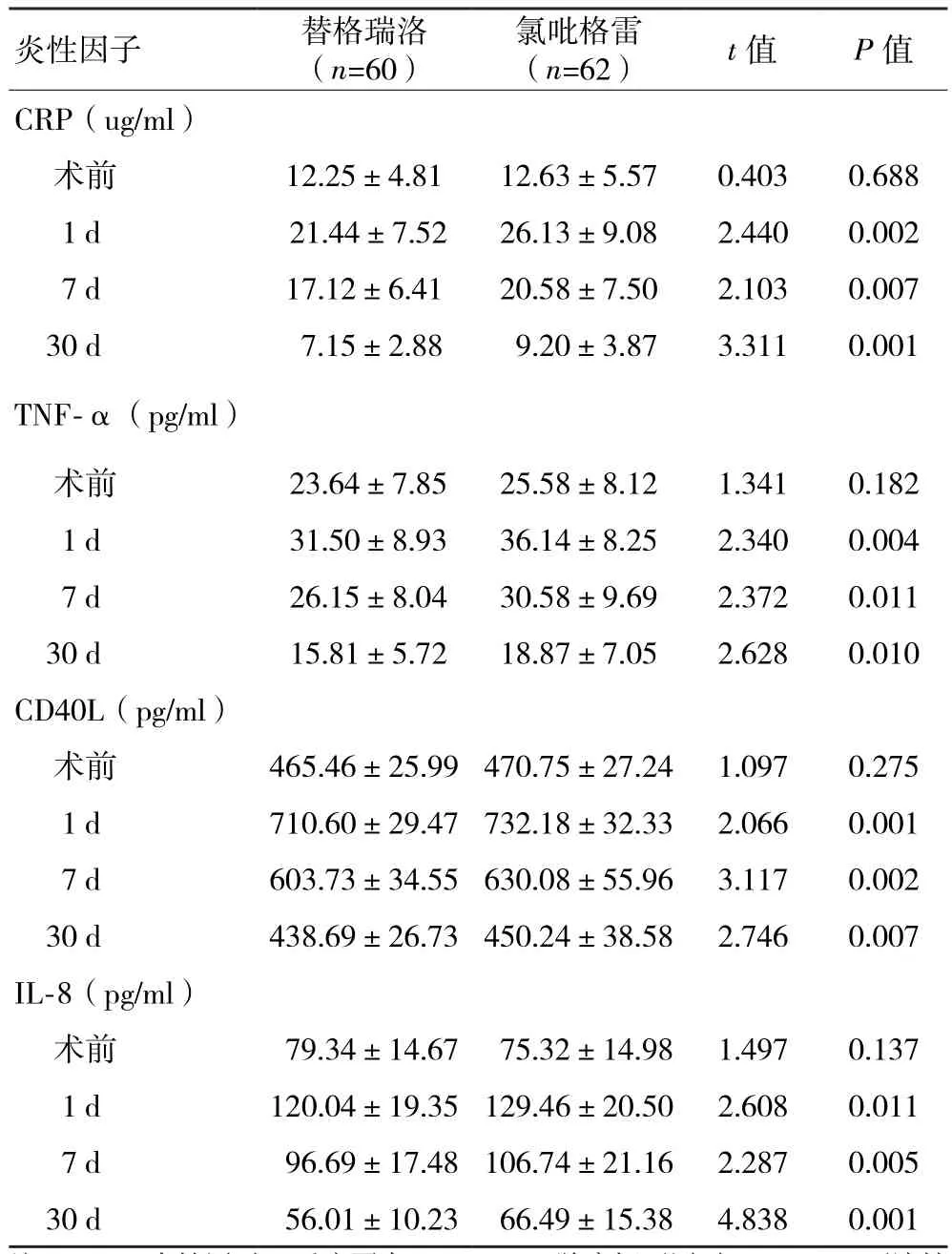
表3 两组患者治疗前后炎性因子水平的比较(x±s)
本研究发现,服用替格瑞洛患者各时间点PRI均较服用氯吡格雷患者低,且在服用负荷剂量2 h后明显起效;替格瑞洛比氯吡格雷更早、更强抑制血小板聚集,这与Gurbel 等[17]研究结果一致。有研究证实,服用负荷剂量P2Y12受体拮抗剂后PRI与PCI术后再发心脏缺血事件有很强的关联性[18]。本研究得出替格瑞洛可更快更强发挥抗血小板的作用,但是两组间不良缺血事件无明显差异,这可能是由于样本量较小,随访时间较短所致。因此替格瑞洛在不增加出血风险的情况下可以减少不良缺血事件的发生。
本研究中试验组用替格瑞洛治疗后,NSTE-ACS患者术后各时间点的炎性细胞因子水平均较对照组明显改善,表明替格瑞洛较氯吡格雷具有更强的抗炎作用。这可能与替格瑞洛具有更强的抗血小板作用有关,其可通过抑制血小板聚集,改善心肌缺血缺氧环境、降低应激反应。但由于炎性反应的复杂性和目前对于急性冠脉综合征炎性反应认识的局限性,替格瑞洛抑制炎性反应的具体机制仍需进一步研究。本研究为单中心研究,样本量较小,随访时间较短,仅用一种方法测定血小板功能及炎性因子,未来需要大样本量多中心临床研究,同时选择多种血小板功能及炎性因子测定方法,进一步研究替格瑞洛对于血小板反应性及炎性因子的影响。总之,替格瑞洛较氯吡格雷不仅具有更快更有效的抗血小板作用,还能够有效抑制炎性反应,并且有降低不良心血管事件的趋势。
[1]Yeh R W, Sidney S, Chandra M, et al. Population trends in the incidence and outcomes of acute myocardial infarction [J]. N Engl J Med, 2010, 362(23): 2155-2165. DOI:10.1056/NEJMoa0908610.
[2]Terkelsen C J, Lassen J F, Norgaard B L. Mortality rates in patients with ST-elevation vs. non-ST-elevation acute myocardial infarction: observations from an unselected cohort [J]. Eur Heart J, 2005, 26(1): 18-26. DOI: 10.1093/ eurheartj/ehi002.
[3]Bellemain-Appaix A, Kerneis M, O'Connor S A, et al. Reappraisal of thienopyridine pretreatment in patients with non-ST elevation acute coronary syndrome: a systematic review and meta-analysis [J]. BMJ, 2014, 349(aug062): g6269. DOI: 10.1136/bmj.g6269.
[4]Bassand J P, Hamm C W, Ardissino D, et al. Guidelines for the diagnosis and force for the diagnosis and treatment of non ST-segment elevation acute coronary syndromes of the European Society of Cardiology [J]. Eur Heart J, 2007, 28(2): 1598-1660. DOI: 10.1093/ eurheartj/ehm498.
[5]Ridker P M. Inflammatory biomarkers and risks of myocardial infarction stroke, diabetes, and total mortality: implications for longevity [J]. Nutr Rev, 2007, 65(2): S253-S259. DOI: 10.1111/j.1753-4887.2007.tb00372.x.
[6]Lucas A R, Korol R, Pepine C J. Inflammation in atherosclerosis: some thoughts about acute coronary syndromes [J]. Circulation, 2006, 113(17): e728-e732. DOI: 10.1161/CIRCULATIONAHA. 105.601492.
[7]Siller-Matula J M, Trenk D, Schro¨r K, et al. EPA (European Platelet Academy) Response variability to P2Y12 receptor inhibitors: expectations and reality [J]. JACC CardiovascInterv, 2013, 6(11): 1111-1128. DOI: 10.1016/ j.jcin.2013.06.011.
[8]Frere C, Cuisset T, Quilici J, et al. ADP-induced platelet aggregation and platelet reactivity index VASP are good predictive markers for clinical outcomes in non-ST elevation acute coronary syndrome [J]. Thromb Haemost, 2007, 98(4): 838-843. DOI:10.1160/TH07-04-0296.
[9]Aradi D, Komo´csi A, Price M J, et al. Efficacy and safety of intensified antiplatelet therapy on the basis of platelet reactivity testing in patients after percutaneous coronary intervention: Systematic review and meta-analysis [J]. Int J Cardiol, 2013, 167(5): 2140-2148. DOI: 10.1016/j. ijcard.2012.05.100.
[10]Windecker S, Kolh P, Alfonso F, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization: The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI) [J]. Eur Heart J, 2014, 46(4): 517-592. DOI: 10.1093/ejcts/ezu366.
[11]Wisman P P, Roest M, Asselbergs F W, et al. Plateletreactivity tests identify patients at risk of secondary cardiovascular events: a systematic review and meta-analysis [J]. J ThrombHaemost, 2014, 12(5): 736-747. DOI: 10.1111/jth.12538.
[12]Wallentin L, Becker R C, Budaj A, et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes [J]. N Engl J Med, 2009, 361(11): 1045-1057. DOI: 10.1056/ NEJMoa0904327.
[13]Wagner D D, Burger P C. Platelets in inflammation and thrombosis [J]. Arterioscler Thromb Vasc Biol, 2003, 23(12): 2131-2137. DOI: 10.1161/01.ATV.0000095974. 95122.EC.
[14]Muhlestein J B. Effect of antiplatelet therapy on inflammatory markers in atherothrombotic patients [J]. ThrombHaemost, 2010, 103(1): 71-82. DOI: 10.1160/TH09-03-0177.
[15]Zhou B D, Zu L Y, Mi L, et al. An analysis of patients receiving emergency CAG without PCI and the value of GRACE score in predicting PCI possibilities in NSTE-ACS patients [J].J GeriatrCardiol, 2015, 12(3): 246-250. DOI: 10.11909/j.issn.1671-5411.2015.03.008.
[16]Patel V B, Robbins M A, Tolol E J. C-reactive protein: a "golden marker" for inflammation and coronary artery disease [J]. Cleve Clin J Med, 2001, 52(2): 109-114. DOI: 10.3949/ccjm.68.6.521.
[17]Gurbel P A, Bliden K P, Butler K, et al. Randomized double-blind assessment of the ONSET and OFFSET of the antiplatelet effects of ticagrelor versus clopidogrel in patients with stable coronary artery disease: the ONSET/OFFSET study [J]. Circulation, 2009, 120(25): 2577-2585. DOI: 10. 1161/ CIRCULATIONAHA. 109. 912550.
[18]Aradi D, Komócsi A, Vorobcsuk A, et al. Prognostic significance of high on-clopidogrel platelet reactivity after percutaneous coronary intervention: systematic review and meta-analysis [J]. Am Heart J, 2010, 160(3): 543-551. DOI: 10.1016/j.ahj.2010.06.004.
(2017-03-24收稿 2017-06-09修回)
(本文编辑 宋宫儒)
Effect of ticagrelor and clopidogrel on platelet reactivity and inf l ammatory factors in patients with non-ST-segment elevation acute coronary syndrome after percutaneous coronary intervention
DING Peng, WEI Yujie, and LIU Huiliang. Department of Cardiology, General Hospital of Chinese People's Armed Police Force, Beijing 100039, China
LIU Huiliang, E-mail: liuhuiliang518@163.com
Objective The study objective was to compare the effect of ticagrelor and clopidogrel on platelet reactivity and inflammatory factors in patients with non-ST-segment elevation acute coronary syndrome (NSTE-ACS) after percutaneous coronary intervention (PCI). Methods A total of 122 NSTE-ACS patients were randomly divided into the ticagrelor group (n=60) and the clopidogrel group (n=62). The ticagrelor group was given a loading dose of ticagrelor (180 mg) and the clopidogrel group with 300 mg clopidorel. The platelet reactivity index (PRI) was measured by vasodilator-stimulated phosphoprotein phosphorylation (VASP-P) before PCI and at 2 h, 24 h and 7 d after PCI. Inflammatory factors were compared by enzyme-linked immunosorbent assay (ELISA) before PCI and 1 d, 7 d and 30 d after PCI. Ischemic and bleeding events were followed up for 30 d. Results The PRI of the ticagrelor group was significantly lower than the clopidogrel group 2 h, 24 h, 7 d after PCI , and the difference was statistically significant (P<0.01). The levels of inflammatory factors were lower in the ticagrelor group than those in clopidogrel group 1 d, 7 d and 30 d after PCI (P<0.01). During the 30 d follow-up period, no significant difference with regard to the rates of bleeding and ischemic events was found between the two groups. Conclusions Ticagrelor produces a significantly higher platelet inhibition and anti-inflammatory effects compared with clopidogrel in NSTE-ACS, and it can reduce the incidence of ischemic events without an increase in the rate of overall major bleeding.
ticagrelor; clopidogrel; non-ST-segment elevation acute coronary syndrome; inflammatory factors
R541.4
10.13919/j.issn.2095-6274.2017.07.004
100039 北京,武警总医院心内科
刘惠亮,E-mail: liuhuiliang518@163.com
