犬免疫介导性血小板减少症的诊断与治疗
2017-08-01迟万怡张海霞孙艳争
黄 欣,迟万怡,张海霞,孙艳争
(中国农业大学动物医院,北京 海淀 100193)
犬免疫介导性血小板减少症的诊断与治疗
黄 欣,迟万怡,张海霞,孙艳争
(中国农业大学动物医院,北京 海淀 100193)
免疫介导性血小板减少症(Immune-mediated thrombocytopenia,ITP)是由免疫介导血小板破坏增加而引起的血小板减少。抗血小板抗体结合至血小板表面形成的抗原抗体复合物,被自身的单核细胞吞噬系统识别为“异物”而吞噬。其破坏速率是正常血小板破坏速率的10倍。ITP分为原发性ITP和继发性ITP,后者由免疫、肿瘤、药物治疗、微生物感染或输血反应等潜在病因引起。现报告一原发性ITP病例如下。
1 病例情况
比熊犬,7岁,雄性(去势),体重6.9 kg。正常免疫,未驱虫。发病当日便血,发病第2天排黑便,第3天至本院就诊。排尿未见异常。平时日粮以干粮、零食和熟鸡胸肉为主,发病前饲喂过葱炒牛肉,发病后无饮食欲,未见呕吐。
2 检查
2.1 体格检查
犬精神尚可,脱水程度<5%,黏膜淡粉色、未见黄染,皮肤黏膜未见明显瘀血点/斑,口腔、鼻部分泌物无可见出血。呼吸未觉明显异常。心率、体温、血压均未见明显异常。
2.2 实验室检验
2.2.1 血常规检查 血常规检查结果提示中度非再生性贫血,白细胞轻度上升以及严重的血小板减少。检查结果异常指标见表1。
2.2.2 粪便检查 粪便检查提示存在潜血,便检中未见虫卵。因此黑粪症并非由消化道寄生虫引起。
2.2.3 其他 生化检查和尿检均未见明显异常。因此排除了肝脏、肾脏等疾病。
2.3 影像学检查 腹部超声提示:胃肠道形态未见明显异常。双肾皮质回声升高接近脾脏。排除消化道肿物等引起黑粪症的可能。
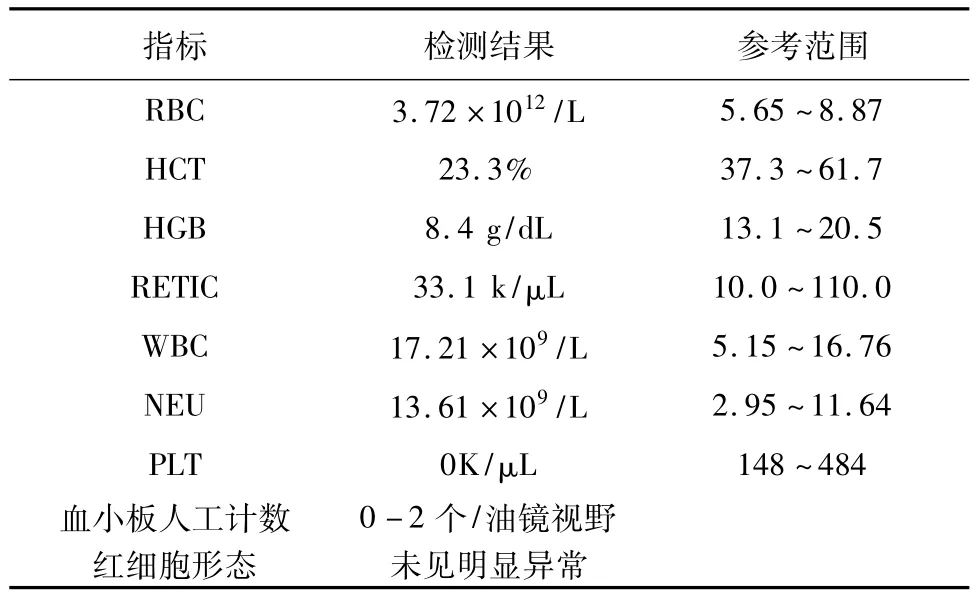
表1 血常规检查异常指标
3 诊断
根据病史及检查结果,排除因为食入含血物质、胃肠道炎症、寄生虫、肿物以及肝肾原因引起黑粪症的可能。并且通过血常规结果确认患犬存在血小板减少症。因此黑粪症可能由于血小板减少引起。血常规显示血小板计数低至0 K/μL,提示存在免疫介导性血小板减少症[1]。同时,病史和检查结果排除了所有可能引起血小板减少的病因,初步诊断为原发性免疫介导性血小板减少症。同时伴有因胃肠道出血导致的中度非再生性贫血。
4 治疗
患犬确诊后第2天住院进行治疗。使用泼尼松龙2 mg/kg体重,每日两次。针对胃肠道症状使用法莫替丁及硫糖铝。常规输液治疗并控制继发感染。
5 转归和预后
使用波尼松龙第3天,血小板数量开始逐渐上升;用药第7天血小板数量恢复至正常水平。此后逐渐减少泼尼松用量,血小板数量未见明显变化(见表2)。红细胞压积随治疗逐步回升,血象提示存在再生性反应(见表2)。使用糖皮质激素治疗后白细胞数量一直呈上升趋势。至用药后第5天,联合使用速诺和拜有利进行治疗,后白细胞数量有所下降(见表2)。

表2 用药后血常规相应指标的变化
6 讨论
6.1 ITP分类及病因学 血小板减少是实验室检验结果中较为常见的异常。首先应当区别是否为人为操作引起的假性结果,如血小板聚集在片尾引起的人工计数下降。北美和欧洲相关调查研究显示,约有5%的犬血小板减少症为原发性ITP[2]。原发性ITP病因未明,其主要致病机制是由于自身免疫调节紊乱,抗体直接攻击血小板抗原而引起的血液学异常。ITP可分为原发性ITP和继发性ITP,继发性ITP的潜在病因包括免疫、肿瘤、药物治疗、微生物感染或输血反应等。
6.2 临床症状 原发性ITP有时可能不表现症状,是进行其他检查时意外发现的异常。常见的原发性ITP表现为嗜睡或精神沉郁(46%)、无饮食欲(34%)以及黑粪症(25%)。体格检查中常发现瘀血点/斑(66%)以及增大的淋巴结(27%)[1]。如果血小板数量<5 K/μL时,可能出现自发性出血。有的病例表现为鼻衄、呕血、血清肿等症状,但较为少见。眼部和中枢神经系统的出血表现为前房积血、视网膜出血或神经症状。在本病例中,只出现了消化道出血的相关症状(黑粪症),而未表现出ITP最常见的皮下瘀血点/斑。
6.3 诊断 原发性ITP的诊断较为困难,需要排除其他疾病才能诊断,因此相对而言花费较高。ITP和DIC引起的血小板减少较为严重(平均值分别为32 K/μL和55 K/μL),与其他原因引起的血小板减少相比具有显著差异[1]。原发性ITP较继发性ITP的血小板计数更少。血涂片上有时可检查到血小板碎片(微血栓),是血小板被免疫破坏的一个指征,但敏感性较差。骨髓穿刺对于ITP的诊断意义仍存争议。有学者认为对于患有血小板减少的犬而言,早期进行骨髓评估能够区别血小板减少是由于生成减少还是消耗/破坏增加引起,并且能够排除骨髓痨、肿瘤、巨细胞再生不良和再生障碍性贫血[3]等病因。但有学者认为,骨髓问题导致的血液学异常多伴有红/白细胞系的异常;另外,即使巨细胞的数量发生变化,也不能确诊ITP,因此对于本病的诊断意义较小,仅当使用免疫抑制治疗无效后才考虑进行检查[4]。在本病例中,由于严重的血小板减少不伴有其他潜在疾病表现(如肿瘤或病原感染),因此应当怀疑存在原发性ITP。原发性ITP的确诊需要证明存在抗血小板抗体,但目前尚未有相关可靠的试验支持。因此在门诊中,原发性ITP的诊断仍以排除性诊断为主。
6.4 治疗 目前治疗原发性ITP的一线用药仍然为糖皮质激素。最常使用的糖皮质激素为中效激素如泼尼松或泼尼松龙。推荐剂量为2~4 mg/kg体重·d,通常分为两次给药。地塞米松有时作为备选方案也可使用。经糖皮质激素治疗7 d内,大部分原发性ITP病例的血小板计数逐步恢复。当血小板计数恢复至正常范围后,可逐步减少糖皮质激素用量。推荐的减量方式为每两周减量20% ~25%,并且在此期间需每周监测血小板计数情况。在少数情况下,单纯使用糖皮质激素可能无效。有研究使用长春新碱联合糖皮质激素治疗原发性ITP,发现联合用药能在更短的时间内恢复血小板计数。但尚未有研究证实长春新碱是否会造成血小板功能异常。咪唑硫嘌呤联合糖皮质激素也是一种治疗方法,但由于咪唑硫嘌呤起效时间较长,因此对于紧急控制ITP效果不佳。还有许多其他联合用药治疗ITP的方法,但由于样本有限,也没有进行对比研究,因此很难判定哪种治疗方式更为有效[5]
6.5 预后 原发性ITP预后难以预估。动物对于免疫抑制治疗的反应有所不同,并且不同地区不同研究显示的复发率也有所差异。一项评估预后因素的回顾性调查发现,诊断原发性ITP时,出现黑粪症和高血清尿素氮为预后不利因素。黑粪症提示的胃肠道出血意味着可能出现更为严重的贫血,需要的相应治疗花费更多,同时动物的体况更差。因此动物主人选择安乐死的几率更大[6]。
[1] Scuderi M A,Snead E,Mehain S,etal.Outcome based on treatment protocol in patients with primary canine immune-mediated thrombocytopenia:46 cases(2000-2013)[J].Canadian Veterinary Journal La Revue Veterinaire Canadienne,2016,57(5): 516-520.[2] Botsch V,Kuchenhoff H,Hartmann K,etal.Retrospective study of871 dogs with thrombocytopenia[J].Veterinary Record,2009,164(21):647-651.
[3] Richard,Nelson C,Guillermo Couto.Small Animal Internal Medicine 5th Edition[M].Elsevier,2013.
[4] Barfield D.BSAVA Manual of Canine and Feline Haematology and Transfusion Medicine[M].Journal of Small Animal Practice,2012.
[5] Nakamura R K,Tompkins E,Bianco D,et al.Therapeutic options for immune-mediated thrombocytopenia[J].Journalof Veterinary Emergency and Critical Care,2012,22(1):59-72.
[6] Omarra S K,Delaforcade A M,Shaw S P,et al.Treatment and predictors of outcome in dogs with immune-mediated thrombocytopenia[J].Javma-journal of The American Veterinary Medical Association,2011,238(3):346-352.
S858.292
B
0529-6005(2017)06-0094-02
2016-12-28
黄欣(1990-),女,硕士,从事小动物诊疗工作,E-mail:xiaoshitot@163.com
孙艳争,E-mail:sunyanzheng2580@163.com;张海霞,E-mail:axiastar@126.com
