酿酒酵母-酒类酒球菌接种方式对樱桃酒品质的影响
2017-07-31张沁芳张云舒李鹏孙舒扬赵玉平
张沁芳,张云舒,李鹏,孙舒扬*,赵玉平
1(烟台大学 生命科学学院,山东 烟台,264025)2(鲁东大学 食品工程学院,山东 烟台,264025)
酿酒酵母-酒类酒球菌接种方式对樱桃酒品质的影响
张沁芳1,张云舒2,李鹏2,孙舒扬2*,赵玉平1
1(烟台大学 生命科学学院,山东 烟台,264025)2(鲁东大学 食品工程学院,山东 烟台,264025)
对比分析了酿酒酵母(F10)-酒类酒球菌(VP41)顺序接种和同时接种2种模式对樱桃酒的发酵过程、酒体成分、生物胺含量以及感官质量的影响。结果显示,同时接种模式能够缩短发酵时间,更高效地萃取樱桃果浆中的多酚和花色苷,降低色胺、苯乙胺、亚精胺和组胺的生成量,赋予樱桃酒更浓郁的果香。因此,酿酒酵母-酒类酒球菌同时接种模式具有在樱桃酒生产中推广应用的潜力。
酒类酒球菌;接种模式;樱桃酒;感官分析;生物胺
樱桃酒富含矿物质、维生素和多酚等保健成分,具有促进血液循环和机体代谢、改善心脑血管功能等功效,符合消费者追求天然、有益于健康的果酒趋势[1-2]。
对樱桃酒而言,适量的有机酸可以赋予其醇厚感和清爽感,抑制病菌的活动,但是当有机酸含量较高时,会给人以酸涩、粗糙的感觉[3],因此,合理的降酸是樱桃酒酿造过程的主要问题。樱桃酒中的有机酸主要是苹果酸和柠檬酸,占总酸的80%以上,使樱桃酒带有强烈的刺激味,严重影响其口感。苹果酸-乳酸发酵(malolactic fermentation,MLF)是樱桃酒酿造过程中非常重要的二次发酵过程,代谢L-苹果酸使其转化为L-乳酸,并释放出CO2,具有改善樱桃酒的口感、降低酸度和涩度、增强微生物的稳定性、增加风味复杂性等作用[4]。MLF可以自然发生,也可以通过人为接种乳酸菌来启动。自发的MLF在发酵时间上具有不确定性,而且不利于樱桃酒的质量控制和安全控制,因此通过人为添加乳酸菌启动MLF是目前樱桃酒生产中的重要工序[5-6]。
在樱桃酒的酿造过程中,一般情况下需要先接种酿酒酵母进行酒精发酵,然后再接种乳酸菌进行苹果酸—乳酸发酵,即所谓的“顺序发酵”[7]。近年来,有研究者提出可以尝试将酿酒酵母和乳酸菌同时接种,促使酒精发酵和MLF同时进行,能够大大缩短发酵时间,从而提高生产效率[8]。本课题通过对酵母菌-乳酸菌接种方式的相关研究,对比同时接种和顺序接种两种方式下酒体的理化指标、生物活性成分、生物胺含量、感官品质的差异,从而选择最佳的接种方式,即在保证樱桃酒质量水平的前提下,获得能够进一步提高生产效率的乳酸菌接种方式。
1 材料与方法
1.1 材料
实验用樱桃品种为大紫,采自烟台,2016年6月成熟并收集。其基本化学成分如下:总糖 174 g/L,可溶性固形物17.3%,滴定酸5.6 g/L,pH 3.76。
1.2 酿造菌种
酿酒酵母F10、酒类酒球菌Lalvin VP41,均购于加拿大Lallemand公司。
1.3 试剂
没食子酸、单宁酸、二甲花翠素-3-葡萄糖苷、组胺、酪胺、色胺、尸胺、苯乙胺、精胺、亚精胺、丹磺酰氯:色谱纯,美国Sigma 公司;L-苹果酸检测试剂盒,德国Biopharm公司;酒石酸钾钠、亚铁氰化钾、次甲基蓝:分析纯,国药集团;其他试剂均为国产分析纯。
1.4 仪器
高效液相色谱仪(配紫外检测器),日本岛津公司;离心机,上海安亭科学仪器厂;氮吹仪,美国Organomation公司;生化培养箱,上海一恒科学仪器有限公司;721G 型分光光度计,上海精密科学仪器有限公司;pB-10 型pH 计,新锐仪表仪器有限公司。
1.5 实验方法
1.5.1 樱桃酒发酵工艺
分别通过顺序接种和同时接种2种方式酿造干型红樱桃酒。具体实验流程如下:
1.5.1.1 顺序接种
樱桃清洗、破碎后送入发酵罐中,102 ℃灭菌10 min,加入50 mg/L SO2和30 mg/L果胶酶,添加适量蔗糖使总糖达到210 g/L。先接种酿酒酵母F10(300 mg/L),并于28 ℃持续发酵7~8 d。发酵过程中监测果浆中还原糖的变化,定期搅拌循环。当樱桃酒中总糖小于4 g/L时,离心分离出酿酒酵母,终止酒精发酵,而后接种酒类酒球菌VP41TM(10 mg/L)进行苹果酸-乳酸发酵。MLF在20 ℃下进行,监测樱桃酒中酒类酒球菌和苹果酸的变化。待苹果酸浓度低于0.5 g/L,离心去除酒类酒球菌终止苹果酸乳酸发酵,而后测定樱桃酒的各种指标。
1.5.1.2 同时接种
樱桃清洗、破碎后送入发酵罐中,102 ℃灭菌10 min,加入50 mg/L SO2和30 mg/L果胶酶,添加适量蔗糖使总糖达到210 g/L。先接种酿酒酵母F10(300 mg/L),并于28℃发酵24 h,而后接种酒类酒球菌VP41TM(10 mg/L),并使发酵温度降低至20 ℃。发酵过程中监测酵母、酒类酒球菌的增殖过程以及还原糖、苹果酸含量的变化。发酵结束后,离心分离出酿酒微生物和果渣,检测樱桃酒的各项酒体指标。
1.5.2 分析方法
酒精度、还原糖、总酸、挥发酸的测定方法参照《GB/T 15038—2006葡萄酒、果酒通用分析方法》执行。其中:还原糖采用斐林试剂法测定,以葡萄糖计;挥发酸和总酸均通过氢氧化钠滴定法测定,分别以乙酸和苹果酸计;L-苹果酸采用L-苹果酸检测试剂盒测定;酒精度采用密度瓶法;pH 通过酸度计测定。
总酚含量采用福林-肖卡法测定,以没食子酸计[9]。单宁含量经福林-丹尼斯法测定,以单宁酸计[9]。花色苷含量利用pH示差法测定,以二甲花翠素-3-葡萄糖苷计[9]。
酵母活细胞数采用梯度稀释法测定。在发酵过程中,定时取样,用无菌水梯度稀释后(稀释倍数为100~108),涂布于酵母膏胨葡萄糖琼脂培养基(YPD),于25 ℃好氧条件下培养72 h后计数[10]。菌体量的表示方法为CFU/mL。
乳酸菌活细胞计数也采用梯度稀释法测定。樱桃酒经无菌生理盐水梯度稀释后(稀释倍数为100~108),涂布于含有200 μg/mL制霉菌素的MRS培养基,在30 ℃厌氧条件下培养3 d后计数。菌体量的表示方法为CFU/mL。
生物胺测定方法参照国标《GB/T 5009.208—2008食品中生物胺含量的测定》执行。
1.5.3 样品感官质量分析
采用定量描述分析法(QDA)对樱桃酒进行感官品质分析。评价小组由13人组成,包括5男8女,年龄22~41岁。正式实验之前,经过多轮检验和讨论,已确定了樱桃酒的3个主要的香气特征,分别是果香、生青气味和醇香;3个主要的味道属性,分别是酸、苦、涩;3个主要的颜色特征,分别是红色、黄色和棕色。
正式实验过程在标准品评室完成(单间小格90 cm× 100 cm,低于40 dB噪音,通风良好,周围无杂物及产异味物等)。品评者将对样品的香气、颜色及味道属性打分。评分采用 10 点制,0代表无,9代表该特征最强。
1.6 数据处理
使用 SPSS v13.0(SPSS 公司,美国)对所有数据进行方差分析。利用方差分析和邓肯的多重比较测试实验来确定酒样指标之间的差异。所有的变量都经标准化(1/Sdev)处理。
2 结果与分析
2.1 顺序接种模式下的发酵进程
在顺序接种模式下,酿酒酵母主导的酒精发酵和酒球菌主导的苹果酸乳酸发酵顺次进行,发酵进程如图1、图2所示。接入酿酒酵母F10后,酒精发酵开始启动(图1)。在发酵初期,醪液中的酵母细胞数较少,但是F10能够迅速适应樱桃汁环境,在微氧条件下迅速生长繁殖,数量迅速增加。随着发酵的进行,醪液中的糖分和营养素大部分被消耗掉,残存的部分葡萄糖缓慢发酵,酵母数量增长缓慢。酒精发酵60 h后F10活细胞数达到最高值(6.78×107CFU/mL),并维持了近60 h。而后酵母开始衰老死亡,数量逐渐减少。
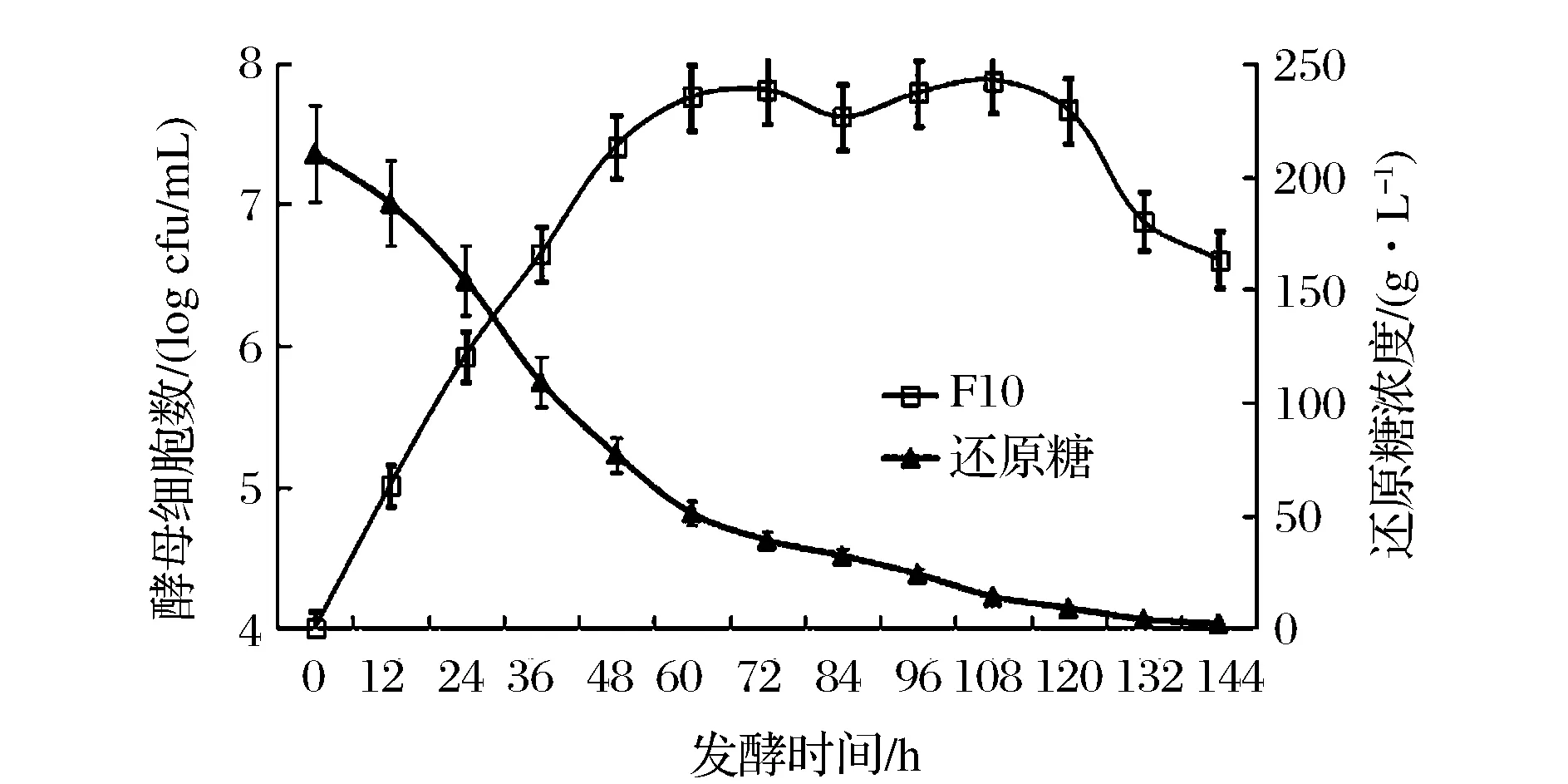
图1 顺序接种模式下酿酒酵母增殖和还原糖代谢过程Fig.1 The evolution of F10 and consumption of reducing sugars during alcoholic fermentation of sequential inoculation culture
酒精发酵结束后,于第7天接入酒类酒球菌VP41启动苹果酸乳酸发酵,进行降酸实验(图2)。VP41需要2 d适应酒体环境,而后呈现较旺盛的生长状态,待发酵进行19 d时,VP41细胞数达到最高(4.26×107CFU/mL),维持了6 d后便以较快的速度衰亡。就苹果酸的代谢过程而言,在MLF初期,苹果酸几乎未被降解,出现了4 d的延滞期。待VP41适应樱桃酒的酒体环境后,苹果酸的含量便开始急剧下降,在发酵第27 天苹果酸浓度低于0.5 g/L,因此,整个MLF持续了20天。
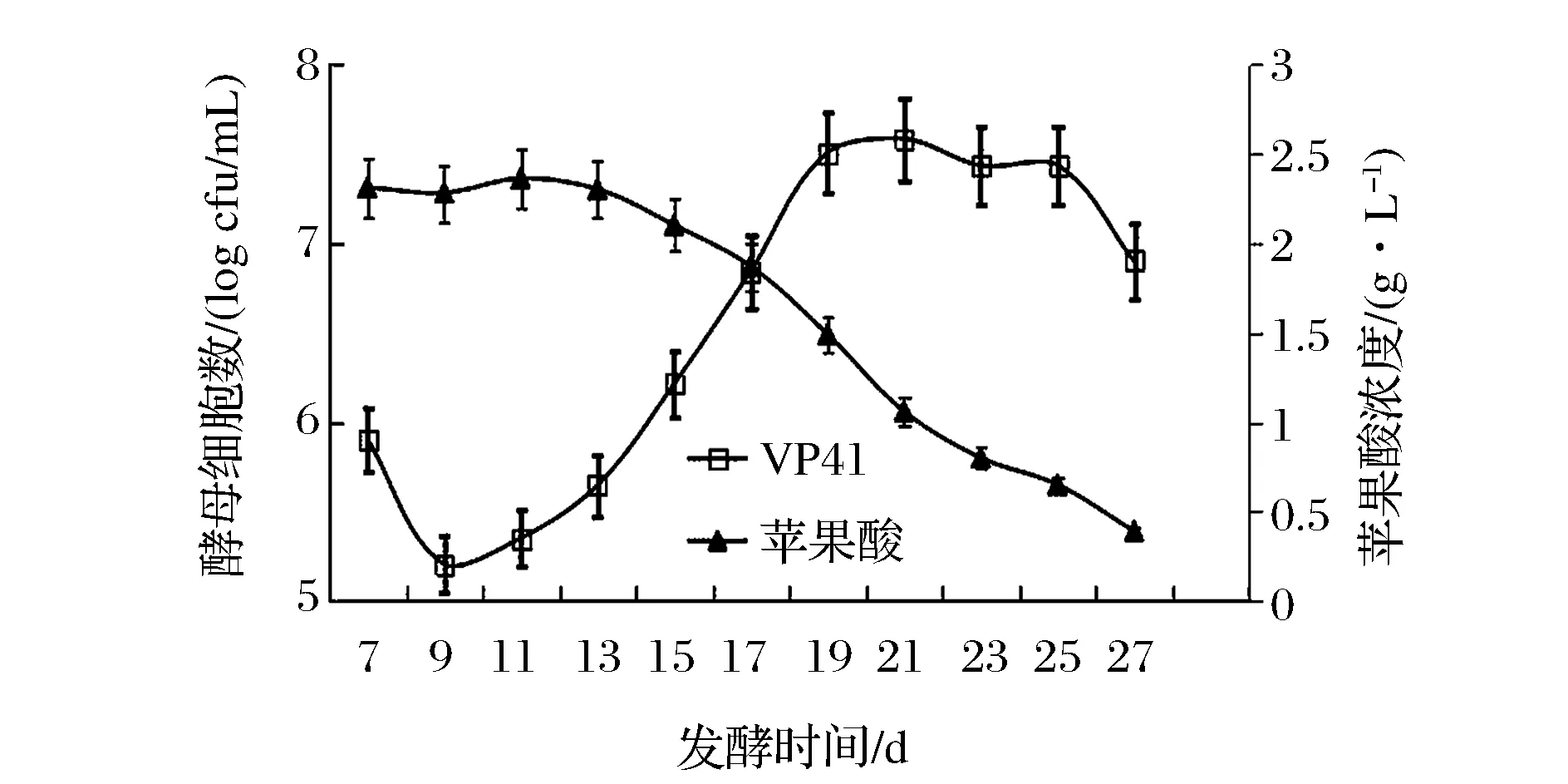
图2 顺序接种模式下乳酸菌增殖和苹果酸代谢过程Fig.2 The evolution of VP41 and consumption of malic acid during malolactic fermentation of sequential inoculation culture
2.2 同时接种模式下的发酵进程
在同时接种模式下,酿酒酵母主导的酒精发酵和酒球菌主导的苹果酸乳酸发酵几乎同步进行,发酵进程如图3、图4所示。通过跟踪测定发现,F10能够迅速适应樱桃果汁,快速启动酒精发酵,表现出较强的发酵动力。在发酵第3天和第11天,F10和VP41的活细胞数分别达到了最高,为5.85×107CFU/mL 和3.79×107CFU/mL。
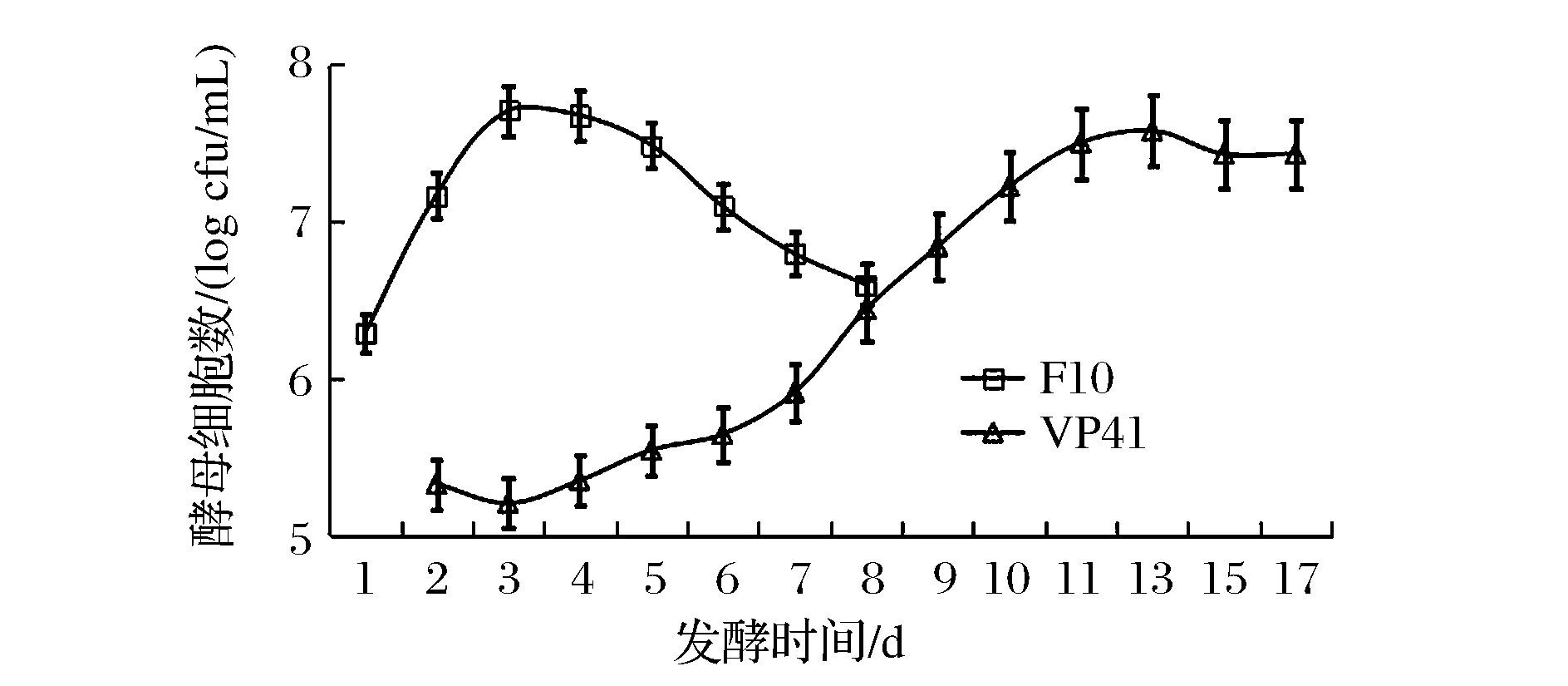
图3 同时接种模式下F10和VP41的增殖进程Fig.3 The evolution of F10 and VP41 during the fermentation of co-inoculation culture
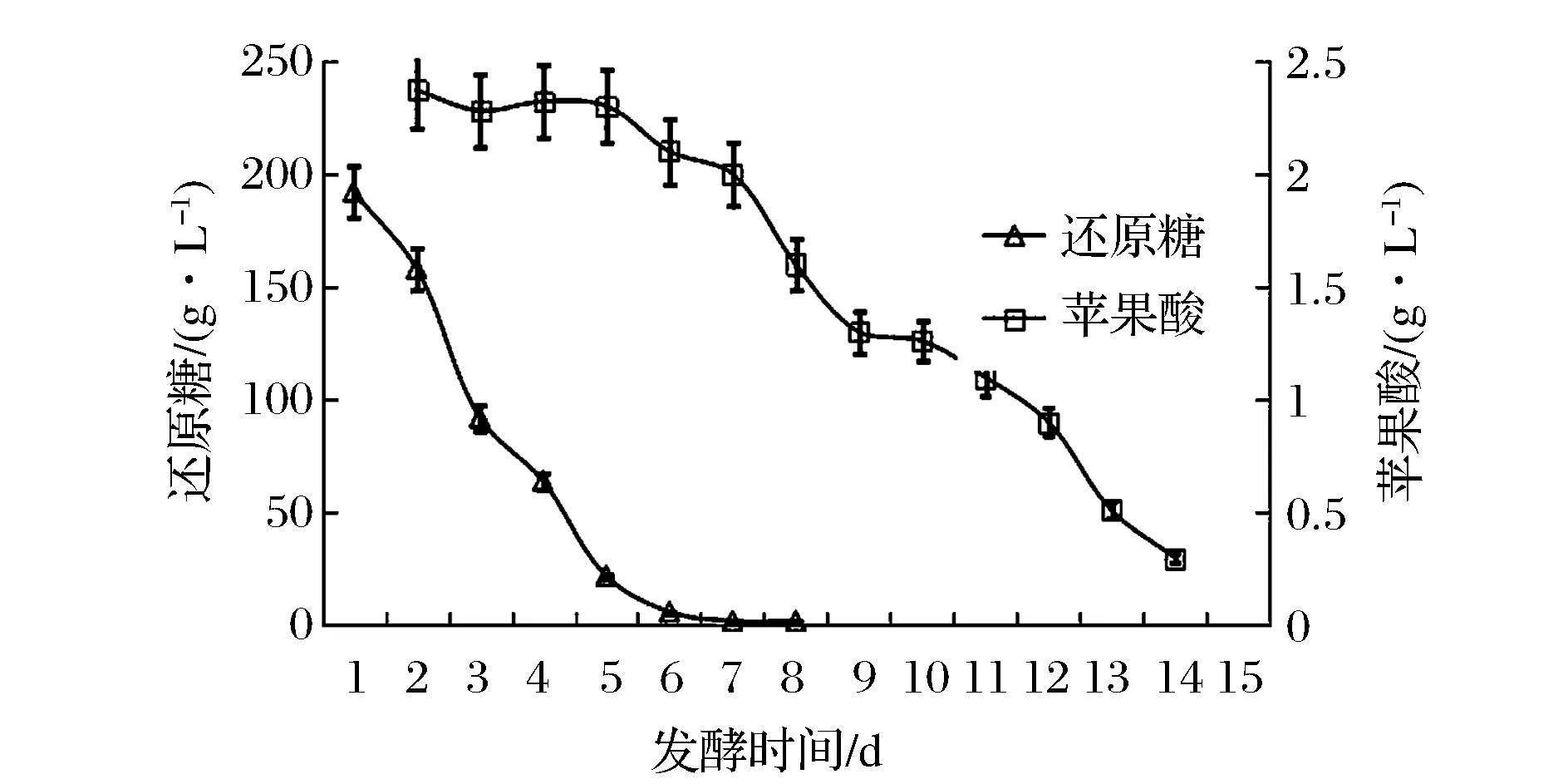
图4 同时接种模式下还原糖和苹果酸的代谢过程Fig.4 The consumption of reducing sugars and malic acid during the fermentation of co-inoculation culture
对比顺序接种模式下酿酒酵母F10的发酵进程,其在同时接种方式下的最大细胞量较少,而且衰亡速度更快,这可能要归因于竞争性的发酵环境,因为在同时接种的模式下,F10与VP41竞争性的利用樱桃汁中的营养物质,如碳源、氮源及其他微量元素等。由于营养素的消耗,导致F10更早的进入衰亡期,且衰亡速度更快。相反的是,VP41则在同时接种的模式下呈现出了更强的竞争力,其增殖速度明显高于顺序接种下的增长速度,这同样要归因于营养素的利用。在顺序接种方式下,先进行酒精发酵必然会消耗大量的营养素,且发酵醪液中含有乙醇,可能会在一定程度上抑制VP41的生长。
通过对比顺序接种和同时接种中酿造微生物的发酵进程,发现顺序接种的发酵周期明显长于同时发酵,顺序发酵过程耗时27天,而同时接种仅需要15天,因此,同时接种展现了更高的生产效率,缩短了发酵时间,具有在樱桃酒生产中推广应用的潜力。
2.3 酒类酒球菌接种方式对樱桃酒酒体成分的影响
发酵结束后,去除发酵残渣,获得澄清酒体,而后检测樱桃酒的各种基本理化指标,包括酒精度、还原糖、pH、滴定酸、苹果酸和挥发酸,以及生物活性组分含量,包括总酚、单宁、黄酮和花色苷,具体结果列于表1中。
检测结果显示,无论采取何种接种方式,樱桃酒的还原糖含量都低于4 g/L,说明发酵已完全。酒精度(10.6%~10.8%)和pH(3.92~3.94)不存在显著性差异。苹果酸在MLF后已降低至0.42~0.45 g/L,说明两种接种方式分解苹果酸的能力相当。根据葡萄酒国家标准(GB15037-2006),挥发酸的质量浓度必须低于1.2 g/L,本研究中两种接种方式下获得的樱桃酒的挥发酸含量均低于0.33 g/L,符合国标规定。通常认为,在同时接种模式下,自然发酵的乳酸菌会导致果酒的挥发酸浓度大幅上升,这是由于酒体中自带的乳酸菌会利用醪液中的糖代谢生成乙醇,进而产生乙酸[11],而采用优选的人工接种苹-乳发酵乳酸菌株则会优先利用醪液中的有机酸,其次才是糖类,因此产生过量乙酸的趋势大幅降低[11]。本实验的研究结果支持以上论断,虽然同时接种模式导致樱桃酒挥发酸含量增加,但增加幅度却十分微小。
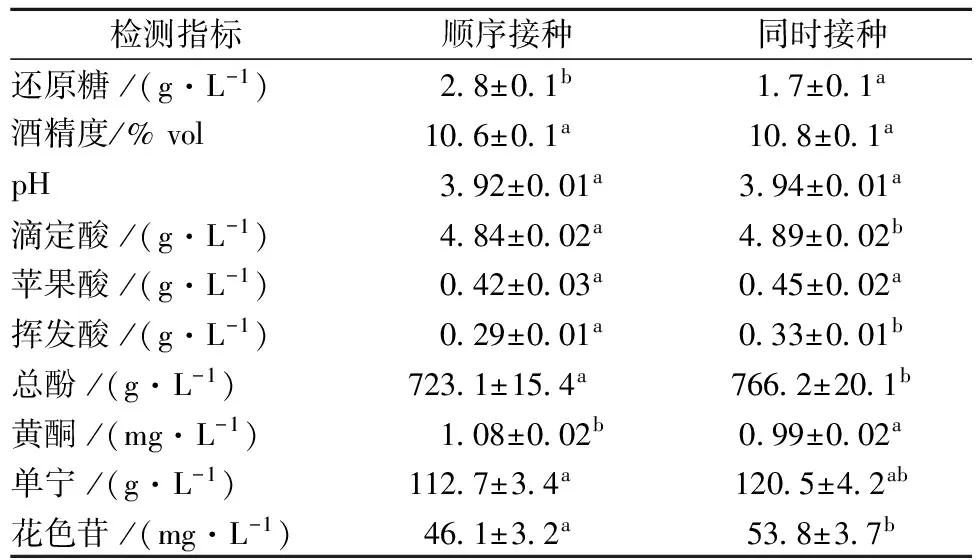
表1 不同接种方式下樱桃酒的酒体成分
注:同行字母(a-b)代表显著性差异(P< 0.05)。
针对樱桃酒中的生物活性物质,本项目主要检测了多酚、单宁、黄酮和花色苷的含量。多酚与樱桃酒的色泽、风味等品质指标密切相关,适量摄入能够减少心血管疾病、动脉粥样硬化、血小板聚集等多种疾病的发病率[12]。单宁是组成樱桃酒骨架的重要组分[9]。黄酮类化合物能赋予樱桃酒的一定的颜色和收敛性,同时还具有抗癌、消炎、抗菌等药理作用[13]。花色苷是樱桃酒中重要的呈色物质,不仅影响樱桃酒的颜色和口感,还能在酒体中发挥重要的抗氧化作用,如清除自由基和螯合金属离子等[9]。对比2种樱桃酒中的生物活性组分,我们发现顺序接种模式下的总酚和花色苷含量均出现了一定程度的下降,总酚较之同时接种模式下降了5.6%,花色苷下降了14.3%,而单宁和黄酮浓度在两种樱桃酒中仅存在微小差异。
在葡萄酒的酿造过程中,顺序接种模式由于发酵周期长,确保了葡萄醪的充分浸渍,因而酒体颜色更为艳丽且口感富于骨架,而同时接种方式由于发酵时间较短,只能萃取部分多酚类化合物,因而颜色和口感均有所逊色[14-15]。但是以上趋势在樱桃酒中却未出现,同时接种不会导致樱桃酒颜色、骨架的损失,相反还有利于它们的形成,这可能要归因于樱桃酒中的特殊的多酚类化合物,其种类、含量和性质与葡萄酒有所不同,长时间浸渍不仅不会提升樱桃酒的色泽和口感,相反还会导致酒体呈现褐色,降低其感官品质。
2.4 酒类酒球菌接种方式对生物胺含量的影响
生物胺是一类含氮的低分子质量化合物的总称,在含酒精的发酵饮料中广泛存在[16]。果酒中的生物胺主要有组胺、酪胺、苯乙胺、精胺等,当这些生物胺过量摄入时,可致使人体出现头痛、呼吸紊乱、心悸、血压变化等中毒反应[17]。生物胺中以组胺对人体健康危害最大,因此,部分国家已制定了严格的食品(葡萄酒)中的组胺限量标准,如法国不得高于8 mg/L,比利时不得高于5~6 mg/L,德国不得高于2 mg/L[18-19]。
在果酒的生产过程中,诸多环节都有可能导致生物胺的形成或积累,其中苹果酸-乳酸发酵是果酒生物胺形成的最主要的阶段。Hernández-Orte等研究Tempranillo葡萄酒中的生物胺时发现,生物胺总量在乙醇发酵之后为7.42 mg/L,但是经过MLF后含量已提高至10.6 mg/L,这是因为主导MLF的乳酸菌携带氨基酸脱羧酶基因,当其作用于酒体中的氨基酸时,便可使氨基酸脱羧形成生物胺[20]。
顺序接种和同时接种均涉及苹果酸乳酸发酵阶段,因此不可避免的会导致生物胺的生成,本研究对两种接种模式下的生物胺的种类和含量进行了检测和比对,研究结果如表2所示。顺序接种和同时接种模式下均检出7 种生物胺,分别是色胺、苯乙胺、尸胺、精胺、组胺、酪胺和亚精胺。

表2 不同接种方式下樱桃酒的生物胺含量
注:同行字母(a-b)代表显著性差异(P< 0.05)。
检测结果显示,精胺是樱桃酒中含量最高的生物胺,在顺序接种樱桃酒和同时接种樱桃酒中的含量分别达到了10.45 mg/L和6.06 mg/L。其次是酪胺,在2种樱桃酒的含量分别达到了3.59 mg/L 和4.21 mg/L。其他生物胺的含量均较低,不超过2 mg/L。组胺在顺序接种和同时接种樱桃酒中的含量仅为1.78 mg/L和0.84 mg/L,低于欧美等国对组胺限量标准。
通过对比顺序接种和同时接种樱桃酒中的生物胺含量,我们发现顺序接种樱桃酒的生物胺浓度更高,尤其是苯乙胺、精胺和组胺,分别是同时接种樱桃酒中相应生物胺的1.4、1.7和2.1倍。此外,顺序接种樱桃酒的生物胺总量也较高,是同时接种樱桃酒的1.3倍。至于同时接种为何会减少生物胺的形成和积累,其机制尚不明确,有待进一步研究。
2.5 酒类酒球菌接种方式对樱桃酒感官品质的影响
定量描述分析(QDA)是一种定性和定量相结合的、具有较强实用性的感官评定方法[21]。本项目召集了13 名专业樱桃酒感官评定人员对樱桃酒的香气特征、色泽以及滋味等感官指标进行描述分析,并对各描述特征强度取均值,形成风味剖面图(图5)。
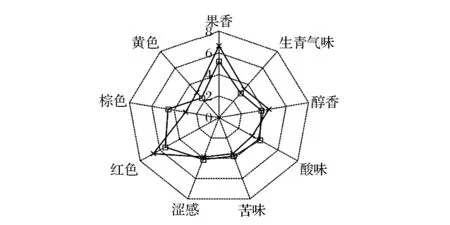
图5 不同接种方式的樱桃酒的感官分析结果Fig.5 The sensory analysis of cherry wines resulting from twoinoculation strategies
品评结果显示,同时接种模式获得的樱桃酒红色调突出,外观感觉较好;而顺序接种的樱桃酒棕色较深,外观质量一般。就味道属性而言,两种接种方式获得的樱桃酒酒体都较圆润,入口舒顺,酸、甜、苦涩感适中,后味干净,因而总体评价很接近。就香气属性而言,同时接种的樱桃酒的果香较浓郁,而顺序接种的酒样的香气得分较低。同时接种模式除了显著性增强果香外,对生青气味和醇香也有一定程度的促进,因而其总体香气较之顺序接种更浓郁。关于同时接种模式促进果香的原因,相关文献中曾提及,在同时接种的发酵醪液中,由于MLF快速启动保证了苹果酸在因酵母代谢形成的还原环境中降解,从而阻止了黄油味或乳味香气的形成,因而使果酒保留了原有的果实香气[11,14]。此外,同时接种模式有利于挥发性酯类化合物的形成和积累,因而会赋予果酒更丰富的香气和更独特复杂的风格[11,14]。
综合各种感官属性,同时接种模式下生产的樱桃酒颜色红艳,香气馥郁协调,入口舒顺,酒体圆润,滋味纯正,属于上乘的樱桃酒。
3 结论
苹果酸-乳酸发酵是樱桃酒生产过程中非常重要的二次发酵过程,能够大幅减少酒体中的有机酸,改善口感,还能提升樱桃酒的微生物稳定性和风味特性。本课题通过对比酿酒酵母F10和酒类酒球菌VP41顺序接种和同时接种对微生物增殖及樱桃酒品质的影响,确定最佳的接种模式。发酵过程的跟踪测定表明,同时接种模式的发酵速度更快,转化效率较高,仅需15 天即可完成发酵。MLF发酵结束后,检测樱桃酒的基本理化指标、生物活性组分及生物胺含量。研究结果表明,两种接种模式下获得的樱桃酒的酒体组成非常相近,仅有微小差异。较之顺序接种,同时发酵能够更高效的萃取樱桃中多酚类化合物,赋予樱桃酒更艳丽的颜色。两种接种模式下均检出7 种生物胺,以组胺的毒性最强。该化合物在两种樱桃酒中的含量均不超过2 mg/L,说明两种接种方式下获得的樱桃酒均具有较高的安全性。对樱桃酒的品评结果显示同时接种能显著增强樱桃酒的果香特征,使酒样香气馥郁协调,产品质量上乘。综合以上结果,我们认为酿酒酵母-酒类酒球菌同时发酵模式具有更显著的优势,适宜在樱桃酒生产中推广应用。本课题的研究结果可为进一步优化樱桃酒发酵工艺及樱桃酒的生产提供一定的理论依据。
[1] NIU Yun-wei,ZHANG Xiao-ming,XIAO Zuo-bing,et al.Characterization of taste-active compounds of various cherry wines and their correlation with sensory attributes[J].Journal of Chromatography B,2012,902:55-60.
[2] SUN Shu-yang,GONG Han-sheng,ZHAO Yu-ping,et al.Sequential culture withTorulasporadelbrueckiiandSaccharomycescerevisiaeand management of fermentation temperature to improve cherry wine quality[J].Journal of the Science of Food and Agriculture,2016,96(6):1 880-1 887.
[3] SUN Shu-yang,GONG Han-sheng,LIU Wen-li,et al.Application and validation of autochthonousLactobacillusplantarumstarter cultures for controlled malolactic fermentation and its influence on the aromatic profile of cherry wines[J].Food Microbiology,2016,55:16-24.
[4] LUCIO O,ISABEL P,SIBYLLE K W,et al.Selection ofLactobacillusstrainsto induce biological acidification in low acidity wines[J].LWT- Food Science and Technology,2016,73:334-341.
[5] BETTERIGE A,PAUL G,VLADIMIR J.ImprovingOenococcusoenito overcome challenges of wine malolactic fermentation[J].Trends in Biotechnology,2015,33(9):547-553.
[6] SUMBY K M,GRBIN P R,JIRANEK V.Implications of new research and technologies for malolactic fermentation in wine[J].Applied Microbiology and Biotechnology,2014,98(19):8 111-8 132.
[7] SUN Shu-yang,CHE Chang-yang,SUN Teng-fei,et al.Evaluation of sequential inoculation ofSaccharomycescerevisiaeandOenococcusoenistrains on the chemical and aromatic profiles of cherry wines[J].Food Chemistry,2013,138(4):2 233-2 241.
[8] SUN Shu-yang,GONG Han-sheng,ZHAO Kun,et al.Co-inoculation of yeast and lactic acid bacteria to improve cherry wines sensory quality[J].International Journal of Food Science & Technology,2013,48(9):1 783-1 790.
[9] XIAO Zuo-bing,FANG Ling-ling,NIU Yun-wei,et al.Effect of cultivar and variety on phenolic compounds and antioxidant activity of cherry wine[J].Food Chemistry,2015,186:69-73.
[10] SUN Shu-yang,GONG Han-sheng,JIANG Xiao-man,et al.Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations withSaccharomycescerevisiaeon alcoholic fermentation behaviour and wine aroma of cherry wines[J].Food Microbiology,2014,44:15-23.
[11] 陈莹,宋茂华,李泽福,等.理想苹果酸-乳酸发酵中乳酸菌接种时机的选择[J].中外葡萄与葡萄酒,2010,(5):53-56.
[12] 蒋宝,罗美娟,张振文.黄土高原地区酿酒葡萄果实多酚物质及抗氧化活性分析[J].食品与发酵工业,2014,40(3):163-168.
[13] CHIU Kou-Lung,CHENG Ya-chuan,CHEN Jun-hao,et al.Supercritical fluids extraction of Ginkgo ginkgolides and flavonoids[J].The Journal of Supercritical Fluids,2002,24(1):77-87.
[14] ALEXANDRE H,COSTELLO P J,REMIZE F,et al.Saccharomycescerevisiae-Oenococcusoeniinteractions in wine:current knowledge and perspectives[J].International Journal of Food Microbiology,2004,93(2):141-154.
[15] JUSSIER D,MORNEAU A D,DE ORDUA R M.Effect of simultaneous inoculation with yeast and bacteria on fermentation kinetics and key wine parameters of cool-climate Chardonnay[J].Applied and Environmental Microbiology,2006,72(1):221-227.
[16] GUO Yan-yun,YANG Yan-ping,PENG Qian,et al. Biogenic amines in wine: a review[J].International Journal of Food Science & Technology,2015,50(7):1 523-1 532.
[17] MOHAMMED G I,BASHAMMAKH A S,ALSIBAAI A A,et al.ChemInform Abstract: A critical overview on the chemistry, clean-up and recent advances in analysis of biogenic amines in foodstuffs[J].Trac Trends in Analytical Chemistry,2016,78(40):84-94.
[18] 李志军,薛长湖,吴永宁.反相高效液相色谱法测定食品中生物胺[J].食品工业科技,2005,26(4):175-178.
[19] 冯婷婷,方芳,杨娟等.食品生物制造过程中生物胺的形成与消除[J].食品科学,2013,34(19):360-366.
[20] HERNANDEZ O P,LAPENA A C,GALLEGO A P,et al.Biogenic amine determination in wine fermented in oak barrels:factors affecting formation[J].Food Research International,2008,41(7):697-706.
[21] Sáenz-Navajas María-Pilar,Yohanna Alegre,Arancha de-la-Fuente,et al.Rapid sensory-directed methodology for the selection of high-quality aroma wines[J].Journal of the Science of Food and Agriculture,2016,96(12):4 250-4 262.
The influence ofSaccharomycescerevisiae-Oenococcusoeniinoculation mode on the quality of cherry wines
ZHANG Qin-fang1,ZHANG Yun-shu2,Li Peng2,SUN Shu-yang2*,ZHAO Yu-ping1
1(College of Life Sciences, Yantai University, Yantai 264025, China)2(School of Food Engineering, Ludong University, Yantai 264025, China)
TheSaccharomycescerevisiaeandOenococcusoeniinoculation modes have a great influence on the fermentation and quality of cherry wines. In the present study, a sequential culture and a co-inoculation culture was separately applied in the production of cherry wines, in order to elucidate their impact on the compositional profile, biogenic amine content and sensory characteristics of cherry wines. Obtained results demonstrated that the co-inoculation strategy could significantly shorten the fermentation time, extract more polyphenols and tannins from the cherry pulp, decrease the formation of biogenic amines and confer the wine with a stronger fruity note. Based on these findings, the co-inoculation culture can be applied in the cherry wine-making industry.
Oenococcusoeni; inoculation strategy; cherry wine; sensory analysis; biogenic amine
硕士研究生(孙舒扬副教授为通讯作者。E-mail:sysun81@aliyun.com)。
国家自然科学基金(31501577);山东省高校科技发展计划(J13LE10)
2016-12-30,改回日期:2017-02-24
10.13995/j.cnki.11-1802/ts.201706019
