生物酶法改性提高植物组织化蛋白的产品特性
2017-07-31李占方诸葛斌宗红陆信曜方慧英许乔张静张润杰
李占方,诸葛斌*,宗红,陆信曜,方慧英,许乔,张静,张润杰
1(江南大学,糖化学与生物技术教育部重点实验室,江苏 无锡,214122)2(江南大学,工业生物技术教育部重点实验室,生物工程学院,工业微生物研究中心,江苏 无锡,214122)3(江苏全盈生物科技有限公司,江苏 宿迁,223800)
生物酶法改性提高植物组织化蛋白的产品特性
李占方1,2,诸葛斌1,2*,宗红1,2,陆信曜1,2,方慧英1,2,许乔1,2,张静3,张润杰3
1(江南大学,糖化学与生物技术教育部重点实验室,江苏 无锡,214122)2(江南大学,工业生物技术教育部重点实验室,生物工程学院,工业微生物研究中心,江苏 无锡,214122)3(江苏全盈生物科技有限公司,江苏 宿迁,223800)
以低温脱脂豆粕、大豆分离蛋白、谷朊粉和小麦淀粉为原料,研究生物酶[菠萝蛋白酶、转谷氨酰胺酶(TG)酶]法改性对植物组织化蛋白产品特性的影响,并探讨了酶改性对植物蛋白组织化过程中化学键和蛋白质二级结构的变化规律。研究表明:经菠萝蛋白酶酶解处理的植物组织化蛋白的产品特性优于TG酶,当菠萝蛋白酶加酶量为12.0 U/g时,组织化蛋白的弹性、咀嚼度分别提高了48%和71%;植物蛋白经菠萝蛋白酶酶解处理后,组织化蛋白中二硫键、氢键与疏水键三者交互作用增强,同时蛋白质二级结构中β-折叠向无规则卷曲转变,无规则卷曲含量提高43%,表明二硫键、氢键和疏水键三者交互作用和二级结构中的无规则卷曲有利于植物组织化蛋白弹性和咀嚼度的改善,其中无规则卷曲含量起关键性作用。
酶改性;植物组织化蛋白;化学键;二级结构
植物组织化蛋白是植物蛋白在挤压过程中受温度场、剪切力、压力场和水的共同作用下,由天然的球状聚集态重组而成的具有纤维状结构的蛋白产品[1-2],它较好地结合了植物蛋白的低胆固醇和动物蛋白的良好纤维结构、咀嚼性的优点,是一种高蛋白低脂肪的健康食品,可广泛应用于肉制品、休闲食品、焙烤食品和保健食品等行业[3]。我国从20世纪90年代开始出现植物组织化蛋白产品,经过十多年发展,现已初具规模,目前从事植物组织化蛋白生产产能较大的企业约有10家,年产量约为8万t,虽然组织化蛋白产量及需求量逐年递增,但目前国内生产的植物组织化蛋白的产品特性参差不齐,提高植物组织化蛋白的产品特性、加强产品升级,适应高附加值保健、休闲、方便食品的要求,是植物组织化蛋白产业的迫切问题。
为提高植物组织化蛋白的产品特性,研究人员在挤压法生产工艺、操作参数、系统参数及物料配比等方面进行了大量研究[4-5],虽然取得了一定的效果,但由于其主要根源在于天然植物蛋白本身的组成、空间结构及其性质,单纯物理方法无法解决根本问题,因此需要修饰或改性天然植物蛋白自身结构以适应组织化要求。生物法改性主要通过酶解改性增加植物蛋白分子内或分子间交联,以提高植物蛋白功能特性或营养效价[6]。BOLLECKER等[7]研究表明,纯化的醇溶蛋白酶解后,溶解度提高,但其他功能特性并未提高;MIMOUNI等[8]研究了脱酰胺处理和酶水解对小麦面筋蛋白功能特性的影响,脱酰胺后再进行酶水解可以显著改善其起泡性能和乳化性能;KATO等[9]用链霉蛋白酶(pronase)处理的面筋蛋白其溶解性和乳化性都有显著提高。虽然关于生物酶法改性植物蛋白的研究比较多,但将酶改性应用到植物组织化蛋白产品中的研究尚未见报道。本课题选取菠萝蛋白酶(Bromelain)和转谷氨酰胺酶( transglutaminase,TG)对植物蛋白进行适度酶解处理,旨在研究酶法改性对植物组织化蛋白产品特性提高的影响,同时探讨组织化过程中化学键交联、蛋白质二级结构的变化规律,以期为植物蛋白生物法修饰改性及其组织化应用提供理论基础。
1 材料与方法
1.1 原料与试剂
低温脱脂豆粕,大豆分离蛋白,谷朊粉,小麦淀粉均由江苏全盈生物技术有限公司提供;菠萝蛋白酶(120万U/g),购自南宁东恒华道生物科技有限责任公司;TG酶(120万U/g),购自泰兴东圣食品科技有限公司;2-巯基乙醇(2-ME)、尿素、SDS等化学试剂均为国产分析纯。
1.2 实验设备
双螺杆挤压机:FMHE 36-24同向啮合高扭矩智能化实验室专用双螺杆挤压机(主要参数如下:螺杆直径:36 mm,螺杆长径比为24∶1,挤压机加工区域长度:喂料区144 mm,二区至六区的每区长度均为144 mm。模具类型为:双圆孔锥形模具,出料口直径为4 mm),湖南富马科食品工程技术有限公司;质构仪(TMS-Pro型),美国Food Technology公司;傅里叶变换红外光谱仪:NEXUS,美国尼高力仪器公司;半自动凯式定氮仪(KDN-103F型),上海纤检仪器有限公司;分光光度计(UV-2000型),美国尤尼柯公司。
1.3 实验方法
1.3.1 植物原料酶解处理
将低温脱脂豆粕粉碎后,与大豆分离蛋白、谷朊粉和小麦淀粉搅拌混匀形成混合原料,将适宜浓度的酶液均匀喷洒在混合原料上,使混合原料处于半干状态,经预实验确定在pH自然、50 ℃条件下酶解15 min后灭酶干燥。
1.3.2 样品挤压操作与数据采集
开启双螺杆挤压机,设定挤压参数,待机器预热1 h后,将预处理后的原料送入挤压机挤压成型,并每隔3 min记录挤压机扭矩、模头压力等数据,共记录5组数据求其平均值。分别收集不同预处理原料的挤压样品,65 ℃下烘干,使样品水分控制在10%,室温保存。
1.3.3 植物组织化蛋白产品特性测定
吸水率:称取约20 g样品(W1),放入500 mL烧杯中,加入300 mL蒸馏水,在40 ℃水浴中保温吸水60 min,取出沥干10 min,称量持水后产品质量(W2)。每个样品重复3次。
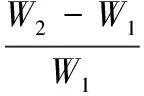
(1)
膨化度:随机取产品10段,以游标卡尺测定其直径,计算平均直径与挤压机模孔直径的比值,即为膨化度[10]。
硬度、弹性、咀嚼度:将样品切成长度为10 mm的条状,用质构仪测定。操作参数:TPA模式,起始力0.5 N,作用力量程10 N,测试速度60 mm/min,间隔时间5 s,往复运动2次,下压程度50%,记录硬度、弹性、咀嚼度的数值,每个样品测量10次,取平均值。
1.3.4 蛋白溶解度及化学键交联的分析
在文献[11]的基础上加以改进,测定挤压样品的蛋白溶解度并对化学键交联进行分析。
浸提溶液制备:① pH7.6, 0.035 mol/L磷酸盐缓冲液(P); ② pH7.6, P+0.1 mol/L 2-ME(M);③ pH7.6, P+1.5% SDS(S); ④ pH7.6, P+8 mol/L尿素(U); ⑤ pH7.6, P+1.5% SDS+0.1 mol/L 2-ME; ⑥ pH7.6, P+8 mol/L U+1.5% SDS;⑦ pH7.6, P+8 mol/L U+0.1 mol/L 2-ME;⑧pH7.6, P+8 mol/L U+1.5% SDS+0.1 mol/L 2-ME。
蛋白质溶解度测定:取2 g左右样品粉碎后(浸提前测定水分含量)加入30 mL上述不同的浸提溶液中,在水平振荡摇床上室温下浸提10 h,10614g离心15 min后取上清液用蒸馏水定容到50 mL,检测样品中总蛋白含量及上清液中蛋白含量。样品中总蛋白含量采用凯氏定氮法测定,上清液中蛋白含量采用福林酚法测定(测定波长750 nm)。按公式(2)计算蛋白溶解度:
(2)
化学键交联分析:根据不同溶液体系中的蛋白质溶解度,确定溶解化学键类型并计算各种化学键交联情况:(1)天然状态蛋白(P):①; (2)二硫键作用(M):②-①; (3)疏水作用(S):③-①; (4)氢键作用(U):④-①; (5)疏水作用和二硫键交互作用(SM):⑤+①-②-③; (6)疏水作用和氢键交互作用(SU):⑥+①-③-④; (7)氢键和二硫键交互作用(UM):⑦+①-④-②; (8)疏水作用、氢键和二硫键三者交互作用(SUM):⑧+②+③+④-①-⑤-⑥-⑦。
1.3.5 蛋白二级结构含量的测定
采用傅里叶变换红外光谱法(FTIR)对蛋白质二级结构含量进行测定:取少量蛋白样品与干燥的已研磨细的KBr粉末按大约 1∶100的质量比混合后放在研钵中进一步研成细粉。取出适量压片,在波数400~4 000 cm-1的范围内用傅里叶变换红外光谱仪进行扫描,扫描32次,分辨率为4 cm-1。然后选取谱图的酰胺Ⅰ区用Peakfit软件进行分峰处理,根据文献[12]确定子峰所对应的蛋白构象,各二级结构所对应的子峰面积占总峰面积的比例即为样品中二级结构的相对含量。
2 结果与分析
2.1 不同酶解处理对植物组织化蛋白产品特性的影响
吸水率、膨化度、硬度、弹性和咀嚼度是衡量植物组织化蛋白产品优劣的重要指标。吸水率大,表明产品组织化程度好、附加值高;膨化度高表明产品熟化程度好;硬度、弹性和咀嚼度高表明产品纤维化程度高,似肉感强。由表1可以看出,菠萝蛋白酶酶解处理对组织化蛋白的吸水率和硬度影响不大,而对膨化度、弹性和咀嚼度有一定影响,随加酶量的增加,产品的膨化度、弹性和咀嚼度呈先增加后降低的趋势,当加酶量为36.0 U/g时,膨化度达到最大值2.23;当加酶量为12.0 U/g时,产品的弹性和咀嚼度最高,分别提高了48%和71%。菠萝蛋白酶对植物蛋白的限制性酶解破坏了其天然构象,使其在挤压过程中更容易沿挤出方向呈线性伸展,这促进了蛋白分子间的相互作用,有利于组织化的形成,因此适度酶解可以改善植物组织化蛋白的产品特性,但过度酶解会使蛋白的肽链断裂,使其降解成小分子的多肽,难以组织化,因此加酶量过大后,植物组织化蛋白的产品特性会变差。TG酶处理对组织化蛋白产品的吸水率、硬度和弹性提升不明显,对咀嚼度有所提高,当加酶量为12.0 U/g时,产品的咀嚼度达到最大值1.45 mJ,提高了12%,明显弱于菠萝蛋白酶。TG酶可催化蛋白质多肽发生分子内和分子间共价交联[13-14],使蛋白质具有聚合或交叉连接的特性,但对蛋白挤压过程中线性结构的形成影响较小,因此对组织化蛋白的产品特性影响不显著。
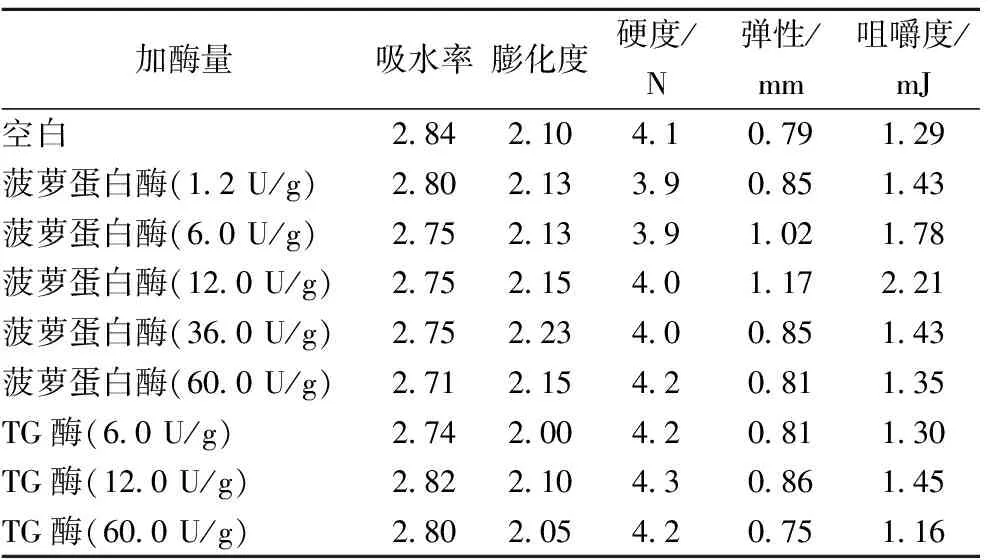
表1 酶改性对植物组织化蛋白产品特性的影响
注:挤压参数为:喂料速度21 kg/h,加水量36%,转速200 r/min,机筒温度组合40-60-100-140-180 ℃;经预实验确定酶解反应条件为:温度50 ℃,时间15 min,pH自然。
2.2 酶改性对植物组织化蛋白化学键交联的影响
SDS、尿素和巯基乙醇分别破坏蛋白质分子之间的疏水键、氢键和二硫键[11-12,15],挤压样品在不同化学键破坏试剂中的溶解度如图1所示,各组样品在P+S+M、P+U+M、P+U+S+M中的溶解度明显高于其他试剂中的溶解度,这表明二硫键与其他化学键之间的交互作用对维持组织化蛋白结构的贡献最大。菠萝蛋白酶酶解样品在P+S、P+U、P+U+S和P+U+S+M中的溶解度上升,其中在P+U+S和P+U+S+M中上升明显,TG酶酶解样品在P+M、P+S、P+U、P+U+S、P+U+S+M、P+U+M中的溶解度均有提升,由此可知,酶解处理对组织化蛋白化学键交联有一定影响。

图1 酶改性对植物组织化蛋白溶解度的影响Fig.1 The effects of enzyme modification on the protein solubility of textured vegetable protein
为了更直观地分析各种化学键交联对维持蛋白质结构的贡献,以样品在不同化学键破坏试剂中的溶解度(图1)为基础,计算由疏水键(S)、氢键(U)、二硫键(M)、疏水键和氢键交互作用(SU)、疏水键和二硫键交互作用(SM)、氢键和二硫键交互作用(UM)以及疏水键、氢键和二硫键三者交互作用(SUM)结合蛋白的情况,如图2所示。

图2 酶改性对植物组织化蛋白化学键交联的影响Fig.2 The effects of enzyme modification on the chemical crosslinking of textured vegetable protein
SUM结合蛋白含量的计算值为负值,这是因为尿素不仅可以破坏氢键,还可以破坏疏水键[11,15,17],而在计算过程中假定其只破坏氢键,使得分析 SUM 作用时多扣除了尿素破坏疏水键的效应,所以得到的计算结果为负值。在不同结合状态的蛋白中,SM、UM和SUM结合蛋白含量对维持组织化蛋白结构贡献最大(图1)。原料经菠萝蛋白酶处理后,样品的SM、UM结合蛋白含量降低,而SUM结合蛋白含量提高20%,说明菠萝蛋白酶酶解可能促使疏水键和二硫键交互作用、氢键和二硫键交互作用向二硫键、氢键和疏水键三者交互作用的转变,其中二硫键、氢键和疏水键三者交互作用的增强对组织化蛋白弹性和咀嚼度的提高有积极作用。原料经TG酶处理后,样品的SUM结合蛋白含量提高30%,但其弹性和咀嚼度不如菠萝蛋白酶酶解样品,可见二硫键、氢键和疏水键三者交互作用虽然对组织化蛋白产品特性(弹性、咀嚼度等)提高有积极作用,但并不呈正相关。因此,为了解酶改性提高组织化蛋白产品特性的机理,需对其二级结构进行研究。
2.3 酶改性对植物组织化蛋白二级结构的影响


表2 原料和不同样品二级结构的百分含量

图3 酶改性对植物组织化蛋白二级结构的影响Fig.3 The effects of enzyme modification on the secondary structures of textured vegetable protein
从以上二级结构定量分析结果可以看出,原料经挤压后,α-螺旋消失,β-折叠含量降低,无规则卷曲和β-转角含量明显上升,这是因为α-螺旋和β-折叠结构主要靠氢键维持,高温挤压造成α-螺旋和β-折叠内部氢键断开,解螺旋并展开,形成β-转角和无规则卷曲结构,从而使蛋白结构更加无序[18]。与对照相比,菠萝蛋白酶酶解样品的β-折叠含量降低,β-转角含量上升不明显,无规则卷曲含量上升43%,这表明菠萝蛋白酶的酶解作用破坏了维持β-折叠结构的化学键,使其向无规则卷曲转变,这种转变有利于组织化蛋白弹性和咀嚼度的提高。TG酶酶解样品的β-折叠含量降低,β-转角含量上升了50%,而无规则卷曲含量变化不明显,这可能是因为TG酶酶解处理使蛋白质之间的交联增强,造成β-折叠内部的氢键断开,促进β-折叠向β-转角转变,但未形成无规则卷曲,导致组织化蛋白弹性和咀嚼度提升有限。综上,对比不同挤压样品的二级结构含量与产品特性可知,蛋白结构中的β-转角和无规则卷曲含量的提高均有利于弹性和咀嚼度的改善,其中无规则卷曲对组织化蛋白弹性和咀嚼度的影响更显著。
3 结论
对比研究了菠萝蛋白酶和TG酶酶解处理植物蛋白对组织化产品质构特性、化学键及蛋白二级结构的影响。植物蛋白经菠萝蛋白酶酶解处理(加酶量为12.0 U/g)后,组织化蛋白的弹性、咀嚼度分别提高48%和71%;二硫键、氢键和疏水键三者交互作用明显增强;蛋白质二级结构中β-折叠向无规则卷曲转变,无规则卷曲含量提高43%。二硫键、氢键和疏水键三者交互作用对植物组织化蛋白弹性和咀嚼度的提升有积极作用,但并不呈正相关,无规则卷曲含量对组织化蛋白弹性和咀嚼度的改善起关键性作用。
[1] MERCIER C, LINKO P, HARPER J M.Extrusion Cooking [M]. St Paul: AACC, 1989: 1-16.
[2] 魏益民,康立宁,张波,等. 高水分大豆蛋白组织化生产工艺和机理分析[J]. 农业工程学报, 2006, 22(10): 193-197.
[3] 董玲,周才琼,张波,等. 大豆蛋白功能性与挤压组织化产品特性的关系研究进展[J].食品科技, 2009, 34(7): 138-141.
[4] 张波,魏益民,陈锋亮,等. 组织化大豆蛋白挤压工艺参数优化研究[J]. 中国粮油学报,2009, 24(8): 16-19.
[5] KOKINI J L, HO C T, KARWE M V. Food extrusion science and technology[M]. NewYork:Marcel Dekker INC, 1992: 619-630; 631-653.
[6] 杨光胜,陈复生,张丽芬,等. 大豆蛋白改性技术研究进展[J]. 粮食与油脂,2013, 26(11):1-3.
[7] BOLLECKER S, VIROBEN G, POPINEU Y, et al. Acid deamidation and enzymatic modification at pH10 of wheat gliadins: influence on their functional properties[J]. Sciences des Aliments, 1990, 10(2): 343-356.
[8] MIMOUNI B, RAYMOND J, MERLE-DESNOVERS AM, et al. Combined acid deamidation and enzymic hydrolysis for improvement of functionalproperties of wheat gluten[J]. Journal of Cereal Science, 1994, 20(2): 153-165.
[9] KATO A, KAZUHIKO S, KUNIHIKO K. Improvement of the functional properties of insoluble gluten by protease digestion followed by dxtran conjugation[J]. Journal of Agricultural and Food Chemistry, 1991, 39(6):1 053-1 056.
[10] SUPATC, KAMOLWANJ, ANUVATJ, et al. Effectofextrusionconditionson physical and chemical properties ofhigh protein glutinous rice-basedsnack[J]. Food Scienceand Technology, 2009, 42(3): 781-783.
[11] CHEN Feng-liang, WEI Yi-min, ZHANG Bo.Chemical cross-linking and molecular aggregation of soybean protein during extrusion cooking at low and high moisture content[J]. Food Science and Technology, 2011, 44(4): 957-962.
[12] 康立宁. 大豆蛋白高水分挤压组织化技术和机理研究[D]. 西安:西北农林科技大学,2007: 90.
[13] LIN S, HUFF H. E, HSIEH F. Texture and chemical characteristics of soy protein meat analog extruded at high moisture[J]. Journal of Food Science, 2000, 65(2): 264-269.
[14] 熊柳,孙庆杰,刘砚,等. 转谷氨酰胺酶改性花生分离蛋白工艺的研究[J].中国粮油学报,2012, 27(4): 44-48.
[15] NONAKA M, TANAKA H, OKIVAMA A, et al. Polymerization of several proteins by Ca2+independent transglutaminase derived from microorganisms [J].Agricultural and Biological Chemistry, 1989, 53 (10): 2 619-2 623.
[16] KAJIRAT R, SUNANTA T, JIRAWAT Y. Effect of soy protein isolate on chemical and physical characteristics of meat analog[J]. Asian Journalof Food and Agro-Industry, 2008, 1(2): 99-106.
[17] LIU K. S, HSIEH F. Protein-protein interactions during high-moisture extrusion for fibrous meat analogues and comparison of protein solubility methods using different solvent systems[J]. Journal of Agricultural and Food Chemistry, 2008, 56 (8): 2 681-2 687.
[18] LIU Ru, ZHAO Si-ming, XIONG Shan-bai, et al. Role of secondary structures in the gelation of porcine myosin at different pH values[J]. Meat Science, 2008, 80(3):632-639.
Enzyme modification to improve product characteristics of textured vegetable protein
LI Zhan-fang1,2, ZHU Ge-bin1,2*,ZONG Hong1,2, Lu Xin-yao1,2, FANG Hui-ying1,2, XU Qiao1,2ZHANG Jing3, ZHANG Run-jie3
1(The Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education,School of Biotechnology, Jiangnan University, Wuxi 214122, China)2(The Key Laboratory of Industrial Biotechnology, Ministry of Education, Jiangnan University,School of Biotechnology, Research Centre of Industrial Microbiology, Wuxi 214122, China)3(Jiangsu Quanying Biotechnology Co. ,Ltd. , Suqian 223800, China)
With defatted soybean meal, soybean protein isolate, wheat gluten and wheat starch as raw materials, the effects of enzyme modification on the textured vegetable proteins’ product characteristics and the chemical crosslinking and secondary structure in the organization process of vegetable protein were explored. The results showed that the product characteristics of textured vegetable protein enzymolysised by bromelain were better than those treated by TG enzyme. When the consumption of bromelain was 12.0 U/g, the elasticity and chewiness of textured vegetable protein were increased by 48% and 71% respectively. After treated by bromelain, the interactions among disulfide bond, hydrogen bond and hydrophobic bond of textured vegetable protein were enhanced. Meanwhile, the β-fold and β-turn of secondary structure were turned to random curl, whose content was increased by 43%. The results showed that the interactions among disulfide bond, hydrogen bond and hydrophobic bond and random curl of secondary structure were helpful for the improvement of textured vegetable protein’s elasticity and chewiness, wherein the content of random curl played a crucial role.
enzyme modification; textured vegetable protein; chemical bond; secondary structure
硕士研究生(诸葛斌教授为通讯作者,E-mail: bzhuge@163.com.cn)。
2017-01-13, 改回日期:2017-02-24
10.13995/j.cnki.11-1802/ts.201706011
