全反式β-胡萝卜素太赫兹光谱的实验及理论研究∗
2017-07-31闫微马淼戴泽林谷雨朱宏钊刘禹彤许向东韩守胜彭勇
闫微 马淼 戴泽林 谷雨 朱宏钊 刘禹彤 许向东韩守胜 彭勇
(电子科技大学光电信息学院,成都 610054)(2016年6月22日收到;2016年10月24日收到修改稿)
全反式β-胡萝卜素太赫兹光谱的实验及理论研究∗
闫微 马淼 戴泽林 谷雨 朱宏钊 刘禹彤 许向东†韩守胜 彭勇
(电子科技大学光电信息学院,成都 610054)(2016年6月22日收到;2016年10月24日收到修改稿)
采用傅里叶变换红外光谱技术和太赫兹时域光谱技术,在室温下对全反式β-胡萝卜素薄膜进行了光谱测试.据此,详细地指认出全反式β-胡萝卜素在太赫兹波段的指纹谱峰,并验证了近期报道的棕树叶的太赫兹光谱结果.运用密度泛函理论的B3LYP方法计算了全反式β-胡萝卜素的太赫兹光谱,理论计算结果与实验测量结果基本符合.此外,根据理论计算结果,对实测的太赫兹特征峰的振动模式进行了系统归属.本文研究结果有助于推动有机物的太赫兹光谱规律和太赫兹响应原理等理论与应用研究.
全反式β-胡萝卜素,太赫兹光谱,密度泛函理论,振动模式
1 引 言
太赫兹波是指频率在0.1—10 THz、波长在3000—30µm范围内的电磁波[1].由于长期缺少稳定的光源和探测技术,太赫兹波的研究进展十分缓慢.近年来,超快激光的出现为太赫兹研究提供了新型、稳定的高功率激发光源,极大地促进了太赫兹技术的发展.利用太赫兹光谱研究材料的结构及其在太赫兹波段的光学特性是太赫兹领域一个新的研究热点.太赫兹光谱包含非常丰富的物理和化学信息,理论及实验研究表明,许多有机分子的色散特性及吸收谱线都处于太赫兹波段[2],因此利用太赫兹光谱技术可以获得有机物分子在太赫兹波段的光学性能,进而研究它们的结构和特性.2000年,Markelz等[3]利用太赫兹时域光谱(terahertz time-domain spectroscopy,THz-TDS)技术研究了DNA、牛血清蛋白和胶原质在太赫兹波段的性质,结果表明这三种物质在太赫兹波段有特定的响应.近几年,有关核苷酸[4]、氨基酸[5]、纤维素[6]等有机分子太赫兹光谱特性的研究也引起了学术界的关注.
β-胡萝卜素是自然界中最普遍、最稳定的一类天然色素,它们广泛地存在于动植物和微生物体中.β-胡萝卜素有许多同分异构体,常见的约有20余种.β-胡萝卜素是含有9个π电子共轭双键的短链多烯类分子[7].由于其特殊的分子结构,此类有机物不仅在光采集、光防护、防癌及抗癌等生物医学方面应用广泛[8−10],而且在光电器件、功能材料等其他方面也有重要的应用[11].近年,β-胡萝卜素在太赫兹波的产生和探测方面的新应用逐渐引起了人们的关注.其中,Zuo等[12]、张磊巍等[13]的研究显示,全反式β-胡萝卜素在太赫兹波段有特定的响应吸收.最近,我们的研究表明,棕树叶中类胡萝卜素等成分具有特殊的太赫兹指纹谱峰[14].遗憾的是,前人[12,13]没有对β-胡萝卜素的太赫兹特征峰进行有效的归属与验证,相关的太赫兹响应原理也未见报道.而且,在我们近期通过直接测量固态棕树叶及其溶剂提取液的数据中[14],所获得的类胡萝卜素的太赫兹指纹谱峰可能存在叶绿素等其他成分的干扰,需要对相关的太赫兹特性进一步甄别与验证.
为此,本文利用傅里叶变换红外光谱(Fourier transforminfrared spectroscopy,FTIR)及THz-TDS两种当今最主要的太赫兹光谱测量技术,系统地研究了全反式β-胡萝卜素试剂的太赫兹光谱特性,据此梳理此类有机分子的太赫兹响应规律.特别地,本文还利用密度泛函理论对全反式β-胡萝卜素进行了光谱理论研究,并根据仿真结果对实测的太赫兹特征峰进行系统归属.研究结果不仅为进一步研究有机分子在太赫兹波段的光谱特征和响应原理提供了很好的借鉴,也为有机物太赫兹光谱的理论研究奠定了基础.
2 实 验
2.1 样品制备
本实验使用的全反式β-胡萝卜素(all-transβcarotene,以下简称β-胡萝卜素,化学结构如图1所示)购自百灵威科技有限公司,纯度为97%;三氯甲烷购自成都市联合化工试剂研究所,纯度为99%;溴化钾购自百灵威科技有限公司,纯度为99.9%.
FTIR的测试样品是采用喷涂法制备的薄膜.首先,称取30mgβ-胡萝卜素晶体溶解在30mL三氯甲烷溶液中,制成浓度为1 mg/mL的溶液,溶液为橘红色.由于β-胡萝卜素在光照下不稳定,三氯甲烷也易挥发,所以实验过程中需用保鲜膜将烧杯口密封,并用锡箔纸包住小烧杯以避光保存.喷涂法制膜使用的衬底为预处理过的洁净硅片(100).喷涂条件包括:喷枪支架的高度设为12 cm;喷涂气体采用高纯氮气,压强为1.5 kPa;喷涂后的薄膜在50◦C下退火30 min.在以上条件下喷涂108 s,制得β-胡萝卜素薄膜.
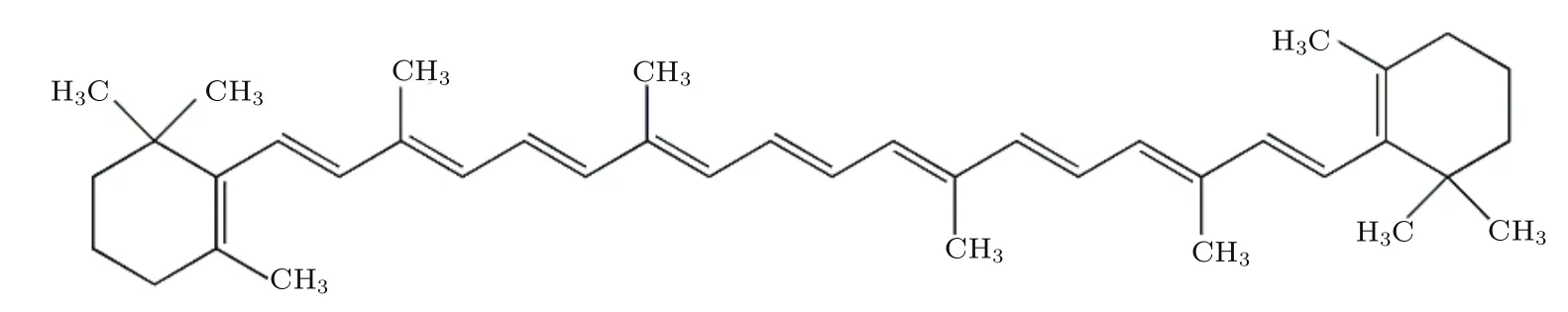
图1 全反式β-胡萝卜素的化学结构图Fig.1.Chemical structure of all-transβ-carotene.
THz-TDS测试的样品通过传统的溴化钾(KBr)压片法进行制备.将β-胡萝卜素样品以质量比1:100与KBr均匀混合,在玛瑙研钵中仔细研磨后放入模具,用20 MPa的压强压成厚度约为1 mm、直径约为13 mm的圆盘形样品.样品的结构均匀,前后两平面保持平行,以减少测量时的多重反射效应.
2.2 太赫兹光谱测量
实验采用美国PerkinElmer公司的Spectrum400型FTIR光谱仪,测量β-胡萝卜素在30—400 cm−1范围的太赫兹光谱.FTIR系统的结构原理如图2(a)所示.其中,红外光源发出的红外光经过干涉仪形成干涉光到达衰减全反射(attenuated total reflection,ATR)系统,红外光在ATR系统中通过晶体进入样品材料并发生衰减全反射,最后携带样品信息的红外光被远红外检测器检测.测试参数包括:扫描次数256次,分辨率为1 cm−1.测试前,先将空白硅片放置在夹具上进行背景扫描以扣除硅片背景.
此外,还采用THz-TDS(型号为TPS Spectra 3000,测量范围为 0.06—3.0 THz,信噪比优于4000:1),以空气为参考,测量压片样品在0.5—3.0 THz范围的太赫兹透射光谱.THz-TDS系统透射测试光路如图2(b)所示.钛蓝宝石(Ti:sapphire)飞秒激光器输出波长为800 nm、重复频率为80 MHz、脉冲宽度小于100 fs、平均功率约为300 mW的激光.激光发出后,经分束镜分为抽运光和探测光.其中,抽运光聚焦到偏置的太赫兹发射天线上,通过光电导原理激发出太赫兹脉冲.然后,太赫兹脉冲被聚焦到待测样品上,经样品透射后与探测光汇合共线通过太赫兹探测器进行相干检测.探测器是基于低温生长的GaAs偶极子天线.检测信号通过快速傅里叶变换得到测试样品在太赫兹波段的响应光谱.在本文的光谱测量中,THz-TDS的光谱分辨率为0.006 THz,测量环境为干燥的空气环境,相对湿度小于1%.
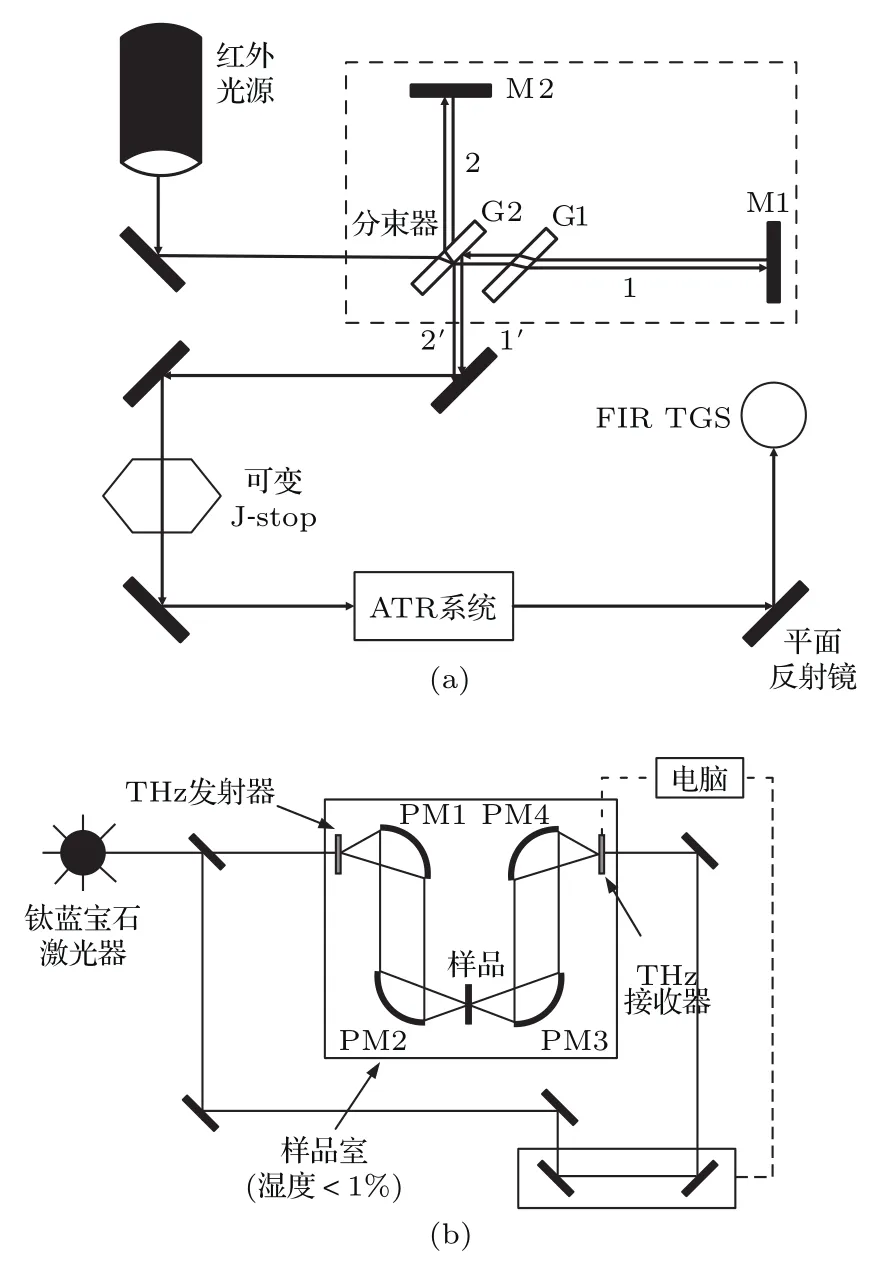
图2 实验装置图 (a)FTIR-ATR;(b)THz-TDS的测量装置示意图Fig.2.Experimental setups of(a)FTIR-ATR and(b)THz-TDS.

图3 β-胡萝卜素薄膜的FTIR光谱Fig.3.FTIR spectra ofβ-carotene fi lm.
3 结果与讨论
图3是使用FTIR光谱仪测得的β-胡萝卜素薄膜在30—400 cm−1(0.9—12 THz)波段的太赫兹光谱.从图3可以看出,在30—400 cm−1波段,β-胡萝卜素的主要吸收峰包括35,53,63,77,89,95,115,124,134,170,247,279 cm−1等. 由于FTIR光源的低波数能量低,容易受到空气中CO2和H2O的影响,产生反常吸收[15].相比而言,THz-TDS采用同步相干探测技术,对热背景噪声不敏感,可以获得很高的信噪比[16].就信噪比而言,THz-TDS在低于3 THz时远高于FTIR,而FTIR则在5 THz以上时更好[17,18].THz-TDS与FTIR相互补充,是研究分子结构和分子振动光谱的重要工具.
为此,本文使用THz-TDS技术进一步测试了β-胡萝卜素在0.5—3.0 THz(17—100 cm−1)波段的太赫兹光谱.本文首先测量压片所用KBr的THz-TDS,结果如图4(a)所示.该图显示,KBr在0.5—2.0 THz频段的吸收很弱,但在2.0—3.0 THz频段的吸收逐渐增强.在此基础上,我们利用THz-TDS继续对压嵌在KBr中的β-胡萝卜素的太赫兹光谱进行测量,结果如图4(b)所示.由于KBr压片在0.5—2.0 THz范围几乎没有吸收峰(图4(a)),所以图4(b)在此范围的吸收峰都源于β-胡萝卜素.另一方面,在2.5—3.0 THz范围,KBr虽然有少量吸收峰(图4(a)),但其光谱透射率均大于93%,吸收峰的强度较弱,而且它们的峰形也明显地与图4(b)的不同.这说明,图4(b)所示在0.5—3.0 THz探测到的主要是β-胡萝卜素的太赫兹吸收峰,KBr没有对前者的太赫兹光谱造成明显影响.图4(b)表明,β-胡萝卜素在1.62 THz(54 cm−1),1.71 THz(57 cm−1),1.83 THz(61 cm−1),1.91 THz(64 cm−1),2.06 THz(69 cm−1),2.21 THz(74 cm−1),2.32 THz(77 cm−1),2.44 THz(81 cm−1),2.54 THz(85 cm−1),2.61 THz(87 cm−1),2.69 THz(90 cm−1),2.76 THz(92 cm−1),2.85 THz(95 cm−1),2.91 THz(97 cm−1),2.95 THz(98 cm−1)处有明显的吸收峰.我们还注意到,图4(b)中的54,64,77,90,95 cm−1等特征峰与FTIR光谱仪测得在50—100 cm−1波段的结果(图3)相符合.图3与图4(b)的比较还说明,采用THz-TDS技术,能够检测到β-胡萝卜素在太赫兹低频段更丰富的特征峰,进一步说明THz-TDS技术在太赫兹低频范围(<3 THz)具有更高的灵敏度.与之相比,FTIR则在太赫兹的高频范围(>3 THz),谱峰稳定、灵敏.遗憾的是,FTIR的35 cm−1峰(图3)没有被THz-TDS检测到(图4(b)),估计该峰可能是FTIR的低频极限测量噪声.我们前期通过FTIR差谱方法获得的结果表明[14],棕树叶中类胡萝卜素的太赫兹指纹谱峰包括37,58,65,75,92,100,121,126 cm−1.类似地,其中的37 cm−1也可能是FTIR的低频极限测量噪声.当然,相关结论有待于将来的进一步确认.令人欣喜的是,这些棕树叶中类胡萝卜素的太赫兹特征峰与本文对β-胡萝卜素试剂的测量结果基本符合,进一步证明我们近期研究植物太赫兹光谱的方法[14]是正确的.需要提醒的是,由于本文测量的是纯度高达97%的全反式β-胡萝卜素试剂的太赫兹光谱,避免了前期研究[14]中棕树叶中共存的高含量叶绿素以及提取液中混合溶剂等的干扰,从而能够进一步甄别与验证类胡萝卜素的太赫兹特征峰.我们还注意到,首都师范大学张存林课题组[12,13]也曾采用THz-TDS和FTIR技术测量了β胡萝卜素分子,其结果表明,该化合物在1.07 THz(36 cm−1),1.91 THz(64 cm−1),2.82 THz(94 cm−1)等处存在太赫兹吸收峰[12],与本文获得的相应的太赫兹指纹谱峰相符合.据此,并结合本文图3的FTIR和图4(b)的THz-TDS实测结果,可以确定β-胡萝卜素在太赫兹波段的特征峰依次为1.62 THz(54 cm−1),1.71 THz(57 cm−1),1.91 THz(64 cm−1),2.32 THz(77 cm−1),2.69 THz(90 cm−1),2.95 THz(98 cm−1),3.45 THz(115 cm−1),3.72 THz(124 cm−1),4.02 THz(134 cm−1),5.11 THz(170 cm−1),7.42 THz(247 cm−1),8.38 THz(279 cm−1)等.
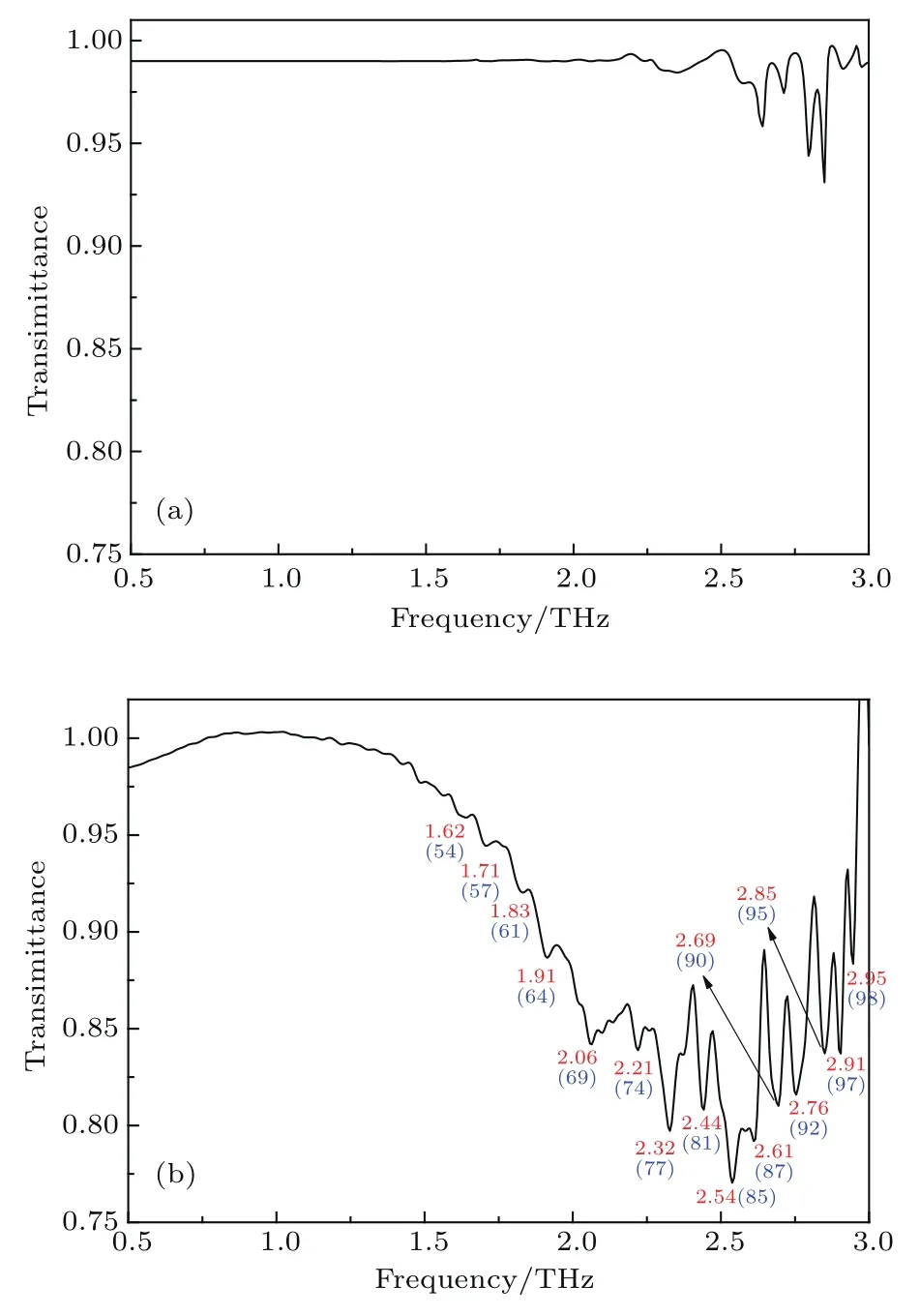
图4 THz-TDS(a)KBr薄膜;(b)β-胡萝卜素薄膜Fig.4.THz-TDS of(a)KBr fi lmand(b)β-carotene fi lm.
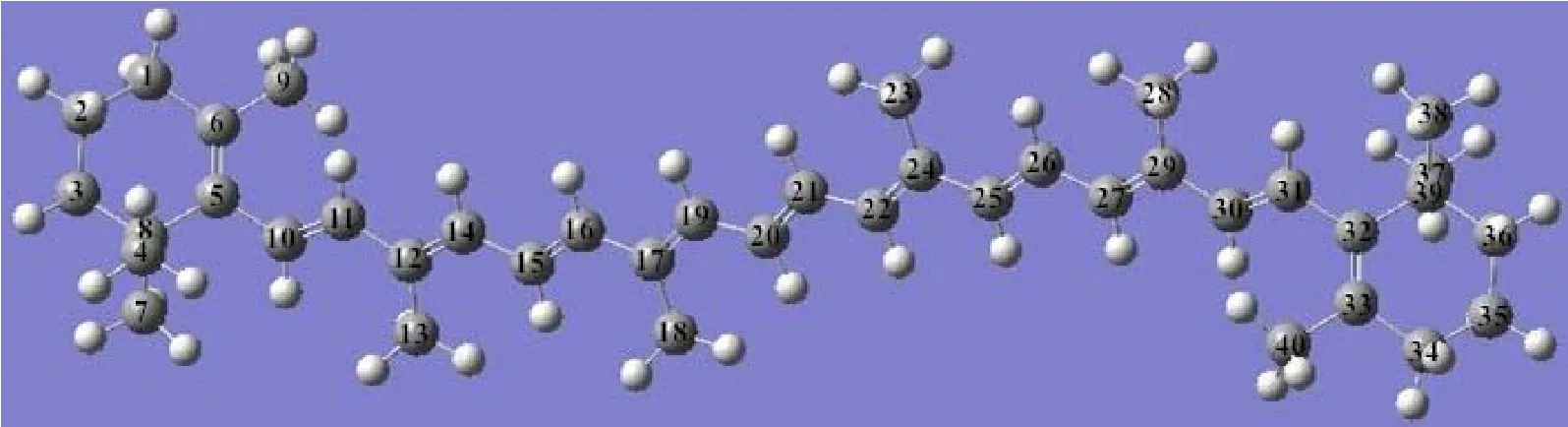
图5 (网刊彩色)β-胡萝卜素分子的几何优化结构Fig.5.(color online)Optimized geometry structure ofβ-carotenemolecule.
为了更好地理解β-胡萝卜素在太赫兹波段的响应原理,并对其太赫兹特征峰进行有效归属,本文使用Gaussian09软件,采用密度泛函理论在B3LYP/6-311G(d,p)基组下对孤立β-胡萝卜素分子的光谱进行了仿真计算.我们首先对胡萝卜素单分子结构进行优化和频率计算.图5是β-胡萝卜素分子经过结构优化后的模型及C原子编号.频率计算无虚频产生,说明优化得到的几何结构为稳定结构.
由于THz-TDS在频率高于3 THz时,测量结果不稳定、噪声大.与之相比,FTIR具有更广的测量范围(1—20 THz).所以,为了在更广的光谱范围里进行评估,我们把理论计算结果与FTIR实测结果进行比较.图6是β-胡萝卜素在30—160 cm−1范围的仿真太赫兹光谱与FTIR实测光谱的对照.其中,本文对理论计算得到的光谱进行了简化处理,只将其主要吸收峰的位置及强度标在图上.图6显示,在30—160 cm−1范围内计算得到5个主要的吸收峰,分别位于52,76,115,132,148 cm−1.其中,52,76,115,132 cm−1分别对应FTIR实测的53,77,115,134 cm−1谱峰,最大误差仅为2个波数,这说明理论计算得出的太赫兹特征峰与实验测得的结果符合程度高(图6),同时表明本文利用β-胡萝卜素分子结构进行理论计算是可行的.我们注意到,仿真的148 cm−1强吸收峰在实测光谱中不明显,造成这种差异的原因可能与温度效应有关.前人的研究表明[19],分子体系内的化学键尤其是氢键强度容易受温度的影响,从而导致其振动频率发生改变.类似地,Shen等[20]在讨论低温下生物分子的太赫兹光谱时也认为,随着温度的降低,太赫兹吸收峰的强度将增强.由于本文理论计算出的振动频率对应温度为0 K时的值,而实际的光谱则是在室温(298 K)下测量,由此导致计算结果与实测结果在148 cm−1处的差异.除此之外,我们还注意到一个明显的现象,即实验测量的63,89,95和124 cm−1等吸收峰在仿真结果中没有出现(图6).这是由于实验测量的样品是多分子体系,体系中除了单分子的原子振动之外,还存在β-胡萝卜素分子之间的相互作用.后者的分子间作用也将引起太赫兹波的特征吸收[21].与之不同,本文的仿真计算采用单分子模型,不存在β-胡萝卜素分子之间的相互作用.因为β-胡萝卜素分子的分子量大,受限于计算条件,我们目前还无法实现多分子计算.而且,现有的能量收敛精度还不足以很好地描述较弱吸收峰所对应的振动模式,这也可能是造成理论计算值与实验值不完全一致的原因之一.据此,我们推测,实测的63,89,95和124 cm−1等吸收峰可能与β-胡萝卜素的分子间相互作用有关,该结果有待于进一步验证.
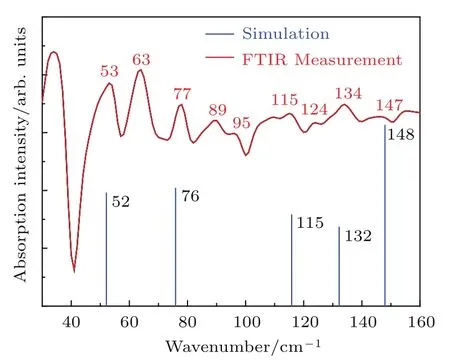
图6 (网刊彩色)β胡萝卜素太赫兹光谱的理论计算结果与FTIR实测结果的比较Fig.6.(color on line)Comparison between the experimental and calcu lated THz spectra ofβ-carotene.
分子在太赫兹波段的振动主要是分子中多个原子参与的变形振动、扭绞振动和弯曲振动[22].由于不同峰位的振动模式不同,结合Gaussview5.08的视频动态功能,能够对β-胡萝卜素在30—160 cm−1波段特征峰的振动模式进行系统的归属.图7为理论计算的148 cm−1吸收峰的β胡萝卜素分子的振动模式.
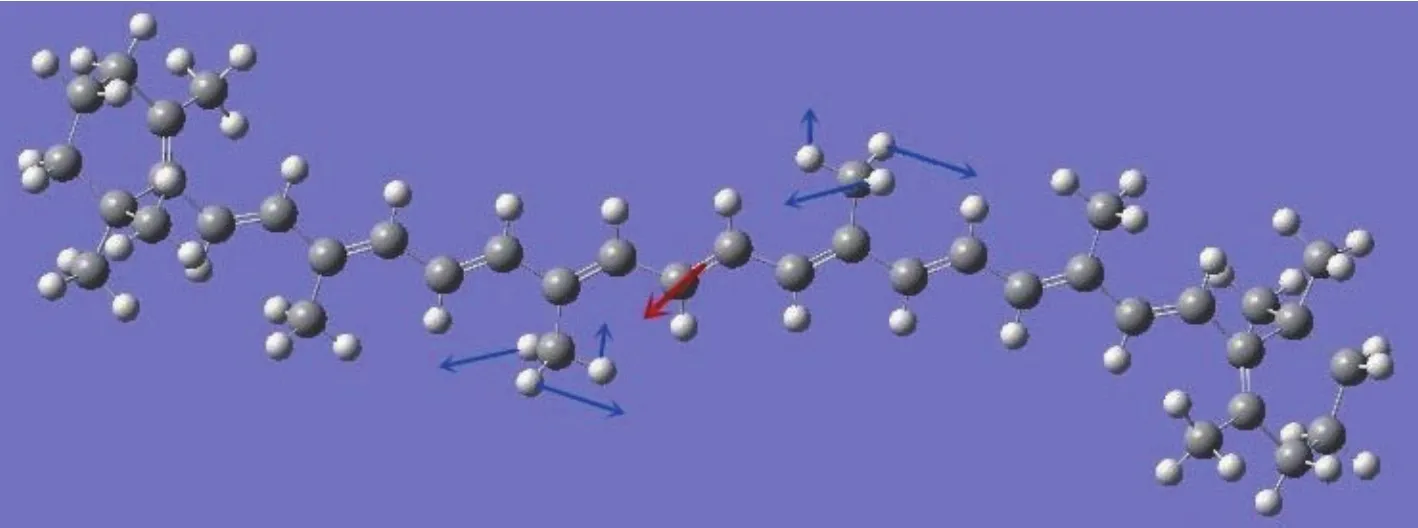
图7 (网刊彩色)β-胡萝卜素在148 cm−1位置吸收峰的振动模式Fig.7.(color on line)V ibration modes ofβ-carotene at 148 cm−1.
根据图7,148 cm−1吸收峰可归属为靠近β-胡萝卜素分子中心的两个—CH3的面内摇摆振动.图中蓝色箭头代表各原子的振动方向,红色箭头代表整个分子的振动方向,箭头的长度代表原子振动幅度的大小.类似地,132 cm−1处的吸收峰归属为β-胡萝卜素分子两端的β-紫萝酮环上—CH2的面内摇摆振动以及—CH3的扭绞振动.相比而言,115,76和52 cm−1处的振动模式较为复杂,涉及多个官能团的振动模式.其中,115 cm−1峰以中心碳链(不包括两端β-紫萝酮环)上原子的振动为主,包含—CH3的面内摇摆振动以及—CH的弯曲振动,但是不涉及分子的整体振动.另外,76 cm−1峰主要是中心碳链上—CH3的扭绞振动和—CH的弯曲振动.52 cm−1峰主要是两端β-紫萝酮环上—CH3的扭绞振动和—CH2的面内摇摆振动,分子整体也没有振动.具体的理论计算结果、实验测量结果以及相对应的振动模式归属均列于表1.由于全反式β-胡萝卜素分子呈中心对称的结构(图5),其两边的振动模式相同,所以表1只需列出其中一部分原子的振动模式.这些结果表明,通过理论仿真与实测光谱相对比的方法,能够有效地归属复杂的有机物太赫兹指纹谱峰.所以,本文的理论计算结果进一步验证和丰富了我们前期的植物太赫兹光谱的研究成果[14],重要的是,还揭示了对有机大分子复杂的太赫兹响应原理进行研究的一种新的有效途径.
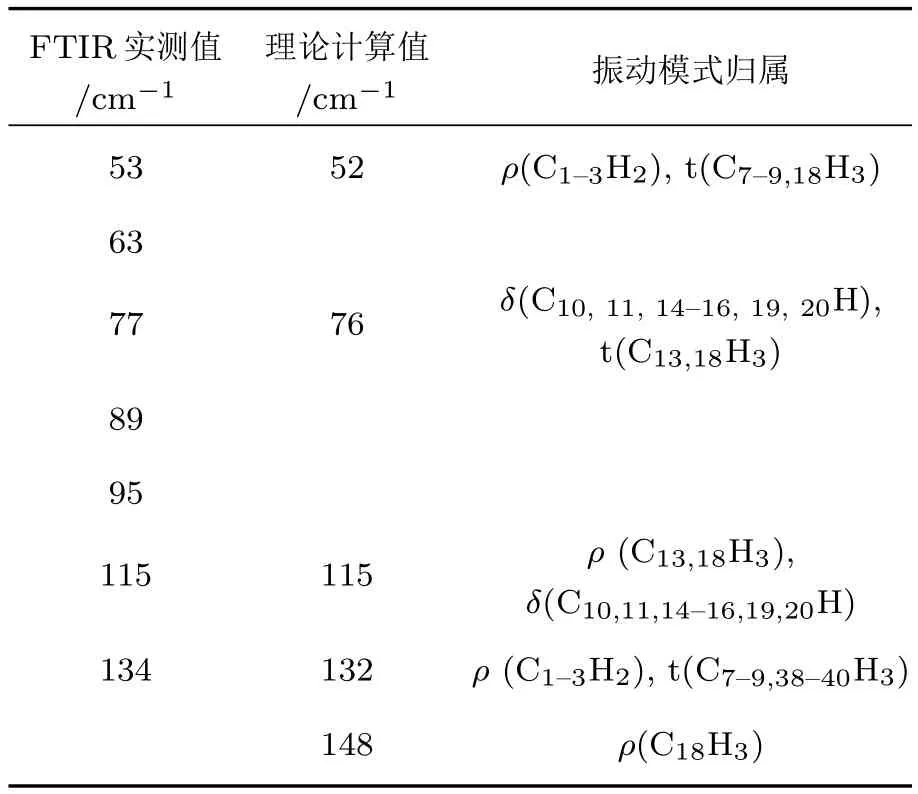
表1 β-胡萝卜素的太赫兹特征峰的振动模式归属Tab le 1. Assignment of absorption peaks forβcarotene.
4 结 论
本文利用FTIR技术测量了全反式β-胡萝卜素在30—400 cm−1波段的太赫兹透射光谱,同时利用THz-TDS技术测量了全反式β-胡萝卜素在0.5—3.0 THz波段的太赫兹透射光谱,两种技术在重叠波段得到的太赫兹特征峰基本符合.据此,我们指认出全反式β-胡萝卜素的太赫兹指纹谱峰为1.62 THz(54 cm−1),1.71 THz(57 cm−1),1.91 THz(64 cm−1),2.32 THz(77 cm−1),2.69 THz(90 cm−1),2.95 THz(98 cm−1),3.45 THz(115 cm−1),3.72 THz(124 cm−1),4.02 THz(134 cm−1),5.11 THz(170 cm−1),7.42 THz(247 cm−1),8.38 THz(279 cm−1)等.另一方面,本文还利用密度泛函理论对β-胡萝卜素分子进行了仿真,计算出β-胡萝卜素的太赫兹特征峰,验证了实测的太赫兹指纹谱峰.重要的是,还对β-胡萝卜素在148,132,115,76和52 cm−1等处的太赫兹特征峰的振动模式进行了归属,较好地解释了该有机物太赫兹光谱的形成机理.本文的研究结果,不仅验证并丰富了相关的近期成果[14],而且还揭示了通过多种测量与理论仿真相结合的方式,探索有机分子结构与太赫兹光谱联系的一种新的研究方法.这对探究有机物的太赫兹光谱特性和响应原理,以及探索有机物的太赫兹指纹甄别及器件应用等都具有重要的参考价值.
[1]Ferguson B,Zhang X C 2002Nat.Mater.1 26
[2]Shen Y C,Upadhya P C,Lin field E H,Davies AG 2004Vib.Spectrosc.35 111
[3]Markelz AG,Roitberg A,Heilweil E J 2000Chem.Phys.Lett.320 42
[4]G lobus TR,W oolard D L,Khromova T,Crowe TW,Bykhovskaia M,Gelmont BL,Hesler J,Samuels AC 2003J.Biol.Phys.29 89
[5]Taday P F,Brad ley IV,Arnone D D 2003J.Biol.Phys.29 109
[6]GuoH,He M,Huang R,QiW,GuoW H,Su R X,He Z M2014RSC Adv.4 57945
[7]Sch lücker S,Szeghalmi A,Schmitt M,PoppJ,Kiefer W 2003J.Raman Spectrosc.34 413
[8]Ziegler R G 1991Am.J.C lin.Nutr.53 251S
[9]Sugisaki M,Fu jiwara M,Nair S V,Ruda HE,Cogdell R J,HashimotoH2009Phys.Rev.B80 035118
[10]Ostroumov E E,Mu ller MG,Reus M,Holzwarth AR 2011J.Phys.Chem.A115 3698
[11]Yanagi K,Miyata Y,Kataura H2006Adv.Mater.18 437
[12]ZuoJ,Zhang L L,Yu F,Zhang Z W,Zhang C L 2010Proc.SPIEBeijing,China,October 18–22,2010 p785439
[13]Zhang L W,ZuoJ,Zhang C L 2014Spectrosc.Spect.Anal.34 405(in Chinese)[张磊巍,左剑,张存林2014光谱学与光谱分析34 405]
[14]Liu Y K,Liu Y T,Xu X D,Yan W,Ma M,Zhu HZ,Ma C Q,Zou R J,D in L,LuoMJ 2015Acta Phys.Sin.64 068701(in Chinese)[刘一客,刘禹彤,许向东,闫微,马淼,朱宏钊,马春前,邹瑞娇,丁廉,罗梦佳2015物理学报64 068701]
[15]Hu Y Q,Chen Y J,Li HH,W ang HS 2012Spectrosc.Spect.Anal.32 339(in Chinese)[胡燕琴,陈玉静,李慧华,王海水2012光谱学与光谱分析32 339]
[16]Naftaly M,Miles R E 2007P.IEEE95 1658
[17]Zhang TJ,Cai J H,Zhou Z K2008Spectrosc.Spect.Anal.28 721(in Chinese)[张同军,蔡晋辉,周泽魁 2008光谱学与光谱分析28 721]
[18]Mickan S P,Lee KS,Lu TM,Munch J,Abbott D,Zhang X C 2002Microelectron.J.12 1033
[19]Li Y B,Zheng Y Y,W ang W N 2007J.Capital Norma l Univ.:Nat.Sci.Ed.28 39(in Chinese)[李元波,郑盈盈,王卫宁2007首都师范大学学报:自然科学版28 39]
[20]Shen Y C,Upadhya P C,Lin field E H,Davies AG 2003Appl.Phys.Lett.82 2350
[21]Ma J L,Xu KJ,Li Z,Jin BB,Fu R,Zhang C H,Ji Z M,Zhang C,Chen Z X,Chen J,Wu P H2009Acta Phys.Sin.58 6101(in Chinese)[马金龙,徐开俊,李哲,金飚兵,傅荣,张彩虹,吉争鸣,张仓,陈兆旭,陈健,吴培亨2009物理学报58 6101]
[22]Yu B,Zeng F,Yang Y,X ing Q,Chechin A,X in X,Zeylikovich I,AlfanoR R 2004Biophys.J.86 164
PACS:78.30.Jw,87.50.U–,31.15.E–,33.20.TpDOI:10.7498/aps.66.037801
Experimental and theoretical study on terahertz spectra of all-trans β-carotene∗
Yan Wei Ma MiaoDai Ze-Lin Gu Yu Zhu Hong-ZhaoLiu Yu-Tong Xu Xiang-Dong†Han Shou-Sheng Peng Yong
(School of Optoelectronic Information,University of E lectronic Science and Technology of China,Chengdu 610054,China)(Received 22 June 2016;revised manuscript received 24 October 2016)
Theβ-carotene is a short chain polyenemolecule containing nineπ-electron con jugated doub le-bonds.Because of its specialmolecular structure,β-carotenehasbeen used widely inmany fields,including functionalmaterials,optoelectronic devices and biological applications of light collection,light protection,anti-cancer,etc.Recently,newapplications of β-carotene in generation and detection of terahertz(THz)wave have alsoattracted great attention.In this work,alltrans β-carotene fi lms are prepared by spray coating,and the THz spectra in a wavenumber range of 30–400 cm−1(a frequency range of 0.9–12 THz)of the as-prepared products are experimentally measured at roomtemperature by Fourier transformin frared spectroscopy.For comparison,the THz spectra in 0.5–3.0 THz are alsocharacterized at the same temperature by THz time-domain spectroscopy.Based on thesemeasurements,the fingerprint peaks of all-trans β-carotene in the THz region are experimentally identified tobe located at 54 cm−1(1.62 THz),57 cm−1(1.71 THz),64 cm−1(1.91 THz),77 cm−1(2.32 THz),90 cm−1(2.69 THz),98 cm−1(2.95 THz),115 cm−1(3.45 THz),124 cm−1(3.72 THz),134 cm−1(4.02 THz),170 cm−1(5.11 THz),247 cm−1(7.42 THz),and 279 cm−1(8.38 THz),respectively.It isworth noting that the recent resu lts about the THz spectra of palmleaves are thus verified.Particularly,the B3 LYP method of density functional theory is further utilized in thiswork totheoretically simu late the THz spectra of all-trans β-carotenemolecu le.It is revealed that the theoretical simulation resu lts accord wellwith those experimentally measured data.In addition,we alsofind that the absorption peaks are caused by the torsion,deformation and rocking vibration of themolecules.Accordingly,the vibrationalmodes of themeasured THz characteristic peaks at 148 cm−1(4.44 THz),132 cm−1(3.96 THz),115 cm−1(3.45 THz),76 cm−1(2.28 THz)and 52 cm−1(1.56 THz)are theoretically assigned,which provides a reference toexplain the formation mechanismof the THz spectra.The valuable resu lts presented in thiswork will be helpful for promoting the studies of the THz spectral features and responsemechanisms of the organics.
all-transβ-carotene,terahertz spectra,density functional theory,vibrationalmodes
10.7498/aps.66.037801
∗国家自然科学基金(批准号:61071032,61377063)资助的课题.
†通信作者.E-mail:xdxu@uestc.edu.cn
*Project supported by the National Natural Science Foundation of China(G rant Nos.61071032,61377063).
†Corresponding author.E-mail:xdxu@uestc.edu.cn
