多配体蛋白聚糖-1联合E-钙黏素在宫颈癌中的表达及其意义
2017-07-31林宁
林宁
·临床经验·
多配体蛋白聚糖-1联合E-钙黏素在宫颈癌中的表达及其意义
林宁
目的:探讨宫颈癌组织中Syndecan-l与E-cadherin的表达及其临床意义。方法:采取免疫组织化学法(HE染色法)观察Syndecan-l与E-cadherin在正常宫颈组织(对照组)、宫颈癌组织(观察组)中的表达,结合临床资料分析2种蛋白的表达与患者年龄、组织类型、肿瘤大小、临床分期、病理分级、淋巴转移有无相关性。结果:Syndecan-1在宫颈癌组织中阳性表达率25.6%,正常宫颈组织中为75.0%, 差异有统计学意义(P<0.05)。E-cadherin在宫颈癌及正常宫颈组织中阳性表达率为32.1%,90.0%,差异有统计学意义(P<0.05)。2种蛋白均与临床分期、病理分级有相关性(P<0.05);2种蛋白在宫颈癌组织中均低表达,2者呈正相关性(R=0.058)。Syndecan-1还与淋巴转移有相关性(P<0.05),2种蛋白均与患者年龄、组织类型、肿瘤大小无相关性(P>0.05)。结论:Syndecan-l与E-cadherin的低表达可能参与宫颈癌的发生发展并发挥重要作用。
宫颈肿瘤; 多配体蛋白聚糖-1; E-钙黏素; 免疫组织化学
女性恶性肿瘤中最常见的是宫颈癌,且具有越来越年轻化趋势,该肿瘤却是可以早发现早干预可治愈的,其预后与淋巴转移、病理分级、临床分期密切相关,肿瘤的发生、发展是多基因多步骤的,其浸润转移的步骤包括细胞黏附、基质降解和细胞运动,因而探讨发现与其相关的肿瘤标志物可提高预后的判断率。Syndecan-1,E-cadherin均表达于正常细胞膜表面,均属于细胞间黏附蛋白,已有恶性肿瘤研究[1]表明两者有协同作用,有保持正常上皮形态结构完整,保持细胞分化发育增值迁移能力,介导正常细胞间接触抑制,进而抑制肿瘤恶性细胞接触依赖性生长的功能。本文用HE染色法分别检测正常组织与宫颈癌组织中2种蛋白的表达,探讨分析2种蛋白和宫颈癌的发生、发展有无相关性,有望为临床诊断、疾病预后提供一个新的指标。
1 资料和方法
1.1 资料 收集2013年3月-2016年2月马鞍山市中心医院病理科经妇科手术(宫颈活检+宫颈癌根治性手术)确定为宫颈癌78例(宫颈鳞癌68例及腺癌10例)为观察组,年龄25~64岁,术前经2位主任医师或副主任医师确定临床分期、肿块大小、术后病理确定分级及有无淋巴结转移。对照组选取因子宫肌瘤行全子宫切除的宫颈组织,术前白带常规及TCT均无异常,术后病理提示为正常宫颈组织20例,年龄35~59岁。
1.2 方法 Syndecan-1和E-cadherin检测采取免疫组化SP法,按试剂盒说明进行操作,一抗工作浓度均为1:100,以已知阳性片分别做Syndecan-1和E-cadherin阳性对照,以磷酸盐缓冲液(PBS)代替一抗作为阴性对照。兔抗人Syndecan-1多克隆抗(anbobio公司),鼠抗人E-cadherin单克隆抗体(Lab Vision公司),S-P免疫组化试剂盒(K27-9901)(福州迈新Elivision plus公司)。Elivision plus法染色进行组织中Syndecan-1和E-cadherin染色:石蜡切片脱水、高压修复抗体活性、冷却后加滴加过氧化物酶阻断试剂,在室温下孵育10 min。PBS冲洗3次×3 min、滴加兔抗人Syndecan-1单克隆抗体,鼠抗人E-cadherin单克隆抗体,室温下孵育60 min。PBS冲洗3次×3 min、滴加聚合物增强剂(试剂A),室温下孵育20 min。PBS冲洗3次×3 min。去除PBS,滴加酶标抗兔聚合物(试剂B),室温下孵育30 min。PBS冲洗3次×3 min、滴加新鲜配制的DAB显色剂(二氨基联本)酶底物显色试剂盒,购自博皂森生物生物工程技术有限公司)显色,显微镜下观察5 min,阳性染色为棕黄色。
1.3 结果判断 Syndecan-1主要位于正常复层鳞状上皮及肿瘤细胞的胞膜上,E-cadherin正常染色部位位于细胞相邻的侧面即细胞与细胞的连接处。显微镜下观察细胞膜表面出现棕黄色的颗粒为阳性表达,以阳性颗粒占每个高倍镜观察视野的50%为界,<50%高倍镜视野为阴性组,>50%高倍镜视野为阳性组。
1.4 统计分析方法 实验所得的数据制成Excel表格,采用SPSS17.0统计软件包,使用Fisher’s确切概率法或者χ2检验进行计数资料的分析,2种蛋白之间的相关性分析使用Spearman秩和方法,P<0.05为差异有统计学意义。
2 结果
2.1 Syndecan-1镜下观察主要表达上皮细胞膜上 随着癌组织的进展阳性表达数下降,散在分布,甚至消失。Syndecan-1正常宫颈组织和宫颈组织中的镜下表达情况,见图1。

1A:正常宫颈组织Syndecan-1的表达×400倍 1B:宫颈鳞癌Syndecan-1的表达×400倍 1C:宫颈腺癌Syndecan-1的表达×400倍 图1 正常宫颈组织与宫颈癌组织中Syndecan-1的镜下表达
2.2 E-cadherin表达于正常宫颈上皮和宫颈癌细胞的包浆及包膜 镜下见包浆及包膜中均匀分布棕黄或黄褐色颗粒,随着癌组织的进展,其异常表达率逐渐增高,表现于阳性表达数下降,散在分布,甚至消失。
正常宫颈组织与宫颈癌组织中E-cadherin的镜下表达情况,见图2。

2A:正常宫颈组织E-cadherin的表达×400倍 2B:宫颈鳞癌E-cadherin的表达×400倍 2C:宫颈腺癌E-cadherin的表达×400倍 图2 正常宫颈组织与宫颈癌组织中E-cadherin的镜下表达
2.3 2组患者宫颈组织中Syndecan-1,E-cadherin的表达 实验得出正常宫颈组织中Syndecan-1表达阳性率为75.0%,对比宫颈癌组织的25.6%,2者差异有统计学意义(P<0.05)。正常宫颈组织中E-cadherin表达阳性率为90.0%,对比宫颈癌组织的32.1%,2者差异有统计学意义(P<0.05)。见表1。
2.4 Syndecan-1,E-cadherin与宫颈癌临床各因素间的关系 宫颈癌临床分期以≤Ⅱa期,≥Ⅱb期分2组,Syndecan-1蛋白随临床分期越晚表达越低,差异有统计学意义(P<0.05),以有无淋巴转移分2组,发现有淋巴转移组其阳性表达明显减少,差异有统计学意义(P<0.05);病理分级分为Ⅰ级、Ⅱ级、Ⅲ级,随级别越高其表达阳性率越低,差异有统计学意义(P<0.05)。Syndecan-1蛋白的表达与宫颈癌患者的年龄,肿瘤的大小及组织的类型无相关性(P>0.05)。E-cadherin淋巴转移组其阳性表达明显减少,差异有统计学意义(P<0.05);随病理分级级别越高其表达阳性率越低,差异有统计学意义(P<0.05)。E-cadherin蛋白的表达与宫颈癌患者的年龄,肿瘤的大小及组织的类型、临床分期间无相关性(P>0.05)。见表2。
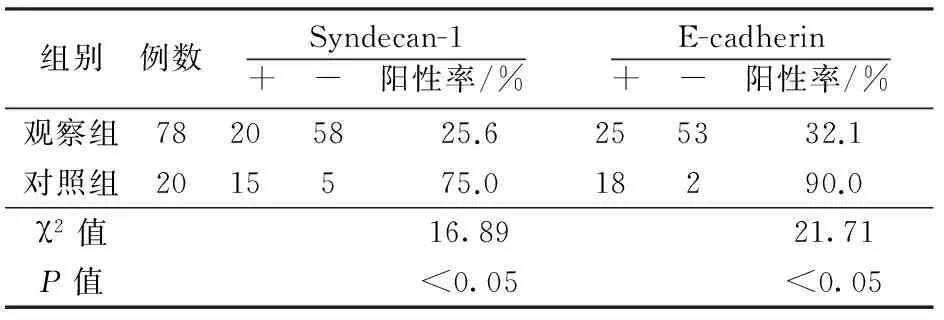
表1 正常宫颈组织和宫颈癌组织中Syndecan-1和E-cadherin的表达

表2 Syndecan-1,E-cadherin和宫颈癌临床病理因素间关系
2.5 Syndecan-1与E-cadherin在宫颈癌组织中的表达及其相关性分析 由表3得知在E-cadherin表达阳性数组织中,Syndecan-1表达阳性数13例,在E-cadherin表达阴性数53例组织中,Syndecan-1阴性表达数48例,E-cadherin与Syndecan-1两者间的表达呈显著正相关(R=0.058),即随着E-cadherin阳性数的减少,Syndecan-1的阳性率递减。
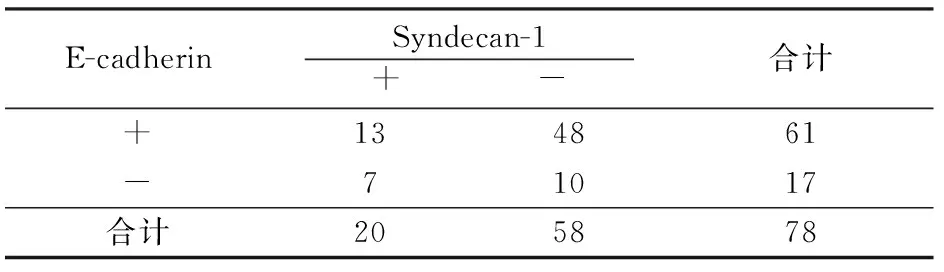
表3 宫颈癌组织中E-cadherin与Syndecan-1表达的相关性
注:χ2=9.0;P<0.05;R=0.058,正相关。
3 讨论
宫颈癌是最常见的女性生殖道恶性肿瘤,目前已明确HPV感染是导致宫颈癌发生的十分明确的病因,检测HPV病毒结合宫颈液基薄层细胞学(TCT)可提高宫颈病变的诊断率,及早发现病变及早干预,减少晚期宫颈癌的发生率,提高患者生存率。进一步研究宫颈癌的发病机制对于预防、诊断和治疗宫颈癌亦有着十分重要的意义。
Syndecan-1是黏附分子整合素跨膜粘结蛋白聚糖家族成员之一,由核心蛋白与未分枝的糖胺聚糖构成,定位在上皮细胞基底的外侧部并具有调节细胞间黏附、保持上皮细胞的形态等功能[2]。国外Kim YI[3]研究报道指出,Syndecan-1表达于宫颈正常鳞状上皮细胞膜表面,细胞质中不表达。研究发现宫颈癌组织中细胞质Syndecan-1高表达,在新生肿瘤细胞中Syndecan-1在细胞膜上分布消失,正是由于这种分布的改变,使得细胞-细胞及细胞-细胞外基质间的紧密连接减弱或者消失,加快细胞移行,进而使肿瘤细胞获得浸润和转移的能力。引起Syndecan-1分布改变的原因可能是单胺聚糖链的降解,或者是核心蛋白域突变不能形成糖链,调节细胞多种生物学行为进而影响肿瘤进展。Masola等[4]用免疫组织化学方法检测13例活体组织皮肤鳞癌Syndecan-1的表达,发现在正常的皮肤上皮细胞Syndecan-1呈现高表达状态,在浸润性皮肤癌为低表达状态,进而提示Syndecan-1表达与皮肤鳞癌的恶性转化相关。Yang N[5]发现在乳腺基质纤维母细胞中Syndecan-1调节细胞外基质的组装和决定细胞外基质纤维的结构,研究表明Syndecan-1改变细胞外基质成分的组成和结构,包括在活的有机体内和体外。改变过的细胞外基质纤维结构可以促进乳腺癌细胞的侵袭方向。Jary M等[6]提示,Syndecan-1可以作为评估转移性结直肠癌预后的指标,指导临床诊断和治疗。本研究中Syndecan-1蛋白的表达与宫颈癌肿瘤分期及组织学分级、淋巴转移具有相关性(P<0.05),与宫颈癌患者的年龄,肿瘤的大小及组织的类型无相关性(P>0.05),推测宫颈癌细胞质中Syndecan-1的高表达预示患者有较好的预后。
E-cadherin作为重要的黏附分子,主要抑制上皮组织来源的恶性肿瘤发生发展[7],Myong NH等研究指出E-cadherin的缺失与宫颈癌的进展密切相关。孟茜等[8]应用免疫组织化学技术检测E-cadherin在宫颈癌中的表达情况,研究表明在宫颈癌组织中E-cadherin低表达并且和临床分期、宫颈管浸润长度及淋巴结转移呈正相关。国外研究如Korean J Pathol[9],Auvinen E等[10]与国内研究一致。本研究结果显示:正常宫颈组织中E-cadherin表达阳性率为90.0%,对比宫颈癌组织的32.1%,2者差异有统计学意义(P<0.05),并与宫颈癌患者淋巴转移、病理分级间的差别有相关性(P<0.05),与宫颈癌患者的年龄,肿瘤的大小及组织的类型、临床分期无相关性(P>0.05)。
E-cadherin和Syndecan-1都表达于上皮细胞,都与肿瘤细胞分子的侵袭转染有关,本实验结果显示,采用Spearman秩相关对78例宫颈癌组织中E-cadherin与Syndecan-1的表达情况进行相关性分析,在E-cadherin表达阳性组织中Syndecan-1阳性13例,在E-cadherin表达阴性53例组织中Syndecan-1阴性表达48例。经统计学处理,E-cadherin与Syndecan-1的相关系数R=0.058(P<0.05),说明宫颈癌组织中的E-cadherin与Syndecan-1表达成正相关,实验得出2者在宫颈癌的发生发展中可能起到重要作用,对宫颈癌的预后具有重要意义。
综上所述,通过本研究结果认为在宫颈癌中E-cadherin和Syndecan-1表达均降低,且二者之间呈明显正相关性。二者的异常表达造成宫颈癌细胞间黏附分子复合体的破坏,进而破坏上皮形态结构的完整性,介导正常细胞接触抑制和肿瘤细胞接触依赖性生长抑制功能减退或者消失,使得肿瘤浸润转移。所以由此得出Syndecan-l与E-cadherin的低表达可能参与宫颈癌的发生发展并发挥重要作用,可有望用于宫颈癌临床诊断及其预后的指标。
[1] MITSELOU A,GALANI V,SKOUFI U,et al.Syndecan-1, Epithelial-Mesenchymal Transition Markers (E-cadherin/β-catenin) and Neoangiogenesis-related Proteins (PCAM-1 and Endoglin) in Colorectal Cancer[J].Anticancer Res,2016,36(5):2271-2280. [2] SUAREZ E,SYED F,ALONSO-RASGADO T,et al.Identification of biomarkers involved in differential profiling of hypertrophic and keloid scars versus normal skin[J].Arch Dermatol Res,2015,307(2):115-133.
[3] KIM YI,LEE A,LEE BH,et al.Prognostic significance of syndecan-1 expression in cervical cancers[J].J Gynecol Oncol,2011,22(3):161-167.
[4] MASOLA V,GAMBARO G,TIBALDI E,et al.Heparanase and syndecan-1 interplay orchestrates fibroblast growth factor-2-induced epithelial-mesenchymal transition in renal tubular cells[J].J Biol Chem,2012,287(2):1478-1488.
[5] YANG N,MOSHER R,SEO S,et al.Syndecan-1 in breast cancer stroma fibroblasts regulates extracellular matrix fiber organizationand carcinoma cell motility[J].Am J Pathol,2011,178(1):325-335.
[6] JARY M,LECOMTE T,BOUCHE O,et al.Prognostic value of baseline seric Syndecan-1 in initially unresectable metastatic colorectal cancer patients: a simple biological score[J].Int J Cancer,2016,139(10):2325-2335.
[7] CAMPBELL K,CASANOVA J.A role for E-cadherin in ensuring cohesive migration of a heterogeneous population of non-epithelial cells[J].Nat Commun,2015,6:7998.
[8] 孟茜,孟娟.E-cadherin和claudin-1在宫颈鳞癌中表达关系的研究[J].中国实用医药,2010,5(17):16-17.
[9] MYONG HN.Loss of E-cadherin and Acquisition of Vimentin in Epithelial-Mesenchymal Transition are Noble Indicators of Uterine Cervix Cancer Progression[J].Korean J Pathol,2012,46(4):341-348.
[10] AUVINEN E,CARPEN O,KORPELA T,et al.Altered Expression of ezrin,E-Cadherin and β-Catenin in Cervical Neoplasia[J].Neoplasma,2013,60(1):56-61.
安徽省马鞍山市中心医院 妇产科,243000
林宁(1987-),女,医师,研究生。
10.14126/j.cnki.1008-7044.2017.04.013
R 737.33
A
1008-7044(2017)04-0415-04
2017-03-06)
