宰后牦牛肉保水性变化与差异蛋白的生物信息学分析
2017-07-31左惠心殷元虎马君义宋仁德余群力
左惠心 殷元虎 韩 玲 马君义 宋仁德 余群力
(1.甘肃农业大学食品科学与工程学院,兰州730070;2.黑龙江省畜牧研究所,齐齐哈尔161005; 3.青海百德投资发展有限公司,西宁810008;4.玉树藏族自治州畜牧兽医工作站,玉树815000)
宰后牦牛肉保水性变化与差异蛋白的生物信息学分析
左惠心1殷元虎2韩 玲1马君义3宋仁德4余群力1
(1.甘肃农业大学食品科学与工程学院,兰州730070;2.黑龙江省畜牧研究所,齐齐哈尔161005; 3.青海百德投资发展有限公司,西宁810008;4.玉树藏族自治州畜牧兽医工作站,玉树815000)
牦牛肉营养丰富,但保水性较低,影响了食用加工品质。为了探究牦牛肉保水性影响机制,利用蛋白质组学及生物信息学方法对高、低保水性组间差异蛋白质进行了研究。以牦牛背最长肌为实验材料,根据滴水损失和蒸煮损失,将18份样品分为高保水性组(HWHC)和低保水性组(LWHC),利用双向电泳(2DE)技术筛选出6个差异倍数大于3倍且达到显著水平(P<0.05)的蛋白点,通过基质辅助激光解吸/电离飞行时间(MALDI-TOF/TOF)质谱进行鉴定,并利用生物信息学方法对差异蛋白质进行了疏水性分析和亚细胞定位分析。结果表明,HWHC和LWHC组间的差异蛋白分别是乳酸脱氢酶(LDH)、肌酸激酶M型(CKM)、磷酸丙糖异构酶(TIM)、肌球蛋白轻链(MLC)、肌钙蛋白T(TnT)和热休克蛋白27 kDa(HSP27)。对影响牦牛肉蒸煮损失的6种关键蛋白质进行了疏水性分析,结果显示LDH、CKM和TIM蛋白疏水性较高,构成蛋白质的氨基酸的高疏水性可以增强蛋白质和水之间的排斥,这可能是导致牦牛肉中保水性差异的原因之一。亚细胞定位分析显示,差异表达的蛋白质在细胞中分为5个位置,差异蛋白质均位于细胞质和细胞核中。研究结果明确了宰后牦牛肉保水性变化趋势,并通过差异蛋白的生物信息学分析揭示了蛋白质影响牦牛肉保水性的作用机理。
牦牛;滴水损失;蒸煮损失;双向电泳;生物信息学
引言
牦牛(Bos grunniens)是世界上唯一能在海拔3 000m以上生长的牛种,在高海拔、冷季长、饲草短缺等严酷条件下,具有极高的适应力和抗逆性[1]。牦牛肉营养丰富,但保水性(Water-holding capacity,WHC)较低,影响了食用加工品质[2]。因此,控制宰后汁液损失,减少经济损失是牦牛肉加工产业中亟待解决的问题。
滴水损失是描述生鲜肉保水性最常用的指标[3],蒸煮损失是描述加工肉保水性最常用的指标[4]。肉中滴水损失和蒸煮损失的升高会引起肉胴体和分割肉的质量损失[5],还可能影响加工肉的产量和品质[6],滴水损失和蒸煮损失的共同研究可以较为全面地研究肉的保水性。虽然影响肉与肉制品保水性的因素很多,但这些影响的最终结果往往是改变了肌肉蛋白质的性质、结构及其空间排布[7]。因此,宰后肌肉蛋白质的变化是研究保水性变化机理的重点之一。前期研究对比了黄牛和牦牛的蛋白质组,发现牦牛为适应高原低氧环境,存在特有的肌肉生物学特性和肉品质形成途径[8]。然而,目前对宰后牦牛肉保水性机制尚未进行深入研究,采用蛋白质组学方法研究生鲜、加工牦牛肉保水性形成的机制也未见报道,采用生物信息学分析方法挖掘差异蛋白质中所包含的生物学信息的研究也较少[9]。
本文以牦牛背最长肌为研究对象,通过比较高、低保水性组中宰后牦牛肉滴水损失率、蒸煮损失率变化,进而鉴定出高、低保水性组中的差异蛋白质,并结合生物信息学方法分析差异蛋白质的疏水性和亚细胞定位,探讨蛋白质影响肌肉保水性的作用机理。
1 材料与方法
1.1 材料与试剂
于甘肃省临夏回族自治州临夏市,采集18头 48月龄放牧牦牛的左、右侧背最长肌各1 500 g,经屠宰后,去除表面脂肪、筋腱及结缔组织后,立即用磷酸盐缓冲液清洗表面血迹后进行宰后成熟。在成熟的不同时间点(0、1、3、5、7 d)分别取样,使用左侧背最长肌测定肉品质指标,之后将右侧背最长肌切成厚2 cm的肉块,装在聚乙烯食品保鲜袋中,于-80℃保存备用。
固定化pH梯度(IPG)胶条(pH值3~10,非线性,长度17 cm),载体两性电解质(Bio-lyte)(pH值3~10),美国Bio-rad公司;3-[(3-胆酰胺丙基)二乙胺]-1-丙磺酸(CHAPS),二硫苏糖醇(DTT),α-氰基-4-羟基肉桂酸(CHCA),乙腈(ACN),三氟乙酸(TFA),美国Sigma公司;其他生化试剂均为国产分析纯。
1.2 仪器与设备
PHS-3C型pH计,上海雷磁仪器厂;UV-250型紫外分光光度计,日本岛津公司;TGL-24MC型台式高速冷冻离心机,长沙英泰仪器有限公司;CP214型电子天平,奥豪斯仪器有限公司;DHG9070A型电热鼓风干燥箱,上海越众仪器设备有限公司;Protean i12 IEF型双向电泳仪,Protein II型垂直电泳仪,美国Bio-Rad公司;5800型MALDI-TOF/TOF质谱仪,AB SCIEX公司。
1.3 实验方法
1.3.1 滴水损失率测定
参照OTTO等[10]的方法并做改进,即取屠宰后的样品50 g,精确称量后用细线系起一端,小心将肉样悬空于袋中,使肉样不与袋接触,用细线将袋口扎紧,悬挂于4℃条件下静置24 h,根据2次称量的质量差异计算肉的滴水损失率。滴水损失率越大,则肉的保水性越差。滴水损失率计算公式为

式中 m1——悬挂前肉样质量
m2——悬挂后肉样质量
1.3.2 蒸煮损失率测定
参照MONTOWSKA等[6]的方法并做改进,将尺寸不小于6 cm×3 cm×3 cm的肉样(约60 g)称量后放入80℃恒温水浴锅中加热,当肉样中心温度达到70℃时开始计时,使肉样中心温度保持在70℃继续煮30 min。用滤纸吸去肉样表面水分后再次称量,根据2次称量的质量差异计算肉的蒸煮损失率。蒸煮损失率越大,则肉的保水性越差。蒸煮损失率计算公式为

式中 m3——蒸煮前肉样质量
m4——蒸煮后肉样质量
1.3.3 pH值测定
参照BEE等[11]的方法,取50 g肉样,用蒸馏水冲洗肉样上的血渍,并用干净滤纸吸干表面残留水分,随机选择3个不同位置的肉样进行pH值测定,取其平均值。
1.3.4 肌肉蛋白质的提取
取出-80℃条件下保存的肌肉组织5 g,冰冻状态下放入研钵中,加入适量液氮研磨至粉末状,然后加入8mol/L尿素、2 mol/L硫脲、0.01 g/mL DTT、0.02 g/mL CHAPS和体积分数2%的Bio-lyte,并进行匀浆[12]。4℃条件下10000 g离心30min,离心后的上清液于 -80℃分装保存。蛋白质定量参照BRADFORD[13]的方法进行。
1.3.5 不同保水性牦牛肌肉双向凝胶电泳
参照ZUO等[2]的方法进行双向凝胶电泳(Two dimensional electrophoresis,2DE)分析,根据蛋白质定量浓度,取400μg蛋白质上样提取液,在以下程序进行等电聚焦:50 V主动水化14 h,500 V快速升压1 h,1 000 V快速升压1 h,2 000 V快速升压,9 000 V线性升压6 h,聚焦到80 000 V·h,500 V保持。聚焦结束后,分别用含质量浓度2 g/(100mL) DTT和2.5 g/(100mL)碘乙酰胺(IAA)的胶条平衡缓冲液平衡胶条各15min[2]。将平衡好的IPG胶条转移到双向凝胶上端,将电泳缓冲液倒入电泳槽中。设置电泳仪参数:100W电泳2 h,然后150W下电泳约10 h,直到溴酚蓝到达胶底部后关闭电泳,拨胶,用快速考马斯亮蓝染色法进行胶的染色。随后将凝胶放于图像扫描器上,根据PDQuest 8.0.1软件匹配结果筛选差异蛋白点,并进行质谱鉴定。
1.3.6 质谱鉴定
(1)胶内酶解
将胶粒切碎后加入200~400μL 100mmol/L碳酸氢铵(NH4HCO3)以及30%ACN脱色液,清洗脱色,加入 100 mmol NH4HCO3,室温(20℃)孵育15min。加入5μL质量浓度2.5~10 ng/μL的测序级胰蛋白酶溶液,37℃反应后静置20 h左右;吸出酶解液,加入100μL 60%ACN与0.1%TFA,超声处理15min,合并酶解液冻干[6]。
(2)质谱分析
冻干后的酶解样品,取2μL 20%ACN复溶。再取0.5μL过饱和CHCA基质溶液点至对应靶位上并干燥。用AB SCIEX 5800型串联飞行时间质谱仪进行测试分析,加速电压为2 kV,采用正离子模式和自动获取数据的模式采集数据[8]。
1.3.7 生物信息学分析
(1)差异蛋白质的疏水性分析
利用ExPASy服务器中的ProtScale程序分析牦牛肉不同保水性组间差异蛋白质的疏水性。输入ExPASy-ProtScale,序列框中输入Uniprot数据库中牦牛差异蛋白质所对应基因的氨基酸序列,选择Hphob./Kyte& Doolittle,即计算基于 K-D(Kyte-Doolittle)法的蛋白质疏水性,点击提交[14]。
(2)差异蛋白质的亚细胞定位
使用Wolf PSORT软件对牦牛肉不同保水性组间差异蛋白质的亚细胞定位进行预测。连接Wolf PSORT服务器,输入以Uniprot数据库中牦牛差异蛋白质所对应基因的FASTA格式序列[15]。得分最高的选项即为蛋白质基于KNN算法的主要定位。
1.4 数据处理与统计分析
采用SPSS 20.0软件进行方差分析,采用一般线性模型、SNK(Student-Newman-Keuls)测试进行显著性分析。凝胶图像的比对分析软件为PDQuest 8.0.1(美国Bio-rad公司),蛋白点丰度差异倍数为3倍以上且P<0.05判定为差异显著。质谱测试用Mascot 2.2软件检索数据库。利用在线数据库ExPASy(http:∥web.expasy.org/protparam/)服务器、Uniprot(http:∥www.uniprot.org/)数据库和Wolf PSORT(http:∥www.genscript.com/wolf-psort.htm l)软件进行蛋白质的疏水性和亚细胞定位分析。
2 结果与分析
2.1 聚类分析
如图1所示,以宰后1 d牦牛肉背最长肌的滴水损失率、蒸煮损失率为变量对18头牦牛进行聚类分析。根据聚类分析结果,分别挑选出高保水性组(High water-holding capacity,HWHC,滴水损失率2.01%~2.43%,蒸煮损失率29.98%~32.34%)和低保水性组(Low water-holding capacity,LWHC,滴水损失率3.62% ~4.15%,蒸煮损失率36.02%~38.07%)各6头(P<0.05)。选取高、低保水性组的牦牛肉样进行宰后肉品质变化及2DE分析。

图1 不同保水性牦牛肉的聚类分析结果Fig.1 Cluster analysis result in differentWHC groups in yak muscle
2.2 牦牛肉中pH值的变化
pH值用来直观体现机体生成的酸性物质(主要是乳酸)含量[16]。如图2所示,随着成熟时间的延长,宰后初期0~1 d牦牛肉的pH值显著降低(P<0.05),随着成熟时间延长,3 d后缓慢回升,在整个成熟过程中,高保水性组和低保水性组差异不显著。图2中a、b不同字母表示pH值随成熟时间差异显著(P<0.05),x表示高、低保水性组间差异不显著(P>0.05)。主要原因可能是宰后初期,糖原被分解而产生大量乳酸使得pH值大幅度下降,接近肌球蛋白等电点;但当pH值降低到一定程度后,H+浓度的升高使得与糖酵解相关的酶被钝化,酵解速度和程度逐渐减小,pH值回升[16]。

图2 不同保水性组牦牛肉宰后成熟过程pH值的变化Fig.2 pH values changes in yak muscle during postmortem aging in differentWHC groups
2.3 牦牛肉中滴水损失率的变化
滴水损失率是衡量肌肉保水性的重要指标[17],如图3所示,高保水性组和低保水性组的牦牛背最长肌滴水损失率随着成熟时间的延长,先增大后减小,在成熟前期(0~3 d)和成熟后期(3~5 d),滴水损失率差异显著(P<0.05)。在宰后成熟过程中,高、低保水性组之间差异显著(P<0.05)。在宰后第3天,高、低保水性组的滴水损失率分别达到3.56%和6.03%。图3中a~d不同字母表示滴水损失随成熟时间差异显著(P<0.05),x、y不同字母表示高、低保水性组间差异显著(P<0.05)。宰后成熟过程中,肌纤维束和单个肌肉细胞会分离,它们之间就留下了一些空隙。水从细胞外空隙移动到肉的表面形成滴水损失的过程,主要是把最大的空隙当作滴水通道,使液体沿着肌纤维方向流到切割肉的表面[18]。
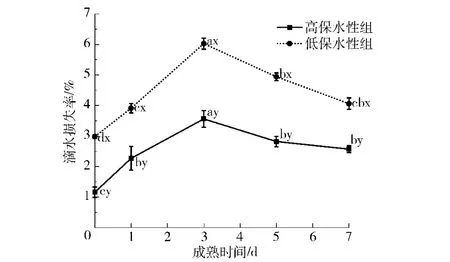
图3 不同保水性组牦牛肉宰后成熟过程中滴水损失率的变化Fig.3 Changes of drip loss rate in yak muscle during postmortem aging in differentWHC groups
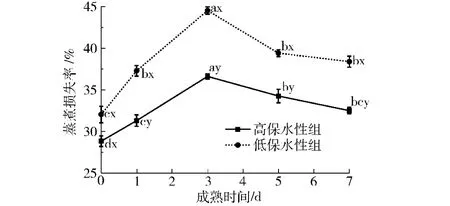
图4 不同保水性组牦牛肉宰后成熟过程中蒸煮损失率的变化Fig.4 Changes of cooking loss rate in yak muscle during postmortem aging in differentWHC groups
2.4 牦牛肉中蒸煮损失率的变化
蒸煮损失率也是评价肌肉保水性的重要指标,如图4所示,随着宰后成熟时间的延长,高保水性组和低保水性组的牦牛背最长肌蒸煮损失率先增大后减小。两组的蒸煮损失率先随着成熟时间(0~3 d)的增加显著增大(P<0.05),高、低保水性组分别在宰后3 d时达最大值36.61%和44.52%。两组的蒸煮损失率在成熟3~7 d逐渐降低。高、低保水性组除开始时,在整个成熟过程中差异显著(P<0.05)。图4中a~d不同字母表示蒸煮损失率随成熟时间差异显著(P<0.05),x、y不同字母表示高、低保水性组间差异显著(P<0.05)。高、低蒸煮损失率组在宰后初期,蒸煮损失率均呈现上升趋势,可能是因为pH值下降诱导肌原纤维网格结构收缩,同时在加热条件下,由于蛋白质的热变性作用使肌原纤维紧缩,能潴留不易流动水的空间变小,部分不易流动水变成自由水流出[19]。
2.5 牦牛肉2DE差异表达蛋白点的确定
将高、低保水性组2DE凝胶均放于图像扫描器上,选择透射模式,以300 dpi分辨率扫描16位灰度图像,设置优化灵敏度、算符大小和背景噪声等参数,初步识别凝胶图像中的点。创建参考胶,手工匹配部分蛋白点,由PDQuest 8.0.1软件自动匹配后进行手工校正,所得结果进一步在参考胶中验证,选择差异倍数大且有统计学意义的蛋白点作为保水性相关的差异表达蛋白点。如图5所示,根据2DE图谱中的点丰度分析,在宰后高、低保水性组牦牛背最长肌中,共确定6个差异倍数大于3倍且达到显著水平(P<0.05)的蛋白点。

图5 宰后不同保水性组牦牛肉2DE差异蛋白点标记Fig.5 2DE gel images of differentially abundant proteins in postmortem yak muscle between HWHC and LWHC groups
2.6 MALDI-TOF/TOF质谱鉴定
通过MALDI-TOF/TOF质谱鉴定,共成功鉴定出可信度大于95%的6种蛋白质,点编号、蛋白名称、检索号、数据库来源、分子量、等电点、蛋白表达量和差异倍数如表1所示。其中3个点在高保水性组的牦牛肉中表达量较高,3个点在低保水性组的牦牛肉中表达量较高。这些差异蛋白质的等电点(pI值)大多集中在 6~9左右,分子量在30~45 kDa之间。根据质谱鉴定结果,差异蛋白质主要在2DE凝胶中性或碱性区被发现,分别为代谢酶、结构蛋白和应激蛋白。

表1 宰后不同保水性组牦牛肉差异蛋白质谱鉴定结果Tab.1 Identification results of differentially abundant proteins in postmortem yak muscle between HWHC and LWHC groups
WU等[20]研究发现,影响牛肉肉色稳定性的蛋白质主要涉及宰后的氧化代谢,这些蛋白质可延缓宰后pH值下降。DICK等[21]对猪肌肉保水性进行蛋白质组学分析,发现在蛋白质丰富度出现显著差异的蛋白质中,磷酸肌酸激酶的高丰富度能使磷酸肌酸快速降解的迟滞阶段相对缩短,进而使pH值下降更快、肌肉收缩加强,最终导致汁液流失的大量增多。本文结果也显示代谢酶在宰后肉保水性变化中起重要作用。
2.7 生物信息学分析
生物信息学作为一门生物学、数学和计算机相互交叉融合而产生的新兴学科,近年来随着基因组学和蛋白质组学的兴起而迅速发展起来。为了充分挖掘差异蛋白质包含的生物学信息,目前在互联网上已经建立了许多蛋白质组数据库,如 NCBInr、Swiss-Prot、PIR、Prosite等,这些数据库通过对生物学实验数据的获取、加工、存储、检索与分析,进而达到提取数据所蕴含的生物学意义的目的[9]。
2.7.1 差异蛋白质的疏水性分析
氨基酸侧链的一个重要特性是其具有亲水性和疏水性,不同性质的蛋白质其亲、疏水性残基的分布不同,分析蛋白质的亲、疏水性模式可揭示某些蛋白质的结构和折叠信息。20种氨基酸的疏水性指数分别为:Ala,1.800;Arg,-4.500;Asn,-3.500; Asp,-3.500;Cys,2.500;Gln,-3.500;Glu,-3.500;Gly,-0.400;His,-3.200;Ile,4.500; Leu,3.800;Lys,-3.900;Met,1.900;Phe,2.800; Pro,-1.600;Ser,-0.800;Thr,-0.700;Trp,-0.900;Tyr,-1.300;Val,4.200[22]。
对与牦牛肉保水性相关的6个差异蛋白质进行了疏水性分析。在本实验中设定窗口宽度为9个氨基酸残基,系统自动绘制出了牦牛乳酸脱氢酶(LDH)、肌酸激酶M型(CKM)、磷酸丙糖异构酶(TIM)、肌球蛋白轻链(MLC)、肌钙蛋白T(TnT)和热休克蛋白27 kDa(HSP27)6个蛋白的疏水性图,6个蛋白均存在显著的疏水区(图6)。牦牛LDH蛋白在75~100和340~350氨基酸之间有2个典型的疏水性区域,峰值约为2.6。CKM在70~80个氨基酸之间有一个典型的疏水性区域,峰值大于2。TIM在约第125个氨基酸位置有一个典型的疏水性区域,峰值约为2.25。MLC蛋白疏水区域较密集,在约第800个氨基酸处有最高峰,峰值约为3。TnT蛋白的疏水性最高峰位于60~80个氨基酸之间,峰值约为1.0。HSP27蛋白在第70~80和130~140个氨基酸之间有2个典型的疏水性区域,峰值约为2.2。

图6 牦牛肉差异蛋白的疏水性分析Fig.6 Prediction analysis of hydrophobicity of differentially abundant proteins in yak muscle
由图6a~6c可知,在LDH、CKM和TIM蛋白中,大于1的疏水性区域较广,因此LDH、CKM和TIM蛋白疏水性较高,保水性较差,与前文2DE结果一致(表1),即表明LDH、CKM和TIM的高疏水性可以增强蛋白质和水之间的排斥,这可能导致低保水性组中水分流失。另一方面,LDH、CKM和TIM均为代谢酶,宰后糖酵解和能量代谢使乳酸堆积,肌肉pH值迅速降低,首先会使肌浆蛋白凝结到肌原纤维上,蛋白质溶解度下降,增加了自由水的流失,造成保水性下降[23]。其次,随着pH值的快速下降,肌球蛋白变性作用的敏感性提高,肌球蛋白变性会降低保水性[24]。另外,pH值下降破坏了肌肉蛋白质电荷间的平衡,蛋白质带净负电荷的数量减少,大量水分被压迫挤出,此时吸附水的能力下降。当pH值下降到接近肌肉蛋白质的等电点时,蛋白质的净电荷为零,此时肌肉的保水性最低[25]。
2.7.2 差异蛋白质的亚细胞定位
蛋白质的亚细胞定位预测一直是生物信息学研究的重点,亚细胞定位与蛋白质的功能存在着非常紧密的联系。如表2所示,高、低保水性组间的6个差异蛋白在细胞中位于5个位置,主要位于细胞质和细胞核中。其中,LDH在线粒体中得分最高,CKM、TIM和MLC在细胞质中得分最高,TnT和HSP27在细胞核中得分最高,得分最高的位置即为该蛋白的主要亚细胞定位。FOUCAULT等[26]研究发现,糖酵解酶和肌酸激酶在肌浆内存在相互作用,以完成能量运输和传导,肌浆是改变细胞内pH值及代谢酶活性的重要场所。代谢酶主要位于肌浆和线粒体中,且差异蛋白质主要位于细胞质和细胞核中。

表2 牦牛肉差异蛋白的亚细胞定位Tab.2 Subcellular unit positioning of differentially abundant proteins in yak muscle
细胞质是细胞膜内的一种凝胶状物质,是细胞新陈代谢的主要场所,对细胞核有一定的调控作用[27]。细胞质包含除细胞核以外的所有细胞器,在细胞发挥生理功能中起重要的作用,主要包括细胞质基质、内膜系统、细胞骨架和中心体。细胞核在细胞的代谢、生长、发育、分化中起着重要作用,是生物体遗传物质的主要存在部位,主要是由核膜、染色质、核仁和核骨架构成[28]。因此,细胞核和细胞质作为蛋白质合成和发挥作用的场所,在肌细胞中发挥了重要的作用,可以通过对蛋白质亚细胞定位的预测为未来专一研究差异蛋白质的性质提供理论依据。
3 结束语
通过比较高、低保水性组中宰后牦牛肉pH值、滴水损失率、蒸煮损失率变化,得到了宰后牦牛肉保水性变化规律。通过蛋白质组学分析,鉴定出与保水性相关的6个差异蛋白质,分别为乳酸脱氢酶、肌酸激酶M型、磷酸丙糖异构酶、肌球蛋白轻链、肌钙蛋白T和热休克蛋白27 kDa。通过生物信息学方法分析差异蛋白质的疏水性,表明氨基酸的疏水性对蛋白质保水性产生重要影响,亚细胞定位分析显示,差异蛋白质主要位于细胞质和细胞核中。本文从肌肉保水性、蛋白质分子、肌肉细胞3个不同层面,阐明宰后成熟过程中牦牛肉的保水性机制,为解释牦牛肌肉生物学特性和肉品质差异提供了有意义的理论依据。
1 师希雄,罗天林,余群力.牦牛肉成熟前后差异蛋白质组学分析[J/OL].农业机械学报,2015,46(9):251-256.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?flag=1&file_no=20150937&journal_id=jcsam.DOI:10.6041/j.issn.1000-1298.2015.09.037.SHIXixiong,LUO Tianlin,YU Qunli.Analysis of differential proteomics between fresh and aging yak meat[J/OL].Transactions of the Chinese Society for Agricultural Machinery,2015,46(9):251-256.(in Chinese)
2 ZUO H X,HAN L,YU Q L,et al.Proteome changes on water-holding capacity of yak Longissimus lumborum during postmortem aging[J].Meat Science,2016,121:409-419.
3 WANG ZY,HE F,RAOW L,etal.Proteomic analysis of goat Longissimus dorsi muscleswith different drip loss values related to meat quality traits[J].Food Science and Biotechnology,2016,25(2):425-431.
4 HUGHES JM,OISETH S K,PURSLOW P P,et al.A structural approach to understanding the interactions between colour,water-holding capacity and tenderness[J].Meat Science,2014,98(3):520-532.
5 OFFER G,COUSINST.Themechanism of drip production:formation of two compartments of extracellular space in muscle post mortem[J].Journal of the Science of Food and Agriculture,1992,58(1):107-116.
6 MONTOWSKA M,POSPIECH E.Species-specific expression of various proteins in meat tissue:proteomic analysis of raw and cooked meat and meat productsmade from beef,pork and selected poultry species[J].Food Chemistry,2013,136(3-4):1461-1469.
7 HUFF-LONERGAN E J,LONERGAN SM.Mechanisms ofwater-holding capacity ofmeat:the role of postmortem biochemical and structural changes[J].Meat Science,2005,71:194-204.
8 左惠心,韩玲,余群力,等.牦牛与黄牛肌肉差异蛋白质组及生物信息学分析[J/OL].农业机械学报,2017,48(4):313-320.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?file_no=20170441&flag=1.DOI:10.6041/j.issn.1000-1298.2017.04.041.ZUO Huixin,HAN Ling,YU Qunli,et al.Proteomics and bioinformatics analyses of differentially expressed proteins in yak and beef cattlemuscle[J/OL].Transactions of the Chinese Society for Agricultural Machinery,2017,48(4):313-320.(in Chinese)
9 吴祖建,高芳銮,沈建国.生物信息学分析实践[M].北京:科学出版社,2010:105-118.
10 OTTO G,ROEHE R,LOOFT H,et al.Drip loss of case-ready meat and of premium cuts and their associations with earlier measured sample drip loss,meat quality and carcass traits in pigs[J].Meat Science,2006,72(4):680-687.
11 BEE G,ANDERSON A L,LONERGAN SM,et al.Rate and extent of pH decline affect proteolysis of cytoskeletal proteins and water-holding capacity in pork[J].Meat Science,2007,76(2):359-365.
12 HOPKINSON A,MCINTOSH R S,LAYFIELD R,et al.Optimised two-dimensional electrophoresis procedures for the protein characterisation of structural tissues[J].Proteomics,2005,5(7):1967-1979.
13 BRADFORD M M.A rapid and sensitivemethod for the quantitation ofmicrogram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
14 牛培培.猪PCYT1A和PEMT的生物信息学分析与苏淮猪不同组织中两基因表达及卵磷脂含量的分析[D].南京:南京农业大学,2012.
15 贾建磊.不同产羔性状绵羊卵巢组织差异表达蛋白质的筛选与分析[D].兰州:甘肃农业大学,2015.
16 田甲春,韩玲,刘昕,等.牦牛肉宰后成熟机理与肉用品质研究[J/OL].农业机械学报,2012,43(12):146-150.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?flag=1&file_no=20121227&journal_id=jcsam.DOI:10.6041/j.issn.1000-1298.2012.12.027.TIAN Jiachun,HAN Ling,LIU Xin,et al.Ageingmechanism and meat quality during postmortem ageing of yak meat[J/OL].Transactions of the Chinese Society for Agricultural Machinery,2012,43(12):146-150.(in Chinese)17 BOWKER B,ZHUANG H.Relationship between water-holding capacity and protein denaturation in broiler breast meat[J].Poultry Science,2015,94(7):1657-1664.
18 KRISTENSEN L,PURSLOW P P.The effect of ageing on the water-holding capacity of pork:role of cytoskeletal proteins[J].Meat Science,2001,58(1):17-23.
19 葛长荣,马美湖.肉与肉制品工艺学[M].北京:中国轻工业出版社,2009:39.
20 WUW,FU Y,THERKILDSEN M,et al.Molecular understanding ofmeat quality through application of proteomics[J].Food Reviews International,2015,31(1):13-28.
21 DICK FM,WIEL V D,ZHANGW L.Identification of pork quality parameters by proteomics[J].Meat Science,2007,51(1): 46-54.
22 查磊.蛋白质分子中RNA结合位点的分析和预测[D].北京:中国人民解放军军事医学科学院,2012.
23 SHEN L,LEIH,ZHANG S,et al.Comparison of energy metabolism and meat quality among three pig breeds[J].Animal Science Journal,2014,85(7):770-779.
24 ANDERSON M J,LONERGAN S M,HUFF-LONERGAN E.Myosin light chain 1 release from myofibrillar fraction during postmortem aging is a potential indicator of proteolysis and tenderness of beef[J].Meat Science,2012,90(2):345-351.
25 ZHANGW G,LONERGAN SM,GARDNER M A,etal.Contribution of postmortem changes of integrin,desmin andμ-calpain to variation in water holding capacity of pork[J].Meat Science,2006,74(3):578-585.
26 FOUCAULTG,VACHER M,CRIBIER S,et al.Interactions between beta-enolase and creatine kinase in the cytosol of skeletal muscle cells[J].Biochemical Journal,2000,346:127-131.
27 FRIEDBERG I.Automated protein function prediction—the genomic challenge[J].Briefings in Bioinformatics,2006,7(3): 225-242.
28 焦仁杰.细胞核骨架—核纤层—中间纤维体系的研究[J].自然科学进展:国家重点实验室通讯,1996,6(1):34-38.
Changes of Postmortem W ater-holding Capacity in Yak Muscle and Bioinformatic Analysis of Differentially Abundant Proteins
ZUO Huixin1YIN Yuanhu2HAN Ling1MA Junyi3SONG Rende4YU Qunli1
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China 2.Animal Husbandry Research Institute of Heilongjiang Province,Qiqihar 161005,China 3.Qinghai Baide Investment Development Limited Company,Xining 810008,China 4.Animal Husbandry and Veterinary Station of Yushu,Yushu 815000,China)
Yak meat is rich in nutrients,but has low water-holding capacity(WHC),which affects its edible and processing quality.Therefore,control of postmortem juice loss and reduction of economic loss are crucial issues needing urgent resolution in the yak meat processing industry.Existing research suggested that changes in proteins affected the WHC of postmortem muscle,but relevantmechanism was still not entirely clear because of the complexity of protein composition.Thus,it is very important to explore the variation mechanism of postmortem WHC of yak meat by combining multiple analytical and testingmethods.Proteomics research combined with bioinformatics approach was studied by comparing high-WHC(HWHC)and low-WHC(LWHC)groups.Based on the data obtained from drip loss and cooking loss,totally 18 longissimus dorsi of yak can be classified into HWHC and LWHC groups.Totally six proteinswere found to be abundant differentially between HWHC and LWHC groups and identified by matrix assisted laser desorption ionization-time of flight/time of flight(MALDI-TOF/TOF).Matched spots exhibited a three fold or more intensity difference in the meantime associated with 5%statistical significance(P<0.05).Then hydrophobicity analysis and subcellular localization prediction were usedto validate the representative proteins.Results showed that differentially abundant proteins were lactate dehydrogenase(LDH),creatine kinase M-type(CKM),triosephosphate isomerase(TIM),myosin light chain(MLC),troponin T(TnT)and heat shock 27 kDa(HSP27).The analysis of hydrophobicity performed that LDH,CKM and TIM had more hydrophobic regions.The results showed that the high hydrophobicity could enhance the rejection of protein and water,which might lead to the weak water retention of yak meat.In subcellular localization prediction,the differentially abundant proteins in the cells were divided into five positions.All of the differentially abundant proteins were located in the cytoplasm and nucleus.Accordingly,proteomics and bioinformatics analyseswere proven to be excellent tools to quantify the changes of proteins and biological information linked to WHC,and thus helping to explain the processes behind characteristicmeat quality traits in yak muscle.
yak;drip loss;cooking loss;two dimensional electrophoresis;bioinformatics
TS207.3
A
1000-1298(2017)07-0325-07
2017-05-18
2017-06-13
国家自然科学基金项目(31460402、31560463)、青海省重点研发与转化计划项目(2017-NK-C6)和国家现代农业产业(肉牛牦牛)技术体系项目(CARS-38)
左惠心(1988—),女,博士生,主要从事畜产品加工研究,E-mail:likevvhappy@163.com
余群力(1962—),男,教授,博士生导师,主要从事畜产品贮藏加工研究,E-mail:yuqunlihl@163.com
10.6041/j.issn.1000-1298.2017.07.041
