宰后牦牛肉细胞凋亡对肌肉内环境与嫩度的影响
2017-07-31王琳琳马君义余群力郭宗林石红梅
王琳琳 马君义 余群力 韩 玲 郭宗林 石红梅
(1.甘肃农业大学食品科学与工程学院,兰州730070;2.青海百德投资发展有限公司,西宁810008; 3.甘南藏族自治州畜牧科学研究所,合作747000)
宰后牦牛肉细胞凋亡对肌肉内环境与嫩度的影响
王琳琳1马君义2余群力1韩 玲1郭宗林1石红梅3
(1.甘肃农业大学食品科学与工程学院,兰州730070;2.青海百德投资发展有限公司,西宁810008; 3.甘南藏族自治州畜牧科学研究所,合作747000)
为探究牦牛肉宰后成熟过程中细胞凋亡对肌肉内环境、细胞凋亡因子及嫩度的影响,以经环孢菌素A(CsA)处理的牦牛背最长肌为研究对象,测定了成熟过程中肌肉内环境指标、凋亡因子及嫩度指标的变化。结果表明,24~120 h时间内,CsA组肌纤维直径和肌纤维横截面积均显著(P<0.05)或极显著(P<0.01)大于对照组;宰后6 h、72~120 h,CsA组pH值显著低于对照组(P<0.05),宰后6~168 h,CsA组ATP含量均高于对照组,且在宰后12 h、72~168 h两者之间ATP含量存在显著差异(P<0.05);成熟过程中CsA组MPTP开放程度极显著低于对照组(P<0.01);成熟前期CsA组胞浆中Cyt-c浓度显著或极显著低于对照组,成熟后期CsA组胞浆中Cyt-c浓度显著或极显著高于对照组;在整个成熟过程中(除72~120 h),CsA组caspase-3活性均显著或极显著低于对照组,CsA组Hsp27表达量均显著或极显著低于对照组;12~24 h,CsA组剪切力显著(P<0.05)或极显著(P<0.01)高于对照组。表明CsA能够通过抑制MPTP的开放而抑制细胞凋亡的发生并影响肌肉内环境、caspase-3活性、Hsp27表达,剪切力及肌原纤维微观结构的变化,说明细胞凋亡的发生对肌肉内环境变化及宰后牦牛肉嫩化具有重要影响,且可以通过控制宰后肌肉细胞凋亡发生进程来调节肌肉内环境变化及肌肉嫩化程度。
耗牛肉;宰后成熟;细胞凋亡;肌肉内环境;环孢菌素A;微观结构
引言
随着国内外学者对肌肉成熟嫩化机制的不断探究,研究的热点逐渐由组织蛋白酶系和钙激活酶系转向细胞凋亡酶系对宰后肌肉嫩度的改善作用。细胞凋亡是指为维持内环境稳定,由基因控制的细胞自主、有序的细胞死亡形式[1-2],分为外源死亡受体途径及内源线粒体途径,其中线粒体途径被认为是哺乳动物及其他细胞模型发生凋亡的主要途径,而Cyt-c从线粒体释放到胞浆中这一关键步骤,是线粒体途径发生的根本原因[3]。线粒体通透性转换孔(MPTP)是位于线粒体内外膜之间由多种蛋白质共同组成的、具有非特异性、电压依赖性的复合物孔道,众多研究表明其与细胞凋亡密切相关,因各种因素导致的MPTP的开放,被认为是Cyt-c从线粒体释放到胞浆中的直接原因[4]。同时,MPTP的专一性抑制剂CsA能够有效抑制MPTP的开放及细胞凋亡的发生[5]。然而,关于在牦牛肉宰后成熟过程中,CsA是否通过抑制MPTP开放进而抑制细胞凋亡的发生,并对肌肉内环境及牦牛肉嫩度造成影响的研究,国内外尚未见报道。因此,有必要研究CsA处理对细胞凋亡的抑制作用及对肌肉内环境和嫩度的影响,为细胞凋亡改善牦牛肉嫩度机制提供理论依据。
细胞凋亡对肌肉的嫩化作用是近年来肉品科学研究的热点,尤其在细胞凋亡对肌原纤维蛋白降解方面国内外学者做了大量研究。SENTANDREU等[6]于2002年首次将细胞凋亡及细胞凋亡酶引入到宰后肌肉的蛋白水解及嫩化过程中,认为在动物屠宰以后会发生细胞的死亡即细胞凋亡,而并非细胞坏死,这一理论为细胞凋亡嫩化机制提供了理论可行性及研究的必要性。KEMP等[7]研究发现宰后猪肉caspase-3活性与剪切力呈显著相关性;孙志昶等[8]在研究宰后不同部位牦牛肉细胞凋亡与肉嫩度之间关系时,也发现caspase-3活性与剪切力呈显著或极显著的关系。CHEN等[9]研究指出凋亡诱导剂喜树碱、依托泊苷及Ca2+均能提高肌原纤维的水解;HUANG等[10]利用 caspase-3的选择性抑制剂DEVE-CHO处理宰后肉类时发现,细胞内的caspase-3选择性抑制剂可以抑制肌肉骨架蛋白的降解,以上研究进一步说明细胞凋亡酶能够降解肌细胞骨架蛋白进而改善肌肉嫩度。
近年来在细胞凋亡对肌肉的嫩化方面,国内外学者已作了大量的研究,然而关于肌肉在宰后成熟过程中细胞凋亡如何发生,及其与肌肉内环境的关系,以及进而改善肌肉嫩度方面的研究报道较少。本文以经CsA处理的牦牛肉为研究对象,测定成熟过程中肌肉内环境变化指标、细胞凋亡相关指标及嫩度相关指标,初步探索CsA处理对细胞凋亡的抑制作用及对肌肉内环境与嫩度的影响,最终明确细胞凋亡发生进程与肌肉内环境、肌肉嫩度变化的关系,以期为牦牛肉宰后实际生产嫩化过程提供理论依据。
1 材料与方法
1.1 材料与试剂
试验材料:牦牛由甘肃天玛生态食品科技股份有限公司提供,选取在同一牧场,生长发育正常、健康无病、体重均匀、平均年龄2~4岁的甘南牦牛10头,宰前禁食16~18 h,禁水2 h。
试验试剂:环孢菌素A、蔗糖、甘露醇、EDTA、牛血清白蛋白、Hepes、二甲苯、连二亚硫酸钠、硫酸铜、酒石酸钾钠、叠氮钠、十二烷基硫酸钠、丙烯酰胺、PVDF膜、免疫印迹化学发光试剂ECL、显影粉、定影粉、Anti-Hsp27抗体;caspase-3活性测定试剂盒等。
1.2 主要仪器设备
Spectramax M2型酶标仪,美国美谷分子仪器有限公司;RF5301-PC型荧光分光光度计,日本岛津公司;TGL-16M型高速台式冷冻离心机,长沙湘仪离心机仪器有限公司;C-LM4型数显式肌肉嫩度仪,上海精密科学仪器有限公司;XH-B型旋涡混合器,江苏康健医疗用品有限公司;Tanon-5200型全自动化学发光分析仪,上海天能科技有限公司;SH-100型凝胶图像分析系统,上海四星生物技术公司。
1.3 试验方法
1.3.1 样品采集和制备
以背最长肌(Longissimus dorsi)为试验对象,从胴体上取下背最长肌约40 g,用锡箔纸包裹后立即放入液氮中作为0 h样品。其余肉样迅速切成小块(40 g/块),随机分成2组,1组不作任何处理为空白对照样品,另1组注射200mmol/L的CsA溶液(料液比1 g/mL),于4℃条件下,分别成熟6、12、24、72、120、168 h,并在相应时间点测定pH值和剪切力,对于caspase-3活力、Cyt-c含量等不便立即测定的指标,将肉样在设计时间点采集并用液氮迅速冷却后置于-80℃待测。
1.3.2 肌肉组织学观察
将样品切成长×宽 ×高为1.0 cm×0.5 cm× 0.5 cm的肉块,用10%中性甲醛溶液浸泡48 h,然后将样品放入70%、80%、90%、95%(体积分数)乙醇溶液中脱水1 h,100%乙醇Ⅰ、Ⅱ各10 min;二甲苯各透明15min后组织包埋、修片、切片、染色,中性树胶封片后显微拍照。然后用 Motic Images Advanced 3.2图像处理系统软件测量单根肌纤维直径、肌细胞间距和肌纤维横截面积,同时观察细胞核的形态变化。
1.3.3 pH值测定
将便携式pH计的探针插入肉样中,使pH计的电极与肌肉组织充分接触,读数稳定后记录,每个肉样重复测定3次,取平均值。
1.3.4 ATP含量测定
参照南京建成生物工程研究所的ATP含量测定试剂盒说明书测定ATP含量(摩尔质量浓度),用双缩脲法测定样品的蛋白含量,ATP含量的单位为μmol/g。
1.3.5 MPTP开放程度测定
参照LI等[11]及胡志刚等[12]研究方法,取牛背最长肌,剪碎后置于 10倍线粒体分离介质中(220mmol/L甘露醇、70mmol/L蔗糖和2.0mmol/L EDTA,5.0mmol/L 4-丙磺酸基吗啉和0.5%牛血清白蛋白,pH值7.4)用匀浆机匀浆。匀浆液于4℃,1 000 g离心10 min,取上清1 000 g离心10 min,于4℃,8 000 g离心20min,所得沉淀为线粒体,上清液为胞浆。线粒体蛋白含量用双缩脲法进行检测,使用前用MPTP测试介质稀释至0.3mg/mL蛋白质量浓度。MPTP测试介质(230 mmol/L甘露醇、70mmol/L蔗糖,3.0mmol/L Hepes,pH值7.4)。在石英杯中加入3mLMPTP测试介质,然后根据线粒体的蛋白浓度加入一定量的线粒体,用紫外分光光度计检测540 nm处的吸光度,吸光度增大,表明孔的开放程度减小。
1.3.6 胞浆中Cyt-c浓度测定
参照辛国荣等[13]研究方法,取纯化的1.5 mL胞浆,加少许连二亚硫酸钠(0.025 g),振摇后,在520 nm处测定吸光度,由标准曲线计算胞浆中Cyt-c的浓度。
1.3.7 caspase-3活性测定
按照caspase-3活性检测试剂盒说明书并稍作改进对caspase-3的活性进行测定。取90 mg组织肉样,剪碎后加入500μL caspase-3裂解液,用玻璃匀浆机于4℃匀浆30次。匀浆液于4℃,10 000 g离心10 min,离心完毕后取上清液待测。取85μL caspase-3反应缓冲液,10μL待测上清液,5μL 2mmol/L caspase-3反应底物DEVD-pNA,依次加入96孔酶标板中,对照孔加入95μL反应缓冲液,5μL caspase-3反应底物DEVD-pNA,用封口膜封住,置于37℃恒温箱中反应1~2 h,取下封口膜,用酶标仪在405 nm处测定吸光度。
1.3.8 Hsp27蛋白表达量测定
采用12%的分离胶和5%浓缩胶,将变性蛋白样品离心吸取上清上样,每条泳道上样100μg总蛋白,电泳分离后用转膜仪将凝胶中的蛋白转到PVDF膜上,转印后的PVDF膜在含5%脱脂奶粉的TBST溶液中室温(20℃)封闭1 h,在1.5 mL的EP管中加入1 mL的封闭液,再加入适量的一抗,于4℃冰箱中放置12 h;将膜取出放入TBST洗膜盒中,在室温条件下清洗3次,每次10 min;之后用1∶4 000稀释的过氧化物标记的羊抗兔免疫球蛋白抗体,室温条件下孵育1 h,再次清洗,随后将ECL发光试剂滴加到膜上,5 min后,用滤纸尽量吸去膜边缘多余的ECL发光试剂,将膜平放到压片暗盒中,进行压片,5min后,在显影液中显影15 s,洗净后将膜置于全自动化学发光分析仪中进行定影。使用Image J软件进行灰度分析,目的条带的灰度与0 h条带灰度之比即为Hsp蛋白表达量的百分数。
1.3.9 剪切力
取厚约4 cm、质量100 g左右的肉样(除去表面脂肪和结缔组织),装入塑料薄膜袋,用夹子封口,放入80℃水浴锅中,加热到中心温度为75℃,取出冷却至室温,然后用1.27 cm的取样器沿肌纤维方向钻取测定样品,用剪切力仪测定剪切力,每组重复3次,取平均值。
1.3.10 肌原纤维及线粒体超微结构观察
参照HORN等[14]研究方法,取尺寸为0.5 cm× 0.5 cm×0.5 cm的肉块,用3%戊二醛磷酸盐缓冲液固定,再用锇酸固定,磷酸缓冲液冲洗,乙醇梯度脱水,环氧树脂浸透包埋,超薄切片机切片,用Hitachi H-7650型透射电镜进行成像观察。
1.4 统计分析
试验结果均采用平均值±标准差表示,数据均平行测定3次,用SPSS 19.0软件进行方差分析(ANOVA,P<0.01,P<0.05),多重比较采用新复极差法(P<0.05),用Origin 8.5软件作图。
2 结果与分析
2.1 细胞核及骨骼肌细胞形态学变化
2.1.1 细胞核形态学变化
如图1所示,宰后成熟过程中对照组与CsA组牦牛骨骼肌细胞核形态存在一定差异。宰后6~24 h,牦牛骨骼肌细胞核的结构完整(如箭头所示),轮廓清晰,并且核质分布均匀;但随着成熟时间的延长,部分骨骼肌细胞核开始向边缘迁移,同时细胞皱缩,细胞间距逐渐增大,这是典型的细胞凋亡特征。KWAK等[15]及孙志昶等[8]研究也证实细胞核向边缘移动,发生边缘化,肌肉发生了明显的细胞凋亡现象。同时,在整个成熟过程中,CsA组骨骼肌细胞核形态较对照组骨骼肌细胞核结构完整,分布均匀,表明CsA组显著抑制了骨骼肌细胞凋亡的发生程度。
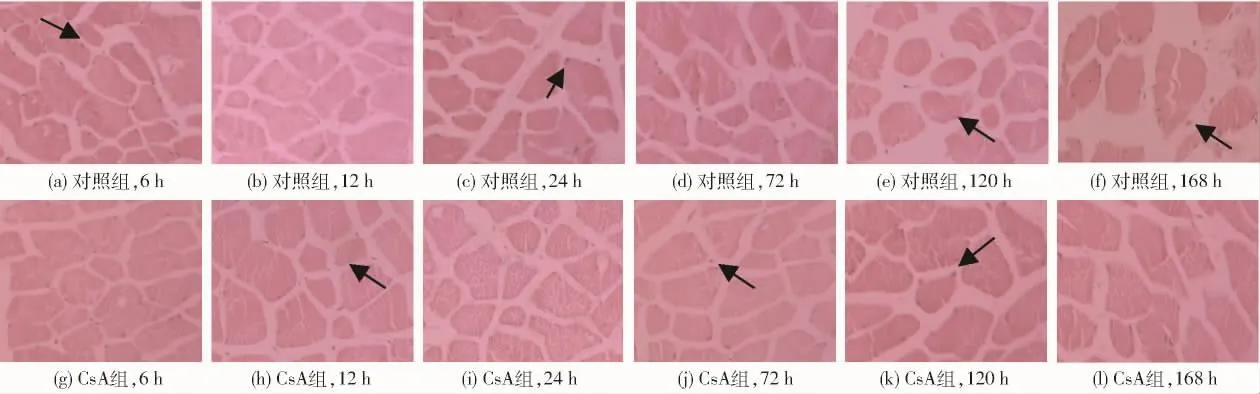
图1 CsA处理对牦牛肉成熟过程中细胞核形态学变化的影响Fig.1 Effect of CsA treatment on morphological changes of yak skeletalmuscle nucleus during postmortem aging
2.1.2 骨骼肌细胞形态学变化
成熟是肌肉宰后发生的一个复杂的生化反应过程,机体在缺血缺氧情况下,肌肉pH值、ATP含量、线粒体形态及功能、骨骼肌细胞形态等均会发生不同程度的改变甚至破坏,同时细胞也进入了一个不可逆的凋亡状态[2]。肌纤维形态是评价肌肉嫩度的指标之一,肌纤维直径越小,嫩度越好[16]。由表1和图1可知,2组骨骼肌肌纤维直径和肌纤维横截面积均随着成熟时间延长而减小,肌纤维间距随时间延长而增大,且在成熟的中后期肌纤维形态皱缩较明显,王莉[16]研究结果也表明随着成熟时间延长,骨骼肌肌纤维直径和横截面积逐渐减小且肌纤维间距逐渐增大;同时,宰后6 h,24~120 h,CsA组肌纤维直径显著或极显著大于对照组(P<0.05,P<0.01);12~120 h,CsA组横截面积显著或极显著大于对照组(P<0.05,P<0.01),宰后12 h、120~168 h,CsA组肌纤维间距显著或极显著小于对照组(P<0.05,P<0.01),说明CsA组肌纤维皱缩速度较对照组慢,嫩度改善作用较弱,综合上述指标说明,CsA处理显著抑制了成熟过程中肌纤维的皱缩,进一步表明抑制细胞凋亡也可抑制骨骼肌细胞形态的改变。
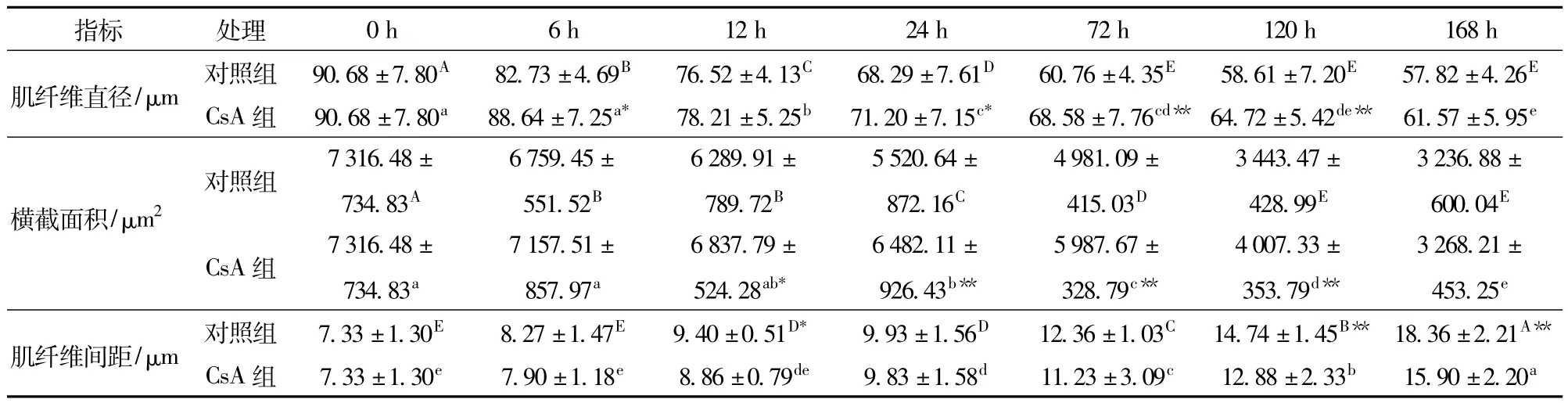
表1 CsA处理对牦牛肉成熟过程中骨骼肌细胞形态学变化的影响Tab.1 Effect of CsA treatment on morphological changes of yak skeletalm uscle cells
2.2 肌肉内环境变化
2.2.1 pH值
宰后细胞缺血缺氧条件造成细胞内环境的酸化,这种变化有利于凋亡现象的发生,有研究表明,肌细胞内环境pH值在7.4以上时能够严重抑制caspase-3酶原的活化,从而抑制caspase-3的激活,阻止细胞凋亡的发生[17]。由表2可知,对照组pH值在成熟过程中呈先下降后上升的变化,宰后24 h pH值显著低于12 h(P<0.05),宰后168 h pH值较宰后0 h显著降低14.58%(P<0.05);宰后6 h、72~120 h,CsA组pH值显著低于对照组(P<0.05),12~24 h时2组pH值无显著差异,此研 究 结 果 与 贾 青[18]研 究 结 果 一 致,BOUDJELLAL等[19]研究发现pH值下降能够导致线粒体释放Cyt-c到胞浆中,启动caspases级联反应发生,也有研究发现pH值下降到6.3时,细胞凋亡发生,本研究指出宰后6 h、72~120 h,CsA组pH值显著低于对照组,说明CsA处理能够显著影响肌肉内环境的变化,且随着成熟时间的延长,CsA抑制作用减弱,pH值下降程度降低,此研究结果与贾青[18]研究结果不同,其研究表明宰后24 h后,抑制剂处理组pH值在72~120 h显著高于对照组,造成此现象的原因可能是所用凋亡抑制剂的种类及作用机理不同。
2.2.2 ATP含量
ATP是caspases家族发生级联反应的必要条件,有研究表明肝脏细胞凋亡的发生主要依赖ATP。由表2可知,随着成熟时间的延长,对照组及CsA组中ATP含量呈不同程度的下降。宰后6~168 h,CsA组ATP含量均高于对照组,且在宰后12 h、72~168 h两者之间ATP含量存在显著差异(P<0.05),12 h时CsA组ATP含量比对照组高31.71%,说明CsA能够抑制ATP含量的下降,ADRAIN等[20]研究指出ATP含量的降低会直接抑制caspases级联反应,使caspases降解蛋白的作用减弱,且抑制细胞凋亡的发生也会抑制ATP含量的下降,与本研究的结果相似,说明宰后成熟过程中细胞凋亡的发生与ATP含量的变化密不可分。

表2 CsA处理对牦牛肉成熟过程中肌肉内环境变化的影响Tab.2 Effect of CsA treatment on internal environment changes of yak skeletalmuscle cells
2.3 MPTP开放程度及胞浆中Cyt-c浓度变化
2.3.1 MPTP开放程度
目前,关于线粒体凋亡途径中Cyt-c的释放机制主要有2种解释:通过Bcl-2家族蛋白的调控;线粒体内、外膜之间的通透性转换孔外膜特异性断裂,导致Cyt-c的释放,在多种细胞模型中都表明Cyt-c通过MPTP释放[21]。在牦牛肉宰后成熟过程中关于Cyt-c的释放机制相关研究不足,HUANG等[1]研究表明在牛肉宰后成熟过程中,抗凋亡因子Bcl-2表达量没有显著变化,而促凋亡因子Bax表达量显著增加。由表3可知,对照组MPTP的开放程度呈先增大后减小的变化且随着成熟时间的延长MPTP呈不可逆的开放状态。在整个成熟过程中,CsA组MPTP开放程度极显著低于对照组(P<0.01),说明CsA处理确实抑制了MPTP的开放,VALERY等[22]的研究也证实CsA能够抑制血细胞MPTP的开放,间接抑制Cyt-c的释放并影响细胞凋亡的发生。同时,在诸如肿瘤细胞等多种细胞模型中也证明CsA能够抑制MPTP的开放,进而影响细胞凋亡级联反应的发生,然而也有部分研究表明Cyt-c的释放与MPTP无关,原因可能与所用细胞模型、MPTP的结构组成及功能有关。

表3 CsA处理对牦牛肉成熟过程中MPTP开放程度及胞浆中Cyt-c浓度的影响Tab.3 Effect of CsA treatment on MPTP opening and Cyt-c content
2.3.2 胞浆中Cyt-c浓度
Cyt-c在多种细胞的凋亡过程中起着关键的凋亡信号放大作用,Cyt-c从线粒体释放到胞浆是细胞凋亡发生的关键步骤[7]。由表3可知,成熟前期CsA组胞浆中Cyt-c浓度显著或极显著低于对照组,而在成熟后期CsA组胞浆中Cyt-c浓度显著或极显著高于对照组,由此说明CsA处理抑制了线粒体中Cyt-c向胞浆中的释放,但随着CsA抑制作用的减弱,Cyt-c被抑制的程度也相应减弱,导致在成熟后期CsA组中Cyt-c被大量释放到胞浆中,由此证明CsA通过抑制MPTP的开放间接抑制了Cyt-c的释放及细胞凋亡的发生。HUANG等[1]研究表明,胞浆中Cyt-c呈先上升后下降的变化,与本研究对照组Cyt-c浓度变化趋势一致,同时本研究结果与PETRONILLI等[23]及KUMARSWAMY等[24]的研究结果也一致,说明抑制MPTP开放能够抑制线粒体Cyt-c释放及细胞凋亡的发生。
2.4 细胞凋亡因子变化
caspases在细胞凋亡过程中的生物化学和形态学变化中起着至关重要的作用,有研究表明活化的caspase-3能介导多种细胞模型中蛋白的水解过程,也有研究表明宰后成熟过程中细胞骨架蛋白的降解主要由caspase-3来完成,具有不可替代的地位[25]。由图2可知,在整个成熟过程中(除72~120 h),CsA组caspase-3活性均显著或极显著低于对照组(P<0.05,P<0.01),表明CsA通过抑制Cyt-c的释放进而抑制下游caspase-3的激活,CHEN等[9]研究表明抑制细胞凋亡能够显著影响caspase-3的活性。PANDEY等[26]及FU等[27]研究表明caspase-9能够激活下游的caspase-3发生细胞凋亡,也有研究指出在caspases蛋白酶水解的级联放大反应中,细胞内的caspase-3酶原裂解成2种亚基,随后这2种亚基异构聚合,使caspase-3活化[28]。

图2 CsA处理对caspase-3活性的影响Fig.2 Effect of CsA treatment on caspase-3 activity
Hsp27是机体中细胞维持和修复的重要成分,能特异性抑制应激诱导的细胞凋亡,有研究者通过免疫共沉淀试验证明,Hsp27可与Cyt-c和caspase-3的酶原结合,从而抑制细胞凋亡的发生[29]。图3表明,对照组中Hsp27蛋白表达量随着成熟时间的延长而显著降低(P<0.05),72 h时达到最小值后又呈上升趋势,此结果与李婕等[30]研究结果相一致; CsA组中,0~24 h时间内的Hsp27蛋白表达量显著下降(P<0.05),说明在成熟过程中Hsp27蛋白表达量会受到成熟时间及CsA处理的影响,同时CsA组Hsp27蛋白表达量在整个成熟过程中均显著或极显著低于对照组(P<0.05,P<0.01),表明细胞凋亡发生程度降低时,Hsp27蛋白表达量也会下降,说明CsA通过抑制细胞凋亡可以间接影响机体的某些应激反应。
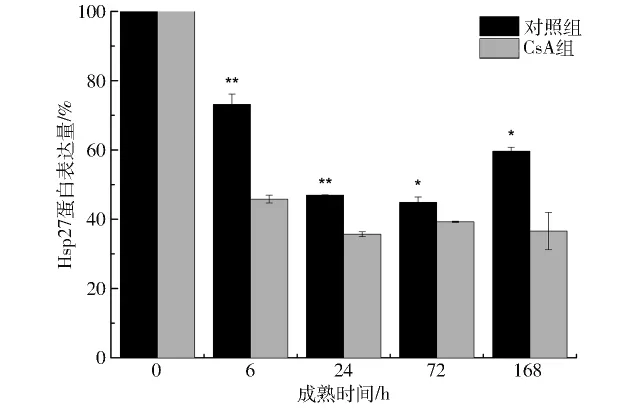
图3 CsA处理对Hsp27蛋白表达量的影响Fig.3 Effect of CsA treatment on Hsp27 expression amount

图4 CsA处理对牦牛肉成熟过程中剪切力变化的影响Fig.4 Effect of CsA treatment on shear force
2.5 剪切力变化
嫩度是在成熟过程中评价肉质成熟程度的重要指标,主要决定于成熟过程中肌肉组织各组分及肌肉内部的生物化学变化对各组分特性的改变[2]。而剪切力是目前肉品研究中评价成熟过程中肌肉嫩度的代表性指标。由图4可知,2组肉样在成熟过程中剪切力都呈先上升后下降的变化,且因蛋白凝固、肌纤维硬化,肌肉进入僵直期,导致剪切力达到最大值,此研究结果与李婕等[30]的研究报道相一致;同时,在12~24 h时间内,CsA组剪切力显著或极显著高于对照组(P<0.05,P<0.01),而在成熟72 h后,CsA组剪切力均显著或极显著低于对照组;以上研究结果表明,CsA通过抑制骨骼肌细胞凋亡级联反应,间接抑制了凋亡效应酶对肌细胞骨架蛋白的降解,且随着CsA抑制作用的减弱,肌肉嫩度得到改善,进一步证明细胞凋亡对宰后肌肉的嫩化起到非常重要的作用,CHEN等[9]的研究结果也支持此结论。
2.6 肌原纤维及线粒体超微结构
从图5可以看出,2组牦牛肉肌原纤维超微结构在形态上基本一致,明带中间的Z线清晰,每一条肌原纤维都呈现规则的明带和暗带。对照组牦牛肉在成熟过程中肌原纤维超微结构发生了明显变化,宰后24 h,肌原纤维连接紧密,肌原纤维框架结构清晰,肌节完整且排列有序,同时,线粒体结构完整,轮廓清晰,线粒体的脊突明显,随着时间的延长,肌纤维的正常排列被破坏,肌间距离变宽,肌纤维发生皱缩,线粒体体积增大并发生肿胀,呈气泡状,宰后168 h,肌原纤维大面积断裂、溶解,出现大量肌原纤维小片,Z线断裂程度加重且部分线粒体溶解消失;CsA组中,宰后120~168 h,肌原纤维结构均较对照组完整,依然能够看到肌原纤维超微结构变化不大,但是部分线粒体也呈空泡状,脊突消失并发生了溶解;CsA组肌原纤维及线粒体超微结构破坏程度小于对照组,说明CsA通过抑制Cyt-c的释放,间接抑制了成熟过程中细胞凋亡的发生,进而降低了细胞凋亡对嫩度的改善作用,降低了超微结构的破坏程度。

图5 CsA处理对牦牛肉成熟过程中肌原纤维及线粒体超微结构的影响Fig.5 Effect of CsA treatment onmyofibrils and mitochondrial ultrastructure
3 结论
(1)CsA显著抑制了牦牛肉宰后成熟过程中骨骼肌肌纤维的皱缩,影响肌肉内环境变化,抑制MPTP的开放程度、胞浆中Cyt-c的浓度及caspase-3活性变化,同时也抑制了成熟过程中Hsp27的表达、肌原纤维及线粒体微观结构变化,且随着成熟时间的延长,CsA的抑制作用减弱,细胞凋亡反应进程加快。
(2)CsA通过抑制MPTP开放程度间接抑制细胞凋亡的发生,并抑制凋亡效应酶对肌细胞骨架蛋白的降解,且随着MPTP被抑制作用的降低,肌肉嫩度得到改善,说明细胞凋亡对牦牛肉宰后内环境变化及肌肉嫩化具有重要作用。
1 HUANG F,HUANG M,ZHANG H,et al.Changes in apoptotic factors and caspase activation pathways during the postmortem aging of beefmuscle[J].Food Chemistry,2016,190:110-114.
2 田甲春,韩玲,刘昕,等.牦牛肉宰后成熟机理与肉用品质研究[J/OL].农业机械学报,2012,43(12):146-150.http:∥www.jcsam.org/jcsam/ch/reader/view_abstract.aspx?flag=1&file_no=20121227&journal_id=jcsam.DOI:10.6041/j.issn.1000-1298.2012.12.027.TIAN Jiachun,HAN Ling,LIU Xin,et al.Ageing mechanism and meat quality during postmortem ageing of yak meat[J/OL].Transactions of the Chinese Society for Agricultural Machinery,2012,43(12):146-150.(in Chinese)
3 YOSHIDA H.Apaf-1 is required formitochondrial pathways of apoptosis and brain development[J].Cell,1998,94(6):739-750.
4 BOATRIGHT K M,SALVESEN G S.Mechanisms of caspase activation[J].Current Opinion in Cell Biology,2003,15(6):725-731.
5 KATHLEENW K,PABLO M P,SHIN Y R,et al.IsmPTP the gatekeeper for necrosis,apoptosis,or both[J].Biochimica et Biophysica Acta,2011,1813(4):616-622.
6 SENTANDREU M A,COULISG,OUALIA.Role ofmuscle endopeptidases and their inhibitors inmeat tenderness[J].Trends in Food Science&Technology,2002,13(12):400-421.
7 KEMPCM,PARR T.The effectof recombinant caspase 3 onmyofibrillar proteins in porcine skeletalmuscle[J].Animal,2008,2(8):1254-1264.
8 孙志昶,冯晓琴,韩玲,等.牦牛肉宰后成熟嫩化与细胞凋亡酶活力变化研究[J/OL].农业机械学报,2014,45(1):191-196.http:∥www.jcsam.org/jcsam/ch/reader/view_abstract.aspx?flag=1&file_no=20140130&journal_id=jcsam.DOI:10.6041/j.issn.1000-1298.2014.01.030.SUN Zhichang,FENG Xiaoqin,HAN Ling,etal.Tenderness and apoptotic activity of yakmeatduring postmortem aging[J/OL].Transactions of the Chinese Society for Agricultural Machinery,2014,45(1):191-196.(in Chinese)
9 CHEN L,FENG X C,LU F,et al.Effects of camptothecin,etoposide and Ca2+on caspase-3 activity and myofibrillar disruption of chicken during postmortem ageing[J].Meat Science,2011,87(3):165-174.
10 HUANGM,HUANG F,XUE M,et al.The effect of active caspase-3 on degradation of chicken myofibrillar proteins and structure ofmyofibrils[J].Food Chemistry,2011,128(1):22-27.
11 LIJX,TONG CW,XU D Q,et al.Changes in membrane fluidity and lipid peroxidation of skeletalmusclemitochondria after exhausting exercise in rats[J].European Journal of Applied Physiology and Occupational Physiology,1999,80(2):113-117.
12 胡志刚,周蕾,丁树哲.有氧训练对力竭运动大鼠线粒体通透性转运孔的影响[J].沈阳体育学院学报,2015,34(3): 64-67.HU Zhigang,ZHOU Lei,DING Shuzhe.Effects of aerobic training to exhaustive exercise ratmitochondrial permeability transition pore[J].Journal of Shenyang Sport University,2015,34(3):64-67.(in Chinese)
13 辛国荣,姜广林,高艳华,等.肝硬化门脉高压症中肝细胞线粒体钙、细胞色素C与细胞凋亡的关系[J].中国组织工程研究与临床康复,2007,34(3):9456-9461.XIN Guorong,JIANG Guanglin,GAO Yanhua,et al.Mitochondrial calcium,cytochrome C and apoptosis of hepatic cells after hepatic cirrhosisportal hypertension[J].Journal of Clinical Rehabilitative Tissue Engineering Research,2007,34(3):9456-9461.(in Chinese)
14 HORN S,LUEKING A,MURPHY D.Profiling humoral autoimmune repertoire of dilated cardiomyopathy(DCM)patients and development of a disease-associated protein chip[J].Proteomics,2006,6(2):605-613.
15 KWAK S,WEISS JH.Calcium-permeable AMPA channels in neurodegenerative disease and ischemia[J].Current Opinion in Neurobiology,2006,16(3):281-287.
16 王莉.牦牛肉肌纤维类型组成及其代谢酶活力差异对宰后肉嫩度的影响[D].兰州:甘肃农业大学,2016.WANG Li.The effect ofmuscle fiber types and their differences in metabolic enzymes activity on postmortem tenderness of yak meat[D].Lanzhou:Gansu Agricultural University,2016.(in Chinese)
17 SEGAL M S,BEEM E.Effect of pH,ionic charge,and osmolality on cytochrome c-mediated caspase-3 activity[J].American Journal of Physiology—Cell Physiology,2001,281(4):C1196-C1204.
18 贾青.细胞凋亡酶-3及其抑制剂对宰后牦牛肉品质变化的影响[D].兰州:甘肃农业大学,2016.JIA Qing.Influence of caspases-3 and the inhibitors on yak meat quality changes[D].Lanzhou:Gansu Agricultural University,2016.(in Chinese)
19 BOUDJELLAL A,BECILA S,COULIS G,et al.Is the pH drop profile curvilinear and either monophasic or polyphasic? Consequences on the ultimate bovinemeat texture[J].African Journal of Agricultural Research,2008,3(3):195-204.
20 ADRAIN C,CREAGH E,MARTIN S.Apoptosis-associated release of Smac/DIABLO from mitochondria requires active caspases and is blocked by Bcl-2[J].EMBO Journal,2001,20(23):6627-6636.
21 SZABO I,PINTO V D,ZORATTIM.Themitochondrial permeability transition pore may comprise VDAC molecules.II.The electrophysiological properties of VDAC are compatible with those of the mitochondrial megachannel[J].FEBS Letters,1993,330(2):206-210.
22 VALERY L,ARMENG,ASUMANM,etal.C0248MPTP-dependentand-independentmechanisms of plateletapoptosis:effects of cyclosporin A[J].Thrombosis Research,2012,130(Supp.1):198-199.
23 PETRONILLIV,PENZO D,SCORRANO L,et al.Themitochondrial permeabilitytransition,release of cytochrome c and cell death[J].The Journal of Biological Chemistry,2001,276(15):12030-12034.
24 KUMARSWAMY R,SETH R K,DWARAKANATH B S,et al.Mitochondrial regulation of insect cell apoptosis:evidence for permeability transition pore independent cytochrome-c release in the Lepidopteran Sf9 cells[J].The International Journal of Biochemistry&Cell Biology,2009,41(6):1430-1440.
25 DEJEAN L M,MARTINEZ-CABALLERO S,MANON S,et al.Regulation of the mitochondrial apoptosis-induced channel,MAC,by BCL-2 family proteins[J].Biochimica et Biophysica Acta,2006,1762(2):191-201.
26 PANDEY P,SALEH A,NAKAZAWA A,et al.Negative regulation of cytochrome c-mediated oligomerization of Apaf-1 and activation of pro-caspase-9 by heat shock protein 90[J].EMBO Journal,2000,19(16):4310-4322.
27 FU M L,SHIW H,LIZ L,et al.Activation ofmPTP-dependentmitochondrial apoptosis pathway by a novel pan HDAC inhibitor resminostat in hepatocellular carcinoma cells[J].Biochemical and Biophysical Research Communications,2016,477(4):527-533.
28 SCHOENWAELDER SM,BURRIDGE K.Evidence for a calpeptin-sensitive protein-tyrosine phoshatase upstream of the small GTPase Rho.A novel role for the calpain inhibitor calpeptin in the inhibition of protein-tyrosine phosphatases[J].Journal of Biological Chemistry,1999,274(20):14359-14367.
29 BRUEY JM,DUCASSE C,BONNIAUD P,et al.Hsp27 negatively regulates cell death by interacting with cytochrome c[J].Nature Cell Biology,2000,2(9):645-652.
30 李婕,罗天林,师希雄,等.牦牛肉宰后成熟过程中Hsp27与食用品质的相关性分析[J].食品科学,2016,37(9):18-22.LIJie,LUO Tianlin,SHIXixiong,etal.Correlation analysis between Hsp27 and eating quality during postmortem ageing in yak meat[J].Food Science,2016,37(9):18-22.(in Chinese)
Effects of Apoptosis on Muscle Internal Environment and Tenderness during Yak Meat Postmortem Aging
WANG Linlin1MA Junyi2YU Qunli1HAN Ling1GUO Zonglin1SHIHongmei3
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China 2.Qinghai Baide Investment Development Limited Company,Xining 810008,China 3.Gannan Institute of Animal Science and Veterinary,Hezuo 747000,China)
With the aim to explore the effects of apoptosis on muscle internal environment,apoptosis factors and tenderness during postmortem aging,the longissimus dorsi muscles injected with specific inhibitor cyclosporin A(CsA)of MPTP were taken as experiment objects.The muscle internal environment factors,apoptosis factors and tenderness index were measured.The results indicated that myofiber diameter and cross section area in the CsA group were significantly or extremely significantly larger than those in the control group(P<0.05,P<0.01);after 6 h and 72~120 h of postmortem,the pH value in the CsA group was lower than that in the control group(P<0.05),and at 6~168 h of postmortem,ATP contents in the CsA group were higher than those in control group,specially,after12 h and 72~168 h of postmortem,ATP contents in the two groups had significant difference(P<0.05);the degree of MPTP opening in the CsA group was lower than that in the control group(P<0.01);Cyt-c content in the cytoplasm was significantly or extremely significantly lower in the early aging stage,and the resultwas opposite in the late aging time;caspase-3 activities in the CsA group was lower than those in the control group during the whole time except after 72~120 h of postmortem;Hsp27 expression in the CsA group was lower than that in the control group,after 12~24 h of postmortem,the shear force of the CsA group was higher compared with the control group.Cyclosporin A could suppress the changes ofinternal environment,caspase-3 activities,Hsp27 expression level and the shear force and changes of myofibrils and mitochondrial ultrastructure by suppressing the opening of MPTP,the apoptotic process played a significant role in the changes of internal environment and yak meat tenderness during postmortem aging and the changes of internal environmentand tenderness could be adjusted by controlling the apoptosis process.
yak meat;postmortem aging;apoptosis;muscle internal environment;cyclosporine A; ultrastructure
TS251.1
A
1000-1298(2017)07-0317-08
2017-02-04
2017-04-05
青海省重点研发与转化计划项目(2017-NK-C6)、国家自然科学基金项目(31560463)、2015甘肃省财政厅专项和国家肉牛牦牛产业技术体系项目(CARS-38)
王琳琳(1988—),女,博士生,主要从事畜产品加工研究,E-mail:jiayouwl123@163.com
余群力(1962—),男,教授,博士生导师,主要从事畜产品加工研究,E-mail:yuqunlihl@163.com
10.6041/j.issn.1000-1298.2017.07.040
