棉花内生蜡状芽孢杆菌YUPP-10对棉花黄萎病的 防治作用及机制
2017-07-31周京龙冯自力冯鸿杰李云卿袁媛李志芳魏锋师勇强赵丽红孙正祥朱荷琴周燚
周京龙,冯自力,冯鸿杰,李云卿,袁媛,李志芳,魏锋,师勇强,赵丽红,孙正祥,朱荷琴,周燚
棉花内生蜡状芽孢杆菌YUPP-10对棉花黄萎病的 防治作用及机制
周京龙1,2,冯自力2,冯鸿杰2,李云卿2,袁媛2,李志芳2,魏锋2,师勇强2,赵丽红2,孙正祥1,朱荷琴2,周燚1
(1长江大学农学院,湖北荆州 434025;2中国农业科学院棉花研究所/棉花生物学国家重点实验室,河南安阳 455000)
【目的】棉花黄萎病(Verticillium wilt)是世界性难以防治的病害,筛选有效的生防微生物资源成为解决棉花黄萎病的重要途径之一,本研究旨在分离一株高效拮抗细菌,并明确其防治机理,为生物防治棉花黄萎病提供技术支持。【方法】用葡甘聚糖作为碳源筛选一株能够降解-1,4糖苷键的棉花内生细菌YUPP-10,通过平板对峙培养、平板对扣培养和悬滴法等测定YUPP-10对大丽轮枝菌()菌丝生长和孢子萌发的抑制效果;用YUPP-10无菌滤液培养大丽轮枝菌微菌核,检测其对微菌核萌发的影响;利用基质接种法进行盆栽试验探究其对棉花黄萎病的防治效果;通过胚根、叶片接种病原菌,木质化和活性氧爆发研究YUPP-10诱导抗病能力;采用实时荧光定量PCR(qRT-PCR)方法检测防御相关基因的表达。【结果】成功获取一株蜡状芽孢杆菌()YUPP-10,其整体代谢产物在7 d时对大丽轮枝菌的抑菌带宽为0.73 cm,挥发性代谢产物在10 d时对大丽轮枝菌菌落的抑制率为77.03%;YUPP-10无菌培养液对大丽轮枝菌孢子和菌核萌发的抑制率分别为17.22%—71.25%和10.69%—26.62%,且抑制率与无菌滤液的浓度呈正相关。在用YUPP-10玉米蛭石培养物拌土处理的盆栽试验中,其对棉花黄萎病的最高防效达到80.60%。诱导抗性试验发现YUPP-10诱导了胚根和叶片抗大丽轮枝菌的侵染,诱导了细胞木质化和活性氧的爆发。qRT-PCR检测结果显示YUPP-10成功激活了苯丙氨酸解氨酶()、过氧化物酶()、多酚氧化酶()、几丁质酶()和病程相关基因()的表达,对大丽轮枝菌在棉花体内的扩散和生长起到了抑制作用。【结论】YUPP-10通过直接抑制病原菌的生长,同时诱导植物防御反应来抵抗病原菌的侵染和扩展,其具有良好的应用前景。
内生细菌;棉花黄萎病;诱导抗性;防御机理
0 引言
【研究意义】真菌病害对作物产量和食品安全均构成了严重威胁,黄萎病(Verticillium wilt)作为一种维管束真菌病害,对重要的经济作物造成了巨大损失,如香蕉、棉花和番茄等。棉花黄萎病是由大丽轮枝菌()引起的土传病害,世界各地均有报道,是世界范围内最重要的棉花病害[1]。随着中国棉花产区和规模的固定化,连作导致棉花黄萎病日趋严重。然而由于病原菌的寄主、传播途径和致病机理多而复杂,目前尚无理想的防治措施。在现有防治措施中,抗病育种因选育周期长且缺乏天然抗性资源而受到限制,化学防治对环境污染严重且对土传病害防治效果不佳,生物防治符合绿色、安全的现代农业发展需求,成为防治棉花黄萎病的重要途径。【前人研究进展】黄萎病的生物防治包括拮抗真菌、拮抗细菌、拮抗放线菌和诱导系统抗病性等。其中,细菌种类和数量无论在植物组织中还是根际土壤或其他环境中都较大,且植物组织中的内生细菌,其强拮抗性菌株的比例较高,因此植物内生细菌作为生防资源受到广泛关注。内生细菌在已经研究的植物中均有发现,存在于寄主植物的组织内部,却没有侵染寄主的负面作用[2-3],并能与寄主形成一系列不同的关系,包括共生、互惠、共栖和营养寄生等[4]。另外,内生细菌在植物中的定殖类似于病原体的生态位,使得其适合作为生物防治剂[5]。拮抗内生细菌在植物病虫害的防治上已有很多报道。目前已经研究应用的拮抗细菌多为芽孢杆菌(spp.),如枯草芽孢杆菌()[6]、解淀粉芽孢杆菌()[7]和蜡状芽孢杆菌()[8]等。还包括一些类芽孢杆菌(spp.)、荧光假单胞()和伯克霍尔德氏菌(spp.)等。其中枯草芽孢杆菌已被登记为农药,研究较多。蜡状芽孢杆菌作为拮抗菌的研究相对较少,国际上多用蜡状芽孢杆菌作为产蛋白的工程菌、重金属的吸附菌和环境的改良菌等。报道中利用蜡状芽孢杆菌作为拮抗资源的有通过产几丁酶防治棉花立枯病、茄子黄萎病、鹰嘴豆灰霉病和番茄灰霉病等[9-12]、产生非蛋白抗菌物质[13]、促植物生长抗病[14]和诱导系统抗病性等[15-16]。【本研究切入点】关于蜡状芽孢杆菌防治棉花黄萎病的研究较少,国内有从苦豆子、焮麻和土壤中分离到的蜡状芽孢杆菌对棉花黄萎病具有防治效果的报道,但防治机理尚不明确,其中对棉花内生蜡状芽孢杆菌用于棉花黄萎病防治的研究更少。本研究定向筛选具有生防潜力的棉花内生细菌用于棉花黄萎病的防治,以提供一种绿色、无公害的生物防治菌株。【拟解决的关键问题】通过富集培养筛选一株能降解-1,4糖苷键的内生细菌,研究其代谢产物对大丽轮枝菌菌丝生长、孢子和微菌核萌发的影响,制成的生防菌剂对棉花黄萎病的防治效果。探究其诱导植物抗病能力,揭示该菌株诱导棉花防御病害的作用机理,以期为生物防治棉花黄萎病提供新的拮抗资源。
1 材料与方法
试验于2015—2017年在中国农业科学院棉花研究所完成。
1.1 供试菌株及棉花材料
强致病力大丽轮枝菌Vd080(菌种保藏号:CGMCC No.5904)分离自中国河北省辛集市病棉,保存于中国农业科学院棉花研究所棉花病害实验室;试验选用棉花耐病品种鲁棉研21号。
1.2 培养基
LB培养基、Czapek培养基、PDA培养基、富集培养基(0.5% polypepton+100 g konjac curds)利用魔芋精粉(konjac curds)作为唯一碳源,魔芋精粉主要成分为葡苷聚糖,通过-1,4糖苷键将D-葡萄糖和D-甘露糖按(1.6—2.0)﹕1结合形成的线性随机共聚物[17-19],真菌细胞壁主要成分几丁质也是通过-1,4糖苷键聚合-乙酰葡糖胺形成的线性聚合物[20],能够利用葡甘聚糖作为碳源的细菌也具有水解几丁质-1,4糖苷键的活性。
1.3 解葡苷聚糖内生细菌的分离
选取健康棉株去皮,在超净工作台中用75%乙醇消毒1 min,无菌水洗涤3次,3%次氯酸钠消毒3 min,无菌水洗涤3次,剪碎,在灭菌研钵中加少量无菌水研磨,将研磨液涂布于富集培养基上,37℃恒温培养箱培养24 h,挑取单菌落继续在富集培养基上进行纯培养。
1.4 解葡苷聚糖内生细菌的鉴定
利用Omega公司的Bacterial DNA Kit试剂盒提取内生细菌的基因组DNA,利用16S rDNA的通用引物1492R(5′-GGTTACCTTGTTACGACTT-3′)和27F(5′-AGAGTTTGATCCTGGCTCAG-3′)进行PCR扩增,将扩增序列在GENEWIZ公司进行测序,将测序结果与EZ taxon数据库中的序列进行同源性比对,利用ClustalX和Mega软件将测序结果与同源性相近的菌株构建系统发育树。
1.5 内生细菌对大丽轮枝菌拮抗作用的检测
1.5.1 对峙培养法测定内生细菌对大丽轮枝菌的影响 将筛选到的YUPP-10在LB固体平板上活化,选取单菌落接种到LB液体培养基中,置于37℃,200 r/min振荡培养箱中培养24 h作为菌种,以1%接种量接种YUPP-10,37℃,200 r/min振荡培养24 h,获得YUPP-10培养液备用。在PDA平板培养基中心接种已经活化的直径为5 mm的Vd080菌饼,呈三角状对称在PDA平板中打孔,每孔距离中心20 mm,在其中两孔接入100 μL YUPP-10培养液,剩余一孔加入100 μL LB液体培养基作为对照,单独接种Vd080作为空白对照,每个处理重复3次,25℃恒温培养观察抑菌情况,7 d后测量抑菌带宽。
1.5.2 对扣培养法[21]测定内生细菌挥发性代谢产物对大丽轮枝菌的影响 在PDA平板培养基中心接种已经活化的直径为5 mm的Vd080菌饼,在LB固体平板上接种20 μL已经活化的YUPP-10培养液(培养液制备方法同1.5.1),将两个平板对扣密封,25℃恒温培养箱中培养10 d。以病原菌与空白的LB平板对峙培养作为对照,每个处理重复3次。利用十字交叉法测定病原真菌菌落直径,计算抑制率。菌落直径(cm)=测量菌落直径-0.5;相对抑制率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100。
1.5.3 悬滴法[22]测定内生细菌非挥发性代谢产物对大丽轮枝菌孢子萌发的影响 将内生细菌培养液(培养液制备方法同1.5.1)在4℃,5 000 r/min离心10 min,用0.22 μm的滤芯过滤上清液除菌。取无菌滤液原液、1/2稀释液和1/4稀释液100 μL,与等量的Vd080孢子悬浮液(2×103cfu/mL,Czapek培养液)均匀混合,取20 μL悬滴于凹玻片上,在25℃下保湿培养,3 h后镜检孢子萌发情况,以LB培养液与Vd080孢子悬浮液的等体积混合液为对照,每处理重复3次。
1.5.4 混合培养法测定内生细菌非挥发性代谢产物对大丽轮枝菌菌核萌发的影响 微菌核的培养及其悬浮液的制备参照Hu等的方法[23-24]。取100 μL微菌核悬浮液与等量的YUPP-10无菌滤液(细菌无菌滤液制备同方法1.5.3),置于20℃下培养24 h后镜检,检测其萌发率,每处理重复3次,每次观察100个微菌核的萌发情况。微菌核长出的芽管长度超过微菌核直径的一半视为萌发。
1.6 内生细菌对棉花黄萎病防治效果的测定
装有玉米蛭石(质量比1﹕1)培养基的克氏瓶灭菌后,接种15 mL活化的细菌菌种(菌种的制备方法同1.5.1),在37℃恒温培养72 h,取出培养物,自然风干制成微生物菌剂。将菌剂按1%、2%和4%的质量比与蛭石沙土基质均匀混合,制作营养钵。纸钵制作、棉苗培育和病原菌的接种方法参照蛭石沙子无底纸钵定量蘸菌液法[25]。将3%次氯酸钠消毒的鲁棉研21号浸种12 h,以每钵8粒种子的密度种植在营养钵中。每6个营养钵为一个处理,每处理重复4次,以蛭石沙土基质混合无菌培养物的营养钵为对照。在温度为23—30℃,相对湿度60%以上的日光温室中培养17 d后,待一片真叶初现时每钵接种10 mL Vd080孢子悬浮液(1×107cfu/mL,Czapek培养液)。接种病原菌25 d后调查病情,参照赵丽红等[26]5级分级标准进行病情的调查统计,计算病情指数和防治效果,同时剖杆观察维管束褐变情况。病情指数=[ Σ (级数×每级的病株数) / (调查的总株数×4) ]×100;防治效果(%)=[ (对照病情指数-处理病情指数) / 对照病情指数]×100。
1.7 内生细菌诱导棉花抗性的检测
1.7.1 浸种诱导抗性 经3%次氯酸钠消毒的鲁棉研21号棉籽在细菌培养液(OD600=0.2)(细菌培养液的制备方法同1.5.1)中浸种18 h,用无菌水洗涤3次,置于培养皿中25℃保湿培养,2 d后在培养皿中接种1 mL Vd080孢子悬浮液(1×104cfu/mL),继续培养3—4 d后观察根部损伤程度。以LB培养基浸种作为对照。将棉苗根部纵切,虎红染液(含虎红1%的1 mol·L-1NaOH溶液)染色1 min,光学显微镜下镜检。
1.7.2 灌根诱导抗性 鲁棉研21号经3%次氯酸钠消毒后,在无菌水中浸种催芽24 h,播种于灭菌的蛭石沙土培养基中,待长到3片真叶时,用细菌培养液(细菌培养液的制备方法同1.5.1)灌根处理,48 h后取真叶进行表面消毒,置于水琼脂平板中,在叶片表面接种Vd080菌饼,25℃恒温培养7 d,观察叶面损伤情况。以LB培养基灌根作为对照,每处理重复3次。
1.8 内生细菌诱导棉花活性氧爆发的检测
棉苗的培养方法同1.7.2,长出2片真叶后,用细菌培养液(细菌培养液的制备方法同1.5.1)进行灌根处理,每处理重复3次,以LB液体培养基灌根处理为对照。48 h后取长势相近的叶片,将叶片用无菌水洗涤3次置于5 mL的离心管中,取适量3,3 -二氨基联苯胺(DAB)染液(1 mg·mL-1,pH 7.5),室温避光染色8 h;去除染液,加适量95%乙醇沸水浴2 min脱去叶绿素,去除液体,加适量无水乙醇在沸水浴中继续脱色,直至绿色完全去除;将叶片浸渍于70%甘油中,赶出叶片细胞间气泡,将叶片置于载玻片上镜检。
1.9 内生细菌诱导棉花细胞木质化的检测
棉苗的培育方法同1.7.2,待一片真叶初现时,用细菌培养液(细菌培养液的制备方法同1.5.1)进行灌根处理,以LB液体培养基灌根处理为对照,将处理和对照各分为两组,2 d后对照和处理的两个组分别接种Vd080孢子悬浮液和Czapek培养基,2 d后取长势相近的棉花,横切下胚轴,将切片置于载玻片上,用10%的间苯三酚染液(溶于无水乙醇中)染色2 min,用浓硫酸孵育片刻,置于光学显微镜下迅速观察拍照。
1.10 内生细菌诱导棉花防御相关基因表达的测定
棉花幼苗的培育、内生细菌的接种、Vd080的接种、取样、RNA的提取、cDNA第一链的合成和荧光定量PCR的方法参照张芸等[27]CEF-082对棉花黄萎病控制作用的研究过程。将棉花中高度保守的作为内参,棉花部分防御基因的特异引物见表1[28-29]。
1.11 数据处理与分析
试验数据采用SPSS 22.0软件进行统计分析。
2 结果
2.1 解葡苷聚糖内生细菌的分离鉴定
在富集选择培养基上成功获得一株能利用葡苷聚糖作为碳源的棉花内生细菌,提取所分离到的内生细菌总基因组DNA,利用16S rDNA通用引物进行PCR,将得到的扩增片段交由北京金唯智公司测序。测序结果与EZ taxon中的序列比对后,其与模式菌株ATCC 14579T(AE016877)的相似度达100%,验证可信度达100%,确定该内生细菌为一株蜡状芽孢杆菌,记为蜡状芽孢杆菌()YUPP-10(图1)。

表1 防御相关基因的特异引物
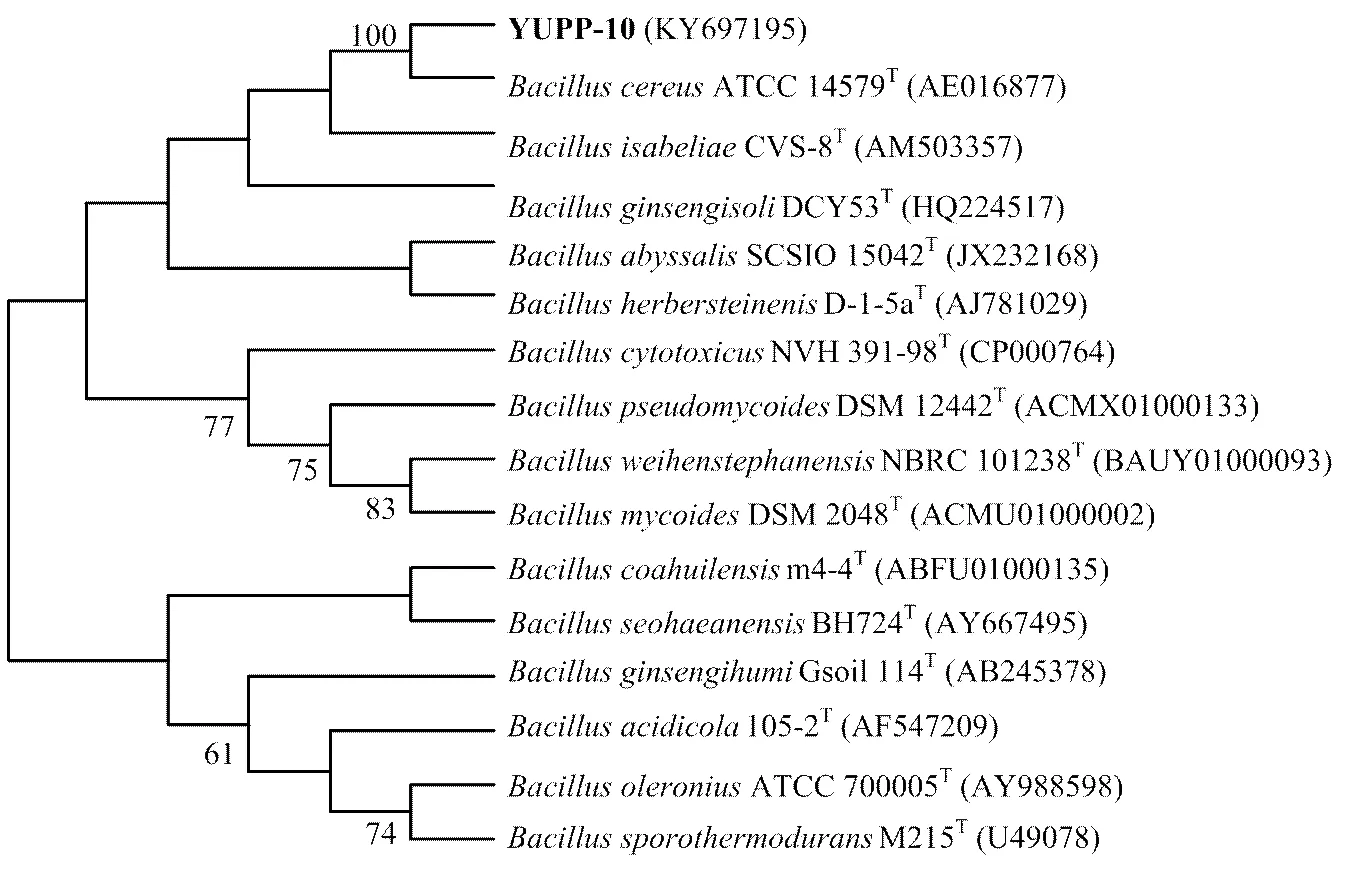
图1 基于YUPP-10 16S rDNA基因序列的系统发育树
2.2 YUPP-10对大丽轮枝菌的抑制作用
2.2.1 YUPP-10对大丽轮枝菌菌丝生长的抑制作用 平板对峙试验结果显示,空白对照中Vd080生长正常;而在接种细菌的处理中,菌落生长受到抑制,平均抑菌带宽为0.73 cm(图2)。表明代谢产物对大丽轮枝菌菌落生长有抑制作用。
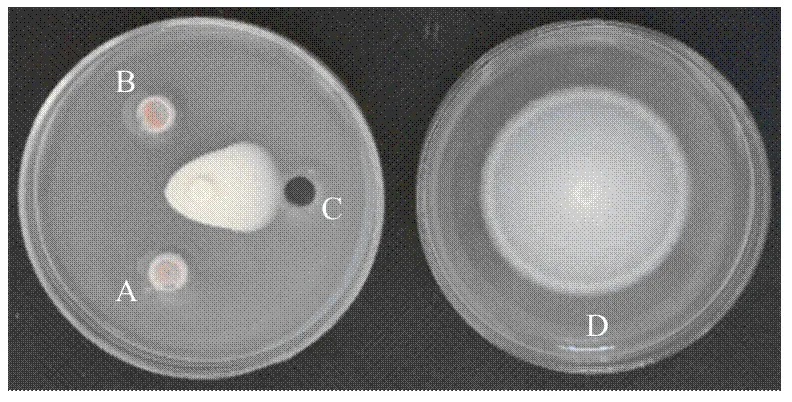
A、B:YUPP-10处理treated by YUPP-10;C:LB培养基处理treated by LB medium:D:空白对照only inoculated with Vd080 as blank control
2.2.2 YUPP-10挥发性代谢产物对大丽轮枝菌菌丝生长的抑制作用 平板对扣试验结果显示,在空白对照中Vd080生长正常,10 d后菌落直径为4.40 cm;而在处理中,菌落生长受到抑制,菌落边缘呈不规则锯齿状,菌丝生长抑制率达到77.33%,表明内生细菌挥发性代谢产物对大丽轮枝菌的生长具有显著的抑制作用(图3)。
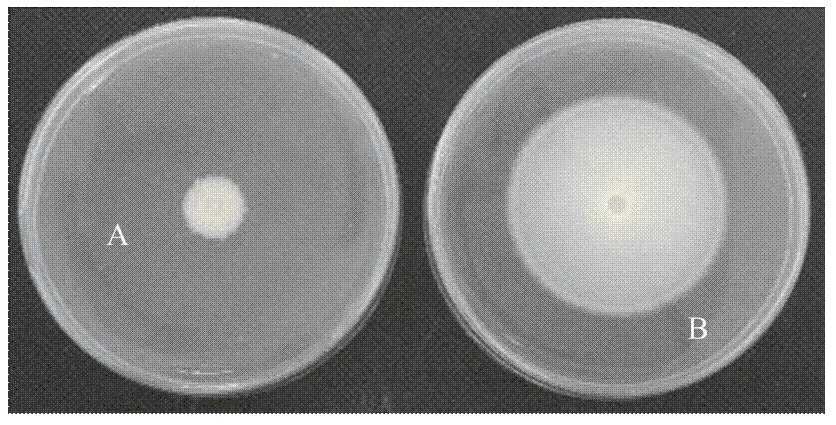
A:YUPP-10处理Inoculated with Vd080 and treated with YUPP-10;B:LB培养基处理Inoculated with Vd080 and treated with LB
2.2.3 YUPP-10对大丽轮枝菌孢子萌发的抑制作用 悬滴法培养孢子,3 h后通过光学显微镜观察孢子萌发情况,结果表明,对照组的孢子萌发率为59.21%,无菌滤液原液、1/2稀释液和1/4稀释液对孢子萌发的抑制率分别为71.25%、43.33%和17.22%,无菌滤液对大丽轮枝菌孢子萌发的抑制率在试验中的浓度范围内均表现出了显著差异,且孢子的萌发率与培养液的浓度呈线性关系(图4)。
2.2.4 YUPP-10对大丽轮枝菌微菌核萌发的抑制作用 混合培养微菌核与细菌培养无菌滤液,暗培养24 h,利用光学显微镜观察微菌核萌发情况,并计算萌发率。结果表明对照的萌发率为81.22%,原液、1/2稀释液和1/4稀释液的萌发抑制率分别为26.62%、19.92%和10.69%,其中无菌滤液原液和1/2稀释液对大丽轮枝菌微菌核萌发的抑制率与对照存在显著差异,1/4稀释液对微菌核萌发的影响与对照比差异不显著,且菌核萌发率与无菌滤液的浓度呈线性关系(图5)。
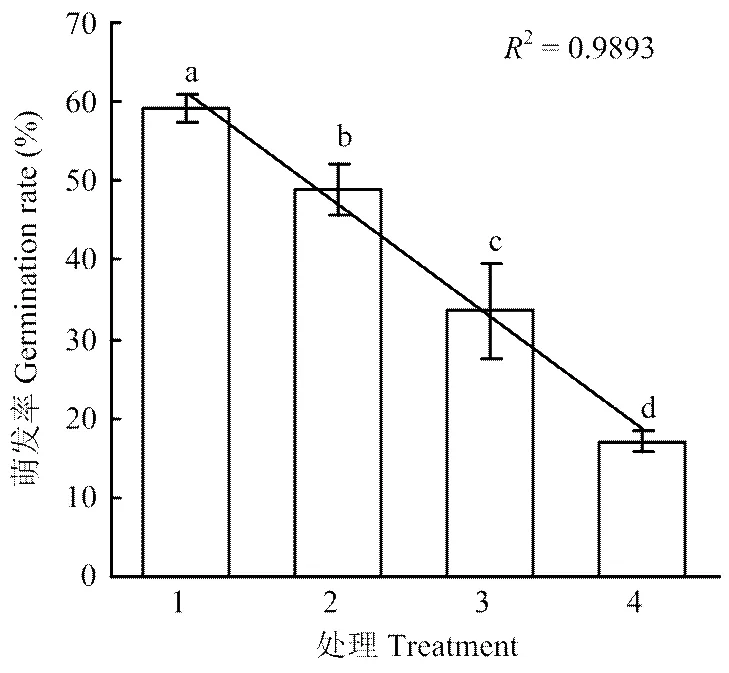
1:LB培养基LB medium;2:1/4稀释液1/4-fold dilution culture solution;3:1/2稀释液 1/2-fold dilution culture;4:原培养液 Original culture solution。不同小写字母表示差异显著(P<0.05)Different lowercases indicated significant difference at P<0.05 level。图5同 The same as Fig. 5
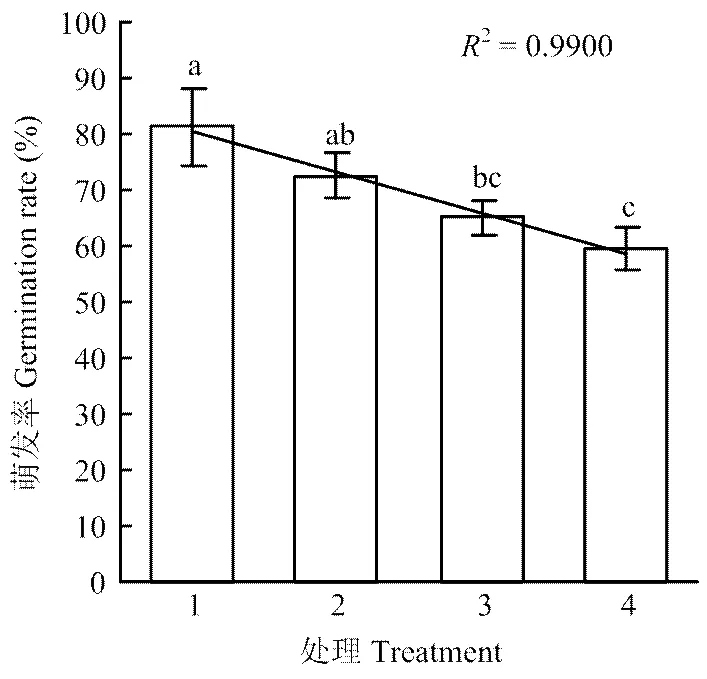
图5 YUPP-10对菌核萌发的影响
2.3 YUPP-10对棉花黄萎病的防治效果
在内生细菌菌剂拌土盆栽的结果中,菌剂处理与对照相比显著降低了棉花病株率和病情指数,防治效果最高达到80.60%(表2),鲁棉研21号为耐病品种,YUPP-10处理后使其达到抗性水平,说明YUPP-10对棉花黄萎病具有较好的防治效果。剖秆观察,YUPP-10处理后茎秆褐变程度明显低于对照(图6)。

图6 YUPP-10处理棉花对黄萎病的防治效果
2.4 YUPP-10诱导胚根抗大丽轮枝菌的侵染
YUPP-10浸种处理后,在恒温箱中保湿培养,2 d后接种Vd080,5 d后观察发现用YUPP-10浸种后的胚根,只有根尖部分被病原菌侵染坏死,而对照胚根3/4以上被伤害,坏死十分严重。同时,将胚根纵切用虎红染液染色后,YUPP-10处理的细胞中大丽轮枝菌定殖量明显低于对照(图7)。
2.5 YUPP-10诱导叶片抗大丽轮枝菌的侵染
YUPP-10灌根处理后,真叶经表面消毒置于水琼脂平板上,在叶片表面接种Vd080菌饼,7 d后观察到叶片表面有很少的菌丝附着,坏死面积很小,而对照中,叶片表面有大量菌丝定殖,损伤程度较重(图8)。
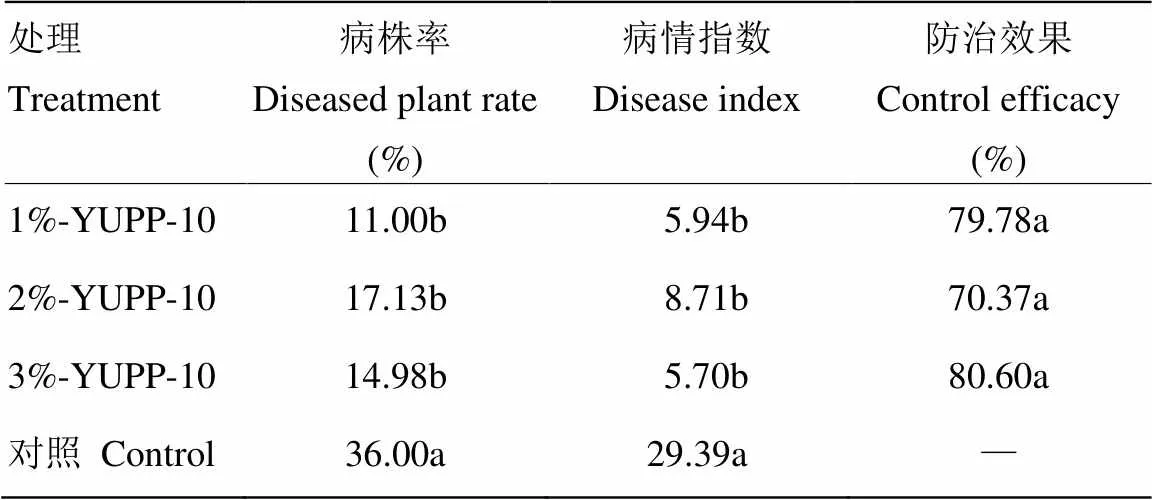
表2 YUPP-10菌剂处理对棉花黄萎病病株率、病情指数的影响及防治效果
同列数据后不同字母表示差异显著(<0.05) Data with different letters in the same column indicated significant difference at<0.05 level
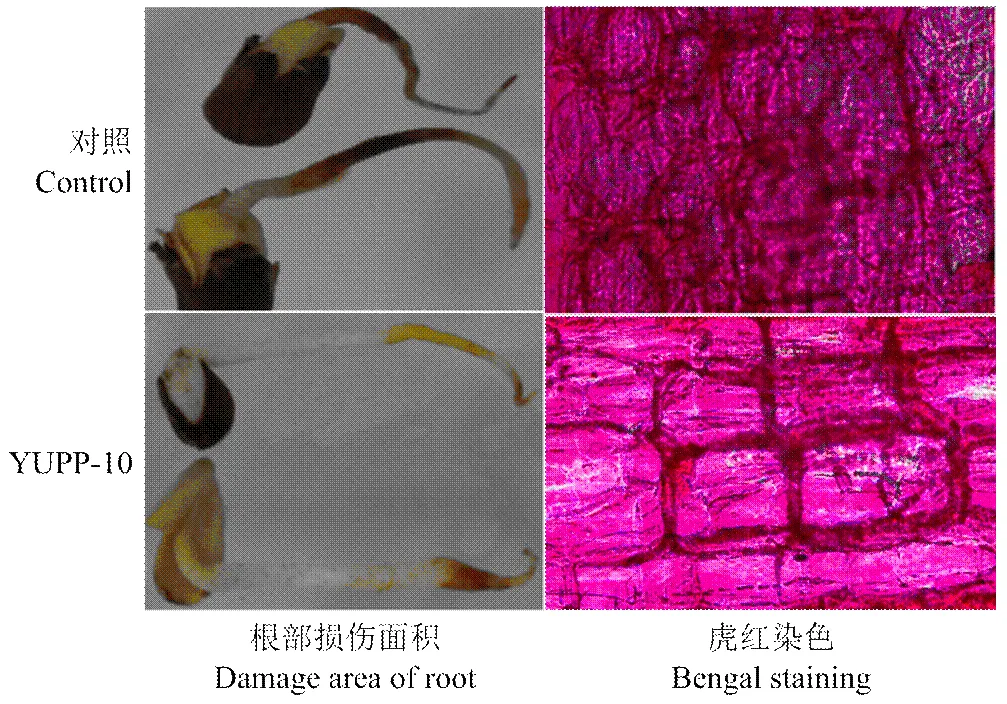
图7 YUPP-10诱导棉花抗大丽轮枝菌
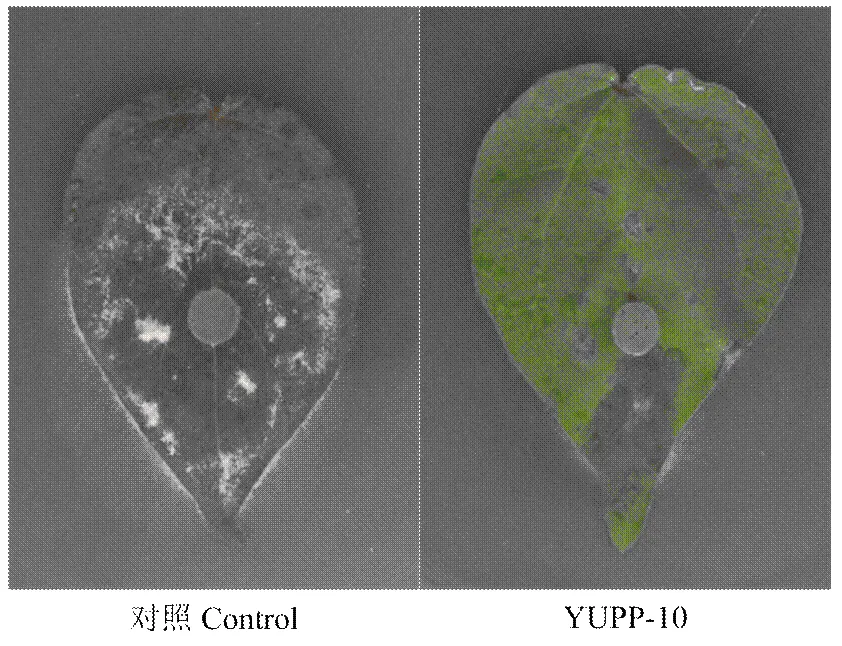
图8 YUPP-10诱导棉花叶片抗大丽轮枝菌
2.6 YUPP-10诱导叶片活性氧的爆发
使用DAB染色组织的方法检测叶片中活性氧的爆发,YUPP-10灌根处理的叶片观察到较多的褐色沉淀,而对照中,褐色沉淀较少,表明YUPP-10引起了棉花叶片活性氧的爆发(图9)。
2.7 YUPP-10诱导木质部的加厚
YUPP-10灌根处理后,将下胚轴横切用10%间苯三酚染色,浓硫酸孵育后立刻镜检观察YUPP-10处理后对棉花下胚轴细胞木质化的影响。通过光学显微镜观察到在用YUPP-10处理后,木质部明显加厚,接种Vd080孢子液后,幼苗木质部进一步加厚。说明YUPP-10和病原菌都可诱导木质部加厚,但在YUPP-10处理后,木质化更为明显,这对抵御黄萎病的侵染具有积极作用(图10)。
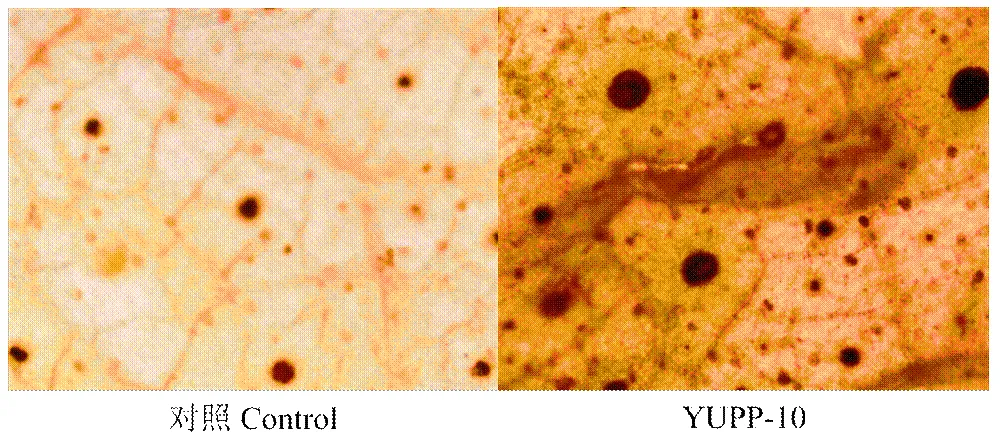
图9 YUPP-10引起棉花叶片活性氧爆发
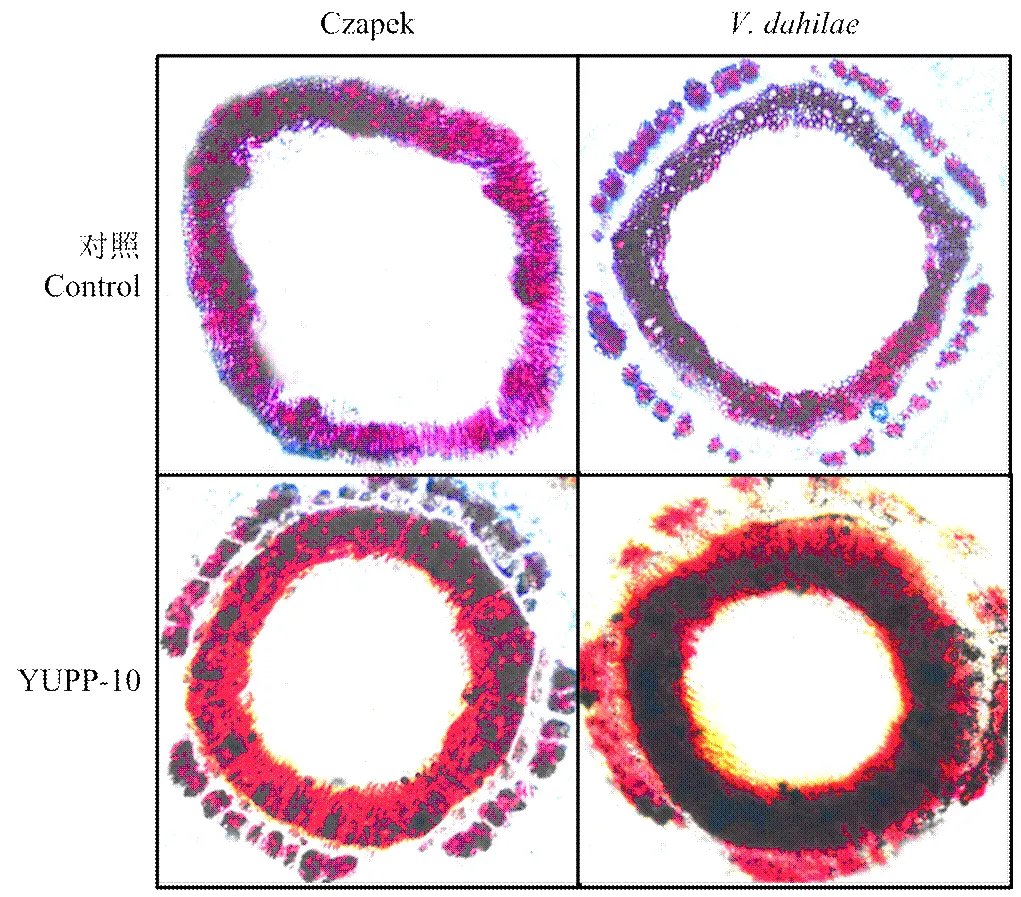
图10 棉花茎部细胞木质化
2.8 YUPP-10诱导棉花防御相关基因的表达
在YUPP-10处理4 d后接种Vd080孢子悬浮液,分别于接菌后12、24、48和72 h取样,提取棉花叶片RNA,通过qRT-PCR检测了苯丙氨酸解氨酶()、过氧化物酶()、多酚氧化酶()、丝裂原活化蛋白激酶()、几丁质酶()和病程相关基因()的表达。结果表明YUPP-10成功诱导了、、、和的表达,然而未检测到的荧光信号。其中,在接种Vd080后12 h表达量达到最大值,最高表达量为对照的11.0倍;、、和在接种Vd080后24 h表达量达到最大值,最高表达量分别是对照的8.8、4.3和4.3倍;在接种Vd080后48 h表达量达到最大值,最高表达量是对照的1.2倍(图11)。

CK为先用LB处理后接种Vd080;YUPP-10为先用YUPP-10培养液处理后接种Vd080。不同大写字母表示差异极显著(P<0.01) CK meant cotton first treated with LB medium, and then inoculated with Vd080. YUPP-10 meant cotton first treated with YUPP-10 culture solution, and then inoculated with Vd080. Different uppercases indicated extremely significant difference at P<0.01 level
3 讨论
本研究通过定向筛选能够降解葡苷聚糖的棉花内生细菌,成功从棉花维管束中分离到一株蜡状芽孢杆菌。鉴于葡苷聚糖的分子结构与真菌细胞壁几丁质结构类似,故该菌也具有破坏几丁质的能力,从而使所筛选的菌株对真菌病害具有广谱抑制能力。其属于棉花内生细菌,通过长期的植物与微生物协同进化,该内生细菌不会对棉花植株造成病变。有益的植物-微生物互作,促进植物的健康发展一直是重要的研究课题,而多数研究集中在根际细菌[5,30],YUPP-10分离自棉花维管束,相对于根际细菌定殖于根部起生防作用的特点,YUPP-10能成功定殖于棉花维管束中起作用,对棉花土传维管束病害-黄萎病的防治具有突出优势。在研究生防菌的同时评估新物种对原有微环境的危害十分重要[31],植物内生细菌对植物本身而言并非“新”物种,故而不会对寄主植物造成危害。棉花内生蜡状芽孢杆菌在棉花黄萎病的防治应用中报道较少,而所筛选的内生细菌用于本寄主病害的防治,有利于生防菌在植物体内定殖,具有现实的研究意义。
生防菌通过种间或种内的相互作用关系来实现对病害的控制,如竞争、寄生、溶菌作用、通过次生代谢产物抗菌、诱导寄主产生系统抗病性、促进植物生长、提高植物防御力和调节寄主的微生态环境等途径。大多情况下一种生防菌可同时通过多种防御机制实现对病害的有效控制。本研究中YUPP-10的代谢产物对大丽轮枝菌菌丝的生长、孢子的萌发和微菌核的萌发均有显著的抑制作用。但对微菌核萌发的抑制率最高只有26.62%,这可能与微菌核的形态结构有关,微菌核作为一种休眠体,其表皮细胞壁厚且坚硬,具有极强的抗逆能力,故而杀死微菌核较为困难。蜡状芽孢杆菌可通过产生抗生素来抵抗病原菌,如硫醚抗生素[13],也可产生各种酶来对病原菌进行有效控制,如溶菌酶[32]。然而对于YUPP-10的关键抑菌物质的成分尚未明确,从其能够利用葡苷聚糖作为碳源的代谢方式推想,该菌可能分泌一种能够降解-1,4糖苷键的酶,这种酶在降解病原真菌细胞壁的过程中起着重要的作用,但这一推论还需试验证明。
微生物挥发性化合物与病原菌形成拮抗关系也有诸多报道,这些挥发性气体可作为抗生素直接抑制病原真菌菌丝的生长和孢子的萌发[33-34],但是这种情况在自然条件下几乎不可能发生,因为只有挥发性气体的浓度足够高才可能出现拮抗作用[35]。有研究表明植物根际微生物散发的挥发性化合物能引起植物的防御反应以达到抗病目的[36-37]。本研究发现YUPP-10的挥发性气体对大丽轮枝菌菌丝的生长有显著的抑制作用,YUPP-10能否激发植物系统抗病性还有待进一步的研究。
在本研究设计的3个菌剂浓度中,YUPP-10对棉花黄萎病都表现出了理想的防治效果,表明其有用作大田病害防治的潜能。在土传病害的防治中,作物轮作、抗性品种选育和化学防治,不足以控制重要作物病害的发生[38],因此生物制剂成为替代化学农药最为环保的选择[39],也是补充现有防治措施不足的重要选择。目前,已有蜡状芽孢杆菌ANTI-8098A获得生物农药登记,其对青枯病具有较好的防治效果,本研究发现的蜡状芽孢杆菌对黄萎病菌高度拮抗,将进一步研究其对棉花生育期其他病害的防治效果,并结合现有栽培技术,提供更为简洁高效的使用方式,以期在大田中实现对棉花病害的防治。
生防菌防治植物病害的一个重要方式是激发植物自身的免疫应答机制,可被有益微生物通过局部激发植物体对病原菌的广谱抗性[40],即诱导系统抗病性。其次植物也可被病原菌激发系统获得抗病性[41],二者均可增强植物的基础抗性。活性氧作为一种信号分子,在引起抗性方面具有重要作用[42],木质素被视为阻止病原菌生长的重要屏障[43]。YUPP-10培养液浸种处理后,显著降低了大丽轮枝菌对供试棉花胚根的侵染,减少了大丽轮枝菌在胚根中的定殖。在用YUPP-10灌根处理后,其成功诱导下胚轴细胞的木质化和叶片活性氧的爆发。PAL、POD和PPO作为防御酶,可催化或参与植物木质素和酚类化合物的合成,这些酚类和木质素类物质与植物形成抵抗病原菌的屏障有关,本研究中发现用YUPP-10处理后,供试棉花中3种防御酶在病原菌侵染初期表达量会显著升高,并在病原菌侵染24 h达到最大值。PR10蛋白具有核酸酶相似结构和活性,该酶能有效提高植物的抗病能力,本研究中在接种病原菌12 h后开始持续大量表达,在48 h后达到最大值。CHI是植物防御反应中的重要防卫因子,通过降解病原真菌菌丝体的细胞壁几丁质达到抑制菌丝生长的目的,YUPP-10处理后的棉花在受到大丽轮枝菌侵染后,的表达量在12 h时急剧上升,随后有所下降,但在48 h内表达量显著高于对照。被认为是水杨酸(SA)信号通路的标志基因[44],YUPP-10诱导大量表达,表明其在诱导植物抗病能力的过程中激活了SA信号通路,至于YUPP-10是否对乙烯(ET)和茉莉酸甲酯(JA)信号通路有影响,还有待研究。另外,YUPP-10在诱导植物系统抗病性的完整通路还需进一步的探索。
4 结论
棉花内生蜡状芽孢杆菌YUPP-10能有效抑制棉花黄萎病菌菌丝的生长、孢子和微菌核的萌发,其挥发性代谢产物同样能抑制病原菌菌丝的生长。此外,YUPP-10成功诱导了棉花胚根和叶片抗病原菌的侵染,同时引起了活性氧的爆发、细胞木质化及防御相关基因的表达,说明YUPP-10通过直接抑制病原菌生长和诱导植物产生防御反应,抵御病原菌在棉花体内侵染和扩展,而达到防治黄萎病的目的。
References
[1] Zhang Z, Zhao J, Ding L, Zou L, Li Y, Chen G, Zhang T. Constitutive expression of a novel antimicrobial protein, Hcm1, confers resistance to both Verticillium and Fusarium wilts in cotton., 2016, 6: 20773.
[2] Holliday P, Holliday P.. New York: Cambridge University Press, 2001.
[3] Schulz B, Boyle C.? //Microbial Root Endophytes. Berlin: Springer, 2006.
[4] Ryan R P, Germaine K, Franks A, Ryan D J, Dowling D N. Bacterial endophytes: recent developments and applications., 2008, 278(1): 1-9.
[5] Berg G, Eberl L, Hartmann A. The rhizosphere as a reservoir for opportunistic human pathogenic bacteria., 2005, 7(11): 1673-1685.
[6] 李社增, 鹿秀云, 马平, 高胜国, 刘杏忠, 刘干. 防治棉花黄萎病的生防细菌NCD-2的田间效果评价及其鉴定. 植物病理学报, 2005, 35(5): 451-455.
Li S Z, Lu X Y, Ma P, Gao S G, Liu X Z, Liu G. Evaluation of biocontrol potential of a bacterial strain NCD-2 against cotton verticillium wilt in field trials., 2005, 35(5): 451-455. (in Chinese)
[7] Li B, Li Q, Xu Z, Zhang N, Shen Q, Zhang R. Responses of beneficialSQR9 to different soilborne fungal pathogens through the alteration of antifungal compounds production., 2014, 5: 636.
[8] Pereg L, Mcmillan M. Scoping the potential uses of beneficial microorganisms for increasing productivity in cotton cropping systems., 2015, 80: 349-358.
[9] Pleban S, Chernin L, Chet I. Chitinolytic activity of an endophytic strain of., 1997, 25(4): 284-288.
[10] Li J G, Jiang Z Q, Xu L P, Sun F F, Guo J H. Characterization of chitinase secreted bystrain CH2 and evaluation of its efficacy against Verticillium wilt of eggplant., 2008, 53(6): 931-944.
[11] Kishore G K, Pande S. Chitin-supplemented foliar application of chitinolyticreduces severity of Botrytis gray mold disease in chickpea under controlled conditions., 2007, 44(1): 98-105.
[12] Hammami I, Siala R, Jridi M, Ktari N, Nasri M, Triki M A. Partial purification and characterization of chiIO8, a novel antifungal chitinase produced byIO8., 2013, 115(2): 358-366.
[13] Wang J, Zhang L, Teng K, Sun S, Sun Z, Zhong J. Cerecidins, novel lantibiotics fromwith potent antimicrobial activity., 2014, 80(8): 2633-2643.
[14] Niu D D, Liu H X, Jiang C H, Wang Y P, Wang Q Y, Jin H L, Guo J H. The plant growth-promoting rhizobacteriumAR156 induces systemic resistance inby simultaneously activating salicylate- and jasmonate/ethylene-dependent signaling pathways., 2011, 24(5): 533-542.
[15] Gong C, Liu Y, Liu S Y, Cheng M Z, Zhang Y, Wang R H, Chen H Y, Li J F, Chen X L, Wang A X. Analysis of-induced resistance to grey mould disease and identification of the key proteins induced in tomato fruit., 2017, 123: 83-93.
[16] Huang C J, Tsay J F, Chang S Y, Yang H P, Wu W S, Chen C Y. Dimethyl disulfide is an induced systemic resistance elicitor produced byC1L., 2012, 68(9): 1306-1310.
[17] Katsuraya K, Okuyama K, Hatanaka K, Oshima R, Sato T, Matsuzaki K. Constitution of konjac glucomannan: chemical analysis and13C NMR spectroscopy., 2003, 53(2): 183-189.
[18] Fang W, Wu P. Variations of konjac glucomannan (KGM) fromand its refined powder in China., 2004, 18(1): 167-170.
[19] Lafarge C, Cayot N, Hory C, Goncalves L, Chassemont C, Le Bail P. Effect of konjac glucomannan addition on aroma release in gels containing potato starch., 2014, 64: 412-419.
[20] Pangburn S H, Trescony P V, Heller J. Lysozyme degradation of partially deacetylated chitin, its films and hydrogels., 1982, 3(2): 105-108.
[21] Whipps J M, Magan N. Effects of nutrient status and water potential of media on fungal growth and antagonist-pathogen interactions1., 1987, 17: 581-591.
[22] Li S K, Ji Z Q, Zhang J W, Guo Z Y, Wu W J. Synthesis of 1-acyl-3-isopropenylbenzimidazolone derivatives and their activity against., 2010, 58(5): 2668-2672.
[23] Hu X, Bai Y, Chen T, Hu D, Yang J, Xu X. An optimized method forproduction ofmicrosclerotia., 2013, 136(2): 225-229.
[24] López-Escudero F J, Mwanza C, Blanco-López M A. Reduction ofmicrosclerotia viability in soil by dried plant residues., 2007, 26(2): 127-133.
[25] 朱荷琴, 冯自力, 李志芳, 赵丽红, 师勇强. 蛭石沙土无底纸钵定量蘸菌液法鉴定棉花品种(系)的抗黄萎病性. 中国棉花, 2010(12): 15-17.
Zhu H Q, Feng Z L, Li Z F, Zhao L H, Shi Y Q. Dip quantitative fungal solution method by using vermiculite sand without bottom paper bowl to identify cotton varieties (lines) of resistance to Verticillium wilt., 2010(12): 15-17. (in Chinese)
[26] 赵丽红, 冯自力, 李志芳, 冯鸿杰, 师勇强, 张芸, 朱荷琴. 棉花抗黄萎病鉴定与评价标准的商榷. 棉花学报, 2017, 29(1): 50-58.
Zhao L H, Feng Z L, Li Z F, Feng H J, Shi Y Q, Zhang Y, Zhu H Q. Development of an improved standard for identifying and evaluating verticillium wilt resistance in cotton., 2017, 29(1): 50-58. (in Chinese)
[27] 张芸, 冯自力, 冯鸿杰, 李志芳, 师勇强, 赵丽红, 朱荷琴, 杨家荣. 内生球毛壳属真菌CEF-082对棉花黄萎病的控制作用. 植物病理学报, 2016, 46(5): 697-706.
Zhang Y, Feng Z L, Feng H J, Li Z F, Shi Y Q, Zhao L H, Zhu H Q, Yang J R. Control effect of endophytic fungusCEF-082 against Verticillium wilt in., 2016, 46(5): 697-706. (in Chinese)
[28] Wubben M J, Callahan F E, Hayes R W, Jenkins J N. Molecular characterization and temporal expression analyses indicate that the MIC (Meloidogyne Induced Cotton) gene family represents a novel group of root-specific defense-related genes in upland cotton (L.)., 2008, 228(1): 111-123.
[29] Han Q, Wu F, Wang X, Qi H, Shi L, Ren A, Liu Q, Zhao M, Tang C. The bacterial lipopeptide iturins inducecell death by affecting fungal signalling pathways and mediate plant defence responses involved in pathogen-associated molecular pattern-triggered immunity., 2015, 17(4): 1166-1188.
[30] Kuiper I, Lagendijk E L, Bloemberg G V, Lugtenberg B J. Rhizoremediation: a beneficial plant-microbe interaction., 2004, 17(1): 6-15.
[31] Roderick G K, Hufbauer R, Navajas A M. Evolution and biological control., 2012, 5(5): 419-423.
[32] Nakamura N, Nakano K, Sugiura N, Matsumura M. A novel cyanobacteriolytic bacterium,, isolated from a Eutrophic Lake., 2003, 95(2): 179-184.
[33] Kai M, Effmert U, Berg G, Piechulla B. Volatiles of bacterial antagonists inhibit mycelial growth of the plant pathogen., 2007, 187(5): 351-360.
[34] Vespermann A, Kai M, Piechulla A B. Rhizobacterial volatiles affect the growth of fungi and., 2007, 73(17): 5639-5641.
[35] Sharifi R, Ryu C M. Are bacterial volatile compounds poisonous odors to a fungal pathogen, alarm signals toseedlings for eliciting induced resistance, or both?, 2016, 7: 196.
[36] Song G C, Ryu C M. Two volatile organic compounds trigger plant self-defense against a bacterial pathogen and a sucking insect in cucumber under open field conditions., 2013, 14(5): 9803-9819.
[37] Thimmaraju R, Meredith L B, Kunjeti S G, Donofrio N M, Czymmek K J, Paré P W, Bais H P. The rhizobacterial elicitor acetoin induces systemic resistance in., 2010, 3(2): 130-138.
[38] Johri B N, Sharma A, Virdi J S. Rhizobacterial diversity in India and its influence on soil and plant health., 2003, 84: 49-89.
[39] González-Sánchez M Á, Vicente A D, Pérez-García A, Pérez-Jiménez R, Romero D, Cazorla F M. Evaluation of the effectiveness of biocontrol bacteria against avocado white root rot occurring under commercial greenhouse plant production conditions., 2013, 67(2): 94-100.
[40] Pieterse C M J, Zamioudis C, Berendsen R L,Weller D M, Van Wees S C, Bakker P A. Induced systemic resistance by beneficial microbes., 2014, 52: 347-375.
[41] Boller T, Felix G. A renaissance of elicitors: perception of microbe-associated molecular patterns and danger signals by pattern-recognition receptors., 2009, 60: 379-406.
[42] Borges A A, Jiménezarias D, Sandalio L M, Pérez J A. Priming crops against biotic and abiotic stresses: MSB as a tool for studying mechanisms., 2014, 5: 642.
[43] Bhuiyan N H, Selvaraj G, Wei Y, King J. Gene expression profiling and silencing reveal that monolignol biosynthesis plays a critical role in penetration defence in wheat against powdery mildew invasion., 2009, 60(2): 509-521.
[44] Wang N, Liu M, Guo L, Yang X, Qiu D. A novel protein elicitor (PeBA1) fromNC6 induces systemic resistance in tobacco., 2016, 12(6): 757-767.
(责任编辑 岳梅)
Biocontrol effect and mechanism of cotton endophytic bacteriumYUPP-10 against Verticillium wilt in
ZHOU Jinglong1,2, FENG Zili2, FENG Hongjie2, LI Yunqing2, YUAN Yuan2, LI Zhifang2, WEI Feng2, SHI Yongqiang2, ZHAO Lihong2, SUN Zhengxiang1, ZHU Heqin2, ZHOU Yi1
(1College of Agriculture, Yangtze University, Jingzhou 434025, Hubei;2Institute of Cotton Research of Chinese Academy of Agricultural Sciences/State Key Laboratory of Cotton Biology, Anyang 455000, Henan)
【Objective】Control of Verticillium wilt is a worldwide problem in agriculture and horticulture, screening of effective biocontrol microbial resources has become one of the important ways to control Verticillium wilt. The use of microbial antagonists to control these pathologies fits modern sustainable agriculture criteria. The objective of this study is to screen an efficient antagonistic bacteria, and characterize the biocontrol mechanism of bacteria against Verticillium wilt, thus providing a technical basis for control of Verticillium wilt of cotton with biocontrol bacteria. 【Method】An endophytic bacterium, which can hydrolyze polysaccharides with-1,4 linkage, was isolated by enrichment medium, which was made of konjac glucomannan as carbon source. The inhibition and prevention of YUPP-10 againstand Verticillium wilt were tested. The inhibition rate of YUPP-10 againstwas assessed using the confront culture method, enclosed chamber test and hanging drop method, cultured microsclerotia with aseptic culture filtrate, and the control effect of cottonon Verticillium wilt was detected by substrate inoculation method in a pot experiment. Induced disease resistance of YUPP-10 in cotton were analysed by embryo and leaves inoculated with, sedimentation of lignin and reactive oxygen species (ROS). In addition, the expression level of defense genes inleaves were detected by real-time quantitative PCR (qRT-PCR). 【Result】Aisolate YUPP-10 was screened. The results showed that YUPP-10 and its volatile organic compounds significantly inhibited the colony growth ofwith the width of the inhibition zone of YUPP-10 was 0.73 cm after 7 days, and the inhibition rate of volatile organic compounds of YUPP-10 was 77.03% after 10 days.YUPP-10 culture filtrate (CF) suppressedspore and microsclerotia germination in a dose-dependent manner. The inhibition rate of CF onspore and microsclerotia germination ranged from 17.22% to 71.25% and 10.69% to 26.62%, respectively. The inhibition rate was 80.60%, when cotton seedlings were pro-inoculated with substrate containing YUPP-10 in a pot experiment. YUPP-10 induced disease resistance, including immature embryo and leaves against, ROS, sedimentation of lignin and some defense genes, such as,,,and.【Conclusion】It was concluded that YUPP-10 is an efficient biocontrol agent that protects cotton plant frominfection. Our data demonstrate thatgrowth is restricted and the additional signals from YUPP-10 must participate in the regulation of the immune response against. Therefore, the YUPP-10 has a great potential in controlling Verticillium wilt.
endophytic bacterium; Verticillium wilt; induced resistance; defense mechanism
2017-01-20;接受日期:2017-03-17
国家公益性行业(农业)科研专项(201503109)、中央级公益性科研院所基本科研业务费专项(1610162016012)
周京龙,E-mail:jing_long_z@163.com。冯自力,E-mail:fzlsky@126.com。周京龙和冯自力为同等贡献作者。通信作者周燚,E-mail:yiyizhzh@yahoo.com.cn。通信作者朱荷琴,E-mail:heqinanyang@sohu.com
