酱香型白酒酒糟中生香酵母的筛选及鉴定
2017-07-31蔡雪梅吴联海陈梦圆陈剑王坤玲杨柳罗爱民
蔡雪梅,吴联海,陈梦圆,陈剑,王坤玲,杨柳,罗爱民*
(1.四川大学轻纺与食品学院,四川成都610064;2.四川省古蔺郎酒厂有限公司,四川古蔺618200)
酱香型白酒酒糟中生香酵母的筛选及鉴定
蔡雪梅1,吴联海2,陈梦圆1,陈剑1,王坤玲1,杨柳2,罗爱民1*
(1.四川大学轻纺与食品学院,四川成都610064;2.四川省古蔺郎酒厂有限公司,四川古蔺618200)
从酱香型白酒酒糟中通过液态发酵初筛获得7株高产乙酸乙酯的菌株,将其进行固态发酵,其发酵产物经气相色谱(GC)检测共得到64种挥发性化合物,通过主成分分析表明,菌株Y3、Y19和Y22的发酵产物相似。其中,菌株Y3和Y19的乙酸乙酯产量显著高于其他菌株(P<0.05),其次是菌株Y22,但与对照组相比,菌株Y19的吡嗪产量显著减少(P<0.05),菌株Y22的高级醇产量显著增加(P<0.05),均不利于酱香型白酒的生香呈味。故最终选用菌株Y3为生香酵母,通过菌种鉴定,确定该菌株为毕赤酵母(Pichia kudriavzevii)。
酱香型白酒;酒糟;生香酵母;筛选;乙酸乙酯
酱香型白酒是我国传统白酒三大基本香型之一,在其酿造过程中,酵母的种类和数量对酱酒的风味和品质有重要的影响[1-2],根据酵母的功能,可分为酿酒酵母和生香酵母[3]。酿酒酵母具有较强的发酵产酒精能力[4],而生香酵母则对酸、醇有不同程度的酯化能力,生产代谢以酯香为主的多种风味化合物,是酯的主要来源,这些香味物质是产生酒体芳香及促进酒体丰满的关键化合物[5]。生香酵母所产的酯类中以乙酸乙酯为主,乙酸乙酯主要表现为水果香和甜香,对酱香型白酒香气贡献较大[6-7],通过向酒糟中添加筛选得到生香酵母可提高白酒中乙酸乙酯的含量,提升酱香型白酒的品质。
酱香型白酒“四高两长”的独特酿造工艺造就了大曲和酒糟中特殊的微生物体系[8],高温大曲是细菌的主要的来源,而酵母主要来源于酒糟摊凉的地面和空气[9],酒糟经过堆积之后,微生物得到大量富集。因此本研究从堆积后的酒糟中进行生香酵母的筛选。以乙酸乙酯为主要评介指标,利用液态单菌发酵进行初筛,再模拟工厂加入高温大曲进行固态发酵,目的是筛选得到适宜应用于酱酒生产的生香酵母。
1 材料与方法
1.1 材料与试剂
酒糟:采集于四川二郎镇某名优酒厂酱香型白酒车间第四轮正常堆积后的酒糟;大曲:取自同一酒厂的高温成品大曲;糠壳:取自同一酒厂;高粱:市售;乙酸、甘油、无水氯化钙(均为分析纯):成都市科龙化工试剂厂。
WL营养琼脂培养基:酵母膏4.0 g/L,蛋白胨5.0 g/L,葡萄糖50.0 g/L,磷酸二氢钾0.55 g/L,氯化钾0.425 g/L,氯化钙0.125 g/L,硫酸镁0.125 g/L,氯化铁0.002 5 g/L,硫酸锰0.0025g/L,琼脂20.0g/L,溴甲酚绿0.022g/L,调pH值至6.5。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)固体培养基:酵母膏10.0 g/L,葡萄糖20.0 g/L,琼脂20.0 g/L,蛋白胨20.0 g/L。
YPD液体培养基:酵母膏10.0 g/L,葡萄糖20.0 g/L,蛋白胨20.0 g/L。
孟加拉红培养基:蛋白胨5.0 g/L,葡萄糖10.0 g/L,磷酸二氢钾1.0 g/L,硫酸镁0.5 g/L,琼脂20.0 g/L,孟加拉红0.033 g/L,氯霉素0.1 g/L。121℃高压灭菌20 min,备用。
液体发酵培养基:YPD培养基中添加葡萄糖10%、乙酸0.5%、体积分数95%的乙醇5%,调整pH为4.0。
上述培养基均在121℃高压灭菌20 min,备用。
固态发酵培养基:整粒高粱/粉碎高粱=7∶3,润洗浸泡2 h,高温蒸4 h,无菌环境中摊凉后加入27%去杂稻壳。1.2仪器与设备
IKAVORTEX1振荡仪:莱贝(上海)科学仪器有限公司;JA1203分析天平:上海楚定分析仪器有限公司;TGL20M-Ⅱ冷冻离心机:湖南凯达科学仪器有限公司;MJPS-250型生化培养箱:上海欧史拓尔实业(集团)有限公司;GC-2010气相色谱仪:美国安捷伦科技(中国)有限公司。
1.3 方法
1.3.1 生香酵母的分离与纯化
称取25 g混匀的酒糟于225 mL无菌生理盐水中,120 r/min常温振荡30 min,吸取上清液稀释至10-4倍,取0.1 mL均匀涂布于添加80 mg/L氯霉素的YPD固体培养基表面,30℃培养48 h,挑取长势良好的单菌落划线转接到WL营养琼脂培养基上,30℃条件下培养72 h,长出的单菌落再次划线至完全纯化。
1.3.2 菌种保存
将分离纯化得到的酵母菌编号,并转接于YPD固体斜面培养基4℃保存备用。同时,再接种单菌落到YPD液体培养基中,30℃、120r/min振荡培养24h,添加等体积的50%无菌甘油,混匀后分装入2.0mL无菌EP管中,-20℃长期保存。
1.3.3 菌悬液的制备
酵母菌在YPD液体培养基中活化后,用无菌水稀释,采用紫外分光光度法,调节光密度OD560nm值为0.5左右,使其菌含量相等,备用。
1.3.4 挥发性化合物的提取
称取25.00 g样品于150 mL磨口三角瓶中,加入1%的无水CaCl2、50 mL的体积分数为57%乙醇溶液,浸泡摇匀,在25℃条件下经超声波浸提60 min后,10 000 r/min离心10 min提取上清液,做3个平行样,将得到的上清液合并,用0.22 μm滤膜过滤,得到待测样品。
1.3.5 气相色谱条件
采用毛细管气相色谱(gas chromatograph,GC)法,氢火焰离子化检测器检测样品,以标准品保留时间定性,叔戊醇、乙酸正戊醇和2-乙基丁酸作内标定量。其色谱条件:CPWAX弹性石英毛细管柱(50.0 m×0.25 mm×0.25 μm)分离;载气为高纯氮气(N2),流速为0.9mL/min;氢火焰离子化检测器(flame ionization ditector,FID)温度230℃;升温程序:起始温度40℃,5min平衡时间,以3℃/min升温至100℃,维持2 min,再以10℃/min升温至210℃,维持30 min;不分流。每检测15个样品后用体积分数为60%的乙醇溶液洗脱毛细管柱。
1.3.6 生香酵母的筛选
初筛(液态发酵):将制备好的菌悬液以2%接种量接种于装液量为100 mL/250 mL液体发酵培养基中,30℃、120r/min条件下培养5d。发酵结束后,将发酵液于4000r/min条件下离心15 min,取上清液用0.22 μm细菌滤膜过滤,待气相色谱检测。
复筛(固态发酵):将固态发酵培养基的水分控制在50%左右,添加3%乙酸,11%大曲,2%酵母菌悬液,拌匀后每300 g分装入1 000 mL无菌锥形瓶中,八层纱布封口,置于恒温恒湿(相对湿度10%)培养箱中培养4 d,第0~4天培养温度分别为:30℃、35℃、40℃、45℃。发酵结束后,参照1.3.3的方法提取挥发性化合物,待气相色谱法检测。
1.3.7 菌株鉴定
(1)菌株形态学鉴定
细胞形态观察:接种酵母菌到YPD液体培养基中,于30℃、120 r/min条件下培养24 h。将活化后的酵母菌制片在40倍下观察细胞形态。
菌落形态观察:将酵母菌划线转接于WL营养琼脂培养基中,30℃条件下培养72 h后观察其在WL营养琼脂培养基上颜色、大小、质地、凸起程度、边缘是否整齐、表面是否光滑等菌落形态特征。
(2)菌株18S rDNA鉴定
真菌基因组DNA提取使用成都福际生物技术有限公司土壤DNA试剂盒。用以下引物对菌株DNA进行聚合酶链反应(polymerase chain reaction,PCR)扩增:ITS1:5′-TCCG TAGGTGAACCTGCGG-3′;ITS4:5′-TCCTCCGCTTATTG ATATGC-3′;PCR扩增体系(50 μL):25 μL MIX(0.1 UTaq聚合酶/μL,500 μmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP),20 mmol/L Tris-HCl/pH 8.3,100 mmol/L KCl,3 mmol/L MgCl2),19 μL ddH2O,2 μL ITS1,2 μL ITS4,2 μL DNA;PCR扩增反应条件:94℃预变性10 min:94℃变性1 min,53℃退火1 min,72℃延伸1 min,循环35次;72℃终延伸8 min,4℃保存。将PCR扩增产物送擎科生物(成都)进行序列测定,再将测序结果与GenBank数据库进行Blast比对分析,通过DNAMAN构建同源树。
1.3.8 数据分析
采用SPSS 19.0对酵母发酵产物风味化合物的检测结果进行主成分分析(principal component analysis,PCA)和方差分析。
2 结果与分析
2.1 生香酵母的初筛
通过对酒糟的分离纯化,结果见表1。由表1可知,共得到26株菌落形态和细胞形态不同的酵母菌株,将其分别进行液态发酵初筛,发酵液挥发性化合物进行GC检测,根据乙酸乙酯含量,选出7株乙酸乙酯产量较高的菌株,其编号分别为Y22、Y19、Y15、Y20、Y11、Y12、Y3。

表1 不同菌株发酵液中乙酸乙酯含量Table 1 Results of ethyl acetate contents in fermentation broth of different strains mg/100 mL
2.2 生香酵母的复筛
将液态发酵初筛得到的7株产乙酸乙酯能力较好的酵母菌株进行固态发酵,结果见表2。由表2可知,复筛模拟酒厂车间酒糟堆积发酵,对照样只添加高温大曲,发酵结束后提取香气成分,进行GC检测,共检测到64种挥发性化合物,其中醇类18种,酯类22种,酸类11种,醛类6种,酮类4种,吡嗪类2种,酚类1种。

表2 不同菌株固态发酵挥发性物质气相色谱检测结果Table 2 Results of volatile compounds in solid-state fermentation of different strains analysis by GC mg/100 mL

化合物对照组Y3Y11Y12Y15Y19Y20Y22己酸乙酯0.73±0.370.46±0.170.27±0.070.51±0.210.52±0.300.30±0.060.83±0.420.30±0.24甲酸乙酯1.52±0.710.79±0.221.29±0.990.76±0.181.23±0.130.58±0.001.87±0.111.54±0.46壬酸乙酯0.57±0.300.13±0.070.33±0.240.33±0.110.32±0.0300.37±0.080.33±0.26乳酸乙酯0.31±0.081.93±0.061.39±0.311.76±0.012.13±1.991.6±1.191.63±1.071.71±2.41十二酸乙酯0.26±0.000.09±0.020.26±0.160.22±0.160.20±0.080.26±0.130.31±0.080.43±0.18戊酸乙酯00.11±0.020.19±0.070.19±0.060.17±0.120.28±0.180.46±0.030.40±0.02辛酸乙酯0.58±0.050.25±0.050.42±0.390.50±0.050.08±0.060.40±0.020.85±0.380.53±0.18乙酸丁酯0.58±0.450.27±0.370.16±0.040.07±0.0100.25±0.571.11±0.300.61±0.14乙酸己酯0.55±0.180.40±0.280.19±0.010.58±0.140.39±0.300.32±0.350.90±0.230.36±0.51乙酸乙酯3.07±0.9327.03±8.4610.88±4.428.48±0.8814.76±2.6527.25±4.2511.08±0.8019.42±4.82乙酸异戊酯00.43±0.100.25±0.020.27±0.140.25±0.030.52±0.300.65±0.170.40±0.56异丁酸乙酯00.16±0.000.25±0.020.29±0.080.12±0.090.16±0.0000.60±0.00异戊酸乙酯0.25±0.010.08±0.040.35±0.15000.0.95±0.170.67±0.04油酸乙酯0.21±0.030.06±0.020.41±0.350.21±0.080.32±0.020.24±0.041.12±0.710.51±0.09棕榈酸乙酯0.15±0.060.12±0.080.31±0.020.05±0.010.11±0.040.23±0.110.33±0.190.18±0.25丙酸3.79±1.731.07±0.112.00±1.023.22±0.712.83±0.401.66±0.114.25±1.151.66±1.24丁酸1.17±1.001.70±0.042.57±0.952.21±0.771.62±1.241.37±0.650.99±0.520.80±0.18庚酸00.13±0.070.16±0.020.21±0.010.06±0.030.37±0.150.40±0.020.19±0.09癸酸0.53±0.190.52±0.061.76±1.122.24±0.151.15±0.090.53±0.071.02±0.491.22±1.01己酸0.15±0.040.26±0.060.05±0.010.73±0.570.55±0.490.45±0.120.60±00.36±0.02十二酸0.37±0.040.10±0.010.26±0.030.30±0.060.25±0.040.32±0.030.12±0.010.62±0.04戊酸0.60±0.250.23±0.180.31±0.240.70±0.230.39±0.070.20±0.020.84±0.440.71±0.16辛酸0.16±0.030.05±0.0300.30±0.080.10±0.0600.13±0.010异丁酸0.60±0.400.85±0.140.91±0.080.60±0.021.05±0.401.43±0.650.50±0.022.28±0.47异戊酸0.19±0.030.61±0.190.73±0.640.42±0.320.54±0.290.65±0.390.43±0.030.64±0.20油酸1.00±0.780.64±0.541.39±0.130.95±0.391.61±0.201.15±0.261.71±0.551.89±0.74 4-乙基苯酚2.92±1.201.24±0.221.46±0.931.00±0.071.76±0.480.84±0.212.84±0.711.01±0.03 2,3-丁二酮3.08±0.980.92±0.410.55±0.381.45±1.021.26±0.300.30±0.101.97±0.381.40±0.48 2-戊酮0.08±0.0200.06±0.02000.10±0.010.25±0.100.13±0.04 3-羟基丁酮1.37±0.395.51±1.720.41±0.201.57±0.285.27±0.381.97±0.390.87±0.371.04±0.28丙酮0.25±0.010.29±0.210.60±0.340.13±0.080.19±0.070.34±0.230.28±0.060.61±0.33三甲基吡嗪3.35±0.361.37±0.371.52±0.031.43±0.101.04±0.380.23±0.052.34±1.030.95±0.58四甲基吡嗪0.47±0.270.17±0.050.42±0.200.11±0.010.31±0.050.08±0.020.26±0.200.43±0.34乙缩醛1.53±0.792.23±0.191.79±0.161.15±0.291.99±0.392.46±1.051.79±0.291.31±0.93异丁醛0.20±0.030.07±0.040.25±0.310.16±0.100.19±0.010.07±0.040.31±0.020.23±0.11异戊醛0.64±0.030.39±0.060.15±0.020.41±0.200.36±0.300.35±0.060.58±0.030.59±0.26 2-甲基丁醛0.19±0.090.14±0.0600.27±0.2600.98±0.3800.71±0.20苯甲醛3.34±1.031.42±0.934.93±0.941.86±1.022.53±0.284.02±0.374.37±1.035.01±0.78糠醛9.03±2.984.26±1.738.15±1.078.64±3.036.94±2.017.01±3.127.07±1.496.04±1.02
2.2.1 主成分分析
通过SPSS19.0软件对7株菌株复筛产物的64种化合物进行主成分分析,发现前两个主成分方差累计贡献率达94.895%(PC1=48.06%,PC2=46.85%),其主成分分析结果见图1。由图1可知,主成分1包括酵母Y11、Y12、Y15和Y20,主成分2包括酵母Y3、Y19、Y22,说明菌株Y11、Y12、Y15和Y20的发酵产物具有一定的相似性,菌株Y3、Y19和Y22的发酵产物具有一定的相似性。
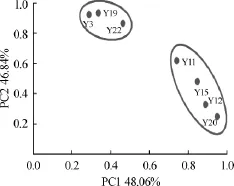
图17 株菌株主成分分析图Fig.1 Principal components analysis of 7 strains
2.2.2 不同生香酵母产生挥发性物质比较
不同生香酵母挥发性物质含量的比较结果见图2。由表2及图2可知,与对照组相比,7株酵母均能将乙酸乙酯含量显著提高(P<0.05),其中菌株Y3和Y19乙酸乙酯产量较高,分别为27.25 mg/100 mL、27.03 mg/100 mL,且两者之间不存在显著差异(P>0.05),其次是菌株Y22,其乙酸乙酯产量为19.42 mg/100 mL,与菌株Y3和Y19均存在显著性差异(P<0.05)。此外,菌株Y3、Y19、和Y22的总酯含量三者之间均存在显著差异(P<0.05),其含量分别为40.28 mg/100 mL、34.99 mg/100 mL、31.37 mg/100 mL。

图2 不同菌株挥发性物质含量的比较Fig.2 Comparison of volatile compounds contents from different strains
另外,与对照组相比,添加酵母后吡嗪含量均减少,其中菌株Y19的吡嗪含量最低,仅0.31 mg/100 mL,而只添加大曲发酵的对照组吡嗪含量为3.82 mg/100 mL。吡嗪主要来源于大曲及堆积过程中芽孢杆菌的代谢[10],添加的菌株可能对产吡嗪的芽孢杆菌生长代谢有所抑制。
此外,添加酵母后总酚含量减少,菌株Y20与对照组总酚含量不存在显著性差异(P>0.05),而其他菌株与对照组均存在显著性差异(P<0.05)。另外,菌株Y3的总醛产量比对照组显著减少(P<0.05)。添加酵母后高级醇(包括异戊醇、正丙醇、正丁醇、正己醇、正戊醇、正辛醇、仲丁醇、仲戊醇)含量均比对照组提高,其中菌株Y22高级醇含量比对照组显著提高(P<0.05),其含量达20.10 mg/100 mL,比已有研究报道中的含量均高[11-12]。这可能是因为菌株Y22不仅自身具有一定的产高级醇能力,还能够与其他微生物相互作用促进了高级醇的产生。
2.2.3 复筛结果
菌株Y3、Y19、和Y22产酯能力均较强,但菌株Y19会降低吡嗪产量,吡嗪尤其是四甲基吡嗪是白酒中的主要功能性成分之一,已经引起行业的广泛关注[10]。菌株Y22使高级醇产量增加,适量的高级醇能使酒体丰富,但是过量的高级醇不仅会给酒的风味带来邪杂味还对人体有害[13-14]。故为降低对其他风味物质的影响,最终选取菌株Y3作为后期工厂酒糟堆积发酵实验的生香酵母。
2.3 菌株鉴定
2.3.1 菌株的形态学观察
对菌株Y3进行细胞形态观察,并划线于WL培养基上培养,观察菌落形态特征,结果见图3。由图3可知,菌株Y3细胞呈椭圆形,在WL营养琼脂培养基上菌落呈淡绿带黄色,边缘褶皱,中央凸起,面粉状,可以初步鉴定菌株Y3为毕赤酵母属(Pichia)[15-17]。

图3 菌株Y3的细胞形态(a)和菌落形态(b)Fig.3 Cell morpholopy(a)and colony morphology(b)of strain Y3
2.3.2 菌株的分子鉴定
对菌株Y3的18SrDNA的PCR扩增产物进行序列测序,将测序结果与GenBank数据库进行Blast比对分析,获得与测序菌株序列相近种、属的18S rDNA序列,通过DNAMAN构建系统发育树,结果见图4。由图4可知,菌株Y3与毕赤酵母(Pichia kudriavzevii)相似性达99%,鉴定菌株Y3为毕赤酵母(Pichia kudriavzevii)。
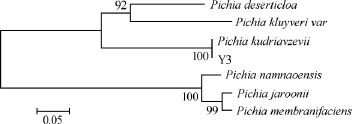
图4 菌株Y3 18S rDNA序列系统进化树Fig.4 Phylogenetic tree of 18S rDNA squences of strain Y3
3 结论
通过单菌液态发酵从酱香型白酒堆积后的酒糟中筛选出7株高产乙酸乙酯的酵母菌株,将其模拟工厂固态发酵进行复筛,发酵产物经GC检测共得到64种挥发性化合物,经PCA分析,得到两个主成分,其中主成分1包括酵母Y11、Y12、Y15和Y20,主成分2包括酵母Y3、Y19、Y22。菌株Y3和Y19的乙酸乙酯产量较高,且不存在显著差异(P>0.05),其次是Y22。但菌株Y19的吡嗪产量显著减少(P<0.05),Y22的高级醇产量显著增加(P<0.05),均不利于酱香型白酒的生香呈味。故菌株Y3更适合应用于生产实践,提高白酒中乙酸乙酯的含量,提升酱香型白酒的品质。经过形态学观察和分子鉴定,确定Y3菌株为Pichia kudriavzevii。关于生产实践,则还需要进行工厂酒糟堆积发酵实验,作进一步的研究探讨。
[1]王晓丹,庞博,陆安谋,等.酱香型白酒堆积过程中酵母变化趋势研究[J].食品工业,2014,35(12):42-44.
[2]邵明凯,王海燕,徐岩,等.酱香型白酒发酵中酵母群落结构及其对风味组分的影响[J].微生物学通报,2014,41(12):2466-2473.
[3]范广璞.白酒中生香酵母的筛选及培养条件的研究[J].中国酿造,2008,26(7):44-47.
[4]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2013:45-52.
[5]DING X F,WU C D,HUANG J,et al.Characterization of interphase volatile compounds in Chinese Luzhou-flavor liquor fermentation cellar analyzed by head space-solid phase micro extraction coupled with gas chromatography mass spectrometry(HS-SPME/GC/MS)[J].LWT-Food Sci Technol,2016,66(32):124-133
[6]沈海月.酱香型白酒香气物质研究[D].无锡:江南大学,2010.
[7]尚柯,韩兴林,王德良,等.酱香型白酒高温堆积酒醅挥发性风味物质的检测分析[J].中国酿造,2016,35(2):139-143.
[8]山其木格,梁慧珍,张长霞,等.酒糟堆积过程中微生物种群的变化规律[J].食品与生物技术学报,2016,35(3):330-335.
[9]吴徐建.酱香型白酒固态发酵过程中酵母与细菌群落结构变化规律的研究[D].无锡:江南大学,2013.
[10]吴建锋.白酒中四甲基吡嗪全程代谢机理研究[D].无锡:江南大学,2013.
[11]曾朝珍,张永茂,康三江,等.发酵酒中高级醇的研究进展[J].中国酿造,2015,34(5):11-15.
[12]VIANAF,GILJV,VALLESS,etal.Increasingthelevelsof2-phenylethyl acetate in wine through the use of a mixed culture of Hanseniaspora osmophila and Saccharomyces cerevisiae[J].Int J Food Microbiol,2009, 135(1):68-74.
[13]游玲,任羽,王涛,等.酵母对浓香型白酒糟醅中高级醇生成的影响[J].食品与发酵工业,2016,42(2):23-28.
[14]吴海静,钟继仁,田晓林,等.大黄米白酒高级醇产生规律的研究[J].中国酿造,2016,35(11):99-102.
[15]杨雪峰,苏龙,刘树文.利用WL营养培养基鉴定葡萄酒中的相关酵母菌[J].中外葡萄与葡萄酒,2008(4):4-7.
[16]孙剑秋,刘雯雯,臧威,等.基于26S rDNA D1/D2序列分析酱香型白酒酒醅中酵母的群落结构[J].微生物学通报,2012,52(10):1290-1296.
[17]王凤梅,马立兵.内蒙古西部地区霞多丽葡萄自然发酵过程中酵母菌群研究[J].南方农业学报,2015,46(10):1817-1822.
Screening and identification of aroma-producing yeast in distiller's grains of Moutai-flavorBaijiu
CAI Xuemei1,WU Lianhai2,CHEN Mengyuan1,CHEN Jian1,WANG Kunling1,YANG Liu2,LUO Aimin1*
(1.College of Light Industry,Textile and Food Engineering,Sichuan University,Chengdu 610064,China; 2.Sichuan Langjiu Group Co.,Ltd.,Gulin 618200,China)
Seven aroma-producing yeasts with high yield ethyl acetate were isolated from Moutai-flavorBaijiuthrough primary screening by liquidstate fermentation.Total 64 flavor compounds were detected by GC from products of solid-state fermentation.Then according to principal component analysis(PCA),results showed that strain Y3,Y19 and Y22 produced similar flavor compounds.The ethyl acetate yield of strain Y3 and Y19 was significantly higher than others,then followed by strain Y22(P<0.05).But compared to the control,the pyrazine yield of strain Y19 reduced significantly(P<0.05)and the higher alcohols yield of strain Y22 increased significantly(P<0.05),which went against the flavoring of Moutai-flavor Baijiu.So strain Y3 was screened as aroma-producing strain and identified asPichia kudriavzevii.
Moutai-flavorBaijiu;distillers'grains;aroma-producing yeast;screening;ethyl acetate
TS261.1
0254-5071(2017)07-0042-06
10.11882/j.issn.0254-5071.2017.07.010
2017-04-19
四川省科技支撑计划项目(2016GZ0366)
蔡雪梅(1994-),女,硕士研究生,研究方向为发酵工程。
*通讯作者:罗爱民(1971-),男,副教授,博士,研究方向为发酵工程。
