PB试验优化德氏乳杆菌增殖培养基的研究
2017-07-31蒋艾廷李宝坤金丹赵利利乔传丽
蒋艾廷,李宝坤*,金丹,赵利利,乔传丽
(石河子大学食品学院,新疆石河子832000)
PB试验优化德氏乳杆菌增殖培养基的研究
蒋艾廷,李宝坤*,金丹,赵利利,乔传丽
(石河子大学食品学院,新疆石河子832000)
试验对一株来源于传统酸奶的优良德氏乳杆菌(Lactobacillus delbrueckii)ATx生长所需的增殖因子进行了研究。在MRS培养基的基础上,测定了菌株ATx的生长曲线,并选取谷氨酸钠、磷酸吡哆醛、抗坏血酸、啤酒、乳糖、胡萝卜汁、番茄汁、pH为增殖因子。采用单因素试验确定每个因子的最优水平,Plackett-Burman试验考察各因子对菌株ATx细胞增殖的影响,通过最陡爬坡与中心组合试验对增殖因子进行优化。结果表明,谷氨酸钠、啤酒以及pH对菌株ATx的增殖具有显著影响(P<0.05),当MRS培养基中添加谷氨酸钠21.5 g/L、啤酒26.8 mL/L、初始pH值为6.4时,德氏乳杆菌ATx的活菌数最大为(7.56±0.23)×109CFU/mL,为高活性发酵剂的制备提供了理论参考。
德氏乳杆菌;生长曲线;增殖因子;Plackett-Burman试验
随着乳酸菌对人体益生作用的不断深入研究与揭示,乳酸菌类制品逐渐受到人们的青睐,发酵乳制品的消费量呈快速增长趋势,各类乳酸菌制品也层出不穷[1]。研究表明[2],进入肠道内的乳酸菌必须具备足够的数量与充足的活力,才能发挥其生物功效。GB 7101—2015《食品国家标准饮料》规定活菌型乳酸菌饮料中的乳酸菌数应高于106CFU/g(mL);日本发酵乳与乳酸菌饮料协会规定发酵乳中的益生菌数高于107CFU/mL[3]。此外在发酵乳制品的加工与生产过程中,发酵菌种保持较高的细胞活力,能够极大地缩短发酵时间、降低能耗,但乳酸菌属于异养型微生物,需要从外界吸收一些氨基酸、维生素等生长因子才能维持正常生长[4]。如何研制出高浓度且活力强的乳酸菌,已经成为限制中国乳品工业发展的一个瓶颈因素。
国内外许多研究人员[5-7]对乳酸菌增殖培养基进行了优化分析,大多采用均匀设计、正交试验以及响应面分析等方法,过程相对繁琐且优化效果不明显[8]。本试验拟以一株产酸快、凝乳时间短的优良德氏乳杆菌(Lactobacillus delbrueckii)为试验菌株,基于软件Design-Expert,在Plackett-Burman(PB)试验基础上,采用最陡爬坡与中心组合试验,设计从8种增殖因子中快速筛选几种主要因子,优化培养基的配方,具有周期短、回归方程精度高等优点,为德式乳杆菌高密度培养提供理论基础与实践依据[11-13]。
1 材料与方法
1.1 材料与试剂
菌株:德氏乳杆菌(Lactobacillusdelbrueckii)ATx,从新疆塔城地区传统酸奶中分离,由石河子大学食品学院保存。
MRS肉汤培养基:葡萄糖20 g/L、蛋白胨10 g/L、牛肉粉5 g/L、结晶乙酸钠5 g/L、酵母粉4 g/L、柠檬酸二铵2 g/L、K2HPO4·7H2O 2 g/L、吐温80 1 mL/L、MgSO4·7H2O 0.2 g/L、MnSO4·4H2O 0.04 g/L,调节pH值至6.0~6.6,121℃灭菌20 min。此培养基主要用于活化菌种。
MRS固体培养基:在MRS液体培养基中加入1.8%的琼脂,煮沸熔化灭菌而成。
增殖培养基:按照单因素试验设计,向MRS基础培养基中添加各增殖因子后用蒸馏水补足至所需体积配成。
乳糖、磷酸吡哆醛(维生素B6)、抗坏血酸(维生素C)、谷氨酸钠(分析纯):上海瑞永生物科技有限公司。
番茄汁:将经过挑选、洗净的番茄破碎,然后连续打浆和纱布过滤分离,滤液8 000 r/min离心后取上清液,4℃保藏备用。胡萝卜汁:对胡萝卜进行选料、清洗、切片,放入烧杯加入3倍质量的蒸馏水100℃煮30~40 min,冷却后进行打浆,纱布过滤后于8 000 r/min离心,完成后取上清液4℃保藏备用。啤酒:本试验采用的啤酒均为乌苏啤酒,麦芽汁浓度为9°P。
1.2 仪器与设备
LDZX-30KBS型立式高压蒸汽灭菌锅:上海申安医疗器械厂;DNP-9272型电热恒温培养箱:上海精宏实验设备有限公司;XB-3200C型电子天平:上海精科上海天平仪器厂;SW-CJ-2D型超净工作台:苏州苏洁净化设备有限公司;Neoluge 15R型台式高速冷冻离心机:香港力康发展有限公司。
1.3 方法
1.3.1 生长曲线的测定
将保藏的菌株ATx活化2次,待恢复活力后,再按3%的接种量接入MRS液体培养基于37℃培养,每3h进行一次菌落计数,计数方法采用平板计数法[14],平行3次,取平均值。
1.3.2 种子液的制备
活化后的乳酸菌按3%的接种量接入培养基中,根据乳酸菌的生长曲线,确定合适菌龄的乳酸菌作为种子液。
1.3.3 单因素试验
乳酸菌的增殖需要多种的生长因子,国内外已有许多研究人员[15-19]通过单因素试验和响应面试验优化增殖培养基的组成,有效的提高了培养基中的活菌数,根据文献记载[20-21],在MRS基础培养基中添加一定量的磷酸吡哆醛、抗坏血酸、啤酒、胡萝卜汁、番茄汁、乳糖以及谷氨酸钠能够促进乳酸菌的生长,此外改变培养基初始pH对乳酸菌的增殖也有较大的影响[22]。本试验在MRS肉汤的基础上,配制成含有不同质量浓度的上述增殖因子的培养基,谷氨酸钠的添加量为10 g/L、20 g/L、30 g/L、40 g/L;啤酒、胡萝卜汁、番茄汁的添加量均分别为10 mL/L、30 mL/L、50 mL/L、70 mL/L;磷酸吡哆醛与抗坏血酸的添加量均分别为1 g/L、2 g/L、3 g/L、4 g/L;乳糖的添加量为5 g/L、10 g/L、15 g/L、20 g/L,进行单因素试验,试验平行3次,取平均值,通过平板计数法计算活菌数。
1.3.4 Plackett-Burman试验
根据单因素试验中各增殖因子的最佳浓度,对谷氨酸钠(A)、磷酸吡哆醛(B)、抗坏血酸(C)、胡萝卜汁(D)、番茄汁(E)、啤酒(F)、乳糖(G)、初始pH(H)8个因子进行考察,每个因子分别取低(-1)和高(+1)2个水平,其中低水平为单因素试验结果的最佳浓度,高水平取低水平的1.5倍,为了确保试验的准确性,本次试验设计含有3个虚拟项,因此选取N=12的PB设计,以活菌数为响应值(Y),筛选对德氏乳杆菌ATx具有影响显著的增殖因子,试验平行3次,取平均值。
1.3.5 最陡爬坡试验
根据PB设计的结果,由各因素效应值的大小确定变化的步长。按一定的梯度增加或者减少各因素的水平值,检测增殖培养基中乳酸菌活菌数的变化,活菌数最高组的水平值即为中心组合设计优化分析的中心组。
1.3.6 中心组合设计
将PB试验筛选的3个显著因素作为试验因素,最陡爬坡试验确定的最佳水平作为中心点,采用Design-Expert 8.05中的中心组合设计(central composite design,CCD)对增殖培养基的成分进行优化。
2 结果与分析
2.1 德氏乳杆菌ATx生长曲线的测定
为了解德氏乳杆菌在MRS培养基中的生长情况,测定了36 h内乳酸菌的生长曲线,结果见图1。以便于准确地掌握种子液的制备时间,确保乳酸菌的活性最大。

图1 德氏乳杆菌ATx的生长曲线Fig.1 Growth curve ofL.delbrueckiiATx
由图1可知,德氏乳杆菌ATx从一开始菌数急增,由于菌株活化2次后活力较强,短时间的延滞期后立即进入对数生长期(2~18 h),21 h达到高峰并进入生长稳定期,此后菌数基本不再增加并稍有下降的趋势,该菌株的生长符合单细胞微生物的典型生长规律。经验证,如果用于接种的种子液处于对数后期或稳定前期则子代培养物的适应期就短,因此为了缩短生产周期,通常都选用处于对数后期的种子接种。本试验选用培养16~18h的菌体作为种子液。
2.2 单因素试验结果
以培养16 h的菌体为种子液,接种量均为3%,接入含不同浓度增殖因子的培养基中于37℃静置培养,培养时间为16 h。通过菌落计数确定各增殖因子的最佳浓度见表1。

表1 单因素试验结果Table 1 Results of single factor experiments
2.3 Plackett-Burman试验结果
PB试验设计及结果见表2。

表2 Plackett-Burman试验结果Table 2 Results of Plackett-Burman experiments
利用Design-Expert 8.05软件对PB试验结果进行分析,其因子影响效果与回归模型方差分析见图2与表3。
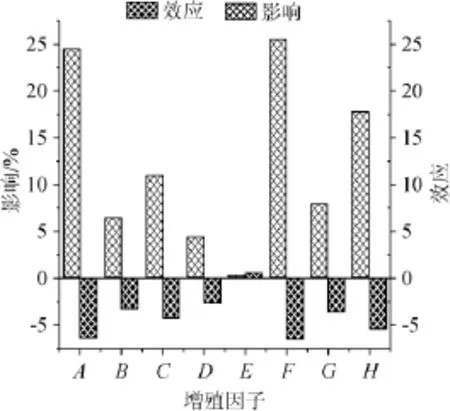
图2 各增殖因子对菌株ATx生长影响的比较Fig.2 Comparison of effects of proliferation factors on strain ATx growth
由图2可知,因子A、B、C、D、F、G、H对德氏乳杆菌ATx有负效应,即在一定浓度范围内,菌体浓度随着增殖因子浓度降低而增大。因子E则具有正效应,即在一定浓度范围内,菌体浓度随着增殖因子浓度增大而增大。这8个因子对德氏乳杆菌ATx生长的影响顺序依次为F>A>H>C>G>B>D>E,其中E对ATx生长的影响最小为0.21%,C、G、B、D的影响较大,为4%~12%,F、A、H对菌株ATx生长的影响最大。
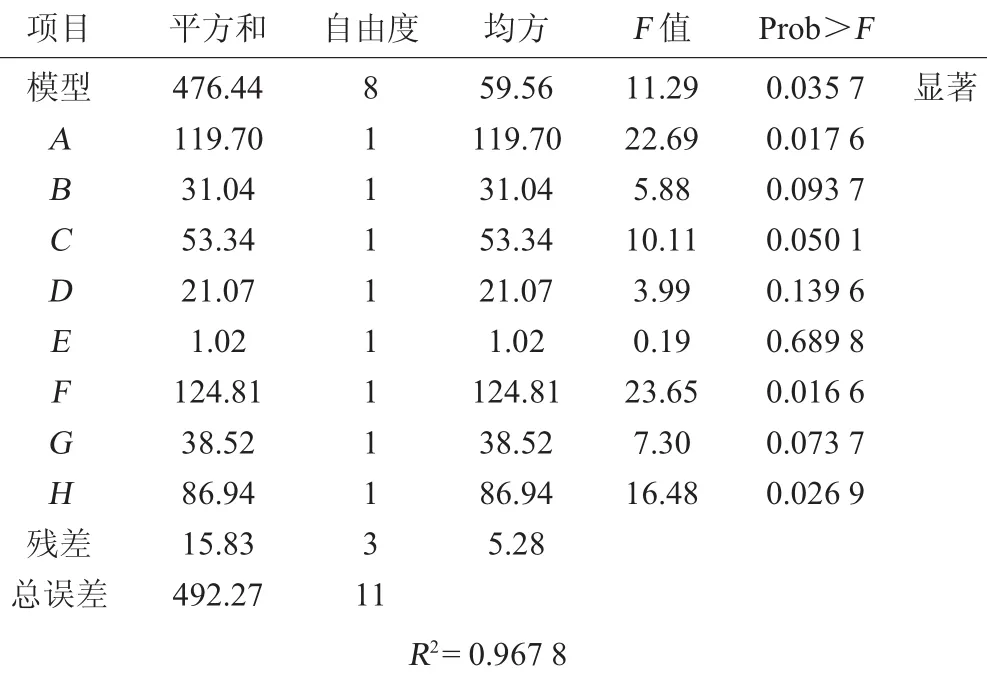
表3 PB试验回归模型方差分析Table 3 Variance analysis of regression equation of PB experiments
由表3可知,所得的回归方程达到显著(P<0.05),决定系数R2=0.967 8,这表明有96.78%的试验数据可用此回归模型来解释。本次试验的8个因子中,啤酒(P<0.05)、谷氨酸钠(P<0.05)、培养基的初始pH(P<0.05),对德氏乳杆菌ATx生长的影响最大,其置信度分别为98.34%、98.24%、97.31%,其他因子对菌株ATx增殖在95%的概率水平上差异均不显著。因此,选择谷氨酸钠、啤酒及培养基的初始pH作为ATx生长的增殖因子。
2.4 中心组合试验结果与分析
由最陡爬坡试验结果(表4)可知,第3组试验中乳酸菌的活菌数最高,故将其水平作为CCD试验的中心点,以第二组的试验结果作为高(+1)水平,第三组试验结果作为低(-1)水平。采用CCD试验设计确定德氏乳杆菌的最佳培养基配方。试验设计及结果见表5,方差分析见表6。对试验设计结果进行回归拟合分析,得到二次多元回归模型:
Y=74.21-2.52A+3.73B-3.62C-3.50AB+2.40AC+0.50BC-3.41A2-9.92B2-7.30C2
由表6可知,该模型(P<0.001)极其显著,失拟项(P= 0.793 3>0.05)不显著,说明模型的拟合性较好。模型的决定系数R2=0.983 1,调整决定系数R2adj=0.967 9,表明响应面的96.79%的变化可以由此模型解释,预测决定系数R2pred= 0.9430接近R2adj,表明模型与实际情况拟合得较好。变异系数(coefficient of variation,CV)为3.55%,说明试验数据可靠、分析结果可信,可用此模型对试验结果进行分析和预测。

表4 最陡爬坡试验设计及结果Table 4 Design and results of the steepest ascent experiments

表5 中心组合设计及结果Table 5 Design and results of central composite experiments

表6 中心组合试验回归模型方差分析Table 6 Variance analysis of regression equation of central composite design
利用Design-Expert8.05软件对回归模型进行响应面分析,得到各因素交互作用的响应面和等高线(见图3)。用此回归模型预测啤酒与谷氨酸钠的添加量分别为26.81 mL/L、21.46g/L,初始pH值为6.37时,德氏乳杆菌的活菌数最大预测值为7.68×109CFU/mL。为方便实际操作,修改条件为啤酒与谷氨酸钠的添加量分别为26.8 mL/L、21.5 g/L,初始pH值为6.4,此时德氏乳杆菌ATx的活菌数为7.56×109CFU/mL,与预测值相近,可见该模型能较好地预测实际培养基中德氏乳杆菌的活菌数,与基础培养基相比活菌数提高了约6.8倍。
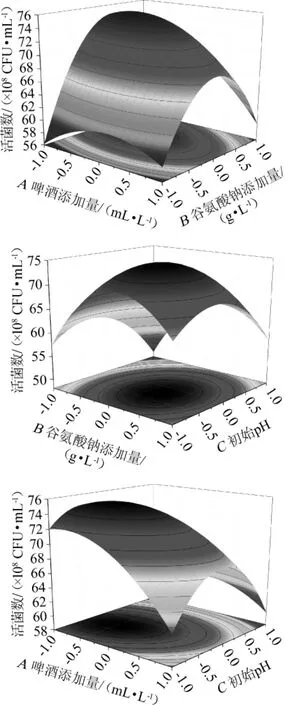
图3 啤酒添加量、谷氨酸钠添加量、初始pH值交互作用对乳酸菌活菌数影响的响应面和等高线Fig.3 Response surface plots and contour line of effects of beer addition,sodium glutamate addition and initial pH on viable counts of lactic acid bacteria
3 结论
本试验通过Plackett-Burman试验得出,啤酒、谷氨酸钠与培养基的初始pH值是影响德氏乳杆菌生长的关键因子。通过回归模型确定增殖培养基的配方为在MRS基础培养基中加入26.8mL/L的啤酒、21.5g/L的谷氨酸钠,初始pH值为6.4,最终德氏乳杆菌活ATx菌数为(7.56±0.23)×109CFU/mL,比优化前提高了约6.8倍,为德氏乳杆菌高密度培养确定了适宜的培养基组成,进而为其工业化生产奠定良好的基础。针对德氏乳杆菌高密度培养技术,如补料分批培养、细胞循环培养、透析培养等还需要后续深入研究。
[1]张和平.中国益生乳酸菌及益生发酵乳研究开发现状及发展对策[J].乳业科学与技术,2009,32(2):51-54.
[2]陈健凯,陈健旋,林洵,等.养乐多饮料中影响干酪乳杆菌代田株活菌数因素的研究[J].中国酿造,2008,27(22):34-36.
[3]易文芝,唐雯倩,刘成国,等.基于高活菌数的益生发酵乳发酵技术研究进展[J].食品与机械,2014,30(4):252-256.
[4]周德庆.微生物学教程[M].北京:高等教育出版社,2011:41-50.
[5]KHOSHAYAND F,GOODARZI S,SHAHVERDI A R,et al.Optimization of culture conditions for fermentation of soymilk usingLactobacillus caseiby response surface methodology[J].Probiot Antim Prot,2011, 3(4):159-167.
[6]ZHAO X,HAN Y,JIN W,et al.Optimization of antifungal lipopeptide production fromBacillussp.BH072 by response surface methodology[J]. J Microbiol,2014,52(4):324-332.
[7]熊亚,李敏杰.鸡枞菌菌丝体基础培养基的优化[J].食品与机械,2013,29(4):185-189.
[8]王菲菲.乳酸乳球菌乳脂亚种BTQY-112增殖培养基的优化[J].食品研究与开发,2016,37(12):159-162.
[9]UNGUREANU C P,FAVIER L,BAHRIM G,et al.Response surface optimization of experimental conditions for carbamazepine biodegradation byStreptomycesMIUG 4.89[J].New Biotechnol,2015,32(3):347-357.
[10]DAYANA P S,BAKTHAVATSALAM A K.Optimization of phenol degradation by the microalgaChlorella pyrenoidosausing Plackett-Burman design and response surface methodology[J].Bioresource Technol,2016,207:150-156.
[11]刘鹏,贾晓强,杨春燕,等.德氏乳杆菌发酵生产乳酸工艺条件优化[J].化工进展,2011,30(6):1332-1340.
[12]符恒,袁爽,陈杰,等.保加利亚乳杆菌在酸奶制品中的应用及其研究进展[J].食品工业科技,2014,35(9):360-367.
[13]李瑞,侯改凤,黄其永,等.德氏乳杆菌对哺乳仔猪生长性能、血清生化指标、免疫和抗氧化功能的影响[J].动物营养学报,2013,25(12):2943-2949.
[14]宋继宏,王记成,其木格苏都,等.发酵乳中乳酸菌计数方法研究进展[J].中国乳品工业,2014,42(12):27-31.
[15]华宝珍,李莎,徐爱才,等.植物乳杆菌ST-Ⅲ脱脂乳的发酵工艺优化[J].农业工程学报,2014,30(11):276-284.
[16]ANNADURAI G,LEE J F,LING L Y.Statistical optimization of medium components and growth conditions by response surface methodology to enhance phenol degradation byPseudomonas putida[J].J Hazard Material,2008,151(1):171-178.
[17]SENTHILKUMAR S,PERUMALSAMY M,PRABHUY H,et al.Response surface optimization for efficient dye removal by isolated strain Pseudomonassp.[J].Open Eng,2012,2(3):425-434.
[18]SERUGA P,KRZYWONOS M.Screening of medium components and process parameters for sugar beet molasses vinasse decolorization by Lactobacillus plantarumusing Plackett-Burman experimental design[J]. Polish J Environ Stud,2015,24(2):683-688.
[19]杨杰,谷新晰,李晨,等.响应面法优化植物乳杆菌绿豆乳增殖培养基[J].中国食品学报,2015,15(12):84-89.
[20]王慕华,潘佩平,赵玉明,等.嗜热链球菌抗噬菌体菌株的富集培养[J].中国乳品工业,2015,45(5):12-15.
[21]李用芳,李学梅,单英芳,等.嗜热链球菌和乳杆菌最佳促生长剂的选择[J].食品与发酵工业,1998,24(3):50-52.
[22]黄丽金,陆兆新,袁勇军.响应面法优化德氏乳杆菌保加利亚亚种增殖培养基[J].食品科学,2005,26(5):103-107.
Optimization of proliferation medium forLactobacillus delbrueckiiby PB experiments
JIANG Aiting,LI Baokun*,JIN Dan,ZHAO Lili,QIAO Chuanli
(College of Food Engineering,Shihezi University,Shihezi 832000,China)
The proliferative factors required for the growth of a high quality strainLactobacillus delbrueckii,named ATx,which isolated from the traditional yogurt was studied.On the basis of MRS medium,the growth curve of strain ATx was determined and sodium glutamate,pyridoxal phosphate,ascorbic acid,beer,lactose,fresh carrot juice,tomato juice and pH were selected as proliferative factors.The optimal level of each factor was determined by single factor experiments,the effects of various factors on the proliferation of strain ATx cells was investigated by Plackett-Burman experiments,and the optimal proliferative factors were optimized by the steepest ascent and central composite tests.The results showed that sodium glutamate,beer and pH had a significant effect on the proliferation of strain ATx(P<0.05).When the MRS medium components were monosodium glutamate 21.5 g/L,beer 26.8 ml/L,and when the initial pH was 6.4,the maximum viable count of strain ATx was(7.56±0.23)×109CFU/ml,which provided theoretical references for production of starter culture with high viability.
Lactobacillus delbrueckii;growth curve;proliferative factor;Plackett-Burman experiment
Q93-335
0254-5071(2017)07-0032-05
10.11882/j.issn.0254-5071.2017.07.008
2017-04-20
国家自然科学基金(31560444);石河子大学重点科技攻关(gxjs2014-zdgg07)
蒋艾廷(1993-),男,硕士研究生,研究方向为乳品微生物。
*通讯作者:李宝坤(1979-),男,副教授,博士,研究方向为乳品微生物。
