鸡传染性贫血病毒SYBR GreenⅠ法荧光定量PCR检测方法的建立及其在疫苗污染检测中的应用
2017-07-31付佳媛房立春崔治中
付佳媛,李 丹,常 臻,李 阳,房立春,崔治中,常 爽,赵 鹏
(1.山东农业大学动物医学院,泰安 271018;2.山东医药技师学院,泰安 271016;3.黄岛出入境检验检疫局,青岛 266000)
·研究论文·
鸡传染性贫血病毒SYBR GreenⅠ法荧光定量PCR检测方法的建立及其在疫苗污染检测中的应用
付佳媛1,李 丹2,常 臻3,李 阳1,房立春1,崔治中1,常 爽1,赵 鹏1
(1.山东农业大学动物医学院,泰安 271018;2.山东医药技师学院,泰安 271016;3.黄岛出入境检验检疫局,青岛 266000)
为了更快速而灵敏地检测禽弱毒疫苗中可能存在的鸡传染性贫血病毒(Chicken infectious anemia virus,CIAV)污染,根据CIAV基因组保守区域VP2部分基因设计和合成了1对特异性引物,通过优化反应条件建立了快速检测CIAV的SYBR GreenⅠ荧光定量PCR方法。结果显示,建立的检测方法灵敏度可达6.36 copies/μL,是常规PCR灵敏度的1000倍。该方法与禽网状内皮组织增生病病毒(Reticuloendotheliosis virus,REV)、禽白血病病毒(Avian leukemia virus,ALV)、鸡马立克氏病病毒(Mareks disease virus,MDV)等均无交叉反应,特异性良好;批内和批间重复试验显示变异系数均小于2.5%,呈现良好的可重复性。在模拟试验中,建立的SYBR Green I荧光定量PCR能够检测到1000羽份弱毒疫苗中1个EID50的低剂量污染,应用该方法从送检的14种(批)商品化禽用弱毒疫苗中检测到2份为CIAV阳性,阳性样品按照经典的SPF鸡检查法进行检测也为CIAV阳性。因此,本研究建立的SYBR Green Ⅰ荧光定量PCR检测方法灵敏度高,特异性强,重复性好,适合用于疫苗中CIAV污染的检验。
鸡传染性贫血病毒;弱毒疫苗;污染;荧光定量PCR;SYBR Green Ⅰ
鸡传染性贫血(Chicken infectious anemia,CIA)是由鸡传染性贫血病毒(Chicken infectious anemia virus,CIAV)引起的一种以雏鸡再生障碍性贫血和免疫抑制为主的病毒性传染病。CIAV是目前已知基因组最小的病毒之一,该病毒自1979年报道以来[1],先后在美国[2-5]、英国[6-8]、澳大利亚[9,10]、德国[11]、丹麦[12]等均报道了本病的发生,我国于1992年首次分离到该病毒[13]。近年来,经过流行病学调查发现,该病毒在全球范围内普遍存在,成为危害养鸡业的主要疾病之一,其中某些感染被怀疑是使用了污染的弱毒疫苗造成[1,14]。
CIAV多与其他免疫抑制性病毒如禽网状内皮增生病病毒(Reticuloendotheliosis virus,REV)、鸡马立克氏病病毒(Mareks disease virus,MDV)、禽呼肠孤病病毒(Avian leukemia virus,ARV)、J亚群禽白血病病毒(Avian leukosis virus subgroup J,ALV-J)等共感染而导致免疫失败[15]。通常情况下,禽弱毒疫苗中污染CIAV等外源病毒剂量较低,因此需要更加灵敏且特异的方法来进行检测。本研究针对CIAV建立了SYBR GreenⅠ荧光定量PCR检测方法,不仅在模拟试验中被证实可有效检测疫苗中低剂量的CIAV污染,还成功从多批商品化疫苗中检测到CIAV污染。
1 材料与方法
1.1 毒株和细胞 CIAV-SDLY08株为2008年本实验室从山东某商品代肉鸡中分离鉴定的野毒株[16],通过卵黄囊接种SPF鸡胚进行增殖,收获病毒液测定其鸡胚半数感染量(embryo median infective dose,EID50)后冻存于-80℃备用。不同亚群ALV(ALV-A、ALV-J),MDV,REV等均由本实验室分离鉴定和保存。SPF鸡胚购自济南斯帕法斯家禽有限公司,按常规方法制备鸡胚成纤维细胞(Chicken embryo fibroblasts,CEF),用于MDV、REV以及ALV的增殖。
1.2 引物设计与合成 根据GeneBank已经发表的CIAV-SDLY08株全基因组序列(登录号:FJ172347),使用Lasergene 7.0软件选取CIAV最保守区域VP2,应用Primer primier 5.0 软件设计SYBR GreenⅠ荧光定量PCR引物。CIAV-F:5'- CGGATTGGTATCGCTGGA-3',CIAV-R:5'-GAGGGAGGCTTGGGTTGAT-3',预期扩增片段154 bp,并由上海生工生物工程有限公司合成。
1.3 荧光定量PCR的建立和条件优化 取保存的CIAV病毒液按照DNA提取试剂盒说明提取病毒DNA,以提取的病毒DNA为模板,以1.2中合成的引物扩增CIAV的相应DNA片段。PCR产物经1%琼脂糖凝胶电泳进行检测并用凝胶回收试剂盒(OMEGA)进行回收纯化,纯化后产物连接至pMD18-T载体上,转化到大肠杆菌DH5α感受态细胞中,挑取单菌落使用质粒提取试剂盒(OMEGA)提取重组质粒,酶切鉴定后送上海生工生物工程有限公司测序。验证后阳性质粒标准品使用核酸定量系统对其进行定量并计算其拷贝数,以不同稀释度的阳性质粒标准品为模板,按照TaKaRa公司SYBR® Premix Ex TaqTM试剂盒说明书进行SYBR GreenⅠ实时荧光定量PCR扩增。分别选用5、10、15 μmol/mL等不同的引物浓度,使用矩阵法对上下游引物进行筛选和优化,以确定最佳反应体系和反应条件。
1.4 荧光定量PCR的敏感性、特异性和可重复性检测 将定量好的质粒标准品进行10倍梯度稀释,取11个梯度的质粒标准品,浓度为6.36×1010~ 6.36 copies/μL,同时以SPF鸡胚源CEF基因组为阴性对照,进行荧光定量PCR的敏感性试验;同时以同等浓度的质粒DNA为模板,进行常规PCR反应,取扩增产物10 μL,用1%的琼脂糖凝胶电泳进行分析,以观察两者的最低检出率,比较其敏感性差异。分别以ALV-A、ALV-J、REV、MDV和CIAV的DNA或cDNA为模板,同时以SPF鸡胚源CEF基因组和灭菌超纯水为阴性对照,进行SYBR Green I实时荧光定量PCR方法进行检测,观察反应的特异性。选取10-3、10-4、10-6、10-74个稀释度的重组质粒标准品,每个浓度分别设置3个重复样,同时进行荧光定量PCR检测,进行批内重复试验;取相同稀释度的核酸在不同时间进行3次批间重复试验检测。分别计算Ct值的平均值和变异系数(变异系数=标准偏差/平均数),以评价建立方法的稳定性和可重复性,同时用无菌去离子水设为阴性对照。
1.5 荧光定量PCR在检测弱毒疫苗CIAV污染中的应用 用无菌PBS稀释已定量的CIAV分别为0.1EID50/2 mL、1EID50/2 mL、10EID50/2 mL、102EID50/2 mL、103EID50/2 mL、104EID50/2mL,然后分别用上述已掺入CIAV的PBS稀释6瓶同一批次的新城疫活疫苗(1000羽份),即获得了人工模拟污染CIAV的6瓶新城疫活疫苗0.1EID50/1000羽份、1EID50/1000羽份、10EID50/1000羽份、100EID50/1000羽份、103EID50/1000羽份、 104EID50/1000羽份,同时用2 mL无菌PBS稀释一瓶同一批次的新城疫活疫苗作为对照。将上述6瓶已稀释好的疫苗利用核酸病毒提取试剂盒提取DNA后,按照本研究中已建立的荧光定量PCR方法进行检测和常规PCR检测。另外,从种禽场送检的总计14种(批)弱毒疫苗按照上述操作均用2 mL无菌PBS稀释后提取核酸,分别使用本研究建立的荧光定量PCR方法和常规PCR进行检测,对于两种方法结果不一致的参照《中华人民共和国兽药典》(2010年版)附录“鸡检查法”对SPF鸡进行点眼、滴鼻和肌肉注射各2次进行免疫和抗体检测,进行复核检测。
2 结果
2.1 实时荧光定量PCR的建立和条件优化 通过对SYBR GreenⅠ实时荧光定量PCR的反应条件进行优化,确定反应体系引物最佳浓度为10 μmol/ mL。反应体系为20 μL:上下游引物各0.4 μL,SYBR Premix Ex Taq 10μL,ROX Reference Dye II 0.4μL,DNA模板 2μL,ddH2O 6.8μL。使用优化后的条件进行实时荧光定量PCR反应,以10倍梯度稀释选取6.36×107~6.36 copies/μL的阳性质粒标准品为模板进行扩增,获得了检测CIAV的动力学曲线(图略)和标准曲线(图略)。结果显示,模板浓度与Ct值呈现良好的线性关系,标准方程为Y= 30.86 - 3.186lgX,R2= 0.999,扩增效率E= 2.06。
2.2 实时荧光定量PCR的敏感性、特异性和可重复性试验 通过对重组质粒各稀释度样品进行实时荧光定量PCR检测,结果显示本方法对重组质粒进行扩增最低可以检测到6.36个病毒核酸分子拷贝,而常规PCR方法在6.36×103个病毒核酸分子拷贝时能勉强观察到目的条带(图1),表明本研究所建立的实时荧光定量PCR方法是普通PCR灵敏度的1000倍。用所建立的实时荧光定量PCR方法对ALV -A/J、REV、MDV的DNA或cDNA进行检测均无扩增信号,而质粒标准品有良好的扩增,表明该方法具有良好的特异性(图略)。选取10-3、10-4、10-6、10-7等4个稀释度(6.36×107,6.36×106,6.36×104,6.36×103copies/μL)的重组质粒标准品,每个浓度做3管同时进行荧光定量PCR,进行3次批内重复和3次批间重复试验,经过统计学结果显示批内重复试验的标准差为0.03~0.28,变异系数为0.160%~0.901%;批间重复试验的标准差为0.365~0.385,变异系数为1.477%~2.310%,变异系数均小于3%(表1)。结果表明本试验建立的荧光定量检测方法具有良好的可重复性和稳定性。
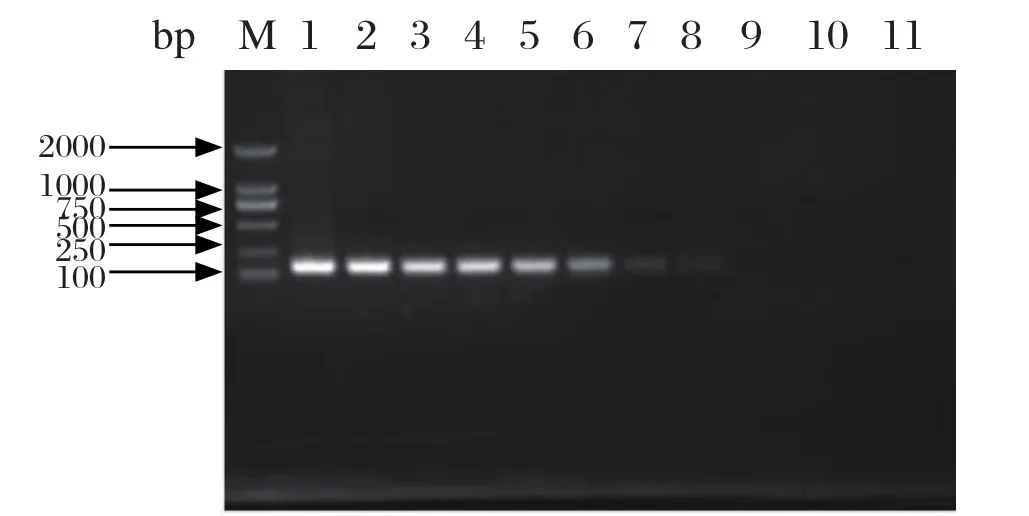
图1 常规PCR敏感性试验Fig.1 Analysis of sensitivity of the conventional PCRM: DNA分子质量标准(DL2000); 1~10: 6.36×1010至6.36×101copies/μL; 11: 阴性对照M: DNA Marker(DL2000); 1-10: 6.36×1010to 6.36×101copies/ μL; 11: Negative control

表1 荧光定量PCR重复性试验结果Table 1 Reproducibility test of qPCR
2.3 SYBR GreenⅠ实时荧光定量PCR检测弱毒疫苗中CIAV污染 利用建立的SYBR GreenⅠ荧光定量PCR检测方法对人工混入6种不同污染剂量的CIAV及未混入CIAV的新城疫活疫苗进行检测,结果显示可检测到1EID50/1000羽份的低剂量污染,而空白疫苗检测为阴性(图2)。而使用同一引物进行常规PCR检测,仅仅可以检测到100EID50/1000羽份的CIAV污染,空白疫苗检测为阴性(图3)。使用建立的荧光定量PCR方法从14种(批)弱毒疫苗检测到1份禽痘病毒(Fowlpox virus,FPV)活疫苗和1份NDV活疫苗中CIAV均为阳性,将这2份活疫苗接种SPF鸡后42 d检测到CIAV特异性抗体,判定为阳性,两种检测方法对14种(批)弱毒疫苗污染CIAV的检测结果符合率为100%;但以常规PCR检测这2份样品结果为阴性。具体结果见表2。

图2 商品化疫苗中污染CIAV的荧光定量PCR检测结果Fig.2 The result of artif cial contamination doses of CIAV by qPCR0: 阴性对照; 1: 空白疫苗; 2~7: 0. 1至10000 EID50/mL; 8: 阳性对照0: Negative control; 1: Blank vaccine; 2-7: 0.1 to 10000 EID50/mL; 8: Positive control

图3 常规PCR检测疫苗人为混入的CIAVFig.3 The result of artif cial contamination doses of CIAV by the conventional PCRM: DNA分子质量标准(DL2000); 1: 阳性对照; 2~7: 104EID50至0.1EID50/μL; 8: 空白疫苗; 9: 阴性对照M: DNA Marker(DL2000); 1: Positive control; 2-7: 104EID50to 0.1 EID50/μL; 8: Blank vaccine; 9: Negative control

表2 不同方法检测商品化疫苗中CIAV污染结果Table 2 Detection of CIAV contamination in commercial poultry vaccines by different methods
3 讨论
目前,对疫苗中外源病毒污染的检测主要包括细胞培养检查法以及经典的SPF鸡检查法。但是,绝大多数疫苗如NDV、MDV和FPV活疫苗的检测非常复杂和困难,这是因为上述病毒接种细胞后能够产生细胞病变,这导致污染的外源病毒复制和增殖受到干扰难以被检测到。尽管经典的SPF鸡检查法相对可靠,但其周期较长,成本也比较高,更重要的是,对于一般种禽场存在困难,因为这需要特定的设备并要求长期饲养SPF鸡备用。因此,越来越多的检测机构试图通过分子生物学检测方法来检测疫苗中外源病毒的污染,例如邵红霞等[14]通过建立针对CIAV的PCR检测方法在一些商品化疫苗中检测出CIAV的污染。
相对于常规PCR,SYBR GreenⅠ实时荧光定量PCR技术具有快速、准确、特异性高、可实时监测、定量以及自动化程度高等优点,可用于动物病毒性疾病的快速诊断及定量检测,目前已经广泛用于鸡新城疫、禽流感、鸡马立克氏病、鸭乙型肝炎、鸭瘟、伪狂犬病、猪瘟及口蹄疫等动物病毒病的诊断[17-21]。通常在禽弱毒疫苗中CIAV污染的剂量是非常小的,这可能导致一般的PCR方法无法有效检测出一些低剂量的CIAV污染。此前,本实验室建立了针对CIAV的TaqMan探针实时荧光定量检测方法[22],并证实其灵敏度、特异性和可重复性均非常良好,可以用于疫苗中CIAV低剂量污染的检测,但是它需要合成专门的TaqMan探针,成本相对较高,并且针对每一种外源病毒检测时均需要合成特定探针,给企业带来较多的经济开支,企业不容易接受。
本研究根据CIAV保守序列设计了1对特异性引物,建立了针对CIAV的SYBR GreenⅠ荧光定量PCR检测方法,并证实其灵敏度、特异性和可重复性均非常好。该方法可以检出的最低浓度为6.36 copies/ μL,其灵敏度远远高于普通PCR,非常适用于禽弱毒疫苗中CIAV污染的微量检测。为了验证所建立的方法在检测疫苗中CIAV污染的最低限度,我们人为地向新城疫疫苗中加入不同剂量的CIAV,结果显示常规PCR只检测到100EID50/1000羽份污染,而本研究建立的SYBR GreenⅠ荧光定量PCR检测方法可检测到1000羽份疫苗中污染1EID50,具有与TaqMan探针实时荧光定量检测方法同等的灵敏度。所建立的荧光定量PCR检测方法灵敏度优势在检测商品化疫苗中得到了更好的体现,利用常规PCR方法对市场上的14种(批)弱毒疫苗进行检测,均未检到CIAV阳性,但本研究建立的SYBR GreenⅠ荧光定量PCR方法检测到1份FPV弱毒疫苗和1份NDV弱毒疫苗中均存在CIAV污染,并进一步通过接种SPF鸡的经典金标准方法得到了证实。本研究建立的方法将有助于企业能够准确而快速地检测禽弱毒疫苗中的CIAV污染。
[1] Yuasa N, Yoshida I. Isolation and Some Characteristics of an Agent Inducing Anemia in Chicks[J]. Avian Dis, 1979, 23(2): 366-385.
[2] Goodwin M A, Brown J, Smeltzer M A, et al. A survey for parvovirus-like virus (so-called chick anemia agent) antibodies in broiler breeders[J]. Avian Dis, 1990, 34(3): 704-708.
[3] Lucio B, Schat K A, Shivaprasad H L. Identification of the chicken anemia agent, reproduction of the disease, and serological survey in the United States[J]. Avian Dis, 1990, 34(1): 146-153.
[4] Goodwin M A, Brown J, Miller S I, et al. Infectious anemia caused by a parvovirus-like virus in Georgia broilers[J]. Avian Dis, 1989, 33(3): 438-445.
[5] Mcnulty M S, Connor T J, Mcneilly F, et al. Chicken anemia agent in the United States: isolation of the virus and detection of antibody in broiler breeder flocks[J]. Avian Dis, 1989, 33(4): 691-694.
[6] Mcnulty M S, Connor T J, Mcneilly F, et al. A serological survey of domestic poultry in the United Kingdom for antibody to chicken anaemia agent[J]. Avian Pathol, 1988, 17(2): 315-324.
[7] Chettle N J, Eddy R K, Wyeth P J, et al. An outbreak of disease due to chicken anaemia agent in broiler chickens in England[J]. Vet Rec, 1989, 124(9): 211-215.
[8] Mcnulty M S, Connor T J, Mcneilly F, et al. Preliminary characterisation of isolates of chicken anaemia agent fromthe United Kingdom[J]. Avian Pathol, 1990, 19(1): 67-73.
[9] Connor T J, Mcneilly F, Firth G A, et al. Biological characterisation of Australian isolates of chicken anaemia agent[J]. Aus Vet J, 1991, 68(6): 199-201.
[10] Brown K, Browning G F, Scott P C, et al. Full-length infectious clone of a pathogenic Australian isolate of chicken anaemia virus[J]. Aus Vet J, 2000, 78(9): 637-40.
[11] Von B V, Fuchs B, Rudolph R. Avian infectious anaemia caused by chicken anaemia agent (CAA)[M]// Acute Virus Infections of Poultry. Springer Netherlands, 1986: 203-212.
[12] Jørgensen P H. A micro-scale serum neutralisation test for the detection and titration of antibodies to chicken anaemia agent--prevalence of antibodies in Danish chickens[J]. Avian Pathol, 1990, 19(3): 583-593.
[13] 崔现兰, 幸桂香, 吴东来, 等. 鸡传染性贫血病病毒的鉴定[J]. 中国预防兽医学报, 1992(6): 3-5.
[14] 邵红霞, 王平平, 武敏, 等. 家禽活疫苗中鸡传染性贫血病毒PCR检测方法的建立[J]. 中国家禽, 2012, 34(21): 28-30.
[15] 崔治中. 免疫抑制性病毒多重感染在鸡群疫病发生和流行中的作用[J]. 畜牧兽医学报, 2003, 34(5): 417-421.
[16] 王林, 陈浩, 崔治中. 1株鸡传染性贫血病毒野毒株对不同日龄SPF鸡的致病性[J]. 中国兽医学报, 2010, 30(2): 188-191.
[17] 屈素洁, 梁媛, 韦显凯, 等. 荧光定量R T-PCR检测鸡新城疫病毒方法的建立及应用[J]. 上海畜牧兽医通讯, 2014(3): 19-21.
[18] 申伟霞, 田巧珍, 陈圆, 等. H3、H9亚型禽流感病毒双重荧光定量PCR方法的建立及初步应用[J]. 中国动物传染病学报, 2014(1): 16-24.
[19] 程洋, 冯泽清, 杨辉林, 等. 鸡马立克氏病毒SYBR GreenⅠ实时荧光定量PCR检测方法的建立[J]. 四川农业大学学报, 2013, 31(4): 427-432.
[20] 于新友, 李天芝, 王金良, 等. 鸭瘟病毒SYBR Green Ⅰ荧光定量PCR检测方法的建立[J]. 水禽世界, 2015, 40(3): 33-35.
[21] 赵丽, 崔保安, 陈红英, 等. 猪伪狂犬病病毒 SYBRGreenⅠ 实时荧光定量 PCR 检测方法的建立[J]. 中国兽医学报, 2010, 30(9): 1185-1188.
[22] 任志浩, 房立春, 栾怀彪, 等. 鸡传染性贫血病毒荧光定量 PCR 检测方法的建立及其在疫苗污染检测中的应用[J]. 畜牧兽医学报, 2016, 47(7): 1459-1464.
DEVELOPMENT AND APPLICATION OF SYBR GREENⅠQUANTITATIVE PCR FOR THE DETECTION OF CHICKEN INFECTIOUS ANEMIA VIRUS CONTAMINATION IN ATTENUATED VACCINES
FU Jia-yuan1, LI Dan2, CHANG Zhen3, LI Yang1, FANG Li-chun1, CUI Zhi-zhong1, CHANG Shuang1, ZHAO Peng1
(1. College of Veterinary Medicine, Shandong Agricultural University, Taian 271018, China; 2. Shandong Medicine Technician College, Taian 271016, China; 3. Huangdao Entry-Exit Inspection and Quarantine Bureau, Qingdao 266000, China.)
To detect the contamination of Chicken infectious anemia virus (CIAV) in attenuated poultry vaccines, one pair of specif c primers were designed and synthesized within conserved region VP2 partial gene sequence of CIAV for development and optimization of a SYBR GreenⅠ real-time quantitative PCR assay. The sensitivity limit of the SYBR Green I quantitative PCR was 6.36 copies/μl, which was 1000 times higher than that of conventional PCR assay. Under experimental condition, the detection limit was 1 EID50/1000 plumes. The SYBR Green I quantitative PCR had good specif city to CIAV and had no cross-reaction with other REV, ALV and MDV genes. The coeff cients of variations of both intra-assay and inter-assay were less than 2.5%, suggesting good repeatability. Two out of14 commercial poultry vaccine samples were tested as CIAV positive by using the SYBR Green I quantitative PCR method, which were conf rmed in classical SPF chicken experiment. These results suggest that the SYBR Green I quantitative PCR developed here has good specif city, sensitivity and repeatability and can be used in diagnostic laboratories for detection of a low dosage CIAV contamination in attenuated vaccines.
Chicken infectious anemia virus; attenuated vaccines; contamination; Real-time PCR; SYBR Green Ⅰ
S852.659.2
A
1674-6422(2017)03-0034-06
2016-11-18
农业部财政项目“禽垂直传播性疾病诊断技术研究”
付佳媛,女,硕士研究生,预防兽医学专业;李丹,女,硕士,主要从事禽疾病监测
常爽,E-mail:changshuang81@126.com;赵鹏,E-mail:zhaopeng@sdau.edu.cn
