猪繁殖与呼吸综合征病毒N蛋白与宿主细胞DDX5蛋白相互作用研究
2017-07-31黄勤锋张文超姜一峰周艳君童光志
刘 欢,黄勤锋,张文超,姜一峰,杨 莘,高 飞,周艳君,童光志
(中国农业科学院上海兽医研究所,上海 200241)
·研究论文·
猪繁殖与呼吸综合征病毒N蛋白与宿主细胞DDX5蛋白相互作用研究
刘 欢,黄勤锋,张文超,姜一峰,杨 莘,高 飞,周艳君,童光志
(中国农业科学院上海兽医研究所,上海 200241)
研究利用免疫共沉淀的方法证明猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV) N蛋白与MARC-145细胞DDX5蛋白之间存在相互作用,且两种蛋白共定位于MARC-145细胞质内。利用构建的EGFP-N和mCherry-DDX5真核表达载体共转染MARC-145细胞后,发现N蛋白并不能将DDX5蛋白募集至细胞质。采用siRNA沉默MARC-145细胞DDX5基因表达之后,病毒复制水平上升;荧光定量检测结果显示,DDX5沉默表达也能够明显促进病毒基因组RNA和长链亚基因组RNA的转录水平。结果表明DDX5参与了病毒复制转录过程并对病毒增殖具有抑制作用。
猪繁殖与呼吸综合征病毒;N蛋白;DDX5;相互作用
猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus, PRRSV)是一种具有囊膜包被的、单股正链RNA病毒。在病毒学分类上,PRRSV属于套式病毒目、动脉炎病毒科、动脉炎病毒属成员之一[1]。该病自20世纪90年代出现以来,由于能够导致怀孕母猪繁殖障碍(流产、产死胎或者木乃伊胎)和各年龄段猪群呼吸障碍等临床症状,给世界各国养猪业造成了严重的经济损失。特别是在2006年我国南方爆发的高致病性猪繁殖与呼吸综合征,给我国和亚洲其他国家造成了严重的经济损失[2]。
PRRSV基因组包含有10个开放性阅读框,其中ORF1a和ORF1b合成病毒的非结构蛋白;而ORF2、ORF2b、ORF3~ORF5、ORF5a、ORF6和ORF7合成病毒的结构蛋白。ORF1a和ORF1b占基因组的80%左右,由基因组RNA直接作为mRNA翻译合成非结构蛋白;ORF1a和ORF1b在翻译过程中共用一个起始密码子,但是在基因组包含的2个核糖体移码位点扩大了蛋白合成能力[3,4]。套式病毒的一个重要特点就是能够转录合成一系列含有相同3'和5'末端序列的亚基因组RNA(subgenomic mRNAs,sg mRNAs),这些sg mRNAs直接作为信使RNA翻译合成病毒的结构蛋白。由此可知,PRRSV的非结构蛋白和结构蛋白的翻译合成来源于两种不同类型的模板。病毒在复制过程中,常常需要在不同阶段和不同水平对转录及翻译过程进行调控,从而实现病毒基因组复制和蛋白合成之间的平衡[5]。
随着近年来蛋白质组学的发展,相关研究指出PRRSV的N蛋白能够与多种宿主蛋白相互作用[6,7],然而这些与之相互作用的宿主蛋白对于病毒复制的影响却并没有进行深入探究。本研究利用免疫共沉淀技术检测证实,PRRSV N蛋白能够与MARC-145细胞的RNA解旋酶(DDX5)相互作用。随后,本研究进一步探究这种相互作用在病毒复制过程中的作用机制,为深入了解PRRSV的复制转录调控机制提供线索。
1 材料和方法
1.1 细胞与病毒 非洲绿猴肾细胞(MARC-145)、人胚胎肾细胞(HEK293T)由本实验保存;HPPRRSV HuN4株是2006年从湖南省某“高热病”发病猪场分离得到的毒株[2],-80℃保存备用。
1.2 抗体与试剂 兔抗DDX5单克隆抗体(ab126730)购自Abcam公司;鼠抗PRRSV N蛋白单克隆抗体由本实验室制备保存;兔抗Flag标签(F7425)多克隆抗体、鼠抗HA标签单克隆抗体(H9658)和偶联鼠抗HA单克隆抗体的Agrose(A2095)均购自Sigma-Aldrich公司;pCMV-N-mCherry真核表达载体购自碧云天公司;Lipofectamine® RNAiMAX Reagent、Alexa Fluor 488 donkey anti-mouse IgG和Alexa Fluor 568 donkey anti-rabbit IgG均购自Invitrogen公司;Protein A/G PLUS-Agrose 购自Santa Cruz公司。
1.3 引物设计 根据GenBank登录的猴DDX5基因序列(NM_001258162),设计上游引物DDX5-F和下游引物DDX5-HA-R、DDX5-Flag-R来扩增MARC-145细胞DDX5蛋白编码基因,扩增得到的DDX5基因片段分别带有HA和Flag蛋白序列。根据PRRSV HuN4株病毒基因组N蛋白基因编码序列,设计上游引物N-F和下游引物N-HA-R、N-Flag-R来扩增分别含有HA和Flag标签的N基因片段,随后将以上片段克隆至真核表达载体pCAGGS上。此外,利用融合PCR的方法,将EGFP和PRRSV N基因融合后克隆至pCAGGS载体。引物序列如表1所示。

表1 本研究使用的引物Table1 Primers used in this study
1.4 总RNA提取和cDNA合成 将PRRSV HuN4株感染MARC-145细胞后,采用TRIzol法提取被感染细胞的总RNA。随后采用RevertAid First Strand cDNA Synthesis Kit试剂盒,以总RNA 为模板,参照说明书进行反转录合成cDNA,-80℃ 备用。
1.5 N蛋白和DDX5真核表达载体构建 以cDNA为模板,采用Phusion® High-Fidelity DNA聚合酶进行PCR反应;利用上游引物N-F和下游引物N-HA-R、N-Flag-R分别扩增含有HA和Flag标签序列的PRRSV N基因片段;以上游引物DDX5-F和下游引物DDX5-HA-R、DDX5-Flag-R分别扩增含有HA和Flag标签序列的DDX5基因片段。胶回收PCR产物,经酶切、纯化后连接至pCAGGS真核表达载体上;将连接产物转化DH5α感受态细胞,挑取阳性克隆和提取质粒DNA,并将阳性质粒送上海生工生物公司测定序列。
1.6 真核表达蛋白免疫共沉淀(co-immunoprecipitation,Co-IP) 将1.5获得的真核表达载体pCAGGS-N-HA和pCAGGS-DDX5-Flag、pCAGGS-DDX5-HA和pCAGGS-N-Flag分别共转染HEK 293T细胞,并单独转染各阳性质粒和空载体作为对照。在转染后24 h使用IP Lysis Buffer裂解细胞并离心收取蛋白样品。在各蛋白样品中加入10 μL的Anti-HA-Agrose,混匀后置于4℃旋转孵育过夜。孵育完成后的Agarose beads在4℃、8000×g离心2 min;弃上清液,加入600 μL的IP Lysis Buffer重悬Agrose beads后,离心2 min;重复洗涤4次后,直接加入1×上样缓冲液重悬Agrose beads,沸水浴10 min后置于-20℃保存备用。
1.7 EGFP-N和mCherry-DDX5融合表达载体的构建 以pCAGGS-N-HA为模板,利用引物EGFP-N-F与EGFP-N-MR PCR扩增得到3'端含有部分EGFP序列的N基因片段;以pCAGGS-EGFP为模板,EGFPN-MF与N-HA-R作为上下游引物PCR扩增得到5'含有部分N基因序列的EGFP片段;胶回收以上2个片段,并测定其浓度;以胶回收产物作为模板(各10 ng),EGFP-N-F和H-HA-R作为上下游引物再次进行PCR扩增得到融合基因EGFP-N,随后将其克隆至pCAGGS载体上,阳性质粒命名为EGFP-N。以pCAGGS-DDX5-HA作为模板,pCMV-DDX5-HA-F和DDX5-HA-R分别作为上下游引物PCR扩增DDX5基因序列后,经酶切后将其克隆至pCMV-N-mCherry上阳性质粒命名为mCherry-DDX5。
1.8 PRRSV N蛋白与宿主细胞DDX5 免疫共沉淀实验接种PRRSV HuN4(第5代和第112代)至MARC-145细胞,接毒量为0.5 MOI;在感染后48 h后,裂解细胞并离心收取蛋白样品。在收取的蛋白样品中加入小鼠IgG(1μg)和20 μL重悬的Protein A/G PLUS-Agrose后,4℃孵育2 h以清除蛋白样品中的非特异性结合作用。孵育完成后,4℃离心并将上清转移至新的1.5 mL离心管中;加入10 μL的鼠抗PRRSV N多克隆抗体,4℃旋转孵育1 h;抗体孵育完成后,加入20 μL重悬的Protein A/G PLUSAgrose 并在4℃条件下旋转孵育过夜;孵育完成后,重复洗涤4次后直接 1×上样缓冲液重悬Agrose beads,沸水浴10 min后置于-20℃保存备用。
1.9 激光共聚焦实验 将HuN4株感染MARC-145细胞24 h后,用4 %多聚甲醛固定细胞,Triton X-100通透处理,5% BSA封闭1 h,以小鼠抗N mAb和兔抗DDX5 mAb为一抗室温孵育2 h,随后以Alexa Fluor 488 donkey anti-mouse IgG和Alexa Fluor 568 donkey anti-Rabbit IgG为二抗室温孵育1 h,最后经DAPI染细胞核,PBS清洗后通过激光共聚焦显微镜观察实验结果。
1.10 siRNA干扰实验 针对扩增得到的MARC-145细胞DDX5基因序列,设计siRNA沉默MARC-145细胞的DDX5表达。采用Lipofectamine® RNAiMAX Reagent转染siRNA至终浓度为100 nmol/μL,并于转染后48 h使用Western blot方法检测蛋白的表达水平。同时将HuN4株以0.01MOI感染siRNA处理后的MARC-145细胞,在感染后每隔12 h收取细胞培养上清,使用MARC-145细胞分别测定其TCID50。
1.11 荧光定量实验 在使用siRNA沉默MARC-145细胞DDX5蛋白表达后,将HuN4株以1 MOI感染细胞并在感染12 h时,使用TRIzol提取细胞总RNA。经反转录合成第1链cDNA后,使用荧光定量方法对细胞内的PRRSV基因组RNA和亚基因组mRNA进行相对定量分析,计算结果按照ΔΔCt法进行分析,引物参照相关文献[13],由上海捷瑞公司合成。
2 结果
2.1 N蛋白与DDX5的Co-IP检测 将PRRSV N蛋白和DDX5真核表达载体共转染至HEK 293T细胞,并同时分别单独转染N蛋白和DDX5真核表达载体和pCAGGS空载体作为对照。Western blot检测结果发现,对照样品(Input)中的各蛋白均正常表达,而正反向Co-IP结果表明,PRRSV N蛋白能够与DDX5互作;而空载体不与DDX5或者N蛋白发生相互作用(图1A,图1B)。
2.2 PRRSV N蛋白与宿主细胞DDX5免疫共沉淀 在PRRSV HuN4株感染MARC-145细胞后,同时设置未感染细胞作为阴性对照。结果发现,不论是强毒(F5)还是弱毒株(F112),病毒的N蛋白同样能够与MARC-145细胞的DDX5蛋白相互作用(图1C)。

图1 Co-IP检测N蛋白与DDX5互作Fig.1 Identif cation of the interaction between N protein and DDX5 by Co-IPA: N蛋白与DDX5免疫共沉淀; B: DDX5与N蛋白免疫共沉淀; C: Co-IP验证病毒N蛋白与DDX5互作A: N protein Co-IP with DDX5; B: DDX5 immunoprecipated with N protein; C: Verif cation of viral N protein interacted with DDX5 by Co-IP
2.3 N蛋白与DDX5亚细胞共定位分析 在HuN4感染MARC-145细胞后48 h后,利用鼠源和兔源的特异性抗体分别标记病毒N蛋白及细胞DDX5蛋白,以检测两种互作蛋白在细胞内共定位部位。结果发现,仅有部分N蛋白与DDX5蛋白在细胞质共定位,在细胞核并没有明显的共定位情况(图2)。
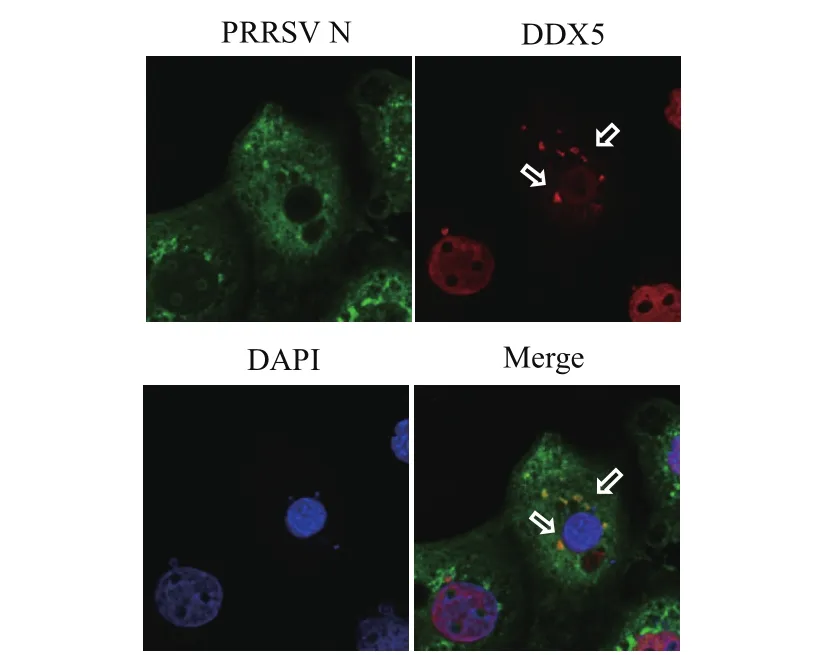
图2 PRRSV N蛋白与DDX5亚细胞共定位检测Fig.2 Subcellular colocalization of PRRSV N protein and cellular DDX5
2.4 N蛋白不募集DDX5至细胞质 将EGFP-N和mCherry-DDX5共转染MARC-145细胞后24 h,在经过固定和通透后,使用DAPI进行细胞核染色。激光共聚焦实验检测发现,单独表达EGFP-N的细胞不存在点状聚集现象;而当细胞表达mCherry-DDX5时,N蛋白能够与DDX5在细胞质出现点状聚集现象,表明N蛋白不能将DDX5募集至细胞质,而是能够特异性的与DDX5在细胞质共定位(图3)。
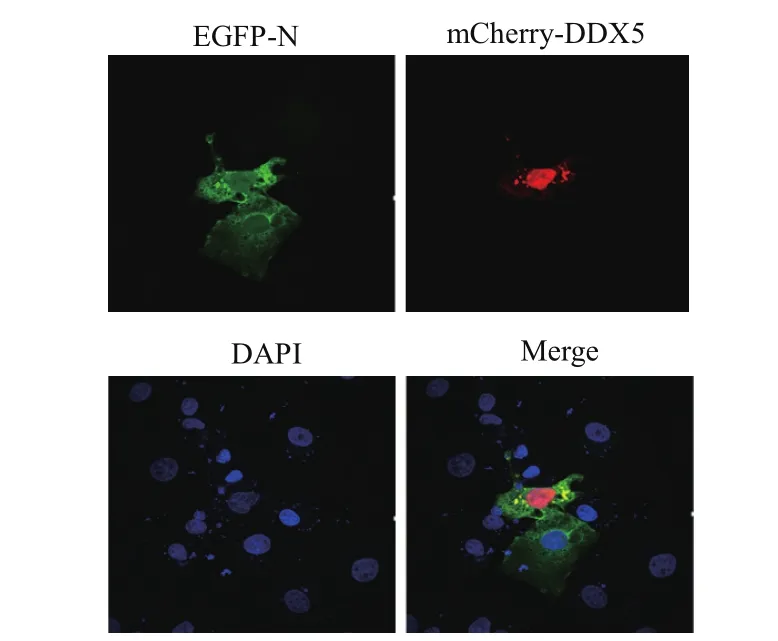
图3 N蛋白不参与募集DDX5Fig.3 N protein is not involved in recruiting DDX5 to the cytoplasma
2.5 siRNA沉默DDX5对病毒复制的影响 利用siRNA干扰方法,沉默MARC-145细胞内DDX5的表达,并检测siRNA干扰效果。以0.01 MOI HuN4株感染沉默DDX5表达的MARC-145细胞,同时设置siRNA对照和细胞空白处理对照。结果发现,当DDX5的表达明显下调后(图4A),病毒在复制水平上升,感染24 h和36 h时比对照组和空白组复制水平高1个滴度左右(图4B)。

图4 沉默DDX5表达对PRRSV复制的影响Fig.4 Effection of DDX5 silencing on PRRSV replicationA: 沉默效果检测; B: HuN4株感染MARC-145细胞24 h和36 h时病毒滴度比较A: Detection of DDX5 silencing eff cacy; B: TCID50comparation at 24 and 36 h postinfection
2.6 DDX5对病毒转录的影响 利用siRNA沉默MARC-145细胞的DDX5蛋白表达后,按照1 MOI接种HuN4株并在感染12 h时,提取细胞内总RNA。采用荧光定量方法分析病毒基因组RNA和亚基因组RNA的转录水平。结果发现,DDX5下调能够明显促进病毒基因组RNA和长链亚基因组RNA的转录,而短链RNA的转录水平与对照组差异不显著。这表明DDX5在PRRSV转录过程中起到了负调控的作用(图5)。
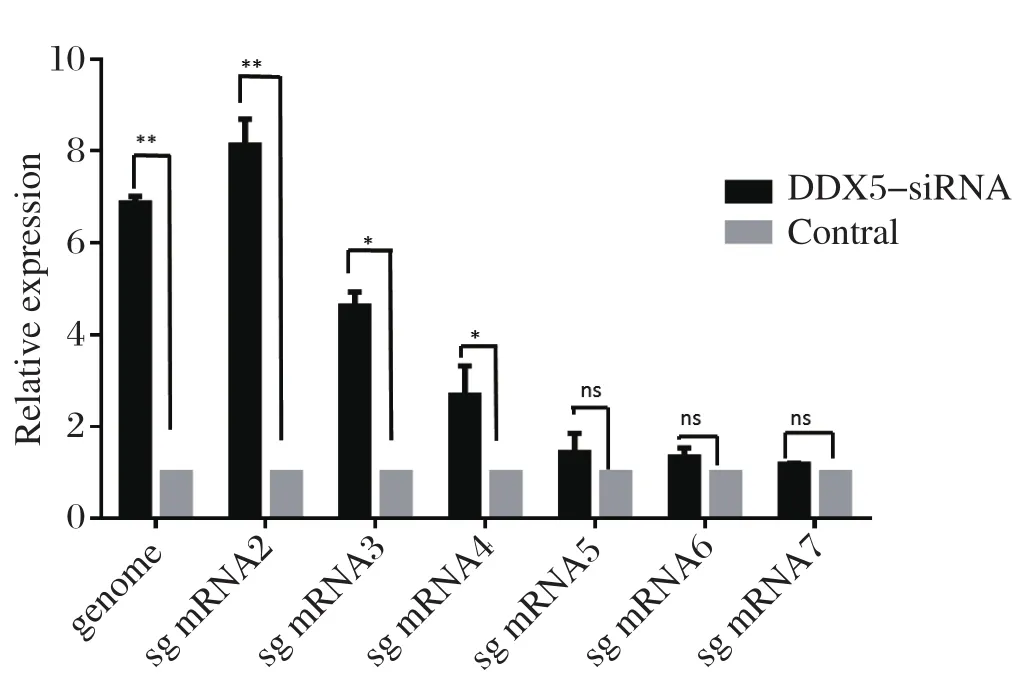
图5 沉默DDX5对PRRSV亚基因组的影响Fig.5 Effection of DDX5 silencing on PRRSV transcription
3 讨论
RNA解旋酶是一种能够利用ATP水解产生的能量结合、重构RNA或者核糖核蛋白复合体的保守性蛋白酶,几乎参与了真核细胞中所有RNA代谢过程[8]。近年来研究发现,DEAD-box解旋酶还具有促进双链形成、去除RNA结合的蛋白分子、作为核糖核蛋白复合体的组装平台等功能[9-11]。
在冠状病毒,Wu等[12]指出冠状病毒磷酸化的N蛋白能够募集宿主细胞的RNA解旋酶DDX1,从而在基因组转录过程中使得转录复合体通读TRS而利于基因组RNA和长链sg mRNA的合成。这可能是由于DDX1在病毒不连续转录过程中,能够解开基因组RNA 5'端的发夹结构的缘故。
在本研究当中,我们证实PRRSV N蛋白能够与MARC-145细胞的RNA解旋酶DDX5相互作用。真核表达的N蛋白或者病毒本身的N蛋白均能够免疫共沉淀宿主细胞的DDX5蛋白(图1)。这一发现表明,PRRSV N蛋白除了能够募集RNA 解旋酶DHX9之外,还能够与宿主细胞的另外一种RNA解旋酶相互作用。先前研究表明PRRSV N蛋白能够与多种宿主细胞RNA解旋酶相互作用,包括DDX3X、DDX5、DHX9、DDX17和DDX30[6]。
在病毒复制过程中,病毒侵入细胞后,经脱衣壳释放病毒基因组,随后直接翻译合成病毒的RdRp酶:nsp9。Nsp9随后启动病毒基因组RNA和亚基因组sg mRNA的合成。而编码N蛋白的sg mRNA7是病毒最短、最容易转录的1条sg mRNA,sg mRNA7翻译合成N蛋白后并不会立即组装成病毒粒子,而是通过磷酸化或者与宿主蛋白之间的相互作用来共同调控病毒的转录过程。
在病毒的复制转录过程,病毒为了最大化的利用细胞的各种资源进行病毒粒子的增殖。PRRSV在病毒复制转录时需要对病毒基因组RNA和亚基因组sg mRNA的转录水平进行调控。在本研究当中,当DDX5受到siRNA干扰而下调表达后,病毒基因组RNA和长链的sg mRNA的合成水平明显高于对照组,而短链的sg mRNA合成水平没有受到影响。这说明在基因组RNA和长链亚基因组sg mRNA的转录过程中,DDX5可能起到了负调控作用。由于N蛋白能够与DDX5和DHX9相互作用,而DHX9证实能够促进病毒基因组RNA和长链亚基因组sg mRNAs的合成[13]。这些结果表明,PRRSV nsp9、DHX9和DDX5可能通过与N蛋白相互作用形成转录调控复合体。这几种蛋白之间能够共同调节病毒RNA转录水平。由此可知,在病毒复制过程中,PRRSV可能通过N蛋白与DDX5和DHX9不同的结合水平而调控病毒基因组RNA和亚基因组sg mRNAs的转录水平。然而DDX5或者DHX9是通过何种机制调控PRRSV 转录过程仍然需要进一步的研究。
[1] Cavanagh D. Nidovirales: a new order comprising Coronaviridae and Arteriviridae[J]. Arch Virol, 1997, 142(3): 629-633.
[2] Tong G Z, Zhou Y J, Hao X F, et al. Highly pathogenic porcine reproductive and respiratory syndrome, China[J]. Emerg Infect Dis, 2007, 13(9): 1434-1436.
[3] Fang Y, Treffers E E, Li Y, et al. Efficient -2 frameshifting by mammalian ribosomes to synthesize an additional arterivirus protein[J]. Proc Natl Acad Sci USA, 2012, 109 (43): E2920-2928.
[4] Meulenberg J J, Hulst M M, de Meijer E J, et al. Lelystad virus, the causative agent of porcine epidemic abortion and respiratory syndrome (PEARS), is related to LDV and EAV. Virology, 1993, 192(1): 62-72.
[5] Pasternak A O, Spaan W J, Snijder E J. Nidovirus transcription: how to make sense...?[J]. J Gen Virol, 2006, 87(Pt 6): 1403-1421.
[6] Jourdan S S, Osorio F, Hiscox J A. An interactome map of the nucleocapsid protein from a highly pathogenic North American porcine reproductive and respiratory syndrome virus strain generated using SILAC-based quantitative proteomics[J]. Proteomics, 2012, 12(7): 1015-1023.
[7] Liu L, Lear Z, Hughes D J, et al. Resolution of the cellular proteome of the nucleocapsid protein from a highly pathogenic isolate of porcine reproductive and respiratory syndrome virus identifies PARP-1 as a cellular target whose interaction is critical for virus biology[J]. Vet Microbiol, 2015, 176(1-2): 109-119.
[8] Tanner N K, Linder P. DExD/H box RNA helicases: from generic motors to specific dissociation functions[J]. Mol Cell, 2001, 8(2): 251-262.
[9] Fairman M E, Maroney P A, Wang W, et al. Protein displacement by DExH/D "RNA helicases" without duplex unwinding[J]. Science, 2004, 304(5671): 730-734.
[10] Grifo J A, Abramson R D, Satler C A, et al. RNA-stimulated ATPase activity of eukaryotic initiation factors[J]. J Biol Chem, 1984, 259(13): 8648-8654.
[11] Rossler O G, Straka A, Stahl H. Rearrangement of structured RNA via branch migration structures catalysed by the highly related DEAD-box proteins p68 and p72[J]. Nucleic Acids Res, 2001, 29(10): 2088-2096.
[12] Wu C H, Chen P J, Yeh S H. Nucleocapsid phosphorylation and RNA helicase DDX1 recruitment enables coronavirus transition from discontinuous to continuous transcription[J]. Cell Host Microbe, 2014, 16(4): 462-472.
[13] Liu L, Tian J, Nan H, et al. Porcine Reproductive and Respiratory Syndrome Virus Nucleocapsid Protein Interacts with Nsp9 and Cellular DHX9 To Regulate Viral RNA Synthesis[J]. J Virol, 2016, 90(11): 5384-5398.
CHARACTERIZATION OF INTERACTION BETWEEN NUCLEOCAPSID PROTEIN OF PORCINE REPRODUCTIVE AND RESPIRATORY SYNDROME VIRUS AND HOST DDX5 PROTEIN
LIU Huan, HUANG Qin-feng, ZHANG Wen-chao, JIANG Yi-feng, YANG Shen, GAO Fei, ZHOU Yan-jun, TONG Guang-zhi
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241,China)
In the present study, the interaction between Porcine reproductive and respiratory syndrome virus(PRRSV) N protein and cellular DDX5 protein was verif ed by co-immunoprecipitation assay. Furthermore, confocal laser experiment showed that PRRSV N protein and DDX5 colocalized in the cytoplasm of virus infected MARC-145 cells. In addition, eukaryotic vectors expressing EGFP-N and mCherry-DDX5 fusion proteins were transfected to MARC-145 cells. The results showed that DDX5 was not recruited into cytoplasm by N protein. When DDX5 was silenced by siRNA, the growth ability of PRRSV was enhanced and real-time RT-PCR results showed that the transcriptional level of genome RNA and longer subgenomic RNA was signif cantly higher than that of the control, which indicating a negative regulatory role of DDX5 during PRRSV replication and transcription.
Porcine reproductive and respiratory syndrome virus; nucleocapsid protein; DDX5; protein-protein interaction
S852.659.6
A
1674-6422(2017)03-0012-06
2017-04-20
国家科技支撑项目(2015BAD12B01-1);国家自然科学基金项目(31502072,31302098,31300140)
刘欢,男,博士研究生,预防兽医学专业
童光志,E-mail:gztong@shvri.ac.cn
