孤独症患者小脑中有氧糖酵解酶的表达☆
2017-07-31程培培禹顺英
程培培禹顺英○☆
孤独症患者小脑中有氧糖酵解酶的表达☆
程培培*禹顺英*○☆
目的研究孤独症患者小脑中有氧糖酵解酶表达水平及其与孤独症发病的关系。方法用Western Blotting方法定量检测8例孤独症患者和8名年龄相匹配的对照者尸脑小脑组织中有氧糖酵解酶己糖激酶Ⅰ型及Ⅱ型同工酶(hexokinase isozyme,HK-Ⅰ、HK-Ⅱ)、血小板型磷酸果糖激酶(platelet-type phosphofructokinase,PFKP)、丙酮酸激酶M型同工酶(pyruvate kinase M isozyme,PKM1/2)、丙酮酸激酶M2亚型同工酶(pyruvate kinase M2 isoform,PKM2)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,GAPDH)、丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)及乳酸脱氢酶A型同工酶(lactate dehydrogenase A isozyme,LDHA)的表达水平。结果孤独症患者与对照相比,小脑中PDH表达减少[(0.715±0.342)vs.(1.028±0.203),P=0.043],其他7种有氧糖酵解酶的表达水平组间差异均无统计学意义(P>0.05)。结论孤独症患者小脑中有氧糖酵解途径PDH表达减少,可能参与孤独症的病理过程。
孤独症小脑有氧糖酵解丙酮酸脱氢酶
孤独症是一种与社会交往缺陷和行为异常有关的神经发育障碍。据统计,目前美国孤独症患病率为14.6‰(1:68)[1]。解剖学、临床及神经影像学的研究表明,小脑具有维持认知功能作用,包括语言功能、执行功能及情感调节,为孤独症受影响的主要脑区之一[2]。语言能力、工作记忆等认知功能缺损程度与小脑容量减少相关[3]。研究发现孤独症患者小脑中浦肯野细胞总数和密度分别减少25%和24%[4]。而且,孤独症患者小脑存在糖代谢减低[5]。由于有氧糖酵解在脑发育早期糖代谢中具有关键作用[6],糖酵解酶表达改变可能参与孤独症发病过程。目前,孤独症患者小脑中有氧糖酵解酶表达情况尚不清楚。本研究测定孤独症患者和年龄相匹配对照者尸小脑组织中8种有氧糖酵解酶的表达水平,包括己糖激酶Ⅰ型及Ⅱ型同工酶(hexokinase isozyme,HK-Ⅰ、HK-Ⅱ)、血小板型磷酸果糖激酶(platelet-type phosphofructokinase,PFKP)、丙酮酸激酶M型同工酶(pyruvate kinase M isozyme,PKM1/2)、丙酮酸激酶M2亚型同工酶(pyruvate kinase M2 isoform,PKM2)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,GAPDH)、丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)及乳酸脱氢酶A型同工酶(lactate dehydrogenase A isozyme,LDHA),探索孤独症患者小脑中有氧糖酵解酶的表达及其与孤独症发病的关系。
1 对象与方法
1.1 研究对象孤独症组8例和对照组8名样本均购买于美国发育障碍脑和组织库(NICHD Brain and Tissue Bank for Developmental Disorders),为新鲜冰冻脑组织(在死亡后3~27 h内完成冰冻)。孤独症组入组标准:符合《美国精神障碍诊断与统计手册第四版》(Diagnostic and Statistical Manual of Mental Disorders,Fourth Edition,DSM-Ⅳ)及修订的孤独症诊断标准(Autism Diagnostic Interview-Revised)。排除标准:①患有脆性X综合征;②患有强迫症;③患有情感障碍;④患有其他神经精神疾病。对照组入组标准:①与孤独症组年龄相匹配的儿童;②不符合孤独症诊断标准。排除标准:①患有脆性X综合征;②患有强迫症;③患有情感障碍;④患有其他神经精神疾病。孤独症组5例男性,3例女性,年龄4~15岁,平均(9.25±3.77)岁;对照组6名男性,2名女性,年龄4~14岁,平均(9.25±3.37)岁。样本具体信息见表1。两组年龄(t<0.001,P=1.000)、性别构成(P=1.000)及死后解剖时间(t=0.719,P=0.484)差异无统计学意义。
1.2 研究方法
1.2.1 小脑组织匀浆将购买的两组新鲜冰冻小脑组织分装于各试管中,分别按体积与质量百分比(10%V/W)加入预冷的组织匀浆液,匀浆液成分为50 mmol/L Tris-HCl(pH为7.4),8.5%蔗糖,2mmol/L乙二胺四乙酸(EDTA),10mmol/Lβ-巯基乙醇(β-mercaptoethanol),以及蛋白酶抑制剂cocktail(Sigma-Aldrich,St.Louis,MO),匀浆结束后用二辛可宁酸(bicinchonininc acid,BCA)法测定各样本的总蛋白浓度。BCA蛋白试剂盒购自Thermo Scientific。
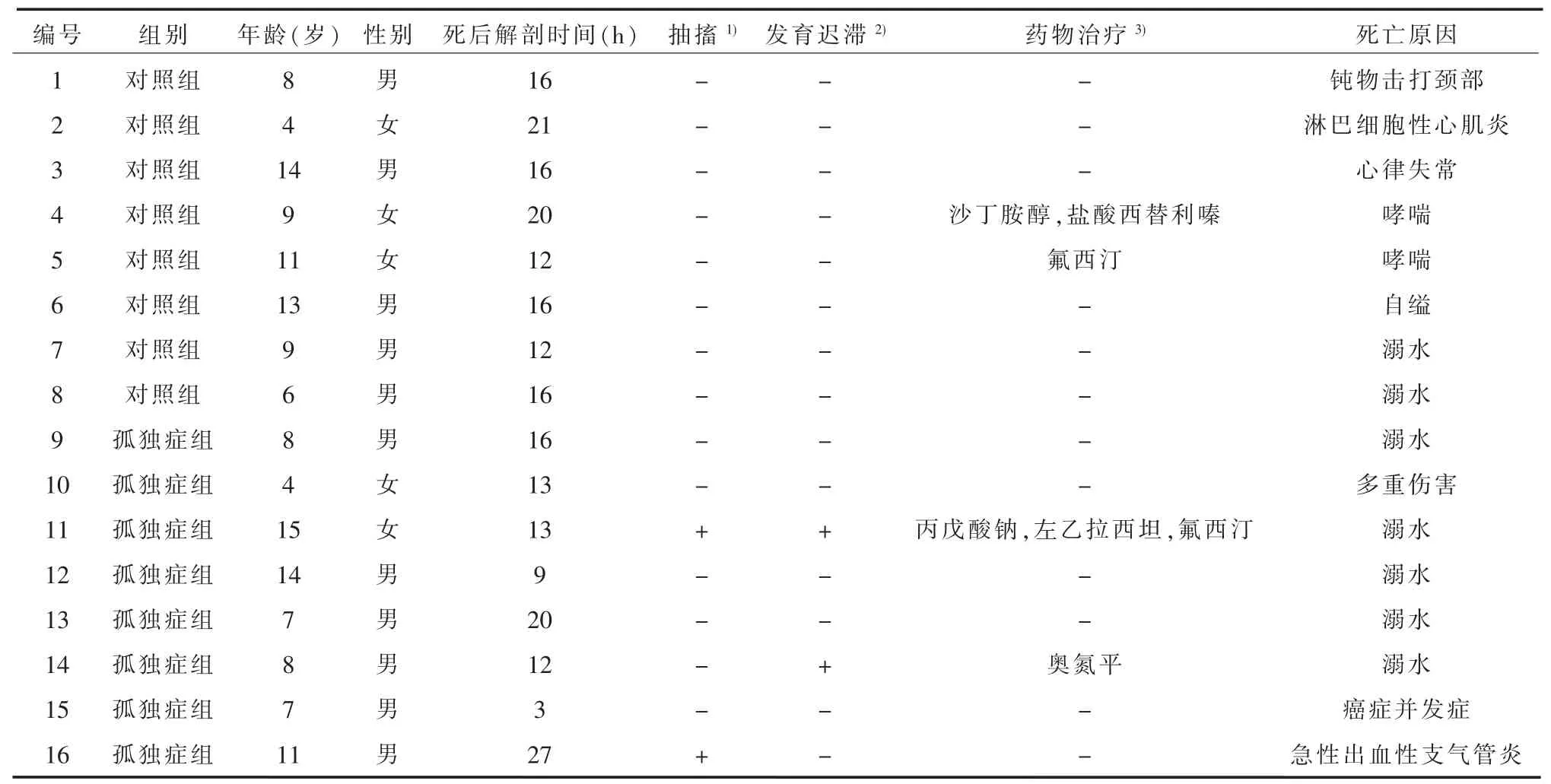
表1 样本信息
1.2.2 测定8种有氧酵解酶的表达水平采用蛋白质印迹法(Western Blotting)分别检测HK-Ⅰ、HK-Ⅱ、PFKP、PKM1/2、PKM2、GAPDH、PDH、LDHA表达水平。制备8%~10%分离胶和5%浓缩胶,加样,电泳,转移蛋白质至PVDF膜。室温下封闭1 h,于4℃孵育一抗(anti-HK-Ⅰ1:1500,anti-HK-Ⅱ1:500,anti-PFKP 1:1500,anti-GAPDH 1:2500,anti-PKM1/2 1:1000,anti-PKM2 1:1000,anti-LDHA 1:1000,anti-PDH 1:2000)过夜(抗体均购买自Cell Signaling Technology),室温孵育二抗(1:2500)1 h,暗室中X光片显影、定影及洗片。以β-tublin或β-actin作为内参对照。使用Image J软件分析Western Blotting结果中条带的灰度值,以反映各种酶表达水平。
1.3 统计学方法统计分析采用SPSS 13.0软件。两组有氧酵解酶的表达水平比较用独立样本t检验。检验水准α=0.05,双侧检验。
2 结果
2.1 有氧糖酵解途径ATP相关催化酶在孤独症尸小脑中表达两组尸小脑中HK-Ⅰ、HK-Ⅱ、PFKP、PKM1/2及PKM2表达情况分析示:与对照组相比,孤独症患者尸小脑中HK-Ⅰ(t=0.658,P= 0.521)、HK-Ⅱ(t=-0.903,P=0.382)、PFKP(t=-0.394,P=0.700)、PKM1/2(t=1.515,P=0.152)及PKM2(t=-1.250,P=0.232)表达水平差异均无统计学意义,见图1、2及表2。
2.2 有氧糖酵解途径NADH相关催化酶在孤独症尸小脑中表达两组尸小脑中GAPDH、PDH及LDHA表达情况分析示:与对照组相比,孤独症组尸小脑中PDH表达减少(t=2.225,P=0.043),差异有统计学意义,两组尸小脑中GAPDH(t=0.544,P=0.598)及LDHA(t=0.242,P=0.813)表达差异均无统计学意义,见图3及表2。
3 讨论

图1 HK-Ⅰ、HK-Ⅱ及PFKP在孤独症组和对照组小脑中的表达情况

图2 PKM1/2及PKM2在孤独症组和对照组小脑中的表达情况
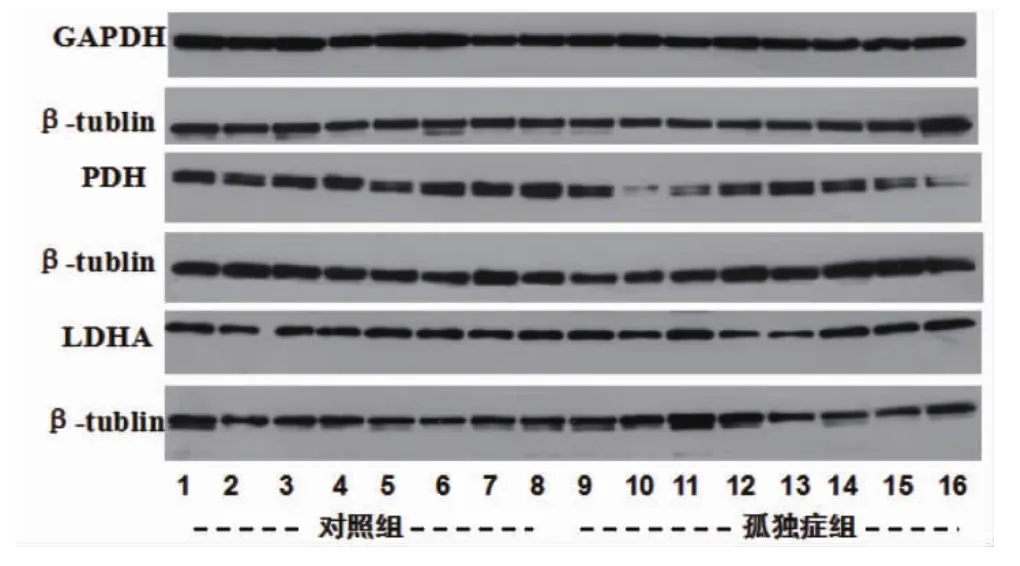
图3 GAPDH、PDH及LDHA在孤独症组和对照组小脑中的表达情况
表2 孤独症组和对照组尸小脑中8种有氧糖酵解酶的表达水平(±s)

表2 孤独症组和对照组尸小脑中8种有氧糖酵解酶的表达水平(±s)
1)与对照组比较,经独立样本t检验,P<0.05
组别孤独症组对照组n88 HK-Ⅰ1.086±0.183 1.139±0.136 HK-Ⅱ0.855±0.277 0.747±0.192 PFKP 1.030±0.132 1.002±0.150 PKM1/2 1.197±0.120 1.335±0.229 PKM2 0.996±0.208 0.889±0.122 GAPDH 1.448±0.281 1.508±0.139 PDH 0.715±0.3421)1.028±0.203 LDHA 0.963±0.287 0.993±0.187
为探讨有氧糖酵解途径在孤独症病理机制中的作用,本研究在孤独症患者尸小脑中分析有氧糖酵解途径中与能量产生或消耗相关的8种酵解酶HK-Ⅰ、HK-Ⅱ、PFKP、PKM1/2、PKM2、GAPDH、PDH及LDHA表达水平,发现与对照组相比,孤独症患者PDH表达显著减少,其余7种有氧糖酵解酶均未发现有显著差异。本研究两组样本的年龄、性别构成及死后解剖时间的差异无统计学意义,然而尚不能完全排除其生前使用药物及死亡原因对结果的影响。
由于有氧糖酵解酶在细胞内的分布及结构不同,酶的活性及表达受多种因素的影响。HK-Ⅰ通过与线粒体结合,催化6-磷酸葡萄糖生成,使糖代谢转向糖酵解方向[7]。本研究孤独症组HK-Ⅰ表达较对照组无显著差异,可能与HK-Ⅰ与线粒体外膜紧密结合有关。由于HK-Ⅱ可与线粒体结合或游离存在于细胞质中,状态的转变受细胞内葡萄糖、6-磷酸葡萄糖及Akt的调节[7],在氧化应激条件下,HK-Ⅱ在Akt磷酸化调节下与线粒体结合发挥对心肌细胞的保护作用[8]。然而,在氧化应激条件下其对神经细胞的作用尚不明确。研究发现PFKP沉默不影响HeLa肿瘤细胞的生存能力及能量产生,包括糖酵解率[9]。PKM2在正常细胞中以高度活跃的四聚体形式存在,在能量需求改变时,能与不活跃的二聚体间发生转换[10]。GAPDH能在氧化应激条件下发挥诱导线粒体消除的作用[11]。LDHA催化丙酮酸产生的乳酸,干扰LDHA表达则导致线粒体活性氧产生增多以及细胞增殖和活动降低[12]。本研究发现两组尸小脑中HK-Ⅰ、HK-Ⅱ、PFKP、PKM1/2、PKM2、GAPDH及LDHA的表达水平无显著差异,提示上述酶在患者小脑中的表达并未受到影响,可能并未参与孤独症发病过程。
PDH是丙酮酸脱氢酶复合物(pyruvate dehydrogenase complex,PDHc)组成中主要起催化作用的部分,PDHc催化丙酮酸转变成乙酰辅酶A,是糖酵解进入三羧酸循环重要的阶段[13]。在对孤独症患者外周血淋巴细胞的研究发现,孤独症组丙酮酸浓度增加,PDH活性则显著降低[14]。线粒体功能受损以及脑能量需求不能满足时,可能引起一系列脑结构和功能改变,导致孤独症症状的产生[15]。本研究发现孤独症小脑中PDH表达减少,造成丙酮酸进入三羧酸循环减少,转而乳酸生成增多,可能造成糖代谢能量减低,导致孤独症脑结构发育异常。研究显示大多数PDHc缺陷患者是由于X染色体连接的PDHA1基因发生突变,该基因编码复合物中PDH的α亚单位[16]。PDH缺陷导致糖类代谢减弱,可能造成脑细胞增殖、分化、迁移成神经元的过程受损[17]。尸脑研究显示,PDH缺陷的婴儿表现出头小畸形、脑回肥厚、小脑和脑干发育不全等[13]。动物研究发现PDH缺陷型雌性小鼠表现出总体细胞、浦肯野神经细胞树突及新生细胞增殖、迁移及分化为神经元的数目减少,缺陷型雄性小鼠则不能存活[17]。另外,既往研究发现孤独症前额叶皮层线粒体中PDH活性降低[15],本研究结果与其一致。PDH活性取决于多酶复合物的完整性,该多酶复合物包含丙酮酸脱氢酶(E1)、二氢硫辛酰胺乙酰基转移酶(E2)及二氢硫辛酰胺脱氢酶(E3),同时受丙酮酸脱氢酶激酶及丙酮酸脱氢酶磷酸酶的竞争性调节[18],本研究未检测孤独症患者小脑中PDH活性调节及PDH在细胞内的表达情况,仍需更多的实验进一步研究。结合既往研究与本研究结果,有氧糖酵解途径中PDH表达减少,可能与孤独症脑结构发育异常相关,提示PDH表达减少可能是孤独症发病的多种因素之一。
综上所述,孤独症患者小脑中有氧糖酵解途径PDH表达减少,可能参与孤独症的病理过程。然而,这只是在尸脑样本中的初步探索,也并未检测酶的活性及定位。未来研究尚需扩大样本量,并在不同发育阶段动物模型中开展研究,进一步探索PDH减少在孤独症发病中的作用与意义。
[1]CHRISTENSEN DL,BAIO J,VAN NAARDEN BRAUN K,et al.Prevalence and Characteristicsof Autism Spectrum Disorder Among Children Aged 8 Years--Autism and Developmental Disabilities Monitoring Network,11 Sites,United States,2012 [J].MMWR Surveill Summ,2016,65(3):1-23.
[2]BECKER EB,STOODLEY CJ.Autism spectrum disorder and the cerebellum[J].Int Rev Neurobiol,2013,113(113):1-34.
[3]ROGERS TD,MCKIMM E,DICKSON PE,et al.Is autism a disease of the cerebellum?An integration of clinical and pre-clinical research[J].Front Syst Neurosci,2013,7:15.
[4]WEGIEL J,FLORY M,KUCHNA I,et al.Stereological study of the neuronal number and volume of 38 brain subdivisions of subjects diagnosed with autism reveals significant alterations restricted to the striatum,amygdala and cerebellum[J].Acta Neuropathol Commun,2014,2:141
[5]CHUGANIHT,JUHASZC,BEHENME,et al.Autism with Facial Port-Wine Stain:A New Syndrome[J].Pediatr Neurol,2007, 37(3):192-199.
[6]BAUERNFEIND AL,BARKSSK,DUKA T,et al.Aerobic glycolysis in the primate brain:reconsidering the implications for growth and maintenance[J].Brain Struct Funct,2014,219(4): 1149-1167.
[7]JOHN S,WEISS JN,RIBALET B.Subcellular localization of hexokinases I and II directs the metabolic fate of glucose[J]. PLoSOne,2011,6(3):e17674.
[8]ROBERTSDJ,TAN-SAH VP,SMITH JM,et al.Akt phosphorylates HK-II at Thr-473 and increasesmitochondrial HK-II association to protect cardiomyocytes[J].JBiol Chem,2013,288(33):23798-23806.
[9]CARDIM PIRES TR,ALBANESE JM,SCHWAB M,et al. Phosphofructokinase-P Modulates P44/42 MAPK Levels in HeLa Cells[J].JCell Biochem,2017,118(5):1216-1226.
[10]MOHAMMAD GH,OLDE DAMINK SW,MALAGO M,et al. Pyruvate Kinase M2 and Lactate Dehydrogenase A Are Overexpressed in Pancreatic Cancer and Correlate with Poor Outcome [J].PLoSOne,2016,11(3):e0151635.
[11]QVIT N,JOSHI AU,CUNNINGHAM AD,et al.Glyceraldehyde-3-Phosphate Dehydrogenase(GAPDH)Protein-Protein Interaction Inhibitor Reveals a Non-catalytic Role for GAPDH Oligomerization in Cell Death[J].JBiol Chem,2016,291(26): 13608-13621.
[12]ARSENEAULT R,CHIEN A,NEWINGTON JT,et al.Attenuation of LDHA expression in cancer cells leads to redox-dependent alterations in cytoskeletal structure and cell migration[J]. Cancer Lett.2013,338(2):255-266.
[13]PIROTN,CRAHESM,ADLE-BIASSETTE H,et al.Phenotypic and Neuropathological Characterization of Fetal Pyruvate Dehydrogenase Deficiency[J].JNeuropathol Exp Neurol,2016,75(3):227-238.
[14]GIULIVIC,ZHANG YF,OMANSKA-KLUSEK A,et al.Mitochondrial Dysfunction in Autism[J].JAMA,2010,304(21): 2389-2396
[15]GU F,CHAUHAN V,KAUR K,et al.Alterations in mitochondrial DNA copy number and the activities of electron transport chain complexes and pyruvate dehydrogenase in the frontal cortex from subjectswith autism[J].TranslPsychiatry,2013,3:e299. [16]GIRIBALDIG,DORIA-LAMBA L,BIANCHERIR,et al.Intermittent-relapsing pyruvate dehydrogenase complex deficiency:a case with clinical,biochemical,and neurological reversibility[J].Dev Med Child Neurol,2012,54(5):472-476.
[17]PLISSL,HAUSKNECHTKA,STACHOWIAKMK,et al.Cerebral developmental abnormalities in a mouse with systemic pyruvate dehydrogenase deficiency[J].PLoSOne,2013,8(6): e67473.
[18]SUN XR,SUN Z,ZHU Z,et al.Expression of pyruvate dehydrogenase is an independent prognosticmarker in gastric cancer [J].World JGastroenterol,2015,21(17):5336-5344.
The expressions of aerobic glycolytic enzymes in the cerebellums of patients w ith autism.
CHENG Peipei, YU Shunying.Shanghai Mental Health Center,Shanghai Jiao Tong University School of Medicine,600 Wan Ping Nan Road,Shanghai 200030,China.Tel:021-34773299.
Objective To study the expression levels of aerobic glycolytic enzymes in the cerebellums and its correlation with pathogenesis of autism in patients with autism.M ethods The Western blotting was used to quantitatively examine the expression levels of aerobic glycolytic enzymes,including HK-Ⅰ,HK-Ⅱ,PFKP,PKM1/2,PKM2, GAPDH,PDH and LDHA in the cerebellums of eight patients with autism and eight age-matched controls.Results Compared to controls,PDH expression was significantly decreased[(0.715±0.342)vs.(1.028±0.203),P=0.043],while expression of other seven aerobic glycolytic enzymes remained unchanged(P>0.05)in the cerebellums of patients with autism.Conclusion The present study has revealed a decrease in the expression of PDH in the cerebellums of patients with autism,which may be involved in the pathologic process of autism.
Autism Cerebellum Aerobic glycolysis Pyruvate dehydrogenase
R749.94
A
2017-02-10)
(责任编辑:肖雅妮)
10.3969/j.issn.1002-0152.2017.05.006
☆国家自然科学基金面上项目(编号:81571342)
*上海交通大学医学院附属精神卫生中心上海市重性精神病重点实验室(上海200030)○☆
(E-mail:yushuny@yahoo.com)
