浅谈高中化学中有关盖斯定律及反应热的计算
2017-07-27刘振世
刘振世


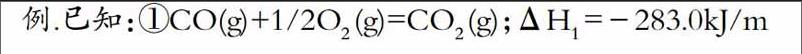
【摘 要】高中化学中有关盖斯定律及反应热的计算题是学生学习的困惑,不会相关的计算题。本文就对该类题的计算方法做了总结归纳。主要从盖斯定律定义及推论出发总结出反应热的计算依据,在反应热的计算中也充分地实现了盖斯定律定义及推论的合理应用。
【关键词】盖斯定律;反应热
下面我从盖斯定律及反应热的計算做一分析。
一、盖斯定律定义及推论
1.盖斯定律
1840年,俄国化学家盖斯通过大量的实验证明,不管化学反应是一步完成或分几步完成,其反应热是相同的。也就是说,化学反应的反应热只与反应的始态和终态状态有关,而与反应的途径(即过程)无关。这就是盖斯定律。
2.推论
推论一:若某化学反应从始态(S)到终态(L)其焓变为△H,而从终态(L)到始态(S)的焓变为△H,这两者和为0。
推论二:若某一化学反应可分为多步进行,则其总焓变为各步反应的焓变之和。
推论三:若多步化学反应相加可得到新的化学反应,则新反应的焓变即为上述多步反应的焓变之和。
二、有关反应热的计算
(一)反应热的计算依据及方法
1.由化学反应的本质(旧键断裂-新键生成)及化学反应能量变化的原因(反应物的总能量与生成物的总能量不等)可得:
(1)反应热=断裂旧键所需的能量-生成新键释放的能量=吸收的能量-放出的能量
通常人们把拆开1mol某化学键所吸收的能量或结合成1mol某化学键所失放出的能量看成该化学键的键能,键能通常用E表示,单位为kJ/mol或kJ·mol-。方法:ΔH=∑E(反应物)-∑E(生成物),即ΔH等于反应物的键能总和与生成物的键能总和之差。如反应H(g)+Cl(g)=2HCl(g)ΔH=E(H—H)+E(Cl—Cl)-2E(H—Cl)。
(2)反应热=生成物的总能量-反应物的总能量
2.根据盖斯定律计算:
写出目标方程式,确定“过渡物质”(要消去的物质),可将各热化学方程式进行适当的“加”、“减”等变形消元法逐一消去“过渡物质”,并且对ΔH进行相应的变化后,再来计算反应热。
(二)反应热的计算题类型
1.已知一定量的物质参加反应放出的热量,写其热化学反应方程式。
例.25C,101KPa下,1g硫粉在氧气中充分燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式。
解析:S+O=SO1g硫粉在氧气中充分燃烧放出9.36kJ热量。
1mol硫粉在氧气中充分燃烧放出热量为:(32g)×(9.35kJ/g)=299.62kJ。所以:S(s)+O(l)=SO(g);△H=-299.62 kJ·mol
2.盖斯定律及其应用。
应用盖斯定律进行简单计算,关键在于设计反应过程,同时注意:
(1)当反应式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应式进行加减运算时,△H也同样要进行加减运算,且要带“+”、“-”符号,即把△H看作一个整体进行运算。
(3)通过盖斯定律计算比较反应热的大小时,同样要把△H看作一个整体。
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互转化,状态由固→液→气变化时,会吸热;反之会放热。
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
3.根据一定量的物质参加反应放出的热量(或根据已知的热化学方程式),进行有关反应热的计算或比较大小。
例1.在一定条件下,氢气和甲烷燃烧的化学方程式为:
4.利用化学反应的本质及化学反应能量变化的原因计算反应热
例:SF是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS(s)转化为气态硫原子时吸收能量280kJ,断裂1molF-F、S-F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F(g)=SF(g)的反应热ΔH为( )
A.-1780kJ/mol B.-1220kJ/mol C.-450kJ/mol D.+430kJ/mol
解析:化学反应的实质是旧键的断裂和新键的形成,旧键的断裂吸收热量,新键的生成放出热量,两个热量变化的总体效应即为反应的热效应。S(s)+3F2(g)=SF6(g)的反应过程中旧键断裂吸收的热量为280kJ+160kJ×3=760kJ,新键生成放出的热量为330kJ×6=1980Kj,反应放出1220kJ的热量,ΔH=E(S)+E(F-F)-2E(S-F)=280kJ+160kJ×3-330kJ×6=-1220 kJ/mol。答案:B
以上是我对高中化学中有关盖斯定律及反应热的计算题的解答方法做了归纳,理解困难要求高,不断的训练非常有利于培养科学思维、科学方法,特别是能培养分析问题、解决问题的能力,以及运用化学原理解决一些简单的生产实际问题的能力。
