人IL-29定点突变体抗肿瘤细胞增殖活性分析
2017-07-25李利云葛春蕾彭荣刚李昕哲陈永康
李利云, 陆 源, 葛春蕾, 彭荣刚,李昕哲,谭 敬, 陈永康,陈 伟*
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 药学院,江苏 无锡 214122;3.江南大学 无锡医学院,江苏 无锡214122)
人IL-29定点突变体抗肿瘤细胞增殖活性分析
李利云1, 陆 源2, 葛春蕾1, 彭荣刚3,李昕哲3,谭 敬3, 陈永康3,陈 伟*3
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 药学院,江苏 无锡 214122;3.江南大学 无锡医学院,江苏 无锡214122)
为分析人白细胞介素-29(hIL-29)变异体抗肿瘤细胞增殖活性,采用大引物PCR方法对人hIL-29基因第104位碱基进行点突变,使hIL-29肽链第35位Arg定点改造为Lys。得到的hIL-29变异体基因经重组后转化毕赤酵母GS115和诱导表达,经纯化获得重组蛋白rhIL-29mut35。SDS-PAGE分析显示rhIL-29mut35的相对分子质量约23×103,Western Blotting鉴定显示其与羊抗人IL-29多克隆抗体发生特异性结合反应。用CCK-8试剂检测rhIL-29mut35对肿瘤细胞增殖的影响,rhIL-29mut35在不同质量浓度时对胃癌细胞SGC7901、肝癌细胞BEL7402、肺腺癌细胞A549和结肠癌细胞HCT8的增殖均有抑制作用,高剂量组(1 000 ng/mL)rhIL-29mut35对胃癌细胞SGC7901、肝癌细胞BEL7402、肺腺癌细胞A549和结肠癌细胞HCT8增值的抑制率分别为(34.20±1.50)%、(27.30±0.31)%、(30.20±0.68)%、(29.13±1.40)%,与阴性对照组相比,差异有统计学意义(P<0.01)。而且高剂量组的抗增殖效应高于野生型rhIL-29的(P<0.01),这为进一步研制开发IL-29的抗肿瘤药物奠定基础。
人白细胞介素-29;定点突变;重组蛋白;抗肿瘤活性
Kotenko等[1]和Sheppard等[2]两个研究小组于2003年共同发现Ⅲ型干扰素,它包括3个成员:IFN-λ1、IFN-λ2和IFN-λ3,即IL-29、IL-28A和IL-28B。IL-29通过结合异源二聚体受体复合物IFN-λR1和 IL-10R2激 活 JAK-STAT(Janus kinase-signal transducer of transcription)信号传导途径,从而发挥其生物学活性[1-2]。IL-29与Ⅰ型干扰素具有相似的生物学性质,如抗病毒、抗肿瘤、抗增殖以及免疫调节等效应[3-5]。Miknis等[6]研究发现,IL-29肽链的某些氨基酸的改变可导致其蛋白质结构发生改变,进而影响其与受体结合的亲和力,从而影响其生物学活性。
文中作者根据生物信息学分析的结果[7],采用大引物PCR方法对人白细胞介素-29(hIL-29)基因的104位碱基进行突变,使hIL-29第35位Arg定点改造为Lys,期望提高其抗肿瘤活性,从而为深入研究探讨IL-29抑制肿瘤细胞增殖的作用机理奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞株、菌株、质粒 人肺腺癌细胞A549由邱丽颖教授(江南大学无锡医学院)惠赠;人胃癌细胞SGC7901、人结肠癌细胞HCT8和人肝癌细胞BEL7402由金坚教授 (江南大学药学院)惠赠;E.coli JM109,毕赤酵母(Pichapastoris)GS115由本实验室保存;克隆质粒pUCm-T,购自生工生物工程(上海)股份有限公司(简称上海生工);真核表达质粒pPIC9KM,购自Invitrogen公司并经本实验室改造和保存;重组质粒pPIC9KM-hIL-29(整合了hIL-29全长DNA的pPIC9KM质粒)由本研究室构建并保存[8],用于表达带有天然N端的hIL-29。
1.1.2 主要试剂 限制性内切酶XhoⅠ、NotⅠ和SalⅠ,T4 DNA连接酶及 250 bp DNA Ladder Marker,低相对分子质量蛋白质标准品,均购于大连Takara公司;Taq plus DNA聚合酶、硝酸纤维素膜(NC膜)、HRP标记兔抗羊IgG、EZ-10柱式DNA回收试剂盒,均购自上海生工;普通新生牛血清,购自浙江天杭生物科技有限公司;羊抗人IL-29多克隆抗体,购自美国 R&D公司;改良型RPMI-1640培养基,购自赛默飞世尔生物化学制品(北京)有限公司;干扰素α2b标准品,购自北京凯因科技股份有限公司;Cell Counting Kit-8试剂和胰酶细胞消化液,购自碧云天生物技术研究所。
1.1.3 引物设计及合成 以hIL-29基因序列为模板,通过Oligo7软件设计扩增编码hIL-29成熟肽cDNA的特异性上游引物(命名为hIL-29-F)、下游引物 (命名为hIL-29-R)及突变引物 (命名为Mutant Primer)。突变引物中第16位碱基设计为T,使该碱基组成的密码子由AGG突变为AAG,该密码子编码的氨基酸则由Arg突变为Lys。引物序列见表1,引物由上海生工合成。

表1 用于大引物PCR的引物序列Table 1 O ligonucleotides used for megaprimer PCR
1.2 方法
1.2.1 rhIL-29mut35基因的克隆与鉴定 利用大引物PCR方法对hIL-29基因进行定点突变。大引物PCR包括两轮PCR扩增,两轮PCR扩增都以pPIC9KM-hIL-29质粒为模板。第一轮PCR扩增以hIL-29-F和Mutant Primer为引物,反应条件如下:94℃预变性5 min;94℃变性30 s,45℃退火30 s,72℃延伸60 s,2个循环;94℃变性30 s,57℃退火30 s,72℃延伸60 s,28个循环,72℃延伸10 min,10℃保温。PCR产物经1.2 g/dL琼脂糖凝胶电泳后,EB染色,按DNA回收试剂盒说明书回收目的片段。以第一轮PCR扩增的回收产物和hIL-29-R为引物进行第二轮PCR扩增,反应条件同第一轮PCR扩增。PCR产物经1 g/dL琼脂糖凝胶电泳后,EB染色,凝胶成像仪拍照并按DNA回收试剂盒说明书回收目的基因片段。
1.2.2 重组真核表达质粒pPIC9KM-rhIL-29mut35的构建 回收的目的基因片段与pUCm-T连接,化学法转化E.coli JM109感受态细胞。转化液涂布于预先涂有IPTG和X-gal的氨苄抗性琼脂平板上,放置1 h后,倒置培养过夜。蓝白斑筛选阳性转化子进行菌液PCR扩增,条带大小正确的菌株送上海生工测序(命名为JM109/pUCm-T-hIL-29mut35)。将测序正确的pUCm-T-rhIL-29mut35及pPIC9KM质粒双酶切然后割胶回收并连接,转化JM109感受态细胞,菌液PCR条带大小正确的菌株送上海生工测序(命名为JM109/pPIC9KM-hIL-29mut35)。
1.2.3 重组质粒pPIC9KM-rhIL-29mut35的表达及鉴定测序正确用碱裂解法抽提重组质粒pPIC9KM-hIL-29mut35并用 SalⅠ线性化, 电转化法转化P.pastoris GS115感受态细胞,转化液涂布于组氨酸缺陷型的MD平板。G418筛选高拷贝重组菌株。经菌液PCR鉴定正确的进行甲醇诱导表达。发酵条件按照参考文献[9]。发酵上清液经SDS-PAGE(12 g/dL分离胶,5 g/dL浓缩胶)鉴定。
1.2.4 重组蛋白 rhIL-29mut35的纯化及活性分析将发酵液离心收集上清液,经过硫酸铵沉淀初步除去色素和部分杂蛋白质。用柠檬酸-柠檬酸钠缓冲液(10 mmol/L,pH 6.0)将沉淀复溶,然后经透析除去部分盐离子;最后经SP-Sepharose Fast Flow阳离子交换层析进一步纯化重组蛋白。阳离子交换层析具体步骤按参考文献[10]。SDS-PAGE分析各洗脱峰,将含有rhIL-29mut35的洗脱液冷冻干燥。取冻干粉末用PBS(10 mmol/L磷酸盐缓冲液,pH 7.2)稀释,Western blotting分析鉴定rhIL-29mut35的活性,具体步骤按参考文献[8-9]。
1.2.5 CCK-8法检测rhIL-29mut35抗肿瘤细胞增殖效应 肿瘤细胞SGC7901、BEL7402、A549和HCT8细胞用改良型RPMI1640完全培养基 (含体积分数10%小牛血清,简称1640完全培养基)在37℃、体积分数5%CO2培养箱培养和传代,取对数生长期的肿瘤细胞用体积分数为0.25%的胰蛋白酶消化后,经血球计数板计数,用1640完全培养基调整细胞浓度为1×105个/mL;按每孔100μL接种于96孔细胞培养板,置37℃、体积分数5%CO2的培养箱培养24 h后,观察细胞贴壁情况,确认贴壁且生长良好后吸去上清液;每孔分别加入100μL用1640完全培养基稀释的阳性对照 IFN-α2b、野生型rhIL-29、rhIL-29mut35,每个样品设置50、500 ng/mL和1 000 ng/mL 3个剂量组,每组设5个平行孔;空白(不接种细胞)和阴性对照组(接种细胞)加入等体积的1640完全培养基,置37℃、体积分数5% CO2的培养箱培养 24 h,每孔加入 10μL Cell Counting Kit-8试剂,继续培养30~60 min(不同细胞测板时间不同)后用酶标仪于450 nm波长处测吸光度(OD450),按式(1)计算各组样品对肿瘤细胞的增殖抑制率。
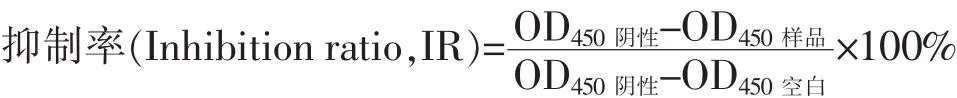
其中,OD450阴性为阴性对照组OD450值;OD450样品为样品组OD450值;OD450空白为空白组OD450值。
1.3 统计学处理
采用SPSS22.0统计软件进行统计分析,用单因素方差分析各组样品对肿瘤细胞的抗增殖作用的差异,检验水准α=0.05。
2 结果与讨论
2.1 大引物PCR产物分析鉴定
通过大引物PCR,第一轮PCR产物经1.2 g/dL琼脂糖凝胶电泳分析,可见约130 bp的特异性条带,大小与理论值相符(见图1泳道1);第二轮PCR产物经1 g/dL琼脂糖凝胶电泳分析,在约560 bp可见特异性条带,且与理论值相符(见图1泳道2)。
2.2 重组质粒测序及序列比对结果
阳性转化子JM109/pUCm-T-hIL-29mut35的测序结果显示其大小为546 bp,编码181个氨基酸;将测定的序列与Gene Bank的hIL-29基因序列(登录号:AY336716.1)比对,结果显示重组质粒JM109/ pUCm-T-hIL-29mut35中目的基因第104位碱基G成功突变为A,且其余序列完全一致(见图2)。重组真核表达质粒JM109/pPIC9KM-hIL-29mut35的测序鉴定结果显示,JM109/pPIC9KM-rhIL-29mut35中目的基因与JM109/pUCm-T-rhIL-29mut35中的完全一致。

图1 大引物PCR结果Fig.1 Result ofmegaprimer PCR
2.3 重组质粒pPIC9KM-rh IL-29mut35在P.pastoris GS115中的表达及鉴定
用3’-AOX和5’-AOX通用引物进行酵母菌液PCR扩增,以空酵母GS115的基因组为模板作对照,扩增出约2 200 bp和500 bp的DNA条带;而以 GS115/pPIC9KM-hIL-29mut35重组子为模板,PCR扩增出约2 200 bp和1 000 bp的特异性条带(见图3),表明hIL-29mut35基因已成功整合入宿主基因组中。鉴定正确的重组子按参考文献[8]条件进行发酵,发酵上清液经SDS-PAGE(12 g/dL分离胶,5 g/dL浓缩胶)鉴定。在约23 000处可见目的蛋白质条带,与理论值相符(见图4)。
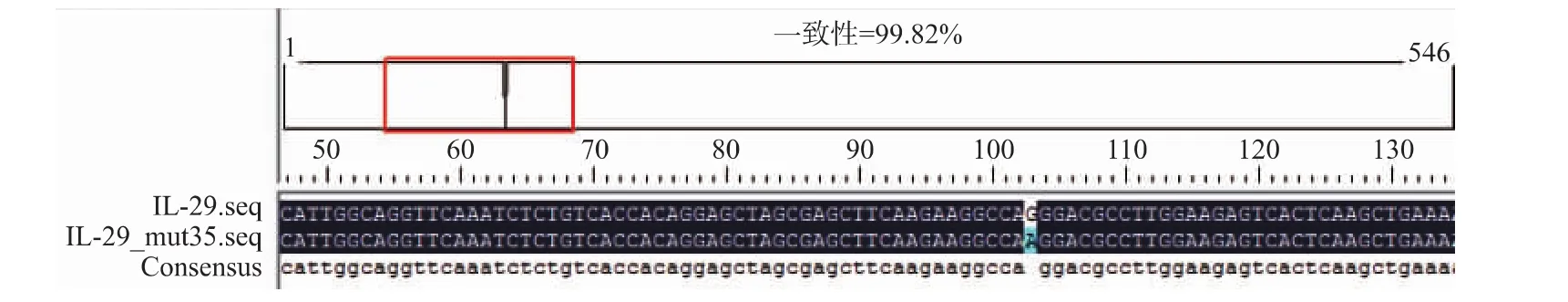
图2 h IL-29和rh IL-29mut35的序列比对结果Fig.2 Sequence comparison result of h IL-29 and rh IL-29mut35
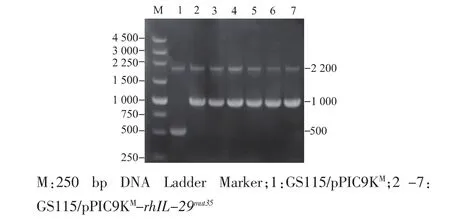
图3 GS115/pPIC9KM-rh IL-29mut35的菌液PCR鉴定Fig.3 PCR confirmation of GS115/pPIC9KM-rh IL-29mut35

图 4 GS115/pPIC9KM-h IL-29mut35重组子发酵液上清的SDS-PAGE分析Fig.4 SDS-PAGE analysis of the expressed supernatant of recombinant GS115/pPIC9KM-h IL-29mut35
2.4 rh IL-29mut35的纯化及活性分析
发酵上清液经硫酸铵沉淀、透析后,再经SPSepharose Fast Flow交换层析洗脱收集洗脱液,用SDS-PAGE分析结果显示,rhIL-29mut35主要出现在含0.6mol/LNaCl的液洗脱峰(峰4),其余洗脱峰为杂蛋白质(见图5)。

图5 rh IL-29mut35的SP-Sepharose Fast Flow离子交换层析Fig.5 SP-Sepharose Fast Flow cation exchange column of rh IL-29mut35
取纯化的 rhIL-29mut35及未纯化发酵液进行SDS-PAGE及Western blotting分析结果显示,纯化的rhIL-29mut35在SDS-PAGE及Western blotting图谱上均出现单一条带,其相对分子质量大小约23 000(见图6—7),表明纯化的rhIL-29mut35可与羊抗人IL-29抗体发生特异性结合反应,保持了免疫学活性,可用于体外细胞学活性的检测。
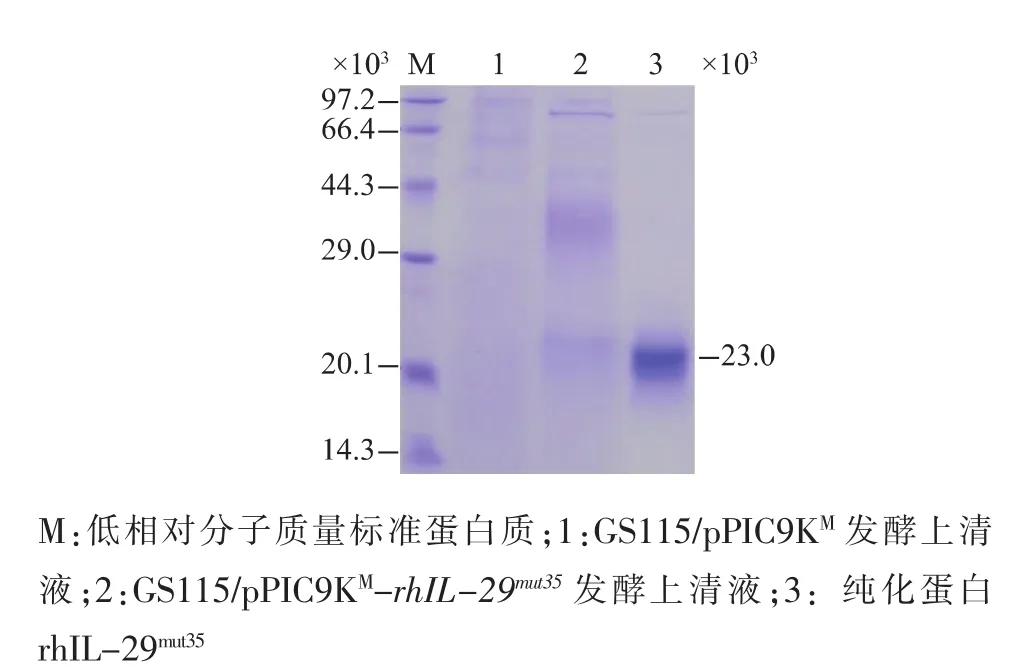
图6 rh IL-29mut35的SDS-PAGE分析Fig.6 SDS-PAGE analysis of rh IL-29mut35

图7 rh IL-29mut35的W estern blotting鉴定Fig.7 Western blot analysis of rh IL-29mut35
2.5 rh IL-29mut35的抗肿瘤细胞增殖活性
按1.2.5方法检测rhIL-29mut35对4种肿瘤细胞的增殖抑制效应显示,不同剂量组的rhIL-29mut35对胃癌细胞SGC7901、肝癌细胞BEL7402、肺腺癌细胞A549和结肠癌细胞HCT8的增殖均表现出抑制作用(见表2);尤其高剂量组对4株肿瘤细胞的增殖均具有较强的抑制效应,与阴性对照组相比,差异均具有显著的统计学意义 (P<0.01)。采用SPSS22.0软件进行统计分析,不同质量浓度rhIL-29mut35对肿瘤 细胞 SGC7901、BEL7402、A549和HCT8的抑制率的P值见表3。

表2 rh IL-29mut35对肿瘤细胞SGC7901、BEL7402、A549和HCT8的抑制率Table 2 Inhibition ratios of tumor cells SGC7901,BEL7402,A549 and HCT8 by rh IL-29mut35

表3 rh IL-29mut35对肿瘤细胞SGC7901、BEL7402、A549和HCT8的抑制率的P值Table 3 P values of inhibition ratios of tumor cells SGC7901,BEL7402,A549 and HCT8 by rh IL-29mut35
方差分析结果显示,rhIL-29mut35、IFN-α2b及野生型rhIL-29对肿瘤细胞SGC7901、BEL7402、A549和HCT8增殖的抑制各有差异。对胃癌细胞SGC7901,高剂量组rhIL-29mut35的抑制效应高于IFN-α2b及rhIL-29的(见图8),差异具有统计学意义(P<0.05)。
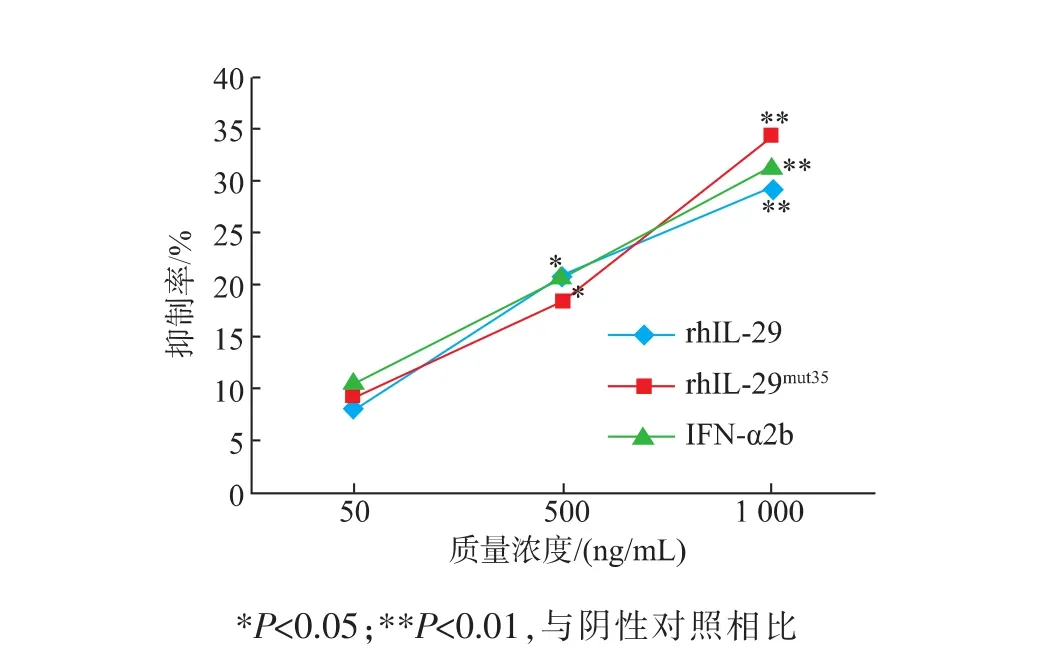
图8 rh IL-29mut35对胃癌细胞SGC7901的抗增殖效应Fig.8 Anti-proliferative effect of rh IL-29mut35on the gastric cancer cell SGC7901
对肝癌细胞BEL7402,中剂量组rhIL-29mut35的抑制效应显著高于IFN-α2b及rhIL-29的,差异具有显著统计学意义(P<0.01),而3个样品高剂量组对BEL7402细胞的增值抑制效应差异不大,无统计学意义(见图9)。
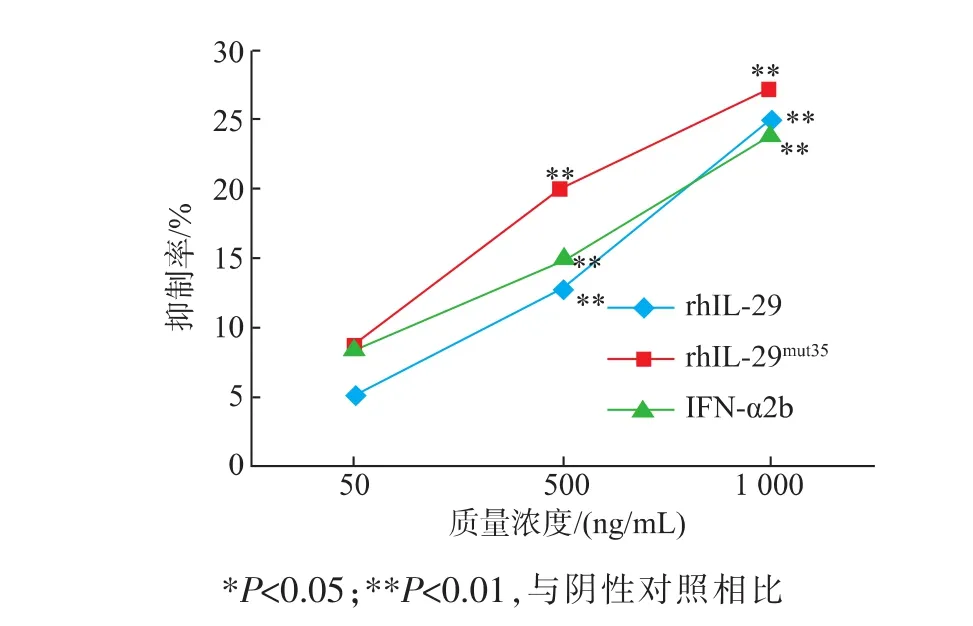
图9 rh IL-29mut35对肝癌细胞BEL7402的抗增殖效应Fig.9 Anti-proliferative effect of rh IL-29mut35on the liver cancer cell BEL7402
对肺腺癌细胞A549,高、中和低剂量组rhIL-29mut35的抑制效应均大于野生型rhIL-29及 IFN-α2b的,其中高剂量组的效应显著高于IFN-α2b及野生型rhIL-29,差异具有统计学意义(P<0.01),表明rhIL-29mut35对A549的增殖抑制效应较强 (见图10)。

图10 rh IL-29mut35对肺腺癌细胞A549的抗增殖效应Fig.10 Anti-proliferative effect of rh IL-29mut35on the lung adenocarcinoma cell A549
对结肠癌细胞HCT8,高、中和低剂量组rhIL-29mut35的抑制效应均大于野生型 rhIL-29及IFN-α2b的,尤其高、中剂量组的效应显著高于野生型rhIL-29及IFN-α2b,差异具有统计学意义 (P<0.01),表明rhIL-29mut35对HCT8的增殖抑制作用较强(见图11)。

图11 rh IL-29mut35对结肠癌细胞HCT8的抗增殖效应Fig.11 Anti-proliferative effect of rh IL-29mut35on the colon cancer cell HCT8
3 结语
文中作者采用定点突变方法对hIL-29肽链进行分子改造后,得到的变异体rhIL-29mut35蛋白对胃癌细胞SGC7901、肝癌细胞BEL7402、肺腺癌细胞A549和结肠癌细胞HCT8的增殖抑制作用均高于野生型rhIL-29,表明对hIL-29与受体结合的关键位点进行定点改造可望提高其抗增殖作用。rhIL-29mut35对4种肿瘤细胞增殖表现出不同的抑制效应,可能是因不同肿瘤细胞的IL-29受体表达存在差异[11]。Li等[12]研究表明,IL-29可通过诱导细胞凋亡和阻滞细胞分裂而抑制肿瘤细胞的增殖,但关键位点氨基酸与IL-29抗肿瘤细胞增殖的构效关系及作用机理还需深入研究,从而为研制开发IL-29的抗肿瘤药物奠定免疫药理基础。
[1]KOTENKO S V,GALLAGHER G,BAURIN V V,et al.IFN-lambdasmediate antiviral protectionthrough a distinct classⅡcytokine receptor complex[J].Nat Immunol,2003,4(1):69-77.
[2]SHEPPARD P,KINDSVOGELW,XUW F,etal.IL-28,IL-29 and their classⅡcytokine receptor IL-28R[J].Nat Immunol,2003,4(1):63-68.
[3]GUENTERBERG K D,GRIGNOL V P,RAIG E T,et al.Interleukin-29 binds to melanoma cells inducing Jak-STAT signaltransduction and apoptosis[J].Mol Cancer Ther,2010,9(2):510-520.
[4]MAHER S G,SHEIKH F,SCARZELLO A J,et al.IFN-αand IFN-λdiffer in their antiproliferative effects and duration of JAK/STAT signaling activity[J].Cancer Biol Ther,2008,7(7):1109-1115.
[5]MEAGER A,VISVALINGAM K,DILGER P,et al.Biological activity of interleukins-28and-29:comparison w ith typeⅠinterferons[J].Cytokine,2005,31(2):109-118.
[6]M IKNISZ J,MAGRACHEVA E,LIW,etal.Crystalstructure of human interferon-λ1 in complex w ith its high-affinity receptor interferon-λR1[J].JM olBiol,2010,404(4):650-664.
[7]ZHENG Haijun,ZHU Rong,GEChunlei,etal.Bioinformaticsofhuman interleukin-29[J].Chin J Biologicals M arch,2013,26(2):209-212.(in Chinese)
[8]CHEN Wei,YU M inglei,ZHENG Haijun,et al.Cloning and eukaryotic expression of human interleukin-29 gene[J].Chin J BiologicalsMarch,2012,25(4):446-448.(in Chinese)
[9]ZHENG Haijun,LU Yuan,CHEN Wei,et al.Optimization of condition for expression of native N-term inus of human interleukin-29mature peptide in Pichia pastoris[J].Chin JBiologicals M arch,2013,26(3):402-405.(in Chinese)
[10]LU Yuan,CHENWei,LILiyun,etal.Expression of recombinanthuman interleukin-29mutant in Pichia pastoris and antitumor analysis[J].Journal of Food Science and Biotechnology,2016,35(2):185-191.(in Chinese)
[11]WITTE K,WITTE E,SABAT R,etal.IL-28A,IL-28B,and IL-29:prom ising cytokinesw ith type I interferon-like properites[J]. Cytokines Grow th Factor Rev,2010,21(4):237-251.
[12]LIQ,KAWAMURA K,MA G,etal.Interferon-lambda induces G1 phase arrestor apoptosis in oesophageal carcinoma cells and producesanti-tumoureffects in combinationw ith anti-canceragents[J].Eur JCancer,2010,46(1):180-190.
Anti-Tumor Proliferation Activity of h IL-29 Variant
LILiyun1, LU Yuan2, GE Chunlei1, PENG Ronggang3, LIXinzhe3,
TAN Jing3, CHEN Yongkang3, CHENWei*3
(1.School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.School of Pharmaceutical Science,Jiangnan University,Wuxi214122,China;3.Wuxi Medical School,Jiangnan University,Wuxi214122,China)
In order to analyze the antineoplastic activity of human interleukin-29(hIL-29)variant,a mutant gene of hIL-29 was amplified bymegaprimer PCR,and the Arg35 of hIL-29 peptide chain wasmutated to Lys35.A recombinantplasmid was constructed and transformed into Pichia pastoris GS115,the recombinantprotein rhIL-29mut35was induced and purified.The purified rhIL-29mut35had a relativemolecularmass of about 23×103on SDS-PAGE profile and showed specific reaction w ithgoat anti-human IL-29 polyclonal antibody in Western blotting.W ith the Cell Counting Kit-8 reagent,the rhIL-29mut35was found to has anti-proliferation effect on tumor cells SGC7901,BEL7402,A549 and HCT8 separately w ith inhibition ratios of(34.20±1.50)%,(27.30±0.31)%,(30.20±0.68)%and (29.13±1.40)% in the high dose group.The anti-proliferation effect of rhIL-29mut35wasstronger than thatofw ild type rhIL-29(P<0.01),which supported the developmentof antineoplastic drugsof IL-29.
human interleukin-29,site-directedmutation,recombinantprotein,antineoplastic activity
Q 71
A
1673—1689(2017)05—0553—07
2015-05-04
*通信作者:陈 伟(1956—),男,江西宜丰人,医学博士,副教授,硕士研究生导师,主要从事免疫学和生物制药方面的研究。
E-mail:chenwei@jiangnan.edu.cn
李利云,陆源,葛春蕾,等.人IL-29定点突变体抗肿瘤细胞增殖活性分析[J].食品与生物技术学报,2017,36(05):553-559.
