水/有机溶剂双相体系中色氨酸合成酶酶法合成2-甲基-L-色氨酸
2017-07-25徐礼生高贵珍曹稳根张兴桃焦庆才
徐礼生, 高贵珍, 曹稳根, 赵 亮,张兴桃, 焦庆才,陈 军, 宋 曼
(1.宿州学院 生物与食品工程学院,安徽 宿州 234000;2.南京大学 医药生物技术国家重点实验室,江苏 南京210093)
水/有机溶剂双相体系中色氨酸合成酶酶法合成2-甲基-L-色氨酸
徐礼生1,2, 高贵珍1, 曹稳根1, 赵 亮1,张兴桃1, 焦庆才2,陈 军1, 宋 曼1
(1.宿州学院 生物与食品工程学院,安徽 宿州 234000;2.南京大学 医药生物技术国家重点实验室,江苏 南京210093)
本文作者研究了水/有机溶剂双相体系中利用色氨酸合成酶催化L-丝氨酸和2-甲基吲哚合成2-甲基-L-色氨酸,考察了有机溶剂、有机溶剂体积分数、pH、反应温度、表面活性剂、金属离子和底物浓度对色氨酸合成酶催化合成2-甲基-L-色氨酸的影响。有机溶剂包括二甲苯、甲苯、乙酸乙酯、乙酸丁酯和辛醇,表面活性剂包括吐温80、聚乙二醇辛基苯基醚(OP)、CTAB和Trion X-100,金属离子包括Mg2+、Ca2+、Cu2+、Co2+和Zn2+。结果表明,酶法最佳转化条件为:有机相溶剂为甲苯,甲苯体积分数为2%,反应温度为40℃,水相pH为8,底物L-丝氨酸浓度为150 mmol/L,表面活性剂Trion X-100质量分数为2%,金属离子Ca2+浓度为0.1 mmol/L,色氨酸合成酶酶促反应5 h,2-甲基-L-色氨酸的质量浓度为21.17 g/L。重组大肠杆菌DM206可作为2-甲基-L-色氨酸生产菌,具有较好的2-甲基-L-色氨酸生产潜力。
色氨酸合成酶;2-甲基-L-色氨酸;L-丝氨酸;2-甲基吲哚
色氨酸在生物体非核糖体多肽和生物碱合成中具有重要作用[1],一些色氨酸衍生物同样具有重要作用,例如5-羟基色氨酸[2-3],7-氯-色氨酸[4]和2-甲基-L-色氨酸[5]。2-甲基-L-色氨酸是抗菌素硫链丝菌肽合成中重要的中间体[6],含有2-甲基色氨酸的寡肽化合物可以使亲躯体细胞(somatotrope)释放生长素,哺乳动物服用能诱导生长激素释放的化合物之后,动物体内的生长素提高,使动物生长速度加快[5]。采用来源于Salmonella enterica的色氨酸合成酶酶法进行合成2-甲基-L-色氨酸,但是反应收率低且反应时间长[7]。由于底物2-甲基吲哚在水中溶解度低,故在水相中酶反应速度相对较低。自20世纪80年代以来,Kirchner等[8]在水/有机溶剂体系中用脂肪酶催化合成脂、肽和手性醇等化合物,非水相酶催化已成为生物工程等领域中的研究热点之一,包括水/有机溶剂双相体系、反相胶团体系和超临界流体体系等[9-14]。在酶催化过程中,双相体系对酶催化具有促进作用,如刘森林等人研究了水/有机溶剂双相中来源于杏仁的 (R)-醇腈酶催化苯甲醛与HCN不对称合成(R)-苯乙氰醇,系统探讨了有机溶剂、水相与有机溶剂相体积比、水相pH值和反应温度对反应速度、产率和产物光学纯度的影响,在优化反应条件下反应产率和产物的光学纯度均高达99%以上[14]。周华等人研究了双水相体系酶法合成L-苯丙氨酸,以天冬氨酸转氨酶为催化剂,双水相体系质量组成为聚乙二醇4 000(质量分数20%)/Na2HPO4(质量分数16%)。苯丙酮酸钠盐、细胞和L-苯丙氨酸在双水相体系中的分配系数分别为8.03,31.7和0.74,当底物质量浓度为43.4 g/L时,该体系酶法合成L-苯丙氨酸得率为78.1%,比在水溶液体系中提高了27.4%[15]。
本文作者在水/有机溶剂双相体系中,利用重组大肠杆菌 DM206[pETDuet-trpBA+trpA/BL21(DE3)]色氨酸合成酶催化L-丝氨酸和2-甲基吲哚合成2-甲基-L-色氨酸(见图1),优化了转化条件,为酶法合成2-甲基-L-色氨酸提供了新思路。
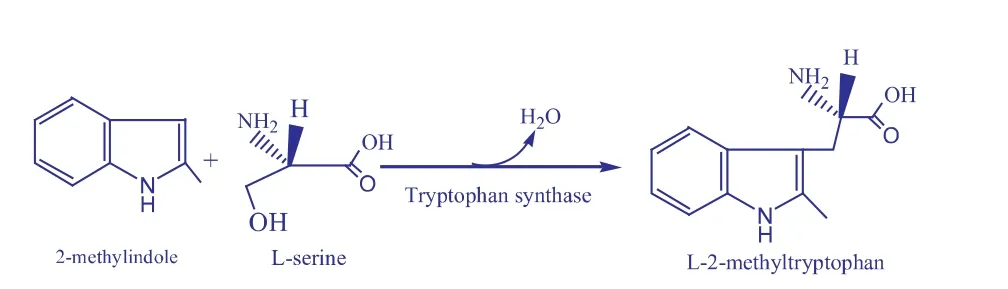
图1 酶催化合成2-甲基-L-色氨酸示意Fig.1 Synthesis of L-2-methyltryptophan from L-serine and indole catalyzed by tryptophan synthase
1 材料与方法
1.1 材料与仪器
L-丝氨酸、2-甲基吲哚、2-甲基-L-色氨酸、甲醇、吐温80、聚乙二醇辛基苯基醚(OP)、CTAB和Trion X-100:购于国药集团上海化学试剂有限公司;二甲苯、甲苯、乙酸乙酯、乙酸丁酯和辛醇:购于合肥中皖化学试剂公司,甲醇为色谱纯,其他试剂均为分析纯;异丙基-β-D-硫代半乳糖苷(IPTG):天根生化科技有限公司产品;L-丝氨酸 (质量分数99.9%):安徽华恒生物工程有限公司产品;2-甲基吲哚(质量分数99%):南京台硝生物质工程有限公司产品;重组大肠杆菌DM206[pETDuet-trpBA+ trpA/BL21(DE3)],作者所在实验室构建;将活化好的重组大肠杆菌种子液以体积分数2%接种量接入装有100mL无菌LB培养基的250 mL的摇瓶中,在37℃和170 r/min条件下发酵4 h后,加入终浓度0.4 mmol/L的IPTG,降至28℃继续发酵12 h,发酵完后离心收集菌体,用无菌水洗涤后,于4℃保存备用。
LC-20AT型岛津高效液相色谱仪,日本岛津公司产品;THZ-CK型空气恒温振荡器,太仓博莱特实验仪器厂制造;THZ-CK型空气恒温振荡器,太仓博莱特实验仪器厂制造。
1.2 酶法合成L-2-甲基色氨酸及酶活测定
将0.1 g菌体加入50 mL双相反应体系中,水相含有100mmol/L L-丝氨酸(质量分数99.9%),有机溶液相含有一定量2-甲基吲哚(质量分数99%),于设定pH、温度和170 r/min振荡条件下反应;另以不加有机溶剂的纯水相作为对照,每组实验重复3次。定时取样,以高效液相色谱法测定2-甲基-L-色氨酸生成量,液相条件为:分离柱为 (5μm×250 mm×4.6mm)岛津 C18,流动相分配比为V(质量分数0.025%磷酸溶液)∶V(甲醇)=20∶80,保留时间为3.610 min,在检测波长为263 nm处检测2-甲基-L-色氨酸。将酶活定义为在上述条件下,每1min生成1mmol的2-甲基-L-色氨酸所用的酶量,单位U/g。高效液相色谱仪测定2-甲基-L-色氨酸生成量:

式 (1)中,R为2-甲基-L-色氨酸产率;R0为2-甲基-L-色氨酸实际生成量;R1为2-甲基-L-色氨酸理论生成量。
2 结果与讨论
2.1 有机溶剂影响
有机溶剂是影响双相体系中酶催化合成2-甲基-L-色氨酸反应,由于底物2-甲基吲哚在水中溶解度较小,酶分子周围底物因浓度较低,而处于边反应边溶解的状态,传质过程受到限制,故反应速度相对较低,为了提高酶反应速度,通过增加底物2-甲基吲哚在酶反应体系中溶解度,以提高酶反应速度;但另一方面有机溶剂往往会剥夺酶分子表面水化层,导致酶分子与有机溶剂接触而使酶活性降低,所以需要选择合适的有机溶剂和有机溶剂添加量,促进酶促反应。本文中选用二甲苯、甲苯、乙酸乙酯、乙酸丁酯和辛醇作为有机相,以不加有机溶剂纯水相的酶活设定为100%,反应条件为5 mmol L-丝氨酸和5mmol 2-甲基吲哚,质量分数1%磷酸吡哆醛(PLP)150μL,总反应体积50mL,0.1 g色氨酸合成酶菌体,不同有机溶剂1mL,pH 8.0,30℃,反应结果见图2,可以看出以甲苯作为有机相时,色氨酸合成酶相对酶活最高,所以选择最合适的有机溶剂为甲苯。
2.2 有机溶剂体积分数影响
双相体系中甲苯体积分数对酶反应的影响见图3,以不加有机溶剂纯水相的酶活设定为100%(反应条件为5mmol L-丝氨酸和5mmol 2-甲基吲哚,质量分数1%PLP 150μL,不同体积分数甲苯,总反应体积50 mL,0.1 g色氨酸合成酶菌体,pH 8.0,30℃)。由图3可见,随着甲苯体积分数的增加,酶活逐渐增加,但体积分数超过2%时,酶活开始降低。有机溶剂可提高底物2-甲基吲哚的溶解度,增加酶分子与底物接触的机会,因而酶活增加,但过量有机溶剂往往会剥夺酶分子表面水化层而进入酶分子内部的活性中心,破坏了酶的稳定构象,因而酶活性降低。综上可见,甲苯体积分数以2%为宜,双相体系中酶活比水相中提高了1.29倍。
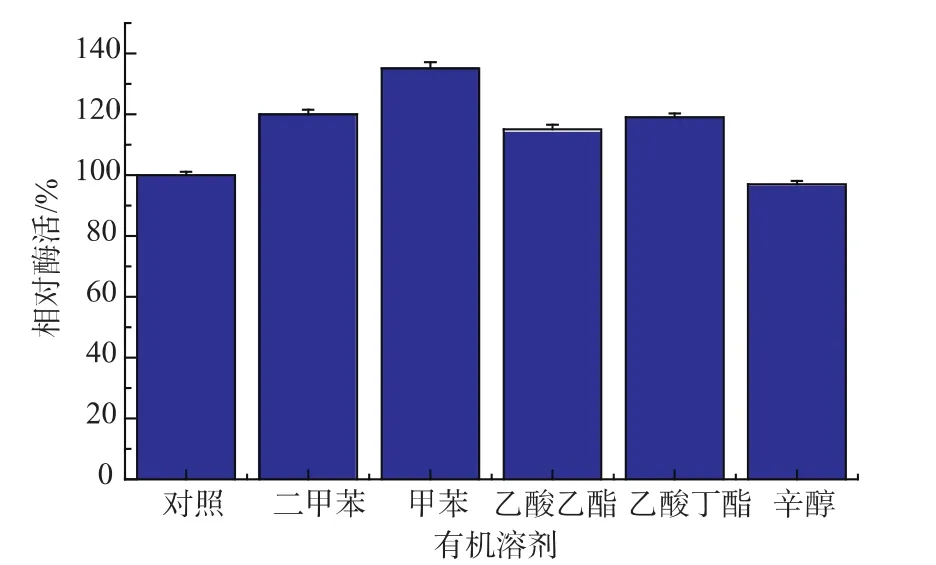
图2 有机溶剂对酶活的影响Fig.2 Effect of organic solvents on the TSase activity
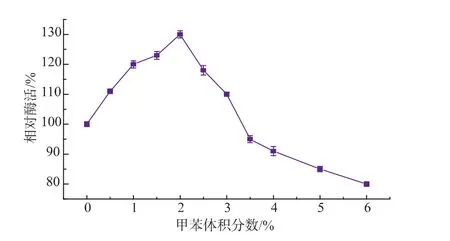
图3 甲苯体积分数对酶活的影响Fig.3 Effect of volume fractions of toluene on the TSase activity
2.3 反应温度和pH影响
在反应条件为5 mmol L-丝氨酸和5 mmol 2-甲基吲哚,质量分数1%PLP 150μL,体积分数2%甲苯,总反应体积50 mL,0.1 g色氨酸合成酶菌体,pH 8.0,改变反应温度得到相对酶活曲线,结果见图4,将测得的最高酶活设定为100%。由图可见,纯水体系在35℃反应时,色氨酸合成酶酶活均较高,温度过高或过低都使酶活下降。双相体系在40℃反应时,色氨酸合成酶酶活均较高,温度过高或过低都使酶活下降,尤其在55℃ 时,酶活大幅度降低失活较严重。
有机介质中的酶具有刚性结构,能记住其存在过的水溶液的最适pH值,称为“pH记忆”效应,在双相体系中,酶处于水相中,酶微环境pH值与水相pH值一致。水相pH值可以改变酶活性部位上有关基团的解离状态,从而影响酶与底物的结合,因此,酶促反应需要在适宜的pH环境中进行。本文中在反应条件为5 mmol L-丝氨酸和5 mmol 2-甲基吲哚,质量分数1%PLP 150μL,体积分数2%甲苯,总反应体积50 mL,0.1 g色氨酸合成酶菌体,35℃下考察了水相pH对酶活的影响,结果见图5,将测得的最高酶活设定为100%。由图可见,过低的pH值可能会影响酶的分子构象,使酶活偏低,当pH=8时,双相体系和纯水体系,酶活均较高,故反应水相pH=8为宜,双相体系中酶活高于纯水体系中酶活。
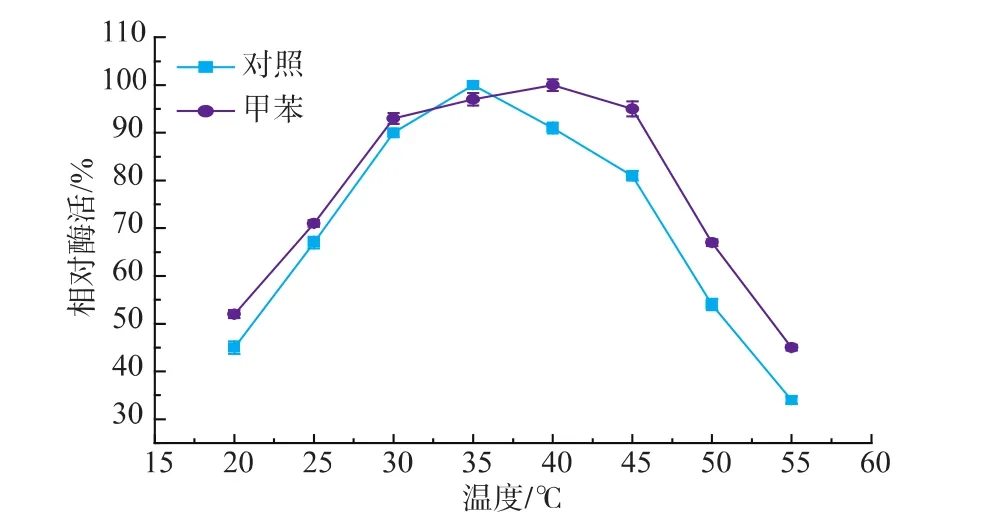
图4 温度对色氨酸合成酶酶活的影响Fig.4 Effect of tem perature on the enzymatic activity.
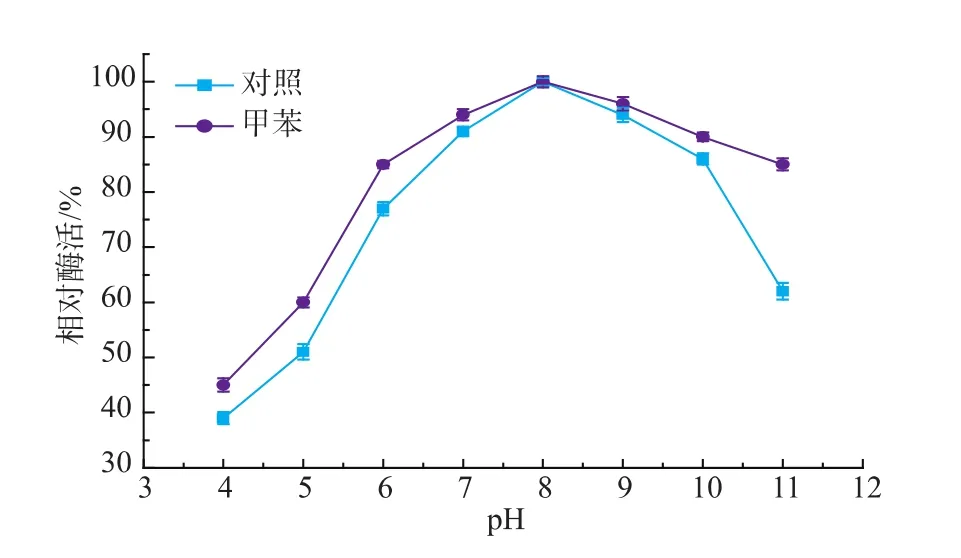
图5 水相不同pH对色氨酸合成酶酶活的影响Fig.5 Effect of pH on the enzymatic activity
2.4 底物浓度对酶活影响
底物浓度会影响酶促反应进程,当底物质量分数较低时,酶活会随着底物浓度升高而增加,当底物浓度过高时,又会产生底物抑制,不利于酶促反应的进行。反应条件为不同浓度L-丝氨酸和2-甲基吲哚,质量分数1%PLP 150μL,体积分数2%甲苯,总反应体积50 mL,0.1 g色氨酸合成酶菌体,35℃,pH 8.0下改变反应体系底物浓度,测得酶活曲线见图6,由图可见,双相体系和纯水体系,底物浓度为150mmol/L时酶活最高,双相体系中酶活高于纯水体系中酶活。

图6 底物浓度对色氨酸合成酶酶活的影响Fig.6 Effect of substrate concentrations on the enzyme activity
2.5 表面活性剂对酶活影响
反应条件为7.5mmol L-丝氨酸和7.5mmol 2-甲基吲哚,质量分数1%PLP 150μL,不同体积分数表面活性剂,质量分数1 mL甲苯,总反应体积50 mL,0.1 g色氨酸合成酶菌体,pH 8.0,35℃,分别用不同浓度吐温80、聚乙二醇辛基苯基醚(OP)、CTAB和Trion X-100处理菌体细胞,以不加表面活性剂的酶活设定为100%,测得酶活曲线,结果见图7。由图可见,经Trion X-100处理后,酶活明显高于其它两者,因此用质量分数2%的Trion X-100处理菌体细胞为宜。

图7 表面活性剂对色氨酸合成酶酶活的影响Fig.7 Effect of surfactants on the enzyme activity
2.6 金属离子对酶活影响
金属离子可以和酶分子结合,改变酶的分子构象,从而激活或抑制酶活力。在酶反应(反应条件为7.5 mmol L-丝氨酸和7.5 mmol 2-甲基吲哚,质量分数 1%PLP 150μL,质量分数 2%Trion X-100,1 mL甲苯,不同金属离子(10-4mol/L),总反应体积 50 mL,0.1 g色氨酸合成酶菌体,pH 8.0,35℃)过程中添加不同的金属离子,添加的离子包括Mg2+、Ca2+、Cu2+、Co2+和Zn2+,金属离子终浓度为10-4mol/L,考察金属离子对酶活的影响。由图8可知,与空白对照相比,Ca2+对酶促反应具有激活作用,所以在酶促反应中添加10-4mol/L的钙离子。

图8 金属离子对色氨酸合成酶酶活的影响Fig.8 Effect ofmetal ions on the enzyme activity
2.7 酶促反应进程
将0.1 g经Trion X-100处理过的湿菌体加到50mL双相反应体系中,水相加入5mmol丝氨酸,有机相加入2-甲基吲哚6mmol,甲苯体积分数为2%,10-4mol/L Ca2+,170 r/min震荡条件下反应;另以不加有机溶剂作为对照,定时取样计算2-甲基-L-色氨酸的生产量。双相反应体系反应5 h内2-甲基-L-色氨酸的生成量不断增加,5 h内反应基本完成,故酶促反应5 h即可终止,2-甲基-L-色氨酸的质量浓度为21.17 g/L。纯水相体系反应10 h内2-甲基-L-色氨酸的生成量不断增加,至10 h时酶促反应基本完成,2-甲基-L-色氨酸的质量浓度为20.29 g/L。
3 结语
在水/有机溶剂双相中,以L-丝氨酸和2-甲基吲哚为底物,利用重组大肠杆菌DM206[pETDuettrpBA+trpA/BL21(DE3)]色氨酸合成酶酶法合成2-甲基-L-色氨酸,并优化了其转化条件。在最佳工艺条件下酶促反应5 h,2-甲基-L-色氨酸的质量浓度为21.17 g/L。通过增加水/有机溶剂双相体系中2-甲基吲哚在酶反应体系中溶解度,可提高酶反应速度,缩短了反应时间,提高了2-甲基-L-色氨酸产率,为酶法合成2-甲基-L-色氨酸提供了新思路。
[1]KEMPTER C,KAISER D,HAAG S,et al.CDA:calcium-dependent peptide antibiotics from Streptomyces coelicolor A3(2)containing unusual residues[J].Angew Chem Int Ed,1997,36:498-501.
[2]TATSUO H,SHOJIM.Separation and assaymethods formelatonin and its precursors[J].J Chromatography B,2000,747:95-110.
[3]KEMA IP,ELISABETHG EV,MUSKIET FA J.Clinical chemistry of serotonin andmetabolites[J].J.Chromatography B,2000,747:33-48.
[4]DONG C,FLECKS S,UNVERSUCHT S,et al.Tryptophan 7-halogenase (PrnA)structure suggests a mechanism for regioselective chlorination[J].Science,2005,309:2216-2219.
[5]奚文波,秦丽星,王卫国,等.N-芴甲氧羰基-2-甲基色氨酸的合成方法:中国,101914605[P].2010-07-27.
[6]FRENZEL T,ZHOU P,FLOSS H G.Formation of 2-methyltryptophan in the biosynthesis of thiostrepton:Isolation of S-adenosylmethionine:Tryptophan 2-methyltransferase[J].Arch Biochem Biophy,1990,278:35-40.
[7]GOSSR JM,NEWILLPLA.A convenientenzymatic synthesisof L-halotryptophans[J].Chem Commun,2006,47:4924-4925.
[8]KIRCHNERG,SCOLLARM P,KLIBANOV A M.Resolution of racem icm ixtures via lipase catalysis in organic solvents[J].J Am Chem Soc,1985,107:7072-7076.
[9]SCHEWEH,HOLTMANN D,SCHRADER J.P450BM-3-catalyzed whole-cellbiotransformation ofα-pinenew ith recombinant Escherichia coli in an aqueous-organic two-phase system[J].ApplM icrobiol Biotechnol,2009,83:849-857.
[10]GUNAWAN C,BREUER M,HAUER B,et al.Improved(R)-phenylacetylcarbinol production w ith Candida utilis pyruvate decarboxylase atdecreased organic to aqueous phase volume ratios[J].Biotechnol Lett,2008,30:281-286.
[11]HILDEBRAND F,LUTZ S.Electroenzymatic synthesis of chiral alcohols in an aqueous-organic two-phase system[J]. Tetrahedron:Asymmetry,2007,18:1187-1193.
[12]FORESTIM L,PEDERNERA M,FERREIRA M L,et al.Kinetic modeling of enzymatic ethyl oleate synthesis carried out in biphasic systems[J].Appl Catal A,2008,334:65-72.
[13]ROSA PA J,FERREIRA IF,AZEVEDO A M,et al.Aqueous two-phase systems:A viable platform in themanufacturing of biopharmaceuticals[J].JChromatography A,2010,1217:2296-2305.
[14]WEID Z,ZHU JH,CAO X J.Enzymatic synthesisof cephalexin in aqueous two-phase systems[J].Biochem Engin J,2002,11:95-99.
[15]ZhOU Hua,YAO Zhong,SUN Guanghai,etal.Preparation of L-phenylalanine by an aqueous two-phase system[J].Chem ical Reaction Engineering and Technology,2006,22(2):146-150.(in Chinese)
Enzymatic Synthesis of L-2-M ethyltryptophan Catalyzed by Tryptophan Synthase in a Water/Organic Solvent Biphase System
XU Lisheng1,2, GAO Guizhen1, CAOWengen1, ZHAO Liang1,ZHANG Xingtao1, JIAO Qincai2, CHEN Jun1, SONGMan1
(1.School of Biological and Food Engineering,Suzhou University,Suzhou 234000,China;2.State Key Laboratory of Pharmaceutical Biotechnology,School of Life Science,Nanjing University,Nanjing 210093,China)
L-2-methyltryptophan plays an important role in many physiological processes.This paper investigated the synthesisof L-2-methyltryptophan in an aqueous/organic biphasic system,and optimized the syntheticmethod.The optimal transformation conditionswere 150mmol/L L-serine,2%toluene,0.1mmol/L Ca2+,2%Trion X-100,40℃and pH 8,which resulted in a contentof over21.17 g/L for L-2-methyltryptophan.Thus,the strain can be used to produce L-2-methyltryptophan and hasan excellentconverting capability of L-2-methyltryptophan.
tryptophan synthase,L-2-methyltryptophan,L-serine,2-methylindole
Q 814
A
1673—1689(2017)05—0547—06
2015-06-02
安徽省高校自然科学研究重点项目(KJ2017A440);安徽省质量工程项目(2015zjjh034、2015ckjh108、2016jyxm1038);宿州区域发展协同创新中心(特色种植业方向)开放课题项目(2015SZXTZXKFYB01)。
徐礼生(1980—),男,安徽安庆人,理学博士,副教授,主要从事微生物与生化药学研究。E-mail:xulisheng111@163.com
徐礼生,高贵珍,曹稳根,等.水/有机溶剂双相体系中色氨酸合成酶酶法合成2-甲基-L-色氨酸[J].食品与生物技术学报,2017,36(05):547-552.
