天门冬酰胺酶纳米囊的药动学及生物等效性研究
2017-07-25晏子俊李万玉胡雪原张景勍
晏子俊, 李万玉, 李 瑶, 胡雪原, 何 丹,张景勍
(重庆医科大学 重庆药物高校工程研究中心,重庆 400016)
天门冬酰胺酶纳米囊的药动学及生物等效性研究
晏子俊, 李万玉, 李 瑶, 胡雪原, 何 丹,张景勍*
(重庆医科大学 重庆药物高校工程研究中心,重庆 400016)
作者研究了载天门冬酰胺酶 (Asparaginase,AN)自组装透明质酸-聚乙二醇(Hyaluronic acid-graft-poly(ethylene glycol),HA-g-PEG)/γ-环糊精(γ-cyclodextrin,γ-CD)纳米囊(HA-g-PEG/γ-CD nanocapsules loaded with AN,AHRPs)在雄性SD大鼠体内的药代动力学和生物等效性。考察了AHRPs的透射电镜、粒径、Zeta电位、包封率,并分别测定大鼠静脉给予AHRPs和游离AN后,不同时间点大鼠血浆样品中AN的活性。采用DAS 2.1.1软件计算药动学参数,对AHRPs和游离AN进行生物等效性评价。经计算,AHRPs的平均粒径为(410.30±3.20)nm,Zeta电位为(-31.40±1.65)mV,平均包封率为(42.80±4.37)%。AHRPs和游离AN的主要药动学参数AUC(0~48h)分别为(104.01±1.68)U/(mL·h)和(46.38±1.98)U/(mL·h),AUC(0~∞)分别为(131.03± 19.67)U/(mL·h)和(51.44±3.01)U/(mL·h),t1/2分别为(4.31±1.53)h和(1.86±0.38)h。与游离AN比较,AHRPs的AUC(0~48h)、AUC(0~∞)和t1/2分别提高了2.24、2.55和2.32倍。AUC(0~48h)、AUC(0~∞)和Cmax的90%可置信区间分别为77.1%~78.7%、76.7%~78.3%、98.9%~100.5%。AHRPs延长了AN在大鼠体内的生物半衰期,提高了AN在大鼠体内的生物利用度,且AHRPs与游离AN不具有生物等效性。
天门冬酰胺酶;纳米囊;药代动力学;生物等效性
天门冬酰胺是细胞合成蛋白质的必需氨基酸。某些肿瘤细胞(如淋巴白血病细胞等)缺乏天门冬酰胺合成酶而不能合天成门冬酰胺,须依赖宿主供给。给予天门冬酰胺酶(Asparaginase,AN)后,AN通过降解患者体内的天门冬酰胺而抑制肿瘤细胞中蛋白质的正常合成,从而使肿瘤细胞死亡,而正常细胞有能力进行自身合成而不受影响[1-2]。但AN在临床应用上存在着生物半衰期短、易被降解、稳定性差等缺点[3],限制了AN在临床上的应用。 因此,延长AN的生物半衰期、增加AN的稳定性和提高AN的生物利用度已成为AN研究热点。近来,文献[4-5]中报道的自组装纳米囊是一种新型的药物载体,其空心结构可封装酶、小分子药物、基因等,它具有生物膜的相似性,能提高封装药物的稳定性,延长被封装药物的生物半衰期,提高封装药物的生物利用度以及降低毒副作用等特点。
本文中依据上述思路,将透明质酸-聚乙二醇(Hyaluronic acid-graft-poly ethylene glycol,HA-g-PEG)与γ-环糊精(γ-cyclodextrin,γ-CD)采用自组装方法制得载带AN的HA-g-PEG/γ-CD纳米囊(HA-g-PEG/γ-CD nanocapsules loaded with AN,AHRPs),并考察了AHRPs的透射电镜、粒径、Zeta电位、包封率以及AHRPs在大鼠体内的药代动力学和生物等效性。
1 材料与方法
1.1 材料和仪器
1.1.1 主要材料、试剂 AN(225 IU/mg,纯度≥96.0%,批号:312PLASP11):购自以色列Prospec公司;HA(纯度:>99.0%,相对分子质量:12 000,批号:20131027):购自曲阜市广龙生物制品厂;γ-CD(纯度:>98.0%,相对分子质量:1297.12,批号:C0014):购自都莱生物技术有限公司;PEG(相对分子质量:2 000,规格:250 g):购自Sigma-aldrich公司;HA-g-PEG(批号:20141012;20141016;20141021):作者所在实验室提供;Tris-HCl缓冲液 (50 mmol/L,pH 7.3),作者所在实验室自配;其它试剂均为分析纯。1.1.2 主要仪器与动物 Milli-Q型超纯水系统:美国Millipore公司产品;pH计:上海精密科学仪器有限公司产品;RE-52AA型旋转蒸发器:上海亚荣生化仪器厂制造;85-2型恒温磁力搅拌器:上海司乐仪器有限公司产品;Zetasizer Nano zs90型激光粒度电位仪:英国马尔文公司产品;UV-7504 PC型紫外分光光度计:上海欣茂仪器有限公司产品。
清洁级健康SD大鼠,雄性,体重(250±20)g,由重庆医科大学实验动物中心提供 (许可证号:SCXK-(渝)2014-0001)。
1.2 试验方法
1.2.1 AHRPs的制备 将适量溶有AN的HA-g-PEG溶液缓慢滴加至γ-CD饱和溶液中,一定温度下磁力搅拌 2 h后,即得 AHRPs[6-8](批号:20141013;20141017;20141022)。
1.2.2 AHRPs的透射电镜 取AHRPs适量,用Tris-HCl缓冲液稀释适当倍数后,在透射电镜下观察AHRPs的形态。
1.2.3 AHRPs粒径和Zeta电位的测定 使用马尔文粒度仪检测AHRPs的粒径和Zeta电位。方法如下:取AHRPs溶液适量,加入Tris-HCl缓冲液稀释一定的倍数后,测定AHRPs的粒径和Zeta电位。
1.2.4 AHRPs包封率的测定 按照葡聚糖凝胶法[9]测定AHRPs的包封率。方法如下:制备过柱后的AHRPs,在595 nm波长下,测得吸光度A1。同法处理,测得未过柱的AHRPs的吸光度A2。由测得的吸收值A1和A2计算出1mL AHRPs混悬液中制剂所含AN的质量M1和AHRPs混悬液中AN总质量M2,包封率按照如下公式计算:
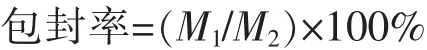
上式中,M1为AHRPs混悬液中制剂所含AN的质量,M2为AHRPs混悬液中AN总质量。
1.2.5 AN活性的测定 主要参照马斯本-利斯通法[6,10]测定AN的活性,并进行改进即实验前样品预热2min。
1.2.6 药代动力学
1)动物的饲养。雄性SD大鼠购买后饲养7 d以上用于实验,环境温度为(25.0±2.0)℃,相对湿度为(50±10)%,自由饮水和进食。
2)动物的分组和给药。将12只雄性SD大鼠随机分为两组,每组6只。分别尾静脉注射给予AHRPs和游离AN,剂量均为2.0 kU/kg。给药前禁食24 h。
3)样品的采集和处理[11-12]。分别在给药后0.08、0.17、0.25、0.50、0.75、1、1.5、2、3、4、6、8、10、12、24、48 h眼底静脉丛取血。采血置于肝素化后的试管,以3 000 r/min离心10 min后分离血浆样品,按“1.2.5 AN活性的测定”项下方法进行活性测定,计算血浆样品中AN的活性,进行AHRPs的药动学研究。
4)实验数据处理方法。根据所测结果,绘制平均血药浓度-时间曲线。用DAS 2.1.1软件计算药代动力学参数。
1.2.7 生物等效性的评价 将AHRPs和游离AN的主要药代动力学参数AUC(0~48h)、AUC(0~∞)及Cmax进行方差分析,再采用双向单侧t检验 (显著性水平P=0.05),90%可信限考察,Tmax采用非参数统计Wilcoxon检验。评价AHRPs和游离AN是否具有生物等效性(α=0.05)。
2 结果与讨论
2.1 AHRPs在透射电镜下的形态
透射电镜下观察到AHRPs呈均匀分布的圆形或椭圆形,如图1所示。
2.2 AHRPs的粒径和Zeta电位
马尔文激光粒度电位仪测得AHRPs的平均粒径为(410.30±3.20)nm,Zeta电位为(-31.40±1.65)mV。
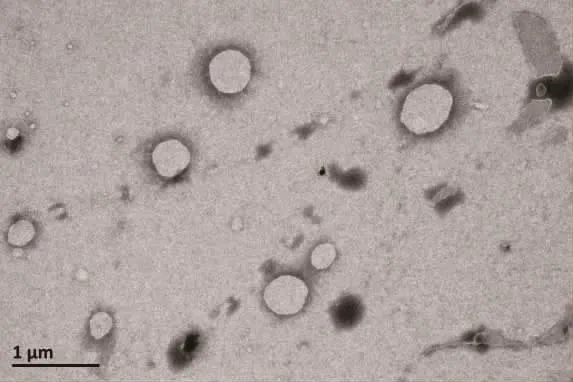
图1 AHRPs的透射电镜图Fig.1 Transm ission electron m icroscopy image of AHRPs
2.3 AHRPs的包封率
测得3批AHRPs的包封率分别为:38.75%,42.20%和47.44%。用excel 2007进行数据统计,统计结果用均数±标准差表示。经计算,AHRPs的包封率为(42.80±4.37)%(n=3)。
2.4 药时曲线和药动学参数
以时间为横坐标,平均血药浓度为纵坐标,建立了AN在大鼠体内AHRPs和游离AN的药-时曲线(见图2),图2(a)为取血时间点下的药-时曲线,图2(b)为相等时间间隔下的药-时曲线。AHRPs和游离AN在SD大鼠体内的药代动力学参数见表1。
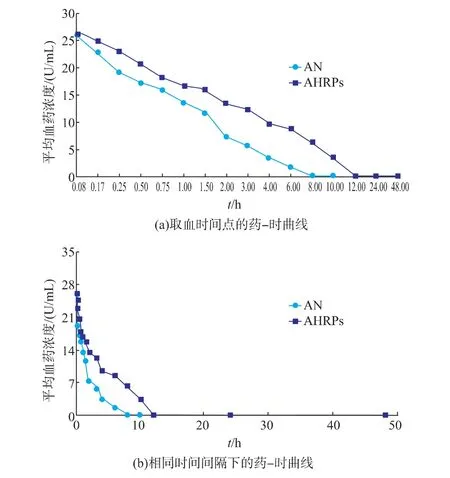
图2 大鼠静脉给予AHRPs和游离AN后的平均血药浓度-时间曲线(±s,n=6)Fig.2 M ean concentration-time curves of AHRPs and free AN w ith intravenous adm inistration
如图2所示,大鼠静脉注射游离AN后,AN失活较快,6 h时几乎完全失活,8 h时完全失活。而AHRPs静注给药后,AN失活较慢,6 h时仍有较高活性,12 h时才完全失活。结果表明,AHRPs延长了AN在大鼠体内的滞留时间,提高了AN在大鼠体内的稳定性。
表1 SD大鼠静脉注射AHRPs和游离AN后的主要药动学参数(±s,n=6)Table 1 M ain pharmacokinetic parameters after the injection of AHRPs and free AN into rats
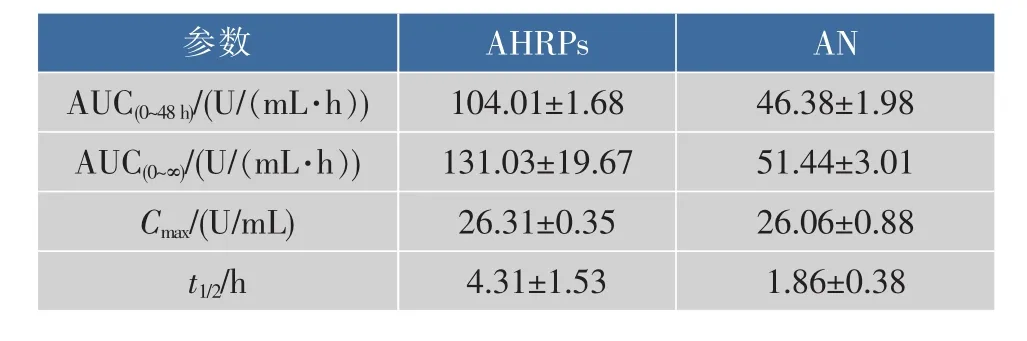
表1 SD大鼠静脉注射AHRPs和游离AN后的主要药动学参数(±s,n=6)Table 1 M ain pharmacokinetic parameters after the injection of AHRPs and free AN into rats
参数A H R P s A N A U C(0~48h)/ ( U /(m L · h)) 4 6 . 3 8 ± 1 . 9 8 A U C(0~∞)/ ( U /(m L · h)) 1 0 4 . 0 1 ± 1 . 6 8 1 3 1 . 0 3 ± 1 9 . 6 7 5 1 . 4 4 ± 3 . 0 1 Cmax/ ( U / m L ) 2 6 . 3 1 ± 0 . 3 5 2 6 . 0 6 ± 0 . 8 8 t1/2/ h 4 . 3 1 ± 1 . 5 3 1 . 8 6 ± 0 . 3 8
由表1参数可以看出:(1)AHRPs的半衰期t1/2为 (4.31±1.53)h,游离AN的为 (1.86±0.38)h,AHRPs的t1/2为游离AN的2.32倍,说明AHRPs消除较慢,能有效延长AN在大鼠体内生物半衰期。(2)AHRPs的AUC(0~48h)为(104.01±1.68)U/(mL·h),是游离AN的2.24倍,说明AHRPs显著提高了游离AN的生物利用度。
2.5 生物等效性评价结果
由实验结果可以看出,AHRPs与游离AN的AUC(0~48h)、AUC(0~∞)和Cmax3个参数的90%可置信区间均不在生物等效性标准区间范围内,因此AHRPs与游离AN生物等效性不合格。另外,对Tmax进行非参数法检验,结果显示AHRPs和游离AN的Tmax具有显著性差异(P<0.05)。按照生物等效性的判定标准,AHRPs与游离AN不具有生物等效性,即AHRPs的药效学标准明显比游离AN的高。
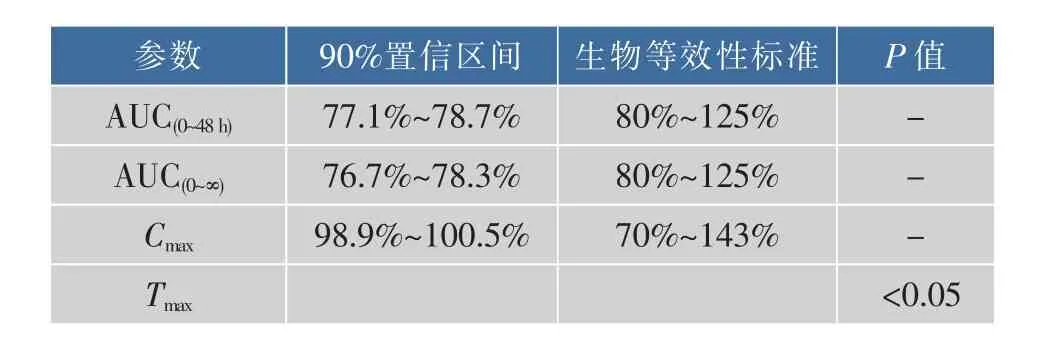
表2 大鼠静注(2 kU/kg,i.v.)AHRPs和游离AN后,生物等效性的比较Table 2 Bioequivalence com parison of AHRPs and free AN via oral(at the identical dose of 50mg/kg of JM)and intravenous(at the dose of 2 kU/kg of AN)routs,respectively,n=6 per group
3 结语
AN在临床应用上存在生物半衰期短、稳定性差和毒副作用等缺点。目前,针对AN的缺点,国内外已进行了下列研究:聚乙二醇对AN进行物理包埋或修饰[15-16];制备纳米结构AN脂肪酸生物共轭体[17];将AN共价结合固定化于丝素纳米颗粒[18];将AN制备成前体脂质体[19-20]等。但以上对AN的改善方法都不能使AN发挥其最优的催化活性,且大都会存在较低的生物相容性、较差的稳定性及AN易脱落等缺点。
作者首次采用自组装法成功制备了AHRPs,并对AHRPs在大鼠体内的药代动力学和生物等效性进行了研究,以期能提高AN在大鼠体内的稳定性,延长AN的生物半衰期,并提高其生物利用度。实验结果显示,将AN制成AHRPs,使AN的静注生物利用度提高了2.24倍,半衰期t1/2延长了2.32倍。说明AHRPs提高了AN在体内的生物利用度和稳定性,并延长了AN在体内的生物半衰期。可能的原因是:该纳米囊材料具有生物相似性,能有效提高AN的吸收:空心纳米囊结构,能阻挡抗胰蛋白水解酶及抗原与AN的接触,因此在一定程度上能增强AN的稳定性。且根据生物等效性判断标准,AHRPs与游离AN生物等效性不合格,即AHRPs的药效学标准明显比游离AN的高。本文中首次制备AHRPs,且对其在大鼠体内的药代动力学和生物等效性进行了研究,故具有一定的前瞻性,也为AN在临床上的进一步研究奠定了基础。
参考文献:
[1]ZHOU Jining,JIN Hao,LIYongfeng,etal.Progress in researches on anti-tumor agent L-asparaginase for treatmentof leukem ia [J].J Biomed Eng,2000,17(3):343-345.(in Chinese)
[2]LIXiaoyuan,CHEN Jianhua,WUWutong.Recentadvances in clinica lStudieson PEG-L-asparag inase[J].Progress in Pharm Aceutical Sciences,2009,33(11):503-510.(in Chinese)
[3]HAFSA K E,WUWutong,LIU Jingjing,et al.The E.coil L-asparaginase wasmodified w ith activated dextran and PEG-2[J]. Pharmaceutical Biotechnology,1997,4(2):118-121.(in Chinese)
[4]ARAVIND A,JEYAMOHAN P,NAIR R,et al.AS1411 aptamer tagged PLGA-lecithin-PEG nanocapsules for tumor cell targeting and drug delivery[J].Biotechnol Bioeng,2012,109(11):2920-31.
[5]HAW,FANM M,PENG SL,etal.Self-assembly of chitosan-g-PEG andα-cyclodextrin into hollow spheres in aqueous solution [J].JControl Release,2011,152(Suppl1):e204-e205.
[6]HA W,MENG X W,LIQ,et al.Self-assembly hollow nanosphere for enzyme encapsulation[J].Soft M atter,2010,6(7):1405-1408.
[7]LI Q,XIA B,BRANHAM M,et al.Self-assembly of carboxymethyl konjac glucomannan-g-poly (ethylene glycol)and(α-cyclodextrin)to biocompatible hollow nanospheres for glucose oxidase encapsulation[J].Carbohydrate Polymers,2011,86(1):120-126.
[8]MENG XW,HAW,CHENG C,etal.Hollow Nanospheres Based on the Self-Assembly of A lginate-graft-poly(ethylene glycol)andα-Cyclodextrin[J].Langmuir,2011(23):14401-14407.
[9]WANG Hong,WU Wutong,GU Xueqiu.Preparation of proliposomes and the determ ination of encapsulation of recombinant-L-asparaginase[J].Journal of Shenyang Pharmaceutical University,1999,16(4):235-238.(in Chinese)
[10]施特尔马赫.酶的测定方法[M].钱嘉渊,译.北京:中国轻工业出版社,1992:85-88.
[11]KONECNA P,KLEJDUSB,HRSTKOVA H.Monitoring the asparaginase activity and asparagine levels in children w ith acute lymphoblastic leukaemia treated w ith differentasparaginase preparations[J].Scripta M edica,2004,77(2):55-62.
[12]CHEN Jianhua,WU Wutong,HIRANO K.Antibody sandw ich enzyme-linked immunoadsorbent assay for determination of recombinant E.coli L-asparaginase in rat plasma and its pharmacokinetics[J].Acta Phamaceutica Sinica,2003,38(8):613-616.(in Chinese)
[13]ZHONG Jingjie,WANG Dongkai,ZHANG Cuixia,etal.Pharmaceuticalsignificance of sodium alginate[J].Chinese Journal of New Drugs,2007,16(8):591-594.(in Chinese)
[14]UMESH K N,SHAMSHER S K,WAM IK A.Pharmacological and clinical evaluation of L-asparaginase in the treatment of leukem ia[J].Critical Reviews in Oncology/Hematology,2007,61(3):208-221.
[15]MOLINEUXG.Engineering improved biopharmaceuticals foroncology[J].Pharmacotherapy,2003,23(8Part2):3S-8S.
[16]AARONSON SA.Cancermedicine[M].5th ed.H amilton:B.C.DeckerInc.2000:2140.
[17]ASHRAFIH,AM INIM,MOHAMMADIS S.Nanostructure AASaraginase-fatty acid bioconjugate:Synthesis,preformulation study and biologicalassessment[J].Int JBiolM acromol,2013,62:180-187.
[18]ZHANG Yuqing,XIANG Ruli,YAN Haibo,etal.Preparation of silk fibroin nanoparticlesand theirapplication to immobilization of L-asparaginase[J].Chem ical Journal of Chinese Universities,2008,3(10):25-36.(in Chinese)
[19]GUOQinlong,CHEN Zhen,DINGQilong.Effectof L-asparaginase,proliposome on toxicity inmice and experimental tumor[J]. Journal of China Pharmaceutical University,2001,32(1):67-69.(in Chinese)
[20]WANG Hong,WU Wutong,GU Xueqiu,et al.Effect of recombinant-L-asparaginase proliposome on the acute lymphatic leukaem iaand the toxicity inm ice[J].Chin Hosp Pharm J,2001,21(4):216-218.(in Chinese)
Pharmacokinetics and Bioequiavailability of Asparaginase Nanocapsules
YAN Zijun, LIWanyu, LIYao, HU Xueyuan, HE Dan, ZHANG Jingqing*
(Engineering Research Center in University,Chongqing Medical University,Chongqing 400016,China)
To study the pharmacokinetics and bioequivalence of asparaginase hyaluronic acid-graft-poly(ethylene glycol)/γ-cyclodextrin nanocapsules(AHRPs)in SD rats.We observed the image of AHRPs under the transm ission electron m icroscopy.Size,Zeta potential,entrapment efficiency were detected.The AN activity was assayed after the intravenous injection of AHRPsand free AN into rats.The pharmacokinetic parameterswere calculated by software DAS 2.1.1,then the bioequivalence was judged.The average particle size was(410.30±3.20)nm,Zeta potential was(-31.40±1.65)mV,average entrapment efficiency was(42.80±4.37)%.AUC(0~48h)of AHRPs andfree AN was(104.01±1.68)U/(m L·h)and(46.38±1.98)U/(m L·h),AUC(0-∞)was(131.03±19.67)U/(m L·h)and(51.44±3.01)U/(m L·h),t1/2was(4.31±1.53)h and(1.86±0.38)h,respectively. Compared w ith free AN,AUC(0~48h),AUC(0-∞)and t1/2of AHRPswere increased 2.24,2.55 and 2.32 times,respectively.The 90%confidential intervals of AUC(0~48h),AUC(0-∞)and Cmaxof tested formulation were 77.1%~78.7%,76.7%~78.3%,98.9%~100.5%,respectively.AHRPs can improve the bioavailability and extend the biological half-life of AN in rats.AHRPs and free AN are not bioequivalent.
asparaginase,nanocapsules,pharmacokinetics,bioequiavailability
Q 556;R 392-33
A
1673—1689(2017)05—0461—05
2015-05-08
国家自然科学基金项目(30973645);重庆市首批高等优秀人才资助计划(X10058);重庆市研究生科研创新项目(CYS16133)。
*通信作者:张景勍(1973—),女,重庆人,理学博士,教授,博士研究生导师,从事药物新剂型与新技术研究工作。
E-mail:zjqrae01@163.com
晏子俊,李万玉,李瑶,等.天门冬酰胺酶纳米囊的药动学及生物等效性研究[J].食品与生物技术学报,2017,36(05):461-465.
