施钾对甘薯根系生长和产量的影响及其生理机制
2017-07-25汪顺义史衍玺
汪顺义 李 欢 刘 庆 史衍玺
青岛农业大学资源与环境学院, 山东青岛 266109
施钾对甘薯根系生长和产量的影响及其生理机制
汪顺义 李 欢 刘 庆 史衍玺*
青岛农业大学资源与环境学院, 山东青岛 266109
为探讨施钾调控甘薯根系生长的生理机制, 设K0 (K2O: 0 kg hm–2)、K1 (K2O: 75 kg hm–2)、K2 (K2O: 150 kg hm–2)和K3 (K2O: 225 kg hm–2) 4个处理, 调查施钾对甘薯生长前期和薯块膨大期根系生长、13C分配量、碳代谢酶活性、光合特性、叶绿素荧光特性、以及产量和产量构成的影响。结果表明, 与CK相比, 施钾处理2个生长时期光电子传递速率(ETR)提高 12.7%~63.6%, 净光合速率(Pn)提高 7.2%~26.4%, 施钾通过提高光合特性加速光合产物积累,为根系生长提供物质基础。同时, 施钾有利于光合产物由地上部向地下部运转, 地下部13C分配量提高10.6%~66.2% (P<0.05)。其次, 施钾处理提高了块根中蔗糖合酶、磷酸蔗糖合酶、腺苷二磷酸葡萄糖焦磷酸化酶活性, 加速了块根中碳的同化, 利于光合产物在块根中的积聚, 促进甘薯根系分化与生长。生长前期, 施钾处理总根长提高13.6%~22.8%, 根平均直径提高 11.3%~51.9%, 显著提高了不定根向毛细根和块根分化量(P<0.05), 有利于有效薯块的早期形成, 保证有效的单株结薯数。薯块膨大期, 施钾处理提高块根生物量, 有利于薯块的膨大, 提高平均薯块重,最终显著增产。与CK相比, 2014年K1、K2和K3处理分别增产15.8%、24.3%和44.7%, 2015年分别增产7.9%、13.4%和22.8%。
甘薯; 根系生长; 光合特性;13C分配; 碳代谢酶活性
作为典型的块根类作物, 甘薯根系不仅是矿质养分吸收器官, 也是光合产物贮藏器官, 甘薯根系形态、分化状况直接决定了甘薯产量[1]。甘薯高产栽培的核心问题就是调控甘薯根系前期分化和后期膨大。在目前甘薯生产中, 前期有效薯分化较少、后期薯块膨大受阻是限制甘薯产量进一步提高的主要障碍。
甘薯属典型的“喜钾”作物, 钾素有维持甘薯细胞渗透压[2], 调节气孔运动[3], 保障酶活性、提高光合速率[4], 促进植株内糖分的运输[5]等作用。增施钾肥能够提高干物质在块根中的分配率, 增加干物质生产量和块根产量, 近年来甘薯生产中十分重视钾肥施用[6-7]。史春余等[8]和宁运旺等[6]研究发现施钾有利于干物质在块根中的分配与积累, 提高块根产量, 李伟柳等[9]和王道中等[10]认为施钾促进了甘薯钾素积累, 进而提高最终产量, Foloni等[11]认为过量施钾会造成甘薯钾素奢侈吸收, 钾肥利用率下降。而施钾提高甘薯产量的原因, 特别是施钾促进根系分化、块根建成的生理机制尚存在不同的观点。宁运旺等[12]认为施钾并不影响生长前期甘薯根系分化(光合产物在根系中积累), 钾对甘薯生长存在前、后功能不一致。而齐鹤鹏等[13]认为施钾对甘薯产量增长原因主要是促进前期根系的分化, 促进侧根的增加和已有须根的膨大。对于田间条件下生长前期根系的分化和生长后期块根的膨大是否受到钾用量的影响还鲜有相关研究报道。本文开展两年田间试验,研究了 2个关键生长时期施钾对根系生长特性的影响, 从根系形态、光合产物分配与积累和碳代谢酶活性角度, 探讨施钾调控甘薯根系生长进而提高甘薯产量的生理机制。
1 材料与方法
1.1 试验设计
选用北方主栽淀粉型品种商薯19, 于2014年5月15日和2015年5月17日, 在青岛农业大学胶州实验基地设置田间试验。试验地区是暖温带季风气候, 降水集中, 雨热同季, 年平均气温 11~14℃。该地土壤类型为砂姜黑土, 布置试验前, 采表层土壤(0~20 cm)风干磨碎后, 按照鲍士旦[14]方法测定土壤有机质、碱解氮、速效磷和速效钾(表1)。

表1 不同试验年份移栽前土壤肥力状况Table 1 Chemical composition of the soil before transplanting in two years
试验设K0 (不施钾肥)、K1 (K2O: 75 kg hm–2)、K2 (K2O: 150 kg hm–2)和K3 (K2O: 225 kg hm–2), 共4个处理, 每处理施底肥75 kg hm–2N和45 kg hm–2P2O5, 采用起垄净作栽培方式, 株距 0.22 m、垄距0.8 m, 小区面积48 m2(7.5 m × 6.4 m), 每个处理3次重复, 随机区组排列。移栽后40 d和100 d, 在晴天 10:00—11:00, 选取每小区生长一致具有代表性的植株4株, 在其主茎第5片展开叶上进行13CO2标记。13CO2由Ba13CO3(13C 99%)和磷酸在反应器中反应生成, 并用气球收集; 标记前将欲标记叶用体积约 500 mL的聚氯乙烯透明塑料薄膜袋密封,用医用注射器注入50 mL13CO2(1%), 在自然光照下光合同化 1 h后撤掉塑料薄膜袋, 标记完成 3 d后收获。
1.2 测定项目与方法
1.2.1 产量 田间试验于移栽 155 d后收获, 每个处理选取 200株甘薯进行单株薯块数和平均薯重统计, 并计算产量。
1.2.2 生物量 将植株分为叶、茎蔓、块根3个部分, 105℃杀青30 min然后75℃烘干至恒重。
1.2.3 总根长、根体积、根表面积、平均直径和根系活力 将甘薯完整的根系取出后用蒸馏水洗净,用根系扫描仪(LA1600+scanner, Canada)扫描根系形态, 用WinRHIZO根系分析系统分析根系动力学参数并统计根系径级分布, 进行毛细根、中等根和块根的分类。并采用TTC法测定根系活力。
1.2.4 样品13C丰度测定 用同位素比率质谱仪(Delta V Advantage)在农业环境与可持续发展研究所稳定性同位素实验室测定δ13C。
1.2.5 净光合速率 于移栽 40 d和 100 d上午9:00—10:30采用 CIRAS-3便携式光合测定仪(Hansatech, USA), 人工控制CO2浓度400 μmol CO2mol–1、温度25℃、光照强度1200 μmol m–2s–1, 测定净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)和蒸腾速率(Tr)。
1.2.6 叶绿素荧光参数 先进行15 min的叶片暗适应处理, 然后采用FMS-2便携式脉冲调制式荧光仪(英国Hansatech公司生产)测定叶片快速叶绿素荧光诱导动力学曲线(O-J-I-P曲线)。随后利用JIP-test对O-J-I-P曲线进行分析, 解析Fo、Fv、Fm、Fs、Fm′和Fv′等叶绿素荧光参数。
1.2.7 SS和 SPS活性 将块根用蒸馏水洗净后,称取0.5 g样品, 加入7 mL Hepes-NaOH缓冲液(pH 7.5), 冰浴研磨至匀浆, 转入15 mL离心管, 10 000× g 4℃离10 min, 上清液即为酶液。取50 μL酶液加入50 μL缓冲液、25 mmol L–1MgCl240 μL、50 mmol L–1UDPG 40 μL和100 mmol L–16-磷酸果糖(果糖) 20 μL, 30℃保温30 min, 100℃沸水浴1 min, 加入2 mol L–1NaOH 100 μL混匀, 100℃水浴10 min, 加入30% HCl 2.0 mL和1%间苯二酚1 mL, 混匀后80℃保温10 min, 冷却后于480 nm波长下比色, 测定生成的蔗糖量, 表示酶活性。酶液经沸水浴后加入反应液为对照[15]。
1.3 计算公式
Fi (13C丰度%) = (δ13C + 1000) ×R标/[(δ13C+1000) ×R标+1000]×100
R标为碳同位素的标比值, R标= 0.0112372
各器官13C积累量13Ci = Ci × (Fi–F自然)×10总碳积累量(g) = 生物量(g)×甘薯器官全碳含量(%)
13C分配率(%) = 该器官13C积累量/植株总13C积累量×100%
ΦPSII(PSII实际光化学效率)=(Fm′–Fs)/ Fm′
qP(光化学淬灭系数)=(Fm′–Fs)/(Fm′–Fo′)
ETR = PAR×ΦPSII×0.84×0.5[16]。
1.4 数据分析
用SPSS (18.0) (SPSS Institute, Inc., Cary, NC, USA)统计分析, LSD法比较平均数间的差异显著性;甘薯产量受光合特性、根系分化因素影响, 为明确各指标对甘薯产量作用效果大小, 利用 DPS7.05软件进行逐步回归分析与通径分析; 为进一步明确根系生长与光合产物积累分配、碳代谢酶活性之间的关联程度, 进行偏相关分析。
2 结果与分析
2.1 施钾对甘薯产量及产量构成的影响
2014—2015年试验(表2)表明, 与K0处理相比,施钾显著提高了甘薯单株薯块数、平均薯重和产量(P<0.05), 其中, 2014年K1、K2和K3处理分别增产15.8%、24.3%和44.7%, 2015年分别增产7.9%、13.4%和22.8%。双因素分析表明, 施钾量对甘薯单株结薯数和平均薯重影响显著(P<0.05), 对甘薯产量影响极显著(P<0.01), 且施钾量与年际对甘薯产量存在显著的互作效应(P<0.05)。通过两年甘薯产量因素分析可见, 施钾提高甘薯产量基于单株块根数与平均块根重的显著增加。
2.2 施钾对甘薯根系形态的影响
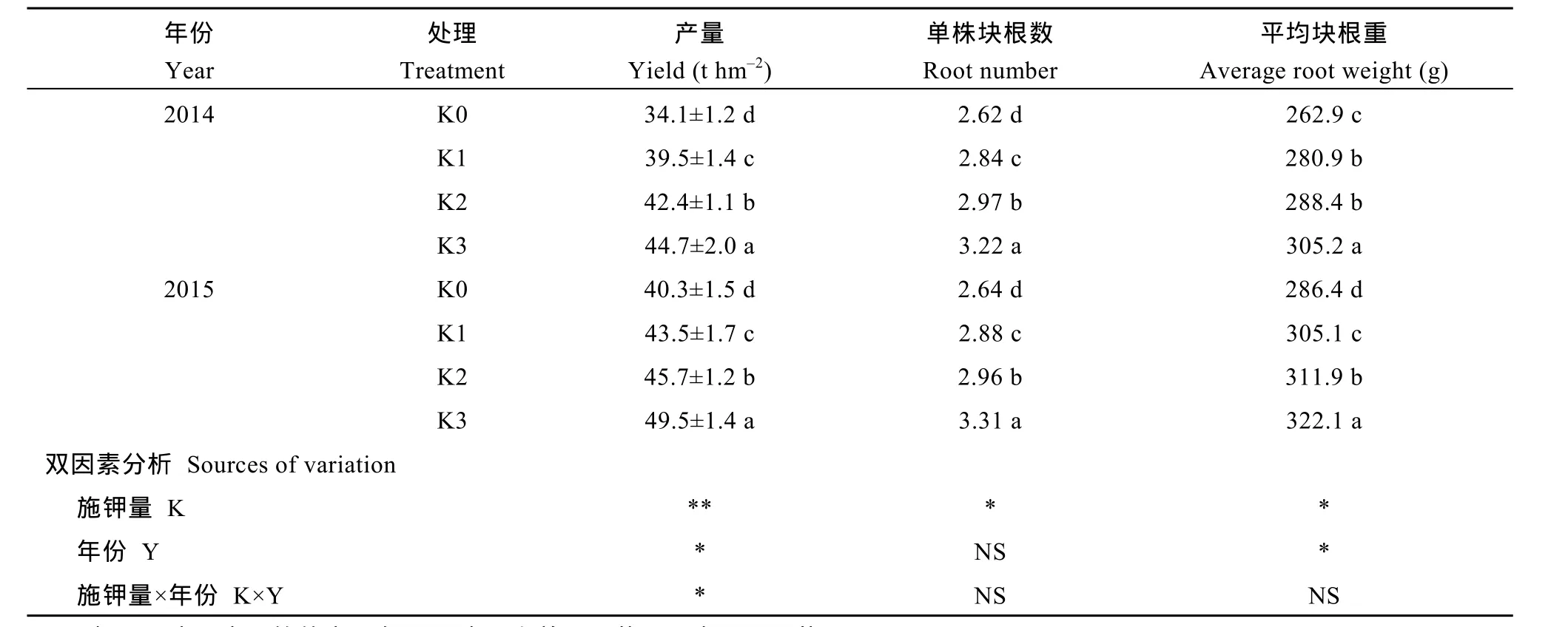
表2 施钾对甘薯产量及产量构成的影响Table 2 Effect of potassium application on yield of and it components in sweetpotato
方差分析表明, 数据年际间变化未达显著性差异, 故数据以两年数据的平均值展示。甘薯根系形态是制约甘薯养分吸收的关键因素。表 3所示, 生长前期(40 d), 与K0处理相比, 3个施钾处理总根长分别提高13.6%、18.7%和22.8% (P<0.05), 根表面积分别提高11.4%、17.5%和28.3% (P<0.05), 根平均直径分别提高 11.3%、25.8%和 51.9%。可见, 施钾不仅促进了甘薯前期根系的伸长, 而且有利于根系的增粗, 有利于根系的早期分化。薯块膨大期(100 d), 与 K0处理相比, 3个施钾处理根体积分别提高19.7%、35.1%和 41.9%, 根平均直径分别增加10.1%、22.8%和 26.8%, 表明施钾有利于甘薯生长后期的薯块的持续膨大。
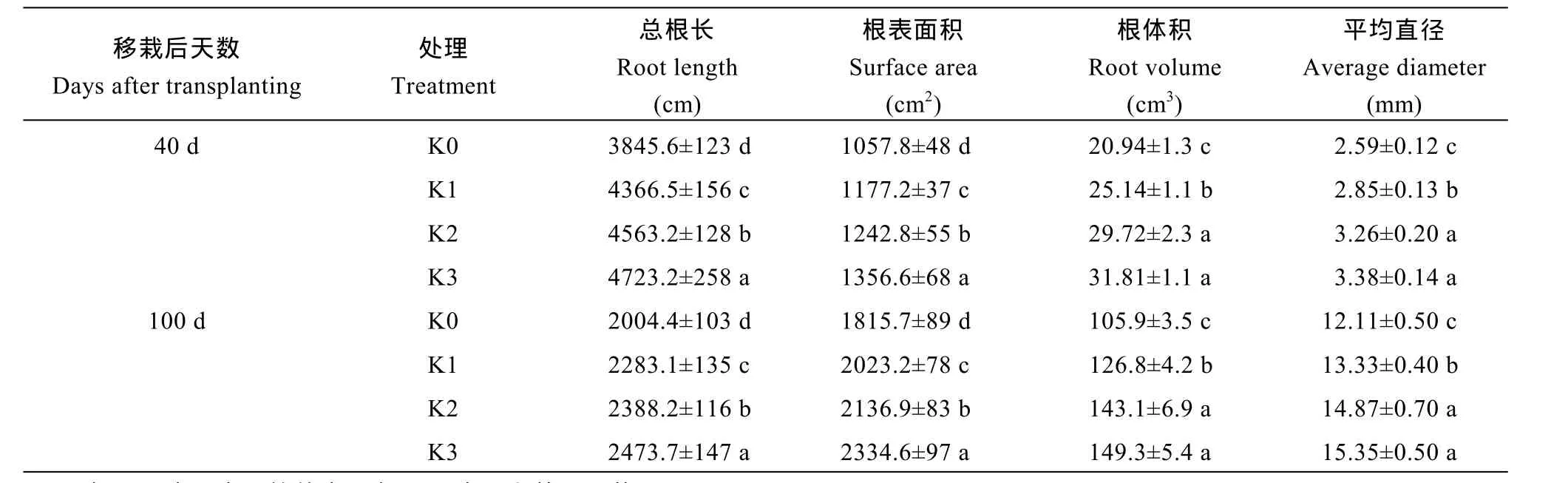
表3 施钾对甘薯根系形态的影响Table 3 Effect of potassium application on root morphology of sweetpotato
2.3 施钾对根系活力的影响
根系活力是表征甘薯根系吸收能力的重要指标之一。图1所示, 与K0处理相比, K1、K2和K3处理根系活力生长前期(40 d)分别提高 20.5%、43.1%和53.9%, 薯块膨大期(100 d)分别提高13.4%、24.5%和38.0%。表明施钾能显著提高根系吸收能力, 且对生长前期的影响较为显著。
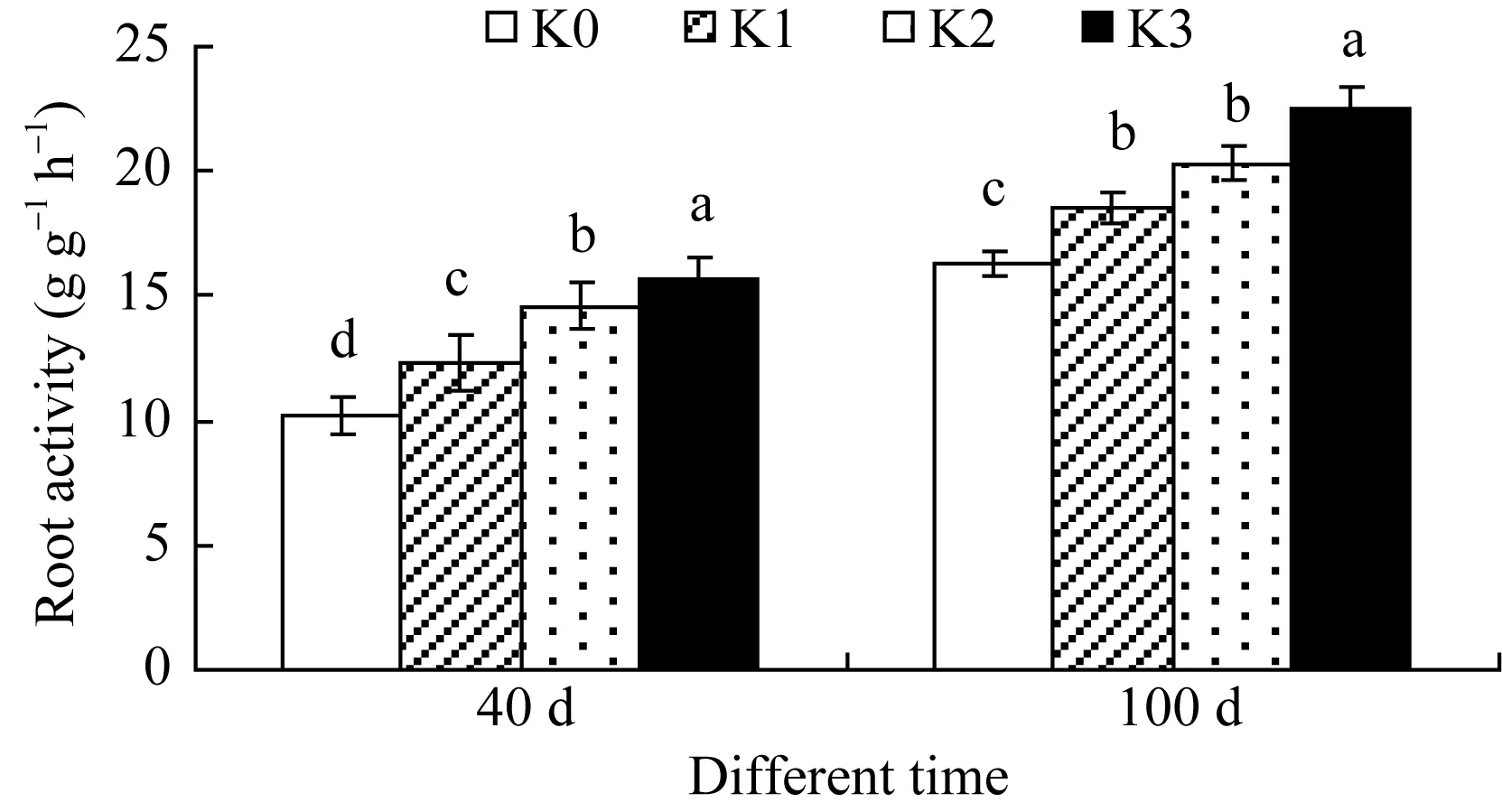
图1 施钾对甘薯根系活力的影响Fig. 1 Effect of potassium application on root activity of sweetpotato
2.4 施钾对甘薯根系径级分布的影响
甘薯根系可依据Noh等[17]分类标准, 将根系分为毛细根、中等跟和块根。表4所示, 生长前期(40 d),与K0相比, 3个施钾处理根鲜重分别提高了16.9%、40.0%和 59.2%。施钾显著促进根系的整体生长(P<0.05)。随施钾量的增加, 毛细根的量分别提高8.9%、19.3%和20.9%, 块根的量分别提高25.3%、64.7%和74.3%。可见, 施钾促进不定根向毛细根和块根的分化。薯块膨大期(100 d), 与K0相比, 3个施钾处理根鲜重分别提高了 21.9%、35.2%和 45.7%,其中块根量分别提高10.3%、23.8%和25.7%。可见,施钾促进了甘薯块根的膨大, 有利于产量的形成。
2.5 施钾对甘薯叶绿素荧光特性的影响
PSII最大光化学效率(Fv/Fm)是反映PSII活性中心的光能转换效率参数, PSII实际光化学效率(ΦPSII)表示电子在PSII和PSI间的传递情况, 光化学淬灭系数(qP)通常用于反映 PSII原初电子受体QA的氧化还原状态和 PSII开放中心的数目, qP越大说明PSII的电子传递活性越大。ETR表示CO2同化时光电子传递速率。2个关键生长期, Fv/Fm、ΦPSII和 qP均表现为K3>K2>K1>K0。与K0处理相比, 生长前期(40 d), K1、K2和K3处理ETR分别提高28.1%、38.1%和 63.6%; 薯块膨大期(100 d), 三施钾处理ETR分别提高12.7%、29.2%和40.0% (表5)。因此,施钾显著提高2个关键生长期光能由PSII向PSI的传递过程, 从而加速CO2的同化。
2.6 施钾对甘薯光合特性的影响
与K0处理相比, 施钾显著提高了甘薯2个关键生长时期净光合速率(Pn) (P<0.05)。生长前期(40 d),3个施钾处理分别提高7.2%、22.1%和26.4%; 薯块膨大期(100 d), 3个施钾处理 Pn分别提高 12.1%、16.9%和20.9%。2个关键生长期, 气孔导度(Gs)、胞间 CO2浓度(Ci)和蒸腾速率(Tr)均表现 K3>K2>K1>K0 (表6)。可见, 施钾通过提高光合特性, 加速光合产物积累, 这为甘薯根系生长提供了物质基础。
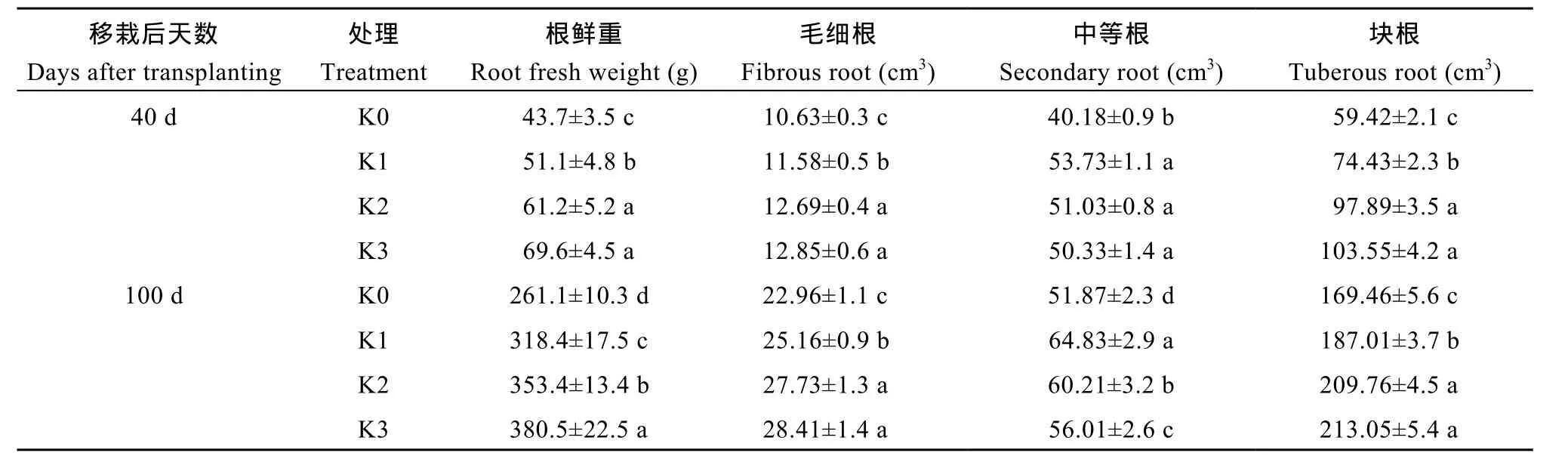
表4 施钾对甘薯根径级分布的影响Table 4 Effect of potassium application on diameter classes root of sweet potato
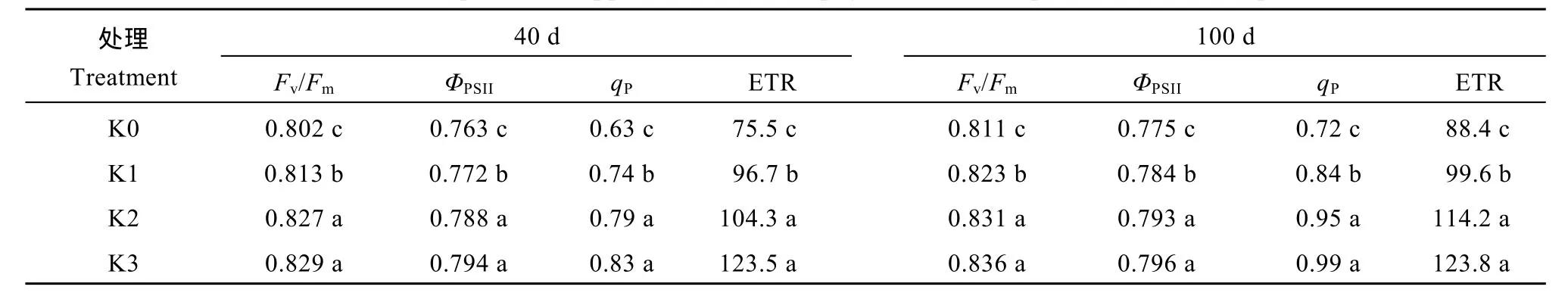
表5 施钾对甘薯叶片叶绿素荧光特性影响Table 5 Effect of potassium application on chlorophyll fluorescence parameters of sweetpotato
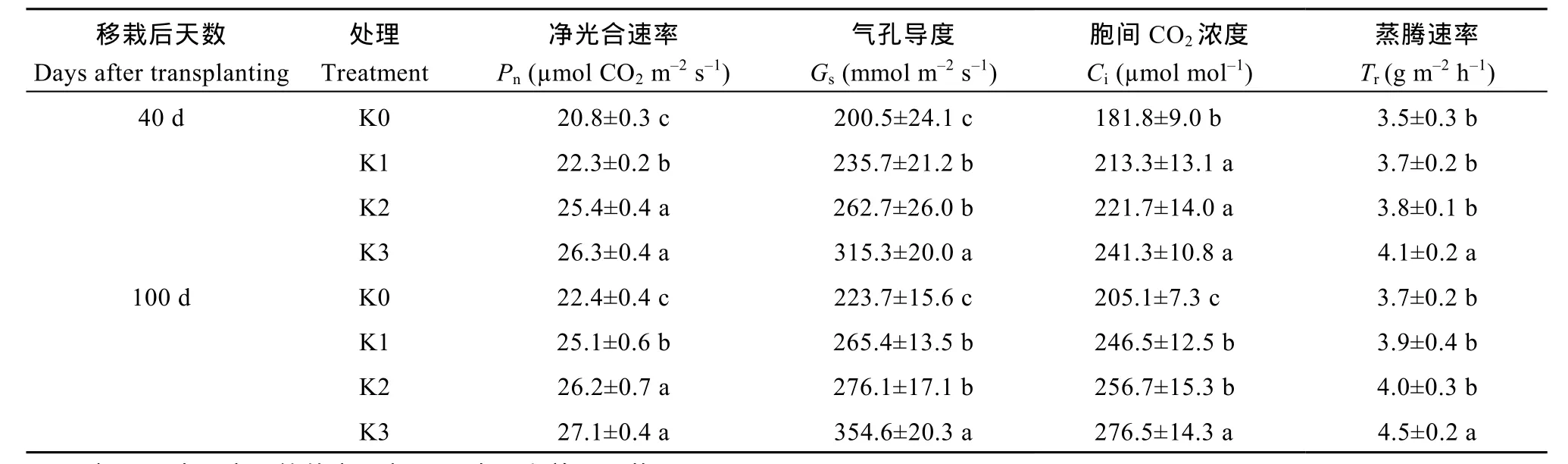
表6 施钾对甘薯叶片光合特性的影响Table 6 Effect of potassium application on photosynthetic of sweet potato
2.7 施钾对甘薯不同器官13C分配量的影响
甘薯不定根的分化是以碳为骨架的光合产物在根系中分配积累的结果。表7所示, 生长前期(40 d),与K0处理相比, 施钾显著提高了13C在叶片和块根中的分配量(P<0.05), 根中13C分配量分别提高10.6%、31.2%和39.5%。可见, 施钾提高了13C在地下部的分配与积累, 为甘薯前期根系向块根分化提供了物质基础。薯块膨大期(100 d), 与K0处理相比,施钾显著提高了13C在块根中的分配量(P<0.05), 增幅分别为31.5%、52.7%和66.2%。由13C分配率来看(数据未列出), 随施钾量的增加,13C地上部分配率降低, 根系中13C分配率升高, 由分配率增幅来看,呈现明显的报酬递减趋势。可见, 施钾可促进此时期光合产物由地上部向地下部转运, 利于薯块的膨大。

表7 施钾量对单株甘薯13C分配量的影响Table 7 Effect of potassium application on13C accumulation amount in sweetpotato plant (µg)
2.8 施钾对甘薯SS、SPS和ADPGase活性的影响
块根中光合产物由蔗糖合酶(SS)、磷酸蔗糖合酶(SPS)和腺苷二磷酸葡萄糖焦磷酸化酶(ADPGase)催化合成淀粉, 淀粉的持续积累促进了块根的膨大。与K0处理相比, 施钾显著提高了甘薯2个关键生长时期SS、SPS和ADPGase活性(P<0.05), 其中,生长前期(40 d), 3个施钾处理 SS活性分别提高17.1%、42.3%和48.0%, SPS活性分别提高11.5%、32.7%和 39.4%, ADPGase活性分别提高 21.5%、30.7%和36.1%; 薯块膨大期(100 d), SS活性分别提高10.4%、33.3%和39.6%, SPS活性分别提高9.7%、31.0%和 37.2%, ADPGase活性分别提高 14.8%、28.9%和34.3%。2个生长时期, K2和K3处理酶活性差异均未达显著水平(表8)。施钾通过提高块根中碳代谢酶活性, 加速了块根中碳的同化。
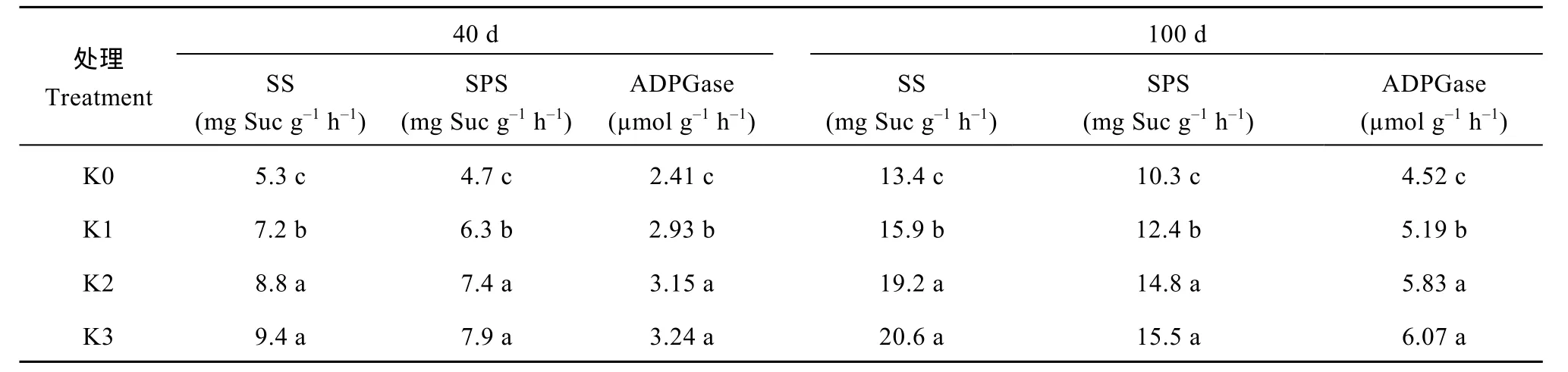
表8 施钾对甘薯块根SS、SPS和ADPGase活性的影响Table 8 Effect of potassium application on SS, SPS, and ADPGase activities of sweet potato
2.9 逐步回归分析、通径分析和偏相关分析
以甘薯根长(X1)、根表面积(X2)、根体积(X3)、根平均直径(X4)、根系活力(X5)、毛细根分化量(X6)、块根分化量(X7)、块根13C积累量(X8)、SS活性(X9)、SPS活性(X10)、ADPGase活性(X11)、Pn(X12)、Fv/Fm(X13)、ΦPSII(X14)、qP(X5)和ETR (X16)为自变量, 甘薯块根产量为因变量(Y)进行逐步回归分析, 其回归方程为Y1= 0.06+1.03X1+1.32X2+0.23X5+1.23X8+0.05 X9+1.93X10+1.93X11+1.93X12+1.93X13–3.45X14+0.24X15+0.01X16(R12= 0.975, P = 0.021), 说明剔除后剩余的指标是影响甘薯块根生长的主要因素。为进一步明确逐步回归确定的指标对块根膨大的调控效应,进行通径分析。结果表明, 对甘薯块根产量总效应最大的是根表面积、块根13C分配量、ADPGase活性、Pn和ETR (表9)。表10所示, 甘薯块根产量与总根长、根表面积、根系活力、SS活性、SPS活性、Pn、ADPGase活性和ETR呈显著的正相关(P<0.05), 与块根13C分配呈极显著正相关(P<0.01)。块根13C分配量与根系活力、SS活性、SPS活性、Fv/Fm和qP呈显著正相关(P<0.05)。SS活性和Pn呈显著正相关(P<0.05)。表明施钾处理通过提高光合特性和糖代谢酶活性, 利于根系形态的构建, 提高2个生长期根系生物量。
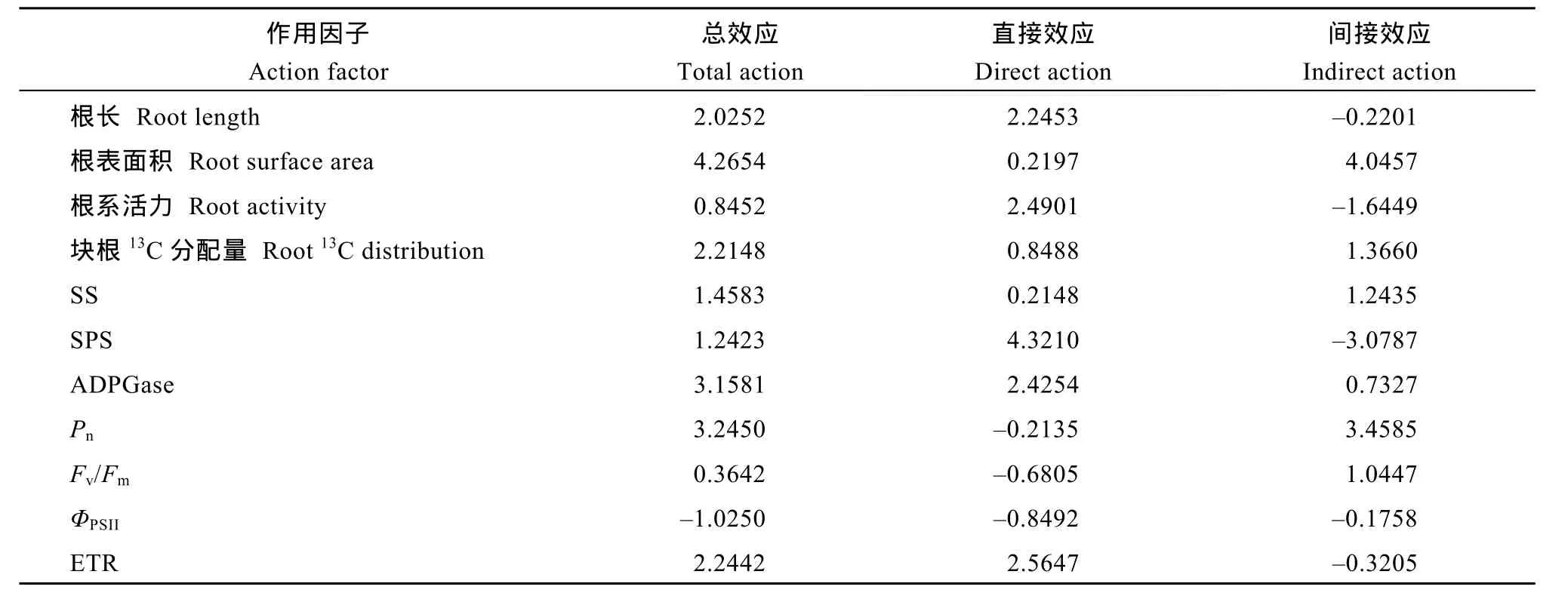
表9 施钾处理下块根产量与生理指标通径系数Table 9 Path coefficient between physiological indicators and root biomass of sweet potato with different K application rates
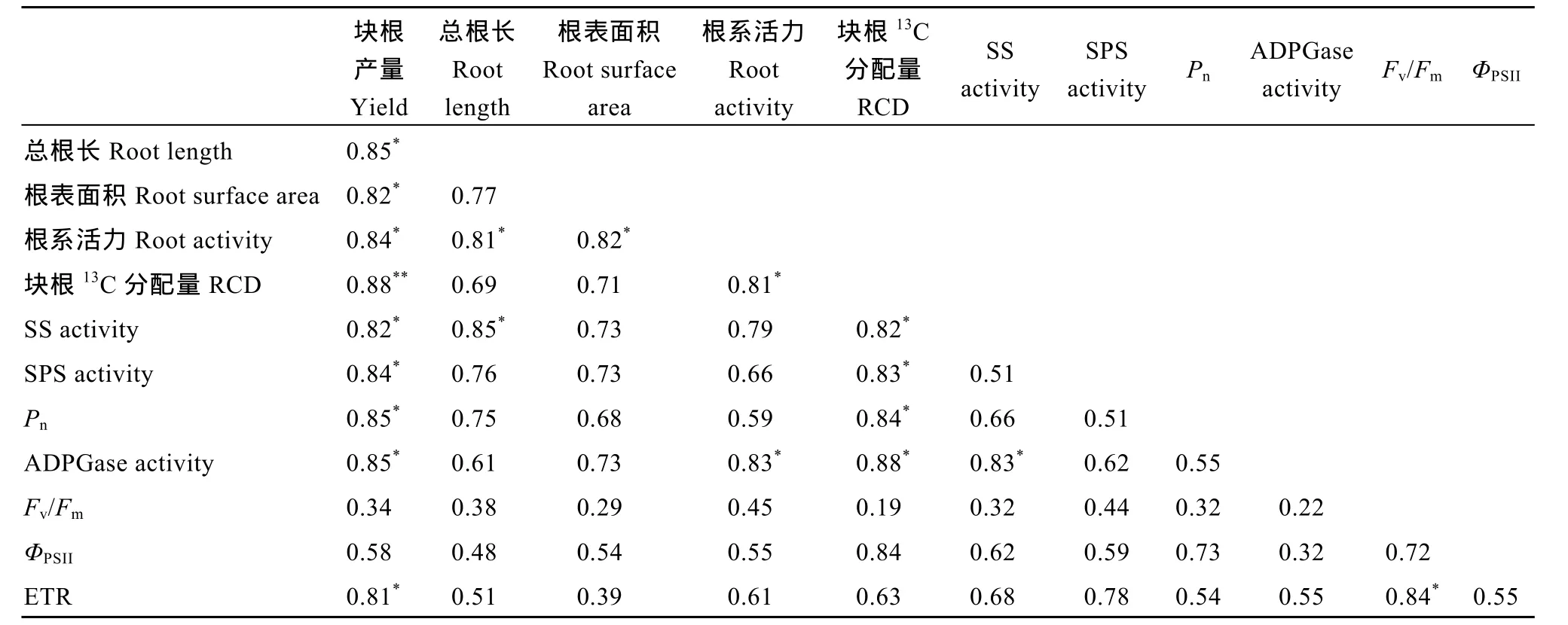
表10 施钾条件下各生理指标与块根量偏相关系数Table 10 Partial correlation coefficients between physiological indices tuberous root
3 讨论
3.1 施钾对甘薯根系生长的影响
甘薯属于营养繁殖的匍匐类块根作物, 根系构建与小麦、玉米等作物不同。甘薯具有较强的发根能力, 生长前期根系分化, 一部分不定根分化为吸收养分和水分的毛细根和徒耗养分的中等跟, 最主要的一部分根系贮存功能异常发达并逐渐向块根发展[1]。因此, 甘薯根系数量多、分布广, 根系构建过程中的主要矛盾不是吸收功能, 而是生长前期的根系分化和生长中后期的块根膨大[18]。本研究发现,生长前期, 与 K0处理相比, 施钾处理总根长提高13.6%~22.8% (P<0.05), 根平均直径提高 11.3%~51.9%, 毛细根的量提高 8.9%~20.9%, 块根的量提高25.3%~74.3%。施钾促进了甘薯前期根系的伸长,提高了须根分化量, 这与在小麦[19]、西瓜[20]等作物上报道一致。同时, 施钾促进了根系的增粗, 不定根早期向块根的分化, 这与宁运旺等[21]报道一致。薯块膨大期, 与 K0处理相比, 施钾处理根体积提高19.7%~41.9%, 块根的量提高10.3%~25.7%, 根系生物量提高25.8%~45.8% (P<0.05)。可见, 施钾有利于甘薯生长中后期块根的持续膨大。
有报道显示, 甘薯根系构建存在 2个明显不同的阶段, 在生长前期, 根系生物量和各项根系形态指标也都随着施钾量的增加呈上升趋势, 施钾处理对分化根根系形态、根冠比无显著的影响, 但能促进薯块膨大期块根膨大, 钾对甘薯生长在前、后存在功能作用不一致现象[12]。齐鹤鹏等[13]认为施钾能显著提高前期根系分化, 提高甘薯个数, 同时提高了单薯质量, 进而实现甘薯增产。本研究发现, 根系分化及构建主要是光合产物积累分配的结果, 施钾条件下13C分配在2个关键生长期存在差异, 生长前期13C主要分配于地上部(叶片和茎蔓), 薯块膨大期13C主要分配于块根, 这种甘薯自身的生理特性掩蔽了生长前期钾对根系总生物量积累的促进作用, 能显著提高侧根分化量, 促进了根系前期分化。
3.2 施钾促进甘薯根系生长的生理机制
甘薯幼根主要功能是吸收土壤中水分和矿质营养, 其吸收能力一方面由根系形态决定, 另一方面取决于根系活力[22]。本研究发现, 施钾显著提高了甘薯根长、根表面积与根系活力(P<0.05)。幼根吸收能力的增强为幼根向块根分化建成奠定了良好的基础[1]。
甘薯根系的生长实质上是基于地上部合成的光合产物向地下部转运并不断积累的过程。本研究发现, 与对照相比, 施钾显著提高了2个关键生长时期Fv/Fm、qP和ETR, 这表明施钾增加了源于光合磷酸化和电子传递过程相偶联所生成的ATP和NADPH的量[23], 同时施钾能够使叶片较大部分反应中心保持开放状态[24], 促进H2O光解产生的电子传递[25-26],提高能量PSII向PSI分配量从而加速碳同化[27], 净光合速率提高7.2%~26.4%, 这提高了光合产物在源叶中的制造量[28]。充足的光合产物为甘薯根系的生长提供了物质基础。而源库器官间的浓度梯度是光合产物由叶片向根系的运输驱动力[29], 叶片较高的光合产物促进了浓度梯度的形成并利于光合产物的向下运输[30], 显著提高了2个关键生长期13C在根系中的分配量(P<0.05)。施钾促进光合产物在块根中的分配与积累是促进甘薯根系生长和块根膨大的生理原因之一。
块根的膨大是淀粉持续积累的结果[31]。块根中SS、SPS和ADPGase是调控淀粉合成的限速酶。本试验发现, 与对照相比, 施钾处理块根中 SS、SPS活性提高11.5%~48.0%, ADPGase活性提高14.8%~34.3%。因此, 本研究认为施钾通过提高碳代谢酶活有利于光合产物在块根中的同化, 触发了淀粉在块根中的积聚, 这可能是施钾进而促进了块根的膨大的酶学机制。甘薯块根膨大的生物学机制, 应结合解剖结构进一步探究。
3.3 施钾对2个关键生长期甘薯块根分化的影响及与产量的关系
甘薯移栽后20~30 d很快在茎基部长出4~10对相邻的不定根, 之后不定根分化增粗并逐渐膨大成为膨大根, 因此在生长前期甘薯的“库”经历了从无到有的过程, 且甘薯茎叶封垄期单株有效薯数基本趋于稳定[32]; 其后, 地上部光合产物在块根中积累并促进其膨大, 这是制约甘薯产量的 2个关键过程[33]。田间试验发现, 甘薯产量的增加是基于单株薯块数和平均薯重的同时提高。施钾促进甘薯生长前期块根分化建成, 形成多的有效薯数。同时, 施钾促进了薯块膨大期光合产物在根系的分配与积累, 提高单株薯块重。这是施钾利于甘薯产量提高的生理基础。
4 结论
施钾有利于光合产物在根系的分配与积累, 促进甘薯生长前期不定根向须根和块根分化, 利于有效薯块的早期形成。同时, 施钾提高根系吸收能力、块根光合产物分配与积累量、碳代谢酶活性进而促进甘薯后期薯块膨大。施钾提高单株结薯数和平均薯重进而显著提高甘薯产量。
[1] 王翠娟, 史春余, 王振振, 柴沙沙, 柳洪鹃, 史衍玺. 覆膜栽培对甘薯幼根生长发育、块根形成及产量的影响. 作物学报, 2014, 40: 1677–1685
Wang C J, Shi C Y, Wang Z Z, Chai S S, Liu H J, Shi Y X. Effects of plastic film mulching cultivation on young roots growth development, tuber formation and tuber yield of sweet potato. Acta Agron Sin, 2014, 40: 1677–1685 (in Chinese with English abstract)
[2] Pervez H, Ashraf M, Makhdum M I. Influence of potassium nutrition on gas exchange characteristics and water relations in cotton (Gossypium hirsutum L.). Photosynthetica, 2001, 42: 251–255
[3] Lebaudy A, Vavasseur A, Hosy E, Dreyer I, Leonhardt N, Thibaud J B, Very A A, Simonneau T, Sentenac H. Plant adaptation to fluctuating environment and biomass production are strongly dependent on guard cell potassium channels. Proc Natl Acad Sci USA, 2008, 105: 5271–5276
[4] Han Q. Height-related decreases in mesophyll conductance, leaf photosynthesis and compensating adjustments associated with leaf nitrogen concentrations in Pinus densiflora. Tree Physiol, 2011, 31: 976–984
[5] Pettigrew W T. Potassium influences on yield and quality production for maize, wheat, soybean and cotton. Physiol Plant, 2008, 133: 670–681
[6] 宁运旺, 曹炳阁, 朱绿丹, 张永春, 汪吉东, 许仙菊, 张辉, 马洪波. 施钾水平对甘薯干物质积累与分配和钾效率的影响.江苏农业学报, 2012, 28: 320–325
Ning Y W, Cao B G, Zhu L D, Zhang Y C, Wang J D, Xu X J, Zhang H, Ma H B. Effects of potassium application rates on drymatter accumulation, dry matter distribution, and potassium efficiency of sweet potato. Jiangsu Agric Sci, 2012, 28: 320–325 (in Chinese with English abstract)
[7] Hammett L K, Miller C H, Swallow W H, Harden C. Influence of N source, N rate, and K rate on the yield and mineral concentration of sweet potato. J Am Soc Hort Sci, 1984, 109: 294–298
[8] 史春余, 王振林, 赵秉强, 郭风法, 余松烈. 钾营养对甘薯某些生理特性和产量形成的影响. 植物营养与肥料学报, 2002, 8: 81–85
Shi C Y, Wang Z L, Zhao B Q, Guo F F, Yu S L. Effect of potassium nutrition on some physiological characteristics and yield formation of sweet potato. Plant Nutr Fert Sci, 2002, 8: 81–85 (in Chinese with English abstract)
[9] 李韦柳, 熊军, 唐秀桦, 闫海锋, 郑虚, 韦民政, 覃维治, 许娟.施钾量对淀粉型甘薯徐薯26产量形成及钾利用的影响. 热带作物学报, 2015, 36: 1037–1042.
Li W L, Xiong J, Tang X H, Yan H F, Zheng X, Wei M Z, Qin W Z, Xu J. Effects of potassium application rate on yield formation and potassium utilization efficiency of starchy sweet potato variety Xushu 26. Chin J Trop Crops, 2015, 36: 1037–1042 (in Chinese with English abstract)
[10] 王道中, 刘小平, 钟昆林, 郭志彬, 田茂尚. 安徽省砂姜黑土地区甘薯钾肥适宜用量研究. 作物杂志, 2014, (5): 109–112
Wang D Z, Liu X P, Zhong K l, Guo Z B, Tian M S. Study on Optimum potassium rate application on sweet potato in Shajiang black soil in Anhui province. Crops, 2014, (5): 109–112 (in Chinese with English abstract)
[11] Foloni J S S, Corte A J, Corte J R D N, Fabio R E, Carlos S T. Topdressing fertilization with nitrogen and potassium levels in sweet-potato. Semina Ciências Agrárias, 2013, 34: 117–126 (in Portuguese with English abstract)
[12] 宁运旺, 马洪波, 张辉, 许建平, 汪吉东, 许仙菊, 张永春.氮、磷、钾对甘薯生长前期根系形态和植株内源激素含量的影响. 江苏农业学报, 2013, 29: 1326–1332
Ning Y W, Ma H B, Zhang H, Xu J P, Wang J D, Xu X J, Zhang Y C. Effects of nitrogen, phosphorus and potassium on root morphology and endogenous hormone contents of sweet potato at early growing stages. Jiangsu Agric Sci, 2013, 29: 1326–1332 (in Chinese with English abstract)
[13] 齐鹤鹏, 安霞, 刘源, 朱国鹏, 汪吉东, 张永春. 施钾量对甘薯产量及钾素吸收利用的影响. 江苏农业学报, 2016, 32: 84–89
Qi H P, An X, Liu Y, Zhu G P, Wang J D, Zhang Y C. Effects of potassium application rates on yield, potassium uptake and utilization in sweet potato genotypes. Jiangsu Agric Sci, 2016, 32: 84–89 (in Chinese with English abstract)
[14] 鲍士旦. 土壤农化分析. 北京: 中国农业出版社, 2000. pp 12–18
Bao S D. Analysis of Soil Aggregation. Beijing: China Agricultural Press, 2000. pp 12–18 (in Chinese)
[15] Hironaka K, Ishibashi K, Hakamada K. Effect of static loading on sugar contents and activities of invertase, UDP-glucose pyrophosphorylase and sucrose 6-phosphate synthase in potatoes during storage. Potato Res, 2001, 44: 33–39
[16] 李鹏民, 高辉远, Strasser R J. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用. 植物生理与分子生物学学报, 2005, 31: 559–566
Li P M, Gao H Y, Strasser R J. Application of the fast chlorophyll fluorescence induction dynamics analysis in photosynthesis study. J Plant Physiol Mol Biol, 2005, 31: 559–566 (in Chinese with English abstract)
[17] Noh S A, Lee H S, Kim Y S, Paek K H, Shin J S, Bae J M. Down-regulation of the IbEXP1 gene enhanced storage root development in sweet potato. J Exp Bot, 2013, 64: 129–142
[18] 江苏省农业科学院和山东省农业科学院. 中国甘薯栽培学.上海: 上海科学技术出版社, 1984. pp 41–45
Jiangsu Academy of Agricultural Sciences and Shandong Academy of Agricultural Sciences. Sweet Potato Cultivation, Shanghai: Scientific and Technical Publisher, 1984. pp 41–45 (in Chinese)
[19] 邹春琴, 李振声, 李继云. 小麦对钾高效吸收的根系形态学和生理学特征. 植物营养与肥料学报, 2001, 7: 36–43
Zou C Q, Li Z S, Li J Y. Study on difference in morpholofical and physiological characters of wheat varieties to potassium. Plant Nutr Fert Sci, 2001, 7: 36–43 (in Chinese with English abstract)
[20] 潘艳花, 马忠明, 吕晓东, 杜少平, 薛亮. 不同供钾水平对西瓜幼苗生长和根系形态的影响. 中国生态农业学报, 2012, 20: 536–541
Pan Y H, Ma Z M, Lyu X D, Du S P, Xue L. Effects of different potassium nutrition on growth and root morphological traits of watermelon seedling. Chin J Eco-Agric, 2012, 20: 536–541 (in Chinese with English abstract)
[21] 宁运旺, 马洪波, 许仙菊, 汪吉东, 张辉, 许建平, 陈杰, 张永春. 氮磷钾缺乏对甘薯前期生长和养分吸收的影响. 中国农业科学, 2013, 46: 486–495
Ning Y W, Ma H B, Xu X J, Wang J D, Zhang H, Xu J P, Chen J, Zhang Y C. Effects of deficiency of N, P, or K on growth traits and nutrient uptakes of sweet potato at early growing stage. Sci Agric Sin, 2013, 46: 486–495 (in Chinese with English abstract)
[22] 范伟国, 杨洪强. 平邑甜茶根系构型、养分吸收和新梢生长对根域形状的反应. 中国农业科学, 2014, 47: 3907–3913
Fan W G, Yang H Q. Response of root architecture, nutrients uptake and shoot growth of Malus hupehensis seedling to the shape of root zone. Sci Agric Sin, 2014, 47: 3907–3913 (in Chinese with English abstract)
[23] Shcansker G, Srivastava A, Covindjee, Strasser R J. Characterization of the 820-nm transmission signal paralleling the chlorophyll a fluorescence rise (OJIP) in pea leaves. Funct Plant Biol, 2003, 30: 785–796
[24] Yu G S, Liu B, Wang L F, Li M H, Liu Y. Damage to the oxygen-evolving complex by superoxide anion, hydrogen peroxide, and hydroxyl radical in photoinhibition of photosystem II. Photosynth Res, 2006, 90: 67–78
[25] Strasser R J, Srivastava A, Covindjee. Ployphasic chlorophyll a fluorescence transients in plants and cyanobacteria. Photochem Photobiol, 1995, 61: 32–42
[26] 孙骏威, 李素芳, 付贤树, 奚辉; 王腾浩. 低钾对水稻不同叶位叶片光合特性及抗氧化系统的影响. 核农学报, 2006, 21: 404–408
Sun J W, Li S F, Fu X S, Xi H, Wang T H. Effects of low potassium stress on photosynthetic characteristics and antioxidant systems in different position leaves of rice plants. J Nucl Agric Sci,2006, 21: 404–408 (in Chinese with English abstract)
[27] Gilmore A M, Hazlett T L, Debrunner P G. Comparative time-resolved photosystem II chlorophyll a fluorescence analyses reveal distinctive differences between photoinhibitory reaction center damage and xanthophyll cycle-dependent energy dissipation. Photochem Photobiol, 1996, 64: 552–563
[28] 孙骏威, 翁晓燕, 李峤, 邵建林. 缺钾对水稻不同品种光合和能量耗散的影响. 植物营养与肥料学报, 2007, 13: 577–584
Sun J W, Weng X Y, Li Q, Shao J L. Effects of potassium-deficiency on photosynthesis and energy dissipation in different rice cultivars. Plant Nutr Fert Sci, 2007, 13: 577–584 (in Chinese with English abstract)
[29] Lalonde S, Wipf D, Frommer W B. Transport mechanisms for organic forms of carbon and nitrogen between source and sink. Annu Rev Plant Biol, 2004, 55: 341–372
[30] Turgeon R. The role of phloem loading reconsidered. Plant Physiol, 2010, 152: 1817–1123
[31] 陈晓光, 史春余, 李洪民, 张爱君, 史新敏, 唐忠厚, 魏猛. 施钾时期对食用甘薯光合特性和块根淀粉积累的影响. 应用生态学报, 2013, 24: 759–763
Chen X G, Shi C Y, Li H M, Zhang A J, Shi X M, Tang Z H, Wei M. Effects of potassium fertilization period on photosynthetic characteristics and storage root starch accumulation of edible sweet potato. Chin J Appl Ecol, 2013, 24: 759–763 (in Chinese with English abstract)
[32] 王翠娟, 史春余, 刘娜, 刘双荣, 余新地. 结薯数差异显著的甘薯品种生长前期根系特性及根叶糖组分比较. 作物学报, 2016, 42: 131–140
Wang C J, Shi C Y, Liu N, Liu S R, Yu X D. Comparison of root characteristics and sugar components in root and leaf at early growth phase of sweet potato varieties with significant difference in valid storage root number. Acta Agron Sin, 2016, 42: 131–140 (in Chinese with English abstract)
[33] 宁运旺, 马洪波, 张辉, 汪吉东, 许仙菊, 张永春. 甘薯源库关系建立、发展和平衡对氮肥用量的响应. 作物学报, 2015, 41: 432–439
Ning Y W, Ma H B, Zhang H, Wang J D, Xu J X, Zhang Y C. Response of sweet potato in source-sink relationship establishment, expanding, and balance to nitrogen application rates. Acta Agron Sin, 2015, 41: 432–439 (in Chinese with English abstract)
Effect of Potassium Application on Root Grow and Yield of Sweet Potato and Its Physiological Mechanism
WANG Shun-Yi, LI Huan, LIU Qing, and SHI Yan-Xi*
College of Resources and Environmental Science, Qingdao Agricultural University, Qingdao 266109, China
The objective of this study was to investigate the physiological mechanism of potassium application on root growth and yield improvement in sweet potato. Two year field experiment was conducted with three potassium levels (0 kg ha–1, 75 kg ha–1, 150 kg ha–1, and 225 kg ha–1) to study the effects ofpotassium on root growth,13C distribution, metabolic enzyme activity, photosynthetic characteristics and yield of sweet potato. Compared with CK, potassium treatments increased ETR 12.7% to 63.6%, Pnby 7.2% to 26.4%. Potassium application improved photosynthetic characteristics and accelerated the accumulation of photosynthate, providing material basis for root growth. While, potassium application was beneficial to the photosynthate products from shoots to roots, root13C distribution amount increased by 10.6% to 66.2% (P<0.05). Then, potassium application by increasing sucrose synthase, sucrose phosphate synthase and adenosine diphosphate glucose pyrophosphorylase activities to accelerate the assimilation of carbon in roots, to improve the photosyntheate accumulation in roots, and to promote root differentiation and growth in sweet potato. In early growing stage, potassium application increased total root length by 13.6% to 22.8%, the average diameter of root increased by 11.3% to 51.9%, and significantly increased the differentiation from adventitious roots to fibrous roots and tuberous roots (P<0.05), which is beneficial to the early formation of effective tuber, ensureing the effective number of tubers per plant. Potassium treatments increased the root biomass and average tuber weight. Compared with CK, the potassium treatments increased yield by 5.8%, 24.3%, and 44.7% in 2014, and by 7.9%, 13.4%, and 22.8% in 2015.
Sweetpotato; Root grow; Photosynthetic characteristics;13C distribution; C enzyme activities
(
): 2016-12-20; Accepted(接受日期): 2017-04-20; Published online(网络出版日期): 2017-04-27.
10.3724/SP.J.1006.2017.01057
本文由国家现代农业产业技术体系建设专项(CARS-11-B-14)和国家青年科学基金项目(31301854)资助。
This work was supported by the National Modern Agro-industry Technology System (CARS-11-B-14) and the Natural Science Foundation for Young Scientists of China (31301854).
*通讯作者(Corresponding author): 史衍玺, E-mail: yanxiyy@163.com, Tel: 0532-82080820
联系方式: E-mail: 644393504@qq.com
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20170427.0948.006.html
