板蓝根水提物对3T3-L1前脂肪细胞增殖和分化的影响
2017-07-25李吉萍张文友孙婷婷冯薏婷刘墨祥
李吉萍,张文友,孙婷婷,冯薏婷,刘墨祥
(扬州大学医学院 1. 药理学教研室、2. 天然药物研究室,江苏 扬州 225001)
板蓝根水提物对3T3-L1前脂肪细胞增殖和分化的影响
李吉萍1,张文友1,孙婷婷1,冯薏婷1,刘墨祥2
(扬州大学医学院 1. 药理学教研室、2. 天然药物研究室,江苏 扬州 225001)
目的 探讨板蓝根水提物(water extract ofRadixIsatidis,WERI)对3T3-L1前脂肪细胞增殖分化的影响及其作用机制。方法 体外培养3T3-L1前脂肪细胞,MTT法和流式细胞技术检测WERI对细胞增殖的影响;鸡尾酒诱导剂诱导3T3-L1前脂肪细胞,油红O染色和比色分析法观察WERI对前脂肪细胞分化及脂肪积累的影响;采用RT-PCR检测脂肪细胞的过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)及CCAAT/增强子结合蛋白α(CCAAT/enhancer-binding protein α,C/EBPα)mRNA的表达;Western blot法检测PPARγ及C/EBPα蛋白表达。结果 WERI在一定浓度范围内能有效抑制3T3-L1前脂肪细胞增殖,同时细胞周期呈现G0/G1向S期阻滞;与空白组相比,用不同浓度的WERI处理后,3T3-L1前脂肪细胞的分化受到明显抑制,且细胞内脂滴生成量明显减少;PCR及Western blot结果显示,WERI还可以抑制脂肪细胞PPARγ和C/EBPα基因及蛋白的表达。结论 WERI具有抑制3T3-L1前脂肪细胞增殖作用,并可通过下调PPARγ和C/EBPα mRNA及蛋白表达来抑制细胞成脂分化。
板蓝根水提物;3T3-L1前脂肪细胞;增殖;分化;PPARγ;C/EBPα;脂肪积累
脂肪是生物体储能的主要形式,与机体的代谢密切相关。脂肪组织包括了脂肪前体细胞和处于分化各阶段的脂肪细胞,而肥胖的产生是由于脂肪细胞的过度增殖与分化所导致[1]。而逆向肥胖过程[2],如减少前脂肪细胞的分化和增殖,通过减少体内脂肪合成或者加快其分解等便成了一项需要攻克的难题。国内外一直有不少学者致力于研究从植物原料中分离提取的化合物是否有调节血脂代谢及脂肪分化方面的作用[3-5]。板蓝根水提物(water extract ofRadixIsatidis,WERI)是从板蓝根中提取分离获得的活性多糖。WERI在前期研究中已经发现具有减肥、调节血脂及抗氧化作用[6]。本文研究了WERI对体外培养的3T3-L1前脂肪细胞[7]增殖和分化的影响,并从前脂肪细胞分化密切相关的两个因子-过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)和CCAAT/增强子结合蛋白α(CCAAT/enhancer binding protein α,C/EBPα)入手,对其相关机制进行初步探讨,为板蓝根在减肥活性上的开发利用提供依据。
1 材料
1.1 细胞 3T3-L1前脂肪细胞,购自美国模式菌种收集中心(ATCC)。
1.2 药物与试剂 板蓝根水提物,由扬州大学药物研究所中药及天然药物研究室提供,多糖含量80%以上,药材原产地:江苏省连云港市灌南县;1-甲基-3-异丁基黄嘌呤(IBMX)、地塞米松(dexamethasone,Dex)、油红O均购自Sigma公司;胰岛素(insulin)为医用胰岛素注射液,购自万邦制药;新生牛血清、胎牛血清,购自杭州天杭生物有限公司;高糖DMEM培养基,购自Gibco公司;TRNzol,购自TIANGEN公司;兔抗鼠PPARγ及C/EBPα购自美国CST公司;兔抗鼠GAPDH购自Abcam公司;HRP标记的抗兔二抗购自CST公司。
1.3 仪器 倒置显微镜,OLYMPUS,型号CK-41;生物安全柜,Thermo公司;自动酶标分析仪,基因有限公司,型号EL800;CO2培养箱,上海力申科学仪器有限公司,型号HF90;台式低温离心机,Eppendorf,型号5810R;立式压力蒸汽灭菌器,上海申安医疗器械厂,型号LDZX-50KBS;恒温浴槽,成都仪器厂,型号HS-4。
2 方法
2.1 3T3-L1前脂肪细胞的培养 3T3-L1前脂肪细胞用含10%新生牛血清的高糖DMEM培养基,在37 ℃、10% CO2条件下培养。细胞达到70%融合后,用0.05%胰蛋白酶1 ∶5消化传代培养。
2.2 WERI对前脂肪细胞增殖的影响 3T3-L1前脂肪细胞以2×107·L-1细胞密度接种于96孔板中,每孔加入100 μL细胞悬浮液,于37 ℃、10% CO2细胞培养箱中孵育12 h后,更换含有不同浓度WERI(5、10、25、50、100 mg·L-1)的完全培养基,同时设置空白对照组和调零组,每组设12个复孔,终体积200 μL。孵育72 h后,每孔加入20 μL 5 g·L-1MTT溶液,于37℃、10% CO2孵箱中继续孵育,4 h后小心吸净每孔中液体,并加入150 μL DMSO,在振荡器上轻微振荡10 min,将产生的紫色结晶充分溶解,于酶标仪在570 nm处测量吸光度。根据吸光度计算细胞存活率。
2.3 WERI对3T3-L1前脂肪细胞周期的影响 取对数生长期3T3-L1前脂肪细胞,以每孔5×104个细胞接种于24孔板。常规培养24 h后,换用以DMEM高糖培养基配制的含WERI的培养基500 μL,WERI的浓度分别为10、25、50 mg·L-1,同时设空白对照组。每个实验组设4个平行孔,继续孵育48 h。PBS清洗细胞后,用0.25%胰酶消化并收集细胞,再用PBS洗3次,重悬后,加入75%冷乙醇固定15 min,4 ℃保存过夜。上机前,弃乙醇,再用PBS洗细胞2次,PBS重悬,调整细胞密度为109·L-1,每组4个样品。加RNase(40 mg·L-1),于37 ℃水浴处理30 min,加PI(50 mg·L-1),在冰浴中避光染色30 min,上机检测。样品分析测定及保存图片。
2.4 3T3-L1前脂肪细胞的诱导分化 用含10% NBCS的高糖DMEM完全培养基于37 ℃、10% CO2条件下培养3T3-L1前脂肪细胞,当细胞接触抑制,即融合度达到100%后,更换新鲜培养基继续培养48 h,之后移除含NBCS的培养基,向每孔中加入体积相同的含或不含WERI的诱导培养基,并根据每孔体积加入相应体积的IBMX、Dex及insulin原液,继续培养48 h,在d 3时更换含胰岛素配制的各组培养基培养48 h,每48 h更换不含胰岛素配制的各组培养基继续培养。
2.5 油红O染色提取 细胞诱导方法及分组参照“2.4”。诱导d 8,3T3-L1前脂肪细胞分化为成熟的脂肪细胞,此时弃去板内培养基,每孔加入PBS清洗残余培养基。弃去PBS,4%中性甲醛固定45 min,弃去固定液后,用PBS清洗细胞2次,并晾干30 min,加入油红O染料静置60 min后,弃去油红O溶液,用60%异丙醇洗涤细胞2次,以去除多余未结合的染料,再用超纯水清洗3~4次后,吸净残留液体,置于显微镜下观察并拍照。测定总脂质含量时加入异丙醇250 μL溶解油红O,振荡5 min后,吸取150 μL液体在酶标板中,用酶标仪在510 nm波长处测定各组吸光度A。
2.6 检测PPARγ与C/EBPα mRNA的表达 采用半定量PCR法检测(诱导方法及分组参照“2.4”)。引物由上海生工生物工程技术有限公司合成。PPARγ上游引物5′-TTTTCAAGGGTGCCAGTTTC-3′,下游引物5′-AATCCTTGGCCCTCTGAGAT-3′,产物长度198 bp;C/EBPα上游引物5′-ACCCGGCCGCCTTCAACGAC-3′,下游引物5′-GTGGCGGCGGTGGCTGGTAG -3′,产物长度354 bp。β-actin上游引物5′-GTGGGGCGCCCCAGGCACCA-3′,下游引物5′-CTCCTTAATGTCACGCACGATTTC-3′,产物长度540 bp。各组的细胞诱导分化培养至d 8,用TRNzol抽提细胞总RNA,根据逆转录试剂盒说明合成cDNA,PCR仪扩增产物,琼脂糖凝胶电泳鉴定扩增产物,UVP凝胶成像系统进行成像分析。
2.7 检测PPARγ与C/EBPα蛋白表达 取对数生长期的3T3-L1细胞接种于6孔板进行分组诱导(诱导方法及分组参照“2.4”),取d 8细胞,用4 ℃预冷的PBS洗2次,加入细胞裂解液,置于冰上裂解,30 min后吸取细胞于1.5 mL离心管中,离心取上清液。吸取5 μL,用PBS稀释10倍后进行BCA法测定蛋白含量,将剩余样品用裂解液及SDS稀释到统一浓度,于95 ℃变性10 min,冷却并涡旋混匀后,用8%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,转膜,脱脂奶粉封闭2 h后,一抗4℃孵育过夜,洗膜,二抗室温孵育2 h后洗膜,上机测定蛋白表达情况。
3 结果
3.1 WERI对前脂肪细胞增殖的影响 3T3-L1前脂肪细胞分别在含0、5、10、25、50、100 mg·L-1的WERI的培养液中培养72 h。5、100 mg·L-1的WERI对3T3-L1前脂肪细胞的增殖无明显影响,差异无统计学意义(P>0.05);WERI在10~50 mg·L-1浓度范围内能明显抑制3T3-L1前脂肪细胞增殖,差异有统计学意义(P<0.05),但是细胞的存活率仍然保持在90%以上,细胞保持较高活性(Fig 1)。
3.2 WERI对前脂肪细胞周期的影响 本实验使用流式细胞术进行分析,通过PI染色法检测WERI处理3T3-L1前脂肪细胞24 h后,对细胞周期阻滞的影响。如Tab 1所示,不同浓度WERI对前脂肪细胞的周期分布具有明显影响。实验组比较发现,随着WERI浓度的增加,G0/G1期比例呈现逐渐上升的趋势,且各组与对照组相比,明显上升(P<0.01)。S期细胞则随实验组浓度增大而逐渐下降,与对照组细胞差异有显著性(P<0.01)。WERI在细胞生长过程中能使其阻滞在G0/G1,导致细胞不能正常地从G0/G1向S期过渡。
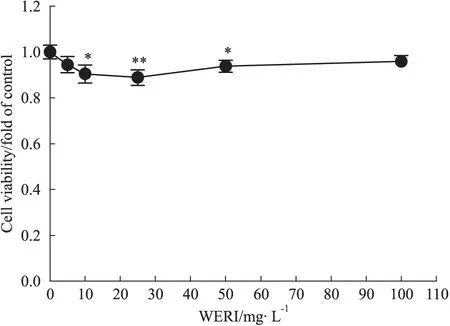
Fig 1 Cytotoxicity of WERI measured by cell viability assays(±s,n=12)
*P<0.05,**P<0.01vscontrol group
Tab 1 Effect of WERI treatment on cell cycle arrest in 3T3-L1 cells(±s,n=3)
**P<0.01vscontrol group
3.3 WERI对前脂肪细胞分化的影响 对照组3T3-L1前脂肪细胞经过诱导分化后,细胞形态已经由原先的成纤维样变为圆形或椭圆形,诱导d 8的细胞经过油红O染色后,光镜下可见对照组90%的细胞由前体脂肪细胞分化为成熟的脂肪细胞,且形成独特的戒环状脂滴,细胞胞体膨大变圆,见Fig 2。随着WERI给药浓度的增加,镜下可见红色脂肪滴逐渐减少,证明了WERI可以抑制脂肪细胞分化。以异丙醇溶解结合于细胞内的油红O,使用酶标仪检测吸光度来测定细胞内脂肪含量,Fig 3结果显示,与对照组比较,WERI各剂量组细胞内的脂肪含量明显降低(P<0.01),且表现出明显的剂量依赖,100 mg·L-1的WERI作用于细胞后,光镜下可以发现细胞分化几乎被完全抑制。
3.4 WERI对成熟脂肪细胞中PPARγ与C/EBPα mRNA表达的影响 Fig 4 RT-PCR结果显示,与对照组相比,WERI各剂量组均能不同程度下调脂肪细胞分化关键调控因子PPARγ与C/EBPα mRNA的表达水平,并且随着WERI剂量增加,表达量逐渐下降,表现出了明显的剂量依赖性,差异具有统计学意义(P<0.01)。

Fig 2 Effect of WERI on differentiation of 3T3-L1 cells
A:Control group;B:WERI 25 mg·L-1group;C:WERI 50 mg·L-1group;D:WERI 100 mg·L-1group
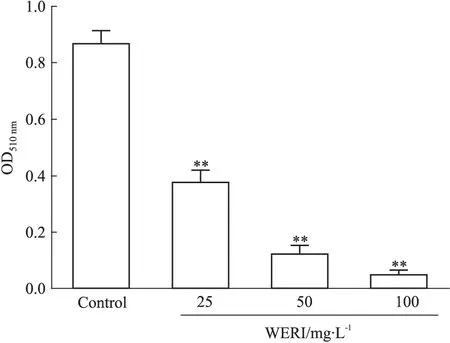
Fig 3 Effect of WERI on lipid accumulation after adipogenic induction of differentiation for 8 days(±s,n=6)
**P<0.01vscontrol group
3.5 WERI对成熟脂肪细胞中PPARγ与C/EBPα蛋白表达的影响 Fig 5 Western blot结果显示,与对照组相比,随着WERI剂量增加,脂肪细胞PPARγ及C/EBPα的蛋白表达量明显下降,且差异具有统计学意义(P<0.01)。
4 讨论
脂肪组织是机体最大的能量储库,在能量代谢和平衡方面发挥着重要的作用。一旦脂肪细胞出现分化失常,包括脂肪细胞的增殖与分化而导致的脂肪组织堆积及脂肪分化相关因子的表达异常,将引起肥胖、动脉粥样硬化等代谢方面疾病的发生和发展[8],并使机体产生一系列炎症反应[9]。因此,研究出一种能对脂肪细胞增殖、分化有抑制效果的药物,对于调节机体脂肪代谢具有重要的意义。

Fig 4 Effect of WERI on expressions of PPARγ and C/EBPα mRNA after adipogenic induction of differentiation for 8 days(±s,n=3)
**P<0.01vscontrol group

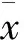
1: Control group; 2: WERI 25 mg·L-1group; 3: WERI 50 mg·L-1group; 4: WERI 100 mg·L-1group.**P<0.01vscontrol group
脂肪细胞的分化是一个高度精细的调控过程,研究发现转录因子过氧化物酶体增殖剂活化受体家族(peroxisome proliferator-activated receptors,PPARs)和CCAAT/增强子结合蛋白家族(CCAAT/enhancer binding proteins,C/EBPs)是脂肪细胞分化的两个最重要的转录调控因子[10]。PPARs受体家族包括PPARα、PPARβ和PPARγ,其中PPARγ与脂肪细胞的分化最为相关,对脂肪细胞的分化成熟和脂肪生成均具有正向调节作用。C/EBPs家族有C/EBPα、β、δ等成员,其中,C/EBPα与PPARγ通过协调作用来影响脂肪细胞的分化[11]。PPARγ可通过促进3T3-L1前脂肪细胞内C/EBPα基因及蛋白表达,而使前体细胞向脂肪细胞转化,同时C/EBPα又能促进PPARγ的高表达,保持分化细胞的表型[12]。
本研究以3T3-L1细胞株为实验模型,观察WERI对3T3-L1前脂肪细胞增殖及分化的影响。增殖实验结果说明,WERI可以阻滞细胞从G0/G1→S期发展,从而抑制3T3-L1前脂肪细胞增殖;油红O结果显示,WERI能够明显抑制脂肪细胞的分化率,降低细胞内脂质积聚,并且分化率随着WERI的给药浓度的增加而降低,表现出了剂量依赖性。PCR及Western blot结果可以看出,与对照组相比,各给药组PPARγ和C/EBPα的基因及蛋白表达量明显下降,且呈现一定的剂量依赖性,提示WERI抑制前脂肪细胞分化的机制可能是通过降低分化途径相关基因及蛋白的表达。
综上所述,WERI能够抑制3T3-L1前脂肪细胞增殖,并可通过降低PPARγ和C/EBPα mRNA及蛋白表达,从而抑制前脂肪细胞向成熟脂肪细胞转化,减少其脂质生成,说明WERI具有调节脂质代谢及治疗肥胖症的潜在药理作用。
(致谢:本实验是在扬州大学动物科学与技术学院实验室完成的,谨向全体课题组实验人员表示衷心感谢。)
[1] Wang Y W,Jones P J.Conjugated linoleic acid and obesity control: efficacy and mechanisms[J].IntJObesRelatMetabDisord, 2004,28(8):941-55.
[2] Frühbeck G.Overview of adipose tissue and its role in obesity and metabolic disorders[J].MethodsMolBiol,2008,456:1-22.
[3] Rashid A M,Lu K,Yip Y M,et al.Averrhoa carambola L.peel extract suppresses adipocyte differentiation in 3T3-L1 cells[J].FoodFunct,2016,7(2):881-92.
[4] 刘庆丰, 刘 毅, 焦 正, 等. 三黄汤对3T3-L1脂肪细胞糖脂代谢的影响[J]. 中国药理学通报, 2016, 32(6):868-73.
[4] Liu Q F,Liu Y,Jiao Z,et al.Effect of Sanhuang Decoction on glucose and lipid metabolism in 3T3-L1 adipocytes[J].ChinPharmacolBull, 2016,32(6):868-73.
[5] Lee M S,Cho S M,Lee M H,et al.Ethanol extract of Pinus koraiensis leaves containing lambertianic acid exerts anti-obesity and hypolipidemic effects by activating adenosine monophosphate-activated protein kinase(AMPK)[J].BMCComplementAlternMed,2016,16:51.
[6] 李吉萍, 江 鸿, 刘墨祥. 板蓝根多糖减肥调血脂与抗氧化作用研究[J]. 医药导报, 2007, 26:58-9.
[6] Li J P,Jiang H,Liu M X.Polysaccharide of radix isatidis for regulating blood lipid and resisting lipid peroxidation[J].HeraldMed,2007,26:58-9.
[7] Green H,Meuth M.An established pre-adipose cell line and its differentiation in culture[J].Cell,1974,3(2):127-33.
[8] Caro J F,Dohm L G,Pories W J,et al.Cellular alterations in liver,skeletal muscle,and adipose tissue responsible for insulin resistance in obesity and type II diabetes[J].DiabetesMetabRev,1989,5(8):665-89.
[9] 杨永玉, 胡长平. 肥胖与脂肪组织重构[J]. 中国药理学通报, 2016, 32(1):9-13.
[9] Yang Y Y,Hu C P.Obesity and adipose tissue remodeling[J].ChinPharmacolBull,2016, 32(1):9-13.
[10]Huang B,Yuan H D,Kim D Y,et al.Cinnamaldehyde prevents adipocyte differentiation and adipogenesis via regulation of peroxisome proliferator-activated receptor-γ(PPARγ) and AMP-activated protein kinase(AMPK) pathways[J].JAgricFoodChem,2011,59(8):3666-73.
[11]Guo L,Li X,Tang Q Q.Transcriptional regulation of adipocyte differentiation:a central role for CCAAT/enhancer-binding protein(C/EBP) β[J].JBiolChem,2015,290(2):755-61.
[12]Rosen E D,Walkey C J,Puigserver P,et al.Transcriptional regulation of adipogenesis[J].GenesDev,2000,14(11):1293-307.
Effects of water extract ofRadixIsatidison proliferation and differentiation of 3T3-L1 preadipocytes
LI Ji-ping1, ZHANG Wen-you1, SUN Ting-ting1, FENG Yi-ting1, LIU Mo-xiang2
(1.DeptofPharmacology,2.InstituteofNaturalDrugResearch,YangzhouUniversity,YangzhouJiangsu225001,China)
Aim To explore the effect of water extract ofRadixIsatidis(WERI) on proliferation and differentiation of 3T3-L1 preadipocytes.Methods 3T3-L1 preadipocytes were cultured to explore the effect of WERI on their proliferation measured by MTT and flow cytometry. Oil red O staining was applied to investigate the effect of different concentrations of WERI on the differentiation of 3T3-L1 preadipocytes. Intracellular fat accumulation was quantified using colorimetry. Semi-quantitative PCR was used to measure the expressions of PPARγ and C/EBPα mRNA. Western blot was applied to detect the expressions of PPARγ and C/EBPα.Results The proliferation of 3T3-L1 preadipocytes was significantly inhibited by treating with a certain range of concentration of WERI, and the cell cycle was also blocked from G0/G1to S. After being treated with different concentrations of WERI, the differentiation of 3T3-L1 preadipocytes was significantly inhibited compared with control group, and the accumulation of lipid droplets within the cells were obviously decreased. It also down-regulated the expressions of PPARγ and C/EBPα both in mRNA and protein.Conclusion WERI can inhibit the proliferation and differentiation of 3T3-L1 preadipocytes and reduce the accumulation of lipid drops, which may be associated with its effects in inhibiting the expressions of PPARγ and C/EBPα both in mRNA and protein.
WERI; 3T3-L1 preadipocytes; proliferation; differentiation; PPARγ; C/EBPα;fat accumulation
2017-03-07,
2017-03-27
江苏省苏北星火带科技攻关项目(No BE2004339)
李吉萍(1960-),女,硕士,副教授,硕士生导师,研究方向:中药药理学,E-mail:jipingli2005@126.com; 刘墨祥(1954-),男,博士,教授,硕士生导师,研究方向:天然药物,通讯作者,E-mail:lmx9378@126.com
时间:2017-7-7 11:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170707.1104.046.html
10.3969/j.issn.1001-1978.2017.08.023
A
1001-1978(2017)08-1159-06
R284.1;R329.24;R392.12;R977.6