养殖密度对流水池塘系统中俄罗斯鲟幼鱼代谢机能的影响
2017-07-24宋志飞温海深李吉方来长青刘传忠
宋志飞,温海深,李吉方,来长青,刘传忠
(1.广西壮族自治区海洋研究所广西海洋生物技术重点实验室,广西北海536000;2.中国海洋大学海水养殖教育部重点实验室,山东青岛266003;3.山东鲟龙渔业科技开发有限公司,山东泗水273211)
养殖密度对流水池塘系统中俄罗斯鲟幼鱼代谢机能的影响
宋志飞1、2,温海深2,李吉方2,来长青3,刘传忠3
(1.广西壮族自治区海洋研究所广西海洋生物技术重点实验室,广西北海536000;2.中国海洋大学海水养殖教育部重点实验室,山东青岛266003;3.山东鲟龙渔业科技开发有限公司,山东泗水273211)
为研究流水养殖系统中不同放养密度对俄罗斯鲟Acipenser gueldenstaedti幼鱼血液激素、生理生化组分的影响机制,选取初始体质量为(29.70±1.32)g的俄罗斯鲟幼鱼,分别按2.5 kg/m3(80 ind./m2) (SD1组)、3.6 kg/m3(115 ind./m2)(SD2组)和4.7 kg/m3(150 ind./m2)(SD3组)3个养殖密度进行流水池塘(4.4 m×4.4 m×0.6 m)养殖,每个密度设3个重复,试验周期为90 d。结果表明:俄罗斯鲟幼鱼养殖50 d后,各密度组试验鱼皮质醇含量迅速升高,至90 d时,SD3密度组皮质醇含量显著高于SD1、SD2密度组;高养殖密度对俄罗斯鲟幼鱼血液生理生化指标均产生一定的抑制作用,血红蛋白含量与养殖密度呈显著正相关(P<0.05);不同养殖密度中俄罗斯鲟幼鱼的白细胞含量有显著性差异(P<0.05),SD3组血液中白细胞数量较SD1、SD2组大幅增多,表明长期高密度养殖对俄罗斯鲟幼鱼免疫机能产生一定影响;各密度组血糖含量均呈现出先上升后下降的趋势,最终SD1组血糖含量显著低于SD2、SD3组(P<0.05);各密度组总胆固醇和总蛋白含量无显著性差异(P>0.05);试验结束时,SD3组血液甘油三酯含量显著高于SD1、SD2组(P<0.05),且SD1和SD2组间无显著性差异(P>0.05)。研究表明:在养殖密度达到12.12 kg/m3时,俄罗斯鲟幼鱼皮质醇含量急剧增加,加速幼鱼糖异生作用,耗能增加,试验鱼生长明显受到抑制;俄罗斯鲟幼鱼能量利用顺序依次为血糖>血清蛋白>血脂。
俄罗斯鲟;养殖密度;激素;血液生理生化
在流水条件下的工厂化水产养殖实践中,提高水产动物的养殖密度可提高单位水体利用效率,但高养殖密度也容易引起种内对空间和饵料的竞争加剧,造成拥挤胁迫[1],导致鱼类和环境间的平衡和协调被打破,使得鱼体内正常生理状态紊乱、生长发育缓慢[2]、繁殖能力下降、免疫机能低下[3],以及发病率和死亡率提高等[4]。目前,国内外已有研究表明,鱼体在遭受拥挤胁迫后会产生一系列的生理适应性代谢反应,进而会引起血液中激素和生理生化成分的变化。如在高密度拥挤胁迫下遭受急性拥挤胁迫后的鲤Cyprinus carpio[5]、草鱼Ctenopharyngodon idellus[6],其血浆皮质醇水平会在短时间内显著升高。同样,塞内加尔鳎Solea senegalensis[7]、鲫Carassius auratus[8]、大西洋鲑Salmo salar[9]、罗非鱼Oreochromis niloticus[10]等在慢性拥挤胁迫下,其血浆皮质醇浓度也会显著增加。张延军等[11]研究发现,高密度养殖会引起金鱼Carassius auratus血球比容降低,使其红细胞形态发生改变。褐牙鲆Paralichthys olivaceus幼鱼在高养殖密度条件下会增加红细胞的数目和血红蛋白含量,以满足机体对氧的需求[12],草鱼Ctenopharyngodon idellus血液中白细胞数目随养殖密度的增加有升高的趋势[6],而银大马哈鱼Oncorhynchus keta白血球含量与养殖密度呈显著负相关关系[13]。这一系列的生理反应均需要机体能量的支持,必然会引起鱼体血液中储能物质葡萄糖、蛋白质和脂肪的含量变化[14-15]。因此,通过探索鱼类抵御拥挤胁迫的生理反应机制,能够为具体的工厂化生产实践提供理论指导,使养殖水体得到更加合理有效地使用,以较少的生产成本获得较高的养殖效益。
鲟是现存最古老的重要水产经济品种,被冠以“水中活化石”的美誉[16]。俄罗斯鲟Acipenser gueldenstaedti在20世纪90年代由俄罗斯引入中国[17],因其易于驯养、生长快、抗逆性强[18],且肉质细腻[19],鱼卵可用于生产鱼子酱,经济价值和观赏价值俱佳[20],俄罗斯鲟迅速成为人们争相养殖的对象。故探寻俄罗斯鲟不同的工厂化和集约化养殖模式,同时降低生产实践中水质败坏、种内竞争、病害等诸多问题发生的可能性已成为研究俄罗斯鲟养殖的核心和重心。曹阳等[21]研究表明,循环水养殖模式下高养殖密度会抑制小规格俄罗斯鲟(4.4 g±1.5 g)生长,并对其生理和免疫指标产生不良影响。也有学者发现,在流水养殖模式中高养殖密度亦会降低俄罗斯鲟幼鱼的生长速度[22],但对于俄罗斯鲟幼鱼遭受拥挤胁迫后的生理反应机制仍需进一步探索。目前,国内流水养殖条件下养殖密度对俄罗斯鲟幼鱼生理生化指标的影响尚未见报道。本研究中,探讨了流水养殖过程中不同放养密度对俄罗斯鲟幼鱼激素及血液生理生化组分的影响,旨在进一步研究俄罗斯鲟幼鱼的胁迫应对机制,为建立流水养殖俄罗斯鲟模式的规范化技术标准提供理论依据和数据参考。
1 材料与方法
1.1 材料
试验鱼由同一批俄罗斯鲟受精卵孵化,初始体质量为(29.70±1.32)g,体长为(17.06±0.56) cm。试验饲料为人工配合饲料。
1.2 方法
1.2.1 试验设计与日常管理 试验在山东省泗水县进行,养殖池为室外正方形水泥池(4.4 m×4.4 m×0.6 m),共9个,试验期间控制水深在0.45 m左右,每个水泥池均有一个专用进水口和中央排污口。试验采用流水养殖模式,进水口水流速控制在4.0 m3/h,水源来自于地下水,在曝气池曝气24 h后使用。整个试验期间,水泥池中溶解氧≥7 mg/L,水温为17℃,pH为7.14~8.14,氨氮含量≤0.05 mg/L。俄罗斯鲟幼鱼在水泥池暂养3 d后开始试验。试验设3个养殖密度组:SD1组(低密度组)、SD2组(中密度组)、SD3组(高密度组),每个密度组设3个重复,初始放养量分别为700、1000、1300尾,初始养殖密度分别为2.5、3.6、4.7 kg/m3,试验周期为90 d。整个试验期间,日投饵量为鱼体质量的2%,分3次投喂:8:00、 16:00和21:00,根据天气和摄食情况调整投饵量。每天监测水质指标(水温、溶解氧、pH)。每10 d对试验鱼进行抽样监测1次,每次从各池随机选取80尾鱼称量其湿质量,重复测定3次,并以此估算俄罗斯鲟幼鱼体质量,适时调整投饵量。
1.2.2 样品采集 试验期间,每10 d采样1次,采样前12 h停止投饵,每次从各池随机取5尾鱼,用MS-222(100 mg/L)快速麻醉,以避免人为刺激造成皮质醇浓度升高。尾静脉采血,一部分血样加入0.5 mL EDTA-2K作为抗凝剂,另一部分血样在4℃下静置6 h后,以3000 r/min离心10 min,吸取上清液置于冰箱(-80℃)中保存备用。1.2.3 指标的分析测定 采用γ放射免疫测定(RIA)的方法(125I标记)测定激素。试剂购自天津九鼎医学生物工程有限公司,并对试验方法进行改进。
采用BC-1800全自动血液细胞分析仪(深圳迈瑞生物医疗电子股份有限公司)测定血液生理指标,利用电阻抗法测定红细胞白细胞数量,以比色法测定血红蛋白浓度。
采用BS-180全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司)测定血液生化指标,分别采用双缩尿法、溴甲酚绿法测定总蛋白(TP)、白蛋白(ALB)含量,采用氧化酶法测定甘油三酯(TG)和总胆固醇(TC)含量。
1.3 数据处理
试验数据用SPSS 19.0软件进行统计处理,用Duncan法进行多重比较(ANOVA),试验结果用平均值±标准误(mean±S.E.)表示,显著性水平设为0.05。
2 结果与分析
2.1 不同养殖密度下俄罗斯鲟幼鱼血浆皮质醇含量的变化
从图1可见:各密度组俄罗斯鲟幼鱼血浆皮质醇初始时含量均较低,且各组间无显著性差异(P>0.05);自50 d后,各密度组皮质醇含量迅速升高,至试验结束时,SD3密度组皮质醇含量显著高于SD1、SD2密度组(P<0.05)。
2.2 不同养殖密度下俄罗斯鲟幼鱼血液生理指标的变化
各密度组俄罗斯鲟幼鱼血细胞数量在试验前后产生显著性变化。从表1可见:试验结束时,各密度组俄罗斯鲟幼鱼血液中红细胞数量均有不同幅度的下降,高密度SD3组下降尤为明显,且与SD1、SD2组有显著性差异(P<0.05);而SD1、SD2组俄罗斯鲟幼鱼血液中白细胞数量略有下降,且两组间并无显著性差异(P>0.05),但SD3组白细胞数量却大幅增多,且与SD1组有显著性差异(P<0.05);各密度组幼鱼血红蛋白含量均呈现上升趋势,其中以SD3组尤为明显,且与SD1组有显著性差异(P<0.05)。
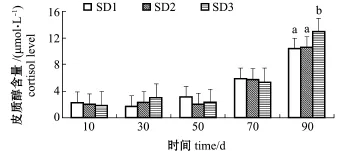
图1 不同养殖密度下俄罗斯鲟幼鱼皮质醇含量的变化Fig.1 Cortisol concentration of juvenile Russian sturgeon Acipenser gueldenstaedti at different stocking densities
2.3 不同养殖密度下俄罗斯鲟幼鱼血液生化指标的变化
从图2可见:各密度组幼鱼血糖含量随时间的延长均呈现出先下降后上升再下降的趋势,试验结束时,SD1组幼鱼血糖含量显著低于SD2、SD3组(P<0.05);3个不同密度组幼鱼血液中总胆固醇和总蛋白含量随时间的延长均呈先上升后下降的趋势,但各组间均无显著性差异(P>0.05);3个密度组幼鱼血液中甘油三酯和总蛋白含量变化趋势基本一致,试验结束时,SD3组幼鱼血液中甘油三酯含量显著高于SD1、SD2组(P<0.05),且SD1和SD2组间无显著性差异(P>0.05)。
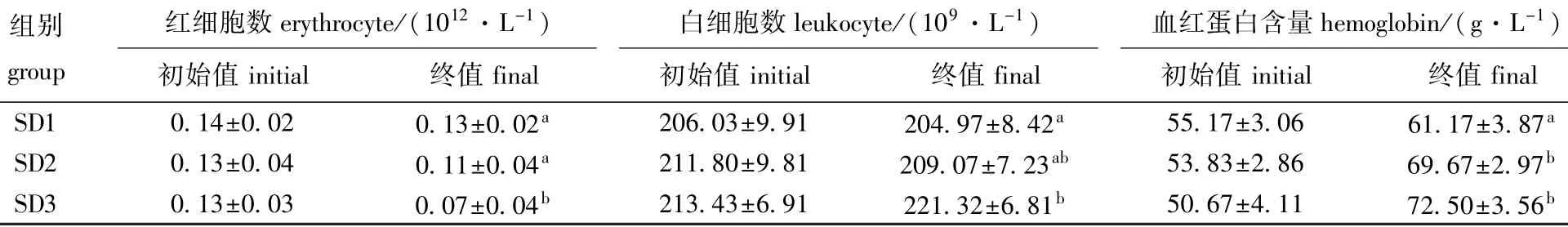
表1 不同养殖密度下俄罗斯鲟幼鱼的血液生理指标Tab.1 Hematological indices of juvenile Russian sturgeon Acipenser gueldenstaedti cultured at different densities
3 讨论
3.1 养殖密度对俄罗斯鲟血浆皮质醇含量的影响
鱼类是较为低等的水生脊椎动物,对外界环境变化的感知比较敏锐。学界普遍认为,鱼类对外界环境因子变化的适应性过程具有阶段性[23],在遭受外界环境胁迫后率先会引起其神经内分泌活动的变化[24]。下丘脑-垂体-肾间组织轴(HPI轴)是鱼类胁迫反应的关键,在遭受胁迫后,鱼体HPI轴会发生一系列的级联反应,最后由肾间组织合成皮质醇并释放到血液中去[25]。因此,血液中皮质醇含量常被作为鱼类是否发生胁迫反应的信号。在本研究中,初始各密度组俄罗斯鲟幼鱼皮质醇浓度均较低且无显著性差异,表明初始养殖密度较低,其生长生存空间足够,并未对鱼体产生拥挤胁迫。但随着试验进行至90 d时,各组幼鱼皮质醇浓度均急速升高,且SD3组皮质醇浓度显著高于SD1、SD2组。据报道,长期高密度养殖条件下,海鲷Sparus aurata[26]、赤鲷Pagrus pagrus[27]、大鳞大麻哈鱼Oncorhynchus tshawytscha[7]等皮质醇水平也显著升高,这表明长期的拥挤胁迫会对鱼体的内分泌活动产生影响,刺激HPI轴释放激素,血液中皮质醇浓度的升高加速了糖类的合成和脂肪的降解以产生更多的能量来抵御胁迫,这也就抑制了鱼体的生长。张磊等[28]的研究也发现,鲤Cyprinus carpio遭受长期拥挤胁迫后会使其处于不良的生存状态,高养殖密度组皮质醇浓度上升幅度显著高于低密度组,但Sammouth等[29]对欧洲鲈Dicentrarchus labrax的研究中发现,不同放养密度下的欧鲈血浆皮质醇水平并无显著性差异,推测这是由于种间特异性造成的。另外,Fevolden等[30]的研究表明,虹鳟Oncorhynchus mykiss在遭受外界环境胁迫后会迅速分泌大量皮质醇来维持内环境的稳定,然而长期的这种反应又会对鱼体的免疫系统产生不良影响。由此可见,大部分鱼类是通过短期内皮质醇浓度的迅速升高来抵御外界不良因子的胁迫。

图2 不同养殖密度下俄罗斯鲟幼鱼葡萄糖、总胆固醇、总蛋白、甘油酸酯含量的变化Fig.2 Variation in Glu,TC,TP,and TG contents in juvenile Russian sturgeon Acipenser gueldenstaedti at different stocking densities
3.2 养殖密度对俄罗斯鲟血液生理指标的影响
鱼类对环境胁迫的适应性应激反应具有3个不同层次的反应阶段[31],在反应初期,各种神经内分泌活动及生理行为不易察觉,而鱼体血液中红细胞、白细胞数量和血红蛋白含量的变化极易被检测,且能明显地反映出鱼体内部的生理变化。在试验初期,由于放养密度较小,作为环境胁迫因子的作用并不明显,各组俄罗斯鲟幼鱼生长状态良好,血红蛋白、红细胞数量增加。但当密度达到一定程度后,对鱼体的压力增大,使得鱼体活动能力减弱,到试验末期红细胞数量和血红蛋白含量均迅速下降。程佳佳等[32]对杂交鲟(西伯利亚鲟Acipenser baeri Brandt♀×施氏鲟Acipenser schrenckii♂)的研究表明,血液血红蛋白含量随养殖密度的增加而升高。而当鲤Cyprinus carpio幼鱼处于不良环境胁迫中,其血红蛋白含量和红细胞数量会随氨氮浓度的升高和胁迫时间的延长呈现出不同程度的降低[33]。与低密度相比,高密度养殖中的俄罗斯鲟幼鱼种间竞争加剧,活动剧烈,促使其产生更多的血红蛋白来满足其对氧的需求。而红细胞数量减少是幼鱼对长期慢性拥挤胁迫的适应性调节。白细胞数量增多表明,长期的高密度胁迫、不良的生存环境,使得俄罗斯鲟幼鱼机体产生不良影响,并引起一系列病理性变化。
3.3 养殖密度对俄罗斯鲟血液生化指标的影响
诸多研究证明,在构成鱼体的有机成分中,主要的供能物质是血液中的葡萄糖,其含量高低直接决定着鱼体营养状况和代谢机制是否良好。当鱼体遭受外界环境胁迫时,血液中葡萄糖含量会迅速升高,这可能是鱼体为抵御不良环境使得新陈代谢水平升高所致,这必然需要更多的葡萄糖来提供能量[34]。所以在试验前期,随着养殖密度的增加,各密度组俄罗斯鲟遭受的拥挤胁迫压力不断加大,导致其代谢活动增强,血糖含量迅速升高,高密度组幼鱼变化尤为明显。逯尚尉等[35]对点带石斑鱼Epinephelus coioiaes幼鱼的研究中也发现,随着放养密度的增加,幼鱼血糖水平升高。长期的拥挤胁迫过多消耗体内血糖,造成鱼体营养状况下降。另外,于淼[36]研究发现,鲤Cyprinus carpio L.在遭受拥挤胁迫后,尽管存在种间差异性,但其血液中葡萄糖浓度皆呈现不同程度的降低,该浓度的降低打破了鱼体原有的内环境平衡,鱼体本身反馈调节机制开始发生作用,通过加强糖异生作用来补充血液中葡萄糖的流失,以维持内环境稳态。薛宝贵等[37]对黄姑鱼Nibea albiflora的研究也表明,在高密度环境胁迫下,鱼体会利用蛋白质和脂肪通过糖异生作用来提供能量,同样各密度组俄罗斯鲟在拥挤胁迫下,发生糖异生作用,使得血糖含量略有上升。因为低密度组所受胁迫程度最轻,所以血糖水平相对较低。血液中的供能物质主要包括葡萄糖、蛋白质和脂肪3大类。因此,当血液中葡萄糖含量较低时,血液中的蛋白质和脂肪也会被消耗,3种供能物质间可通过一系列复杂的生理生化反应完成转变,它们被消耗的顺序也不尽相同,具有生物特异性。任源远[38]对施氏鲟Acipenser schrenckii的研究表明,在遭受慢性拥挤胁迫时首先利用血糖,其次是血脂,最后才是血清蛋白。大杂交鲟(达氏鳇Huso dauricus♀×施氏鲟Acipenser schrenckii♂)在高密度养殖条件下,其血清蛋白和甘油三酯也呈现下降的趋势[39]。本研究中总蛋白和总胆固醇含量随时间呈先上升后降低趋势,而甘油三酯则呈现先下降后上升再下降的趋势。这表明,俄罗斯鲟在遭受环境胁迫时首先利用血糖,当血糖含量不足时,血清蛋白继而转化成血糖被利用,然后甘油三酯被利用,所以甘油三酯自50 d后才开始下降,之后总蛋白、总胆固醇含量也开始下降,血糖含量上升作为一个反馈调节因子,促使总蛋白、总胆固醇和甘油酸酯最终维持在一个相对稳定的程度。
综上所述,较高的养殖密度会对俄罗斯鲟幼鱼产生慢性拥挤胁迫,已有研究表明,较高的养殖密度致使俄罗斯鲟幼鱼特定生长率降低、生长离散加剧,严重制约了幼鱼生长性能[22],但胁迫在生长指标上的体现所需时间较长,具体生产实践中应用效率偏低,而其生理生化指标在遭受胁迫后变动较为灵敏,能够迅速反映出鱼体是否遭受胁迫,这就有利于在实际生产中及时发现并解决问题。本研究中在养殖密度达到12.12 kg/m3时,俄罗斯鲟幼鱼皮质醇含量急剧增加,血糖含量迅速升高,使得鱼体内环境紊乱,鱼体被迫消耗能量来抵御这种胁迫,致使流向生长和繁殖的能量减少。生产过程中如不及时调低较高的养殖密度,既会造成鱼福利水平的下降,也会影响产量。
[1] Procarione L S,Barry T P,Malison J A.Effects of high rearing densities and loading rates on the growth and stress responses of juvenile rainbow trout[J].North American Journal of Aquaculture, 1999,61(2):91-96.
[2] Wafa A H,Pierre D,Daniel B.Modelling growth and food intake rhythms of brook trout Salvelinus fontinalis under the effects of density and ration[J].Ecological Modelling,2004,175(4):385-394.
[3] Tort L,Balasch J C,MacKenzie S.Fish health challenge after stress.Indicators of immunocompetence[J].Contributions to Science,2005,2(4):443-454.
[4] 任源远,温海深,李吉方,等.池塘放养密度对施氏鲟幼鱼生长、摄食和肌肉组分的影响[J].大连海洋大学学报,2014,29 (1):45-50.
[5] Ruane N M,Komen H.Measuring cortisol in the water as an indicator of stress caused by increased loading density in common carp (Cyprinus carpio)[J].Aquaculture,2003,218(1-4):685-693.
[6] 李爱华.拥挤胁迫对草鱼血浆皮质醇、血糖及肝脏中抗坏血酸含量的影响[J].水生生物学报,1997,21(4):384-386.
[7] Salas-Leiton E,Anguis V,Martín-Antonio B,et al.Effects of stocking density and feed ration on growth and gene expression in the Senegalese sole(Solea senegalensis):potential effects on the immune response[J].Fish&Shellfish Immunology,2010,28(2):296-302.
[8] 王文博,汪建国,李爱华,等.拥挤胁迫后鲫鱼血液皮质醇和溶菌酶水平的变化及对病原的敏感性[J].中国水产科学,2004, 11(5):408-412.
[9] Schreck C B.Accumulation and long-term effects of stress in fish [M]//Moberg G P,Mench J A.Biology of Animal Stress.WallQ Aingford:CABI Publishing,2000:147-158.
[10] Welker T L,Lim C,Yildirim-Aksoy M,et al.Growth,immune function,and disease and stress resistance of juvenile Nile tilapia (Oreochromis niloticus)fed graded levels of bovine lactoferrin [J].Aquaculture,2007,262(1):156-162.
[11] 张廷军,杨振才,孙儒泳.鱼类对高密度环境的适应[J].水产科技情报,1998,25(3):110-113.
[12] 董晓煜,张秀梅,张沛东.溶解氧与养殖密度对褐牙鲆幼鱼血细胞数量及血红蛋白含量影响的研究[J].海洋水产研究, 2008,29(6):40-46.
[13] Schreck C B,Patino R,Pring C K,et al.Effects of rearing density on indices of smoltification and performance of coho salmon,Oncorhynchus kisutch[J].Aquaculture,1985,45(1-4):345-358.
[14] 韩宇田,王桂芹.鱼类拥挤胁迫的代谢及调控[J].饲料工业, 2012,33(22):44-45.
[15] Tejpal C S,Pal A K,Sahu N P,et al.Dietary supplementation of L-tryptophan mitigates crowding stress and augments the growth in Cirrhinus mrigala fingerlings[J].Aquaculture,2009,293(3-4):272-277.
[16] 姜礼燔.世界鲟鱼资源及养殖前景[J].中国渔业经济研究, 1998(2):33-35.
[17] 孙大江,曲秋芝,张颖,等.中国的鲟鱼养殖[J].水产学杂志, 2012,24(4):67-70.
[18] 石振广,董双林,王云山,等.我国鲟鱼养殖业现状及问题分析[J].中国渔业经济,2008,26(2):58-62.
[19] 卢迈新,黄樟翰,肖学铮,等.主要养殖鲟鱼的生物学及养殖前景[J].大连水产学院学报,2000,15(4):280-287.
[20] 张墨,李吉方,温海深,等.放养密度对大杂交鲟大规格鱼种血液生理生化指标的影响[J].海洋湖沼通报,2014(2):67-72.
[21] 曹阳,李二超,陈立侨,等.养殖密度对俄罗斯鲟幼鱼的生长、生理和免疫指标的影响[J].水生生物学报,2014,38(5):968-974.
[22] 宋志飞,温海深,李吉方,等.养殖密度对流水养殖系统中俄罗斯鲟幼鱼生长的影响[J].水产学报,2014,38(6):835-842.
[23] Ishioka H.Live Fish Transportation.Series of Fisheries Book [M].Tokyo:Kosesha Kosekaku,1982:52-69.
[24] Barton B A.Physiological changes in fish from stress in aquaculture with emphasis on the response and effects of corticosteroids [J].Annual Review of Fish Diseases,1991,1:3-26.
[25] 张玉蓉,黄庆达,刘书婷,等.不同大小草鱼血液学指标研究[J].重庆师范大学学报:自然科学版,2013,30(1):38-41.
[26] Montero D,Iuierdo M S,Tort L,et al.High stocking density produces crowding stress altering some physiological and biochemical parameters in gilthead seabream,Sparus aurata,juveniles[J]. Fish Physiology and Biochemistry,1999,20(1):53-60.
[27] Rotllant J,Tort L.Cortisol and glucose responses after acute stress by net handling in the sparid red porgy previously subjected to crowding stress[J].Journal of Fish Biology,1997,51(1):21-28.
[28] 张磊,樊启学,赵志刚,等.慢性拥挤胁迫对鲤生长及血液生化指标的影响[J].大连水产学院学报,2007,22(6):465-469.
[29] Sammouth S,Sammouth E R,Gasset E,et al.The effect of density on sea bass(Dicentrarchus labrax)performance in a tank-based recirculating system[J].Aquacultural Engineering,2009,40 (2):72-78.
[30] Fevolden S E,Røed K H,Fjalestad K.A combined salt and confinement stress enhances mortality in rainbow trout(Oncorhynchus mykiss)selected for high stress responsiveness[J].Aquaculture,2003,216(1-4):67-76.
[31] Kumar P,Thirunavukkarasu A R,Subburaj R,et al.Concept of stress and its mitigation in aquaculture[M]//Perumal S, Thirunavukkarasu A R,Pachiappan P.Advances in Marine and Brackishwater Aquaculture.India:Springer,2015:95-100.
[32] 程佳佳,李吉方,温海深,等.养殖密度对杂交鲟幼鱼生长、肌肉组分和血液生理生化指标的影响[J].中国水产科学, 2015,22(3):433-441.
[33] 王琨.氨氮对鲤(Cyprinus carpio Linnaeus)幼鱼部分组织及血液指标的影响[D].哈尔滨:东北农业大学,2007.
[34] 林艳华.鱼类血液学指标的影响因素[J].安徽农业科学, 2011,39(14):8657-8659.
[35] 逯尚尉,刘兆普,余燕.密度胁迫对点带石斑鱼幼鱼生长、代谢的影响[J].中国水产科学,2011,18(2):322-328.
[36] 于淼.拥挤胁迫对鲤生长和生理指标的影响[D].武汉:华中农业大学,2005.
[37] 薛宝贵,楼宝,徐冬冬,等.密度胁迫对黄姑鱼幼鱼生长、代谢及非特异性免疫的影响[J].渔业科学进展,2013,34(2):45-51.
[38] 任源远.养殖密度对施氏鲟大规格鱼种生长性能及血液生理生化组分的影响[D].青岛:中国海洋大学,2014.
[39] 步艳,李吉方,温海深,等.养殖密度对大杂交鲟幼鱼体组分和血液生化指标的影响[J].海洋湖沼通报,2014(3):69-74.
Influence of stocking density on physiological metabolism function of juvenile Russian sturgeon Acipenser gueldenstaedti in running water cultivation
SONG Zhi-fei1,2,WEN Hai-shen2,LI Ji-fang2,LAI Chang-qing3,LIU Chuan-zhong3
(1.The Key Laboratory of Marine Biotechnology of Guangxi,Guangxi Zhuang Autonomous Region Institute of Oceanology,Beihai 536000,China; 2.The Key Laboratory of Mariculture,Ministry of Education,Ocean University of China,Qingdao 266003,China;3.Shandong Xunlong Fishery Science&Technology Development Company Limited,Sishui 273211,China)
Juvenile Russian sturgeon Acipenser gueldenstaedti with initial body weight of 29.70 g±1.32 g were reared in nine square concrete ponds(4.4 m×4.4 m×0.6 m)at stocking density of 2.5 kg/m3(80 ind./m2) (SD1),3.6 kg/m3(115 ind./m2)(SD2),and 4.7 kg/m3(150 ind./m2)(SD3)for 90 days with triplication to investigate the influence of stocking density on hormone,physiological and biochemical components of the juvenile. Cortisol levels were shown to be elevated in the Russian sturgeon reared for 50 d in the experimental groups,significantly higher in the fish reared for 90 d in group SD3 than in SD1 group and SD2 group(P<0.05).The hemoglobin content was found to be significantly and positively correlated with the stocking density(P<0.05).There were significant differences in leukocyte contents at different stocking densities of Russian sturgeon(P<0.05),significantly higher white blood cell count in the juvenile Russian sturgeon in group SD3 than those in group SD1 and group SD2(P<0.05),indicating that the long-term high-density culture of the Russian sturgeon led to physical and pathological damage of the fish by the end of the experiment.The Russian sturgeon juveniles showed a tendency of blood-sugar levels upgrade first then descending,significantly lower in group SD1 than in group SD3 and group SD2(P<0.05).There were no significant differences in levels of total cholesterol and total protein(P>0.05).At the end of the experiment,the juveniles had significantly higher blood triglyceride content in group SD3 than the juveniles in group SD1 did(P<0.05),without significant difference between group SD1 and SD2.The findings indicate that the order of energy utilization in Russian sturgeon was expressed as blood sugar>serum protein>blood lipid.
Acipenser gueldenstaedti;stocking density;hormone;blood physiological and biochemical index
Q786;S917
A
10.16535/j.cnki.dlhyxb.2017.04.003
2095-1388(2017)04-0393-06
2016-10-12
国家公益性行业(农业)科研专项(201003055)
宋志飞(1991—),男,硕士研究生。E-mail:1019782126@qq.com
温海深(1963—),男,教授。E-mail:wenhaishen@ouc.edu.cn
