一株海绵放线菌的分离培养、发酵条件优化及其抑制弧菌效果
2017-07-24杜英侠李晶莹傅敏张鑫曲春强李小艺张菊林顾颖王选骏付晚涛
杜英侠,李晶莹,傅敏,张鑫,曲春强,李小艺,张菊林,顾颖,王选骏,付晚涛、5
(1.大连海洋大学水产与生命学院,辽宁大连116023;2.大连海洋大学海洋科技与环境学院,辽宁大连116023;3.大连市长海县渔政管理所,辽宁大连116500;4.大连市海监渔政局,辽宁大连116001;5.辽宁省高校近岸海洋环境科学与技术重点实验室,辽宁大连116023)
一株海绵放线菌的分离培养、发酵条件优化及其抑制弧菌效果
杜英侠1,李晶莹2,傅敏2,张鑫2,曲春强2,李小艺2,张菊林2,顾颖3,王选骏4,付晚涛2、5
(1.大连海洋大学水产与生命学院,辽宁大连116023;2.大连海洋大学海洋科技与环境学院,辽宁大连116023;3.大连市长海县渔政管理所,辽宁大连116500;4.大连市海监渔政局,辽宁大连116001;5.辽宁省高校近岸海洋环境科学与技术重点实验室,辽宁大连116023)
为研究放线菌对海水养殖病原弧菌(哈维弧菌Vibrio harveyi和灿烂弧菌Vibrio splendidus)的抑制效果,从繁茂膜海绵Hymeniacidon perlevis中分离筛选出了一株具有抑菌活性的放线菌(FH),并采用16S rDNA基因序列进行分析,初步鉴定为球孢链霉菌Streptomyces globisporus;以抑菌活性为导向对放线菌FH菌株的发酵条件进行优化,并通过测量发酵沉淀菌丝体干质量,获得了FH菌株生长曲线,同时研究了发酵产物保存温度及时间对抑菌效果的影响,以及FH发酵产物在灭菌海水中对弧菌的抑制作用。结果表明:对FH菌株生长曲线测定结果显示,0~15 h为适应期,15~72 h为指数生长期,72~120 h为稳定期,120 h后为衰亡期;抑制弧菌效果试验显示,FH菌株发酵正交试验的最优条件为温度25℃、pH 7.5、装液量30 mL(250 mL三角瓶);在正交试验最优条件下,FH菌株发酵培养72 h获得的粗提物抑制哈维弧菌和灿烂弧菌的效果最好;FH菌株发酵粗提物在4℃和-20℃下保存60 d和在室温保存7 d,其抑菌效果无显著性差异(P>0.05);在100 mL灭菌海水中,FH菌株发酵产物2 mL可有效抑制哈维弧菌和灿烂弧菌的繁殖。研究表明,海绵放线菌及其发酵产物在海水养殖领域具有潜在应用价值。
海绵放线菌;弧菌;发酵条件优化
弧菌是海水养殖中最常见的一类条件致病菌,已成为海水养殖动物的主要病原菌之一[1]。哈维弧菌Vibrio harveyi能感染多数海水鱼类和对虾[2-3],如鲈的出血病,引发死亡率高达50%以上,严重时可达80%~100%[4-6]。灿烂弧菌Vibrio splendidus是引起刺参腐皮综合征的主要病原菌之一,死亡率高达90%以上,也是大菱鲆、鲈等海水鱼类的重要致病菌之一[7-8]。目前,控制水产动物疾病的主要手段仍是药物治疗,而大部分渔用药物多是移用兽药、农药,较难满足水产病害防控需求,因此,开发水产专用药物已迫在眉睫[9]。
放线菌是一大类有益次级代谢产物的生产者,具有抗细菌、抗真菌等多种生物活性[10]。海洋放线菌由于所处生态环境的特异性,能够产生不同于陆生微生物的结构新颖的次级代谢产物[11],因此,受到人们的广泛关注。海绵是一种简单古老的多细胞动物,能产生比其他海洋生物更加丰富的生物活性产物,从海洋中分离出的活性化合物约40%来自海绵[12]。同时,海绵也是海洋放线菌最重要的一种共附生动物,其体内的微生物可占海绵总生物量的50%~60%[13-14],是目前新型天然活性化合物的重要来源之一。
近年来,对海洋放线菌在抑菌方面的研究[15]较多。本研究中,从繁茂膜海绵Hymeniacidon perlevis中分离筛选出了若干海绵放线菌,并将其中一株具有抑菌活性的海绵放线菌命名为FH菌株,对FH菌株进行了发酵条件优化、生长曲线测定以及发酵产物对海水养殖病原菌的抑菌试验,为后续研究工作奠定了基础,也为进一步开发海水养殖专用抑菌药物提供理论依据。
1 材料与方法
1.1 材料
1.1.1 海水、培养基 试验用海水取自大连海洋大学沙滤罐过滤海水。沙滤海水在110℃下灭菌15 min制备成灭菌海水。所用试剂无特别标注,均为分析纯试剂。
(1)放线菌分离培养基[16]。包含甘油6 mL、精氨酸1 g、K2HPO4·3H2O 1 g、NaCl 20 g、Mg-SO4·7H2O 0.5 g、琼脂粉18 g、蒸馏水1000 mL, pH 7.4,再加入终浓度为15 mg/L的萘啶酮酸和50 mg/L的重铬酸钾。
(2)国际链霉菌计划培养基2(International Streptomyces Project medium 2,ISP2)液体培养基。包含酵母浸出粉4 g、麦芽提取物10 g、葡萄糖4 g、陈海水1000 mL,pH 7.4。
(3)改良高氏一号琼脂培养基[16]。包含可溶性淀粉20 g、KNO31 g、NaCl 0.5 g、K2HPO40.5 g、MgSO40.5 g、FeSO40.01 g、琼脂18.0 g、蒸馏水1 L,pH 7.2~7.4。
(4)营养琼脂培养基。包含蛋白胨10 g、NaCl 5 g、牛肉膏粉3 g、琼脂18 g、陈海水1000 mL,pH 7.2~7.4。
1.1.2 海绵、指示弧菌 繁茂膜海绵采自大连市黑石礁海域潮间带,0.5 h内带回实验室。指示弧菌——哈维弧菌Vibrio harveyi、灿烂弧菌Vibrio splendidus,均取自大连海洋大学农业部北方海水增养殖重点实验室。
1.2 方法
1.2.1 海绵放线菌的分离培养及形态观察 采集新鲜繁茂膜海绵,用无菌海水冲洗多遍,去除表面附着物,在无菌研钵中研磨成浆,并加入10倍体积的灭菌海水浸泡[16],用无菌纱布过滤,在放线菌分离培养基上平板涂布,于28℃下倒置培养7~10 d。从放线菌分离培养基上挑取海绵放线菌单菌落,在改良高氏一号培养基上划线纯化,纯化后的海绵放线菌菌株用20%甘油作为保护剂,于-80℃下冷冻保存。
将海绵放线菌在改良高氏一号培养基上于28℃下培养7 d,观察菌落的颜色、形态,有无可溶性色素等,菌株形态观察在光学显微镜下进行。
1.2.2 海绵放线菌FH的16S rDNA分子鉴定
(1)将从海绵中分离筛选出的一株FH单菌落接入装有5 mL灭菌ISP2液体培养基的试管中,在恒温振荡培养箱(上海一恒科技有限公司,THZ_ 98AB)中30℃下培养2~3 d。
(2)用1.5 mL Tube管收集1 mL上述培养液,按照MiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0试剂盒(TaKaRa)说明书,提取此株放线菌基因组DNA。
(3)按照TaqTM试剂盒(TaKaRa)说明书,以提取的基因组DNA为模板,根据信艳娟等[17]PCR反应条件,在PCR仪(Applied Biosystems,2720 Thermal Cycler)上扩增此株放线菌的16S rDNA片段。
(4)将16S rDNA扩增产物送至生工生物工程(上海)股份有限公司进行测序。测序结果在NCBI的GenBank数据库中进行Blast比对。
1.2.3 FH菌株的培养与无菌发酵粗提物的制备
(1)菌株活化。将-80℃下保存的FH菌株接种到改良高氏一号琼脂培养基上,于28℃培养箱(上海一恒科技有限公司,LRH-150)中倒置培养5~7 d,然后挑取单菌落在改良高氏一号琼脂培养基上两次划线接种,使菌株恢复健壮状态用于试验。
(2)摇瓶发酵。挑取恢复健壮状态的FH单菌落,接种到装有30 mL灭菌ISP2液体培养基的三角瓶中,在恒温振荡培养箱中以120 r/min培养5 d。
(3)无菌发酵粗提物制备。从摇瓶中取FH菌株发酵液30 mL,在低速离心机(湖南湘仪实验室仪器开发有限公司,L535-1)中,以4000 r/min离心10 min,离心后的上清液用0.22 μm滤膜过滤除菌,然后在旋转蒸发器(上海亚荣生化仪器厂,RE-52CS)中浓缩至原液体积的1/10,制成FH菌株的无菌发酵粗提物(简称发酵粗提物),于4℃下保存备用。
1.2.4 FH菌株发酵培养条件的正交试验 参考放线菌发酵条件优化研究结果[18-22],设计FH菌株发酵条件的正交试验L9(34),试验因素水平见表1。在恒温培养箱中,每个250 mL锥形瓶中装有一定量的菌液,在转速120 r/min条件下培养5 d,制成无菌发酵粗提物。然后,采用琼脂打孔法[23],使用营养琼脂培养基平板进行抑菌试验,分别以哈维弧菌、灿烂弧菌作为指示菌,使用庆大霉素(0.25 mg/L)作为阳性对照,观察在30℃下培养24 h时的抑菌结果。以抑菌圈直径为指标,判断发酵粗提物抑菌活性的大小,考察发酵培养条件对FH菌株发酵粗提物抑菌效果的影响。

表1 发酵培养条件的正交试验因素及水平Tab.1 Factors and levels of fermentation culture conditions in an orthogonal test
1.2.5 发酵时间对FH菌株发酵粗提物抑菌效果的影响 在恒温振荡培养箱中放置装有FH菌液的27个250 mL三角瓶,在正交试验最优条件下培养,分别在15、24、48、72、120、168、216、264、312 h时取出3个三角瓶做平行试验,以4000 r/min离心10 min。取菌丝体沉淀烘干至恒重并称量,以时间为横坐标,菌丝体干质量为纵坐标,绘制FH菌株在该条件下的生长曲线。同时,取上清液制备发酵粗提物并进行抑菌试验。同样采用琼脂打孔法、使用庆大霉素(0.25 mg/L)作为阳性对照,以上述2株弧菌为指示菌,根据抑菌圈直径判断活性大小,考察发酵时间对FH菌株发酵粗提物抑菌效果的影响。
1.2.6 FH菌株发酵粗提物的存放温度和时间对抑菌效果的影响 在最优正交试验和发酵时间条件(称为最佳发酵条件)下,制得FH菌株发酵粗提物并分成3份,分别于室温、4℃、-20℃下保存,分别考察发酵粗提物的存放温度及存放时间(0、7、30、60 d)对指示弧菌抑菌效果的影响。
1.2.7 灭菌海水中FH菌株发酵产物抑制弧菌的效果 在最佳发酵条件下培养FH菌株,发酵液以4000 r/min离心10 min,取上清液通过0.22 μm滤膜过滤除菌,获得FH发酵产物。将哈维弧菌制成菌悬液,接入装有9个100 mL灭菌海水的三角瓶中,监测指示弧菌初始浓度。其中3个三角瓶分别加入2 mL灭菌海水,作为空白对照组;另外3个三角瓶中分别加入1 mL灭菌海水和1 mL发酵产物,作为试验组1;剩余3个三角瓶中分别加入2 mL发酵产物,作为试验组2。将上述9个三角瓶放入恒温培养箱中30℃下培养,分别在0、6、12、24、48 h各取海水1 mL,用灭菌海水10倍体积稀释后,用TCBS琼脂平板涂布,在培养箱中30℃下培养48 h,用菌落计数海水中弧菌密度。对灿烂弧菌的抑菌试验,除了指示弧菌不同之外,其他条件及过程与抑制哈维弧菌试验均相同。
1.3 数据处理
试验数据采用SPSS 20软件进行方差分析,用t检验进行组间多重比较。
2 结果与分析
2.1 FH菌株的形态特征
FH菌株在改良高氏一号培养基上生长良好,气生菌丝发达,菌落呈米色,产生浅咖啡色可溶性色素。在光学显微镜下观察,其孢子丝呈直线、弯曲状、分支多且长(图1)。
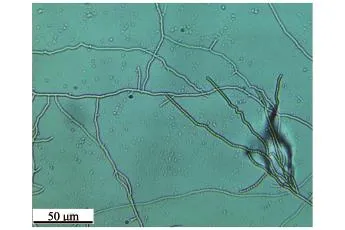
图1 FH菌株在显微镜下的形态(400×)Fig.1 Morphology of the sponge-associated actinobacterium FH under a microscope(400×)
2.2 FH菌株的16S rDNA分子鉴定
结合FH菌株形态特征,通过PCR反应和测序,获得FH菌株16S rDNA部分序列1325 bp,并在GenBank数据库中进行序列比对,发现该序列同链霉菌属的球孢链霉菌相似性达到99.6%,初步鉴定FH菌株为球孢链霉菌Streptomyces globisporus。
2.3 FH菌株发酵培养条件的正交试验
采用ISP2液体培养基,用空列(D)的极差R值作为误差界限,按照正交设计安排发酵培养FH菌株制备获得的发酵粗提物的抑制效果见表2。根据极差R值的大小,采用直观分析法,判断发酵培养条件对FH菌株发酵粗提物抑菌效果的影响强弱均为温度>pH>装液量(表2)。上述3个因素的R值均大于空列R值,因此,各因素的效应可靠[24]。由表2极差分析可得,以对哈维弧菌和灿烂弧菌产生的抑菌圈为考察指标,FH菌株发酵培养条件的最优组合均为A2B1C3,即温度为25℃、pH为7.5、装液量为30 mL。
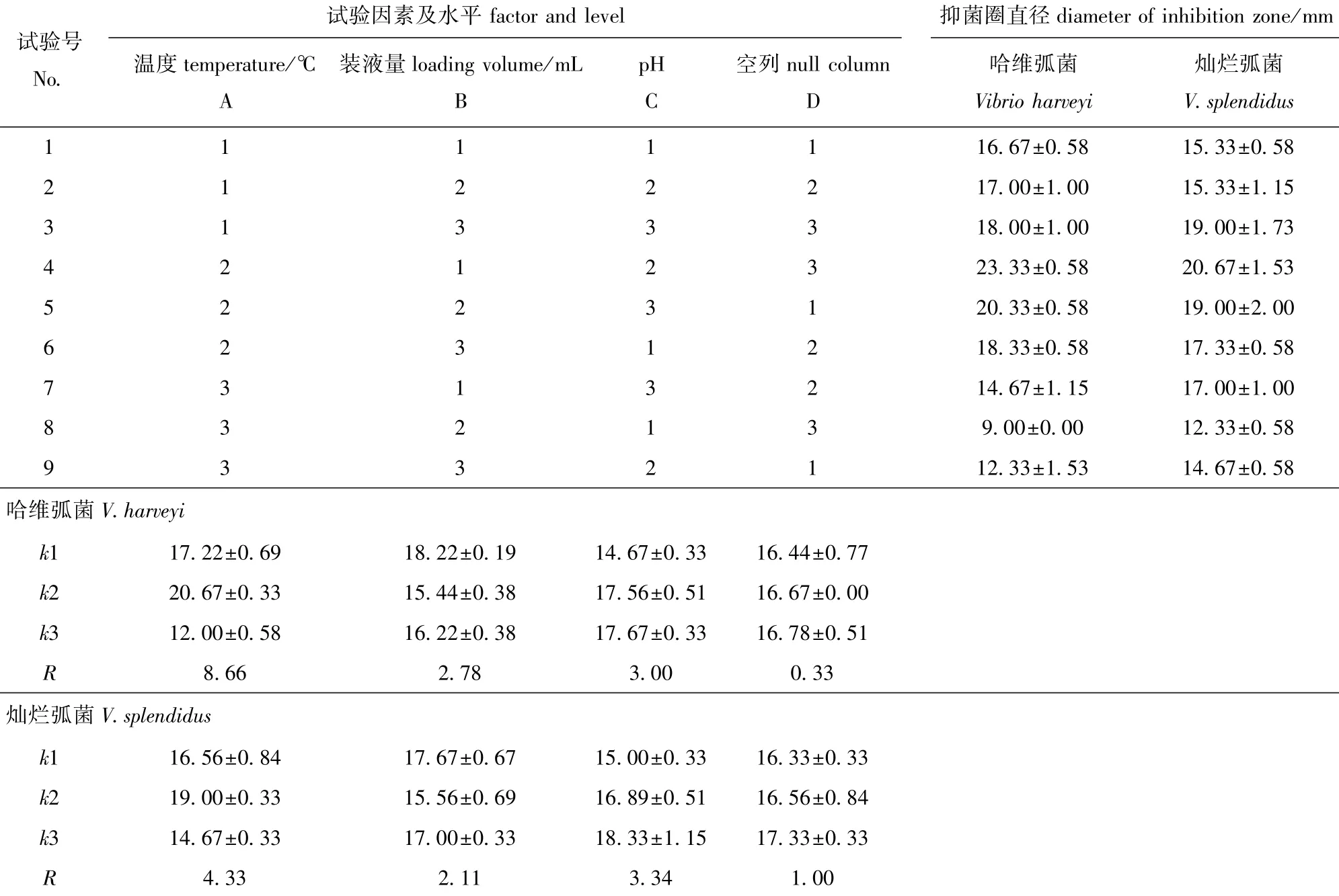
表2 正交试验设计及试验结果Tab.2 Design and results in the orthogonal test
2.4 发酵时间对FH菌株发酵粗提物抑菌效果的影响
2.4.1 FH菌株生长曲线 由图2可见:在正交试验最优条件下(温度25℃、pH 7.5、装液量30 mL),接种到ISP2培养液后,FH菌株呈典型指数生长特征,并且适应期很短,指数生长阶段从15 h持续至72 h,对应的FH菌株的菌丝干质量从(0.018±0.002)g增加至(0.104±0.005)g,此阶段的比生长速率为0.085/h;72 h~120 h时,FH菌株进入稳定期,120 h之后FH菌株进入衰亡期。2.4.2 发酵时间对FH菌株发酵粗提物抑菌效果的影响 由图3可见:在正交试验最优条件下(温度25℃、pH 7.5、装液量30 mL),72~168 h,时FH发酵粗提物对哈维弧菌显现出较好的抑菌效果,此时间段试验组平均抑菌圈直径为(24.56±0.51)mm,比阳性对照组大8.23 mm;72 h时,FH发酵粗提物抑制哈维弧菌效果最好,其最大抑菌圈直径为25.00 mm。

图2 FH菌株的生长曲线Fig.2 Growth curve of sponge-associated actinobacterium FH

图3 无菌发酵粗提物对哈维弧菌的抑菌效果Fig.3 Antibacterial effect of sterile crude extracts from fermented liquid on Vibrio harveyi
由图4可见:FH菌株发酵粗提物在15~72 h时,对灿烂弧菌呈现一定的抑菌效果;在72 h时,FH发酵粗提物对灿烂弧菌的抑制效果最好,其抑菌圈直径最大,为(24.67±1.53)mm,比此时阳性对照组大5.67 mm。尽管FH菌株无菌发酵粗提物对2株指示弧菌均产生了抑菌作用,但其对每种指示弧菌的抑菌效果差异较大,并且FH菌株发酵时间不同,其发酵粗提物对2株指示弧菌的抑菌效果也相差较大。
2.5 保存温度和时间对FH菌株发酵粗提物抑菌效果的影响
由表3可见:与0 d抑菌效果比较,保存在4℃和-20℃下的FH菌株发酵粗提物在60 d内对2株指示弧菌抑菌效果均无显著性差异(P>0.05);在室温条件下,保存7 d的FH菌株发酵粗提物对2株指示弧菌抑菌效果无显著性差异(P>0.05),保存30 d的发酵粗提物尽管还有抑菌效果,但其抑菌圈直径仅略高于阳性对照组,保存60 d的FH发酵粗提物对2株指示弧菌抑菌效果均显著降低(P<0.05),且明显低于阳性对照组。
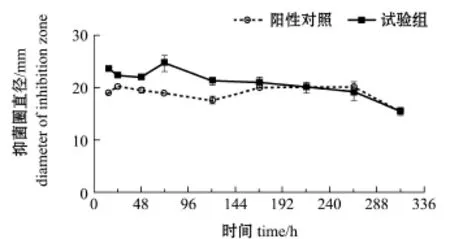
图4 无菌发酵粗提物对灿烂弧菌的抑菌效果Fig.4 An antibacterial effect of sterile crude extracts from fermented liquid on Vibrio splendidus

表3 不同的保存温度和时间对无菌发酵粗提物抑菌活性的影响Tab.3 Impacts of different storage temperature and time on the antibacterial effect of sterile crude extracts from fermented liquid
2.6 灭菌海水中FH菌株发酵产物抑制指示弧菌的效果
在最佳发酵条件下获得的FH菌株发酵产物分别抑制2株指示弧菌的试验结果见图5、图6。
在100 mL灭菌海水中,接种哈维弧菌初始密度为(1.4±0.1)×103CFU/mL。未添加发酵产物的对照组中,哈维弧菌也呈指数生长特征,在12 h时进入指数生长阶段,此时哈维弧菌密度为(40.0±1.4)×103CFU/mL,在24和48 h时仍然处于指数生长阶段,对应哈维弧菌密度分别为(705.0± 106.1)×103、(2610.0±200.7)×103CFU/mL。在添加1 mL发酵产物的试验组1中,哈维弧菌在12 h时进入指数生长阶段,此时弧菌密度为(110.2± 53.4)×103CFU/mL,在24 h时进入平台期,弧菌密度为(1400.0±42.4)×103CFU/mL,高于对照组24 h弧菌密度98.6%,这可能是发酵产物中的营养物质促进了哈维弧菌生长所致。在添加2 mL发酵产物的试验组2中,24 h时哈维弧菌密度为(41.0±24.0)×103CFU/mL,尽管高于初始弧菌密度,但比此时对照组弧菌密度降低94.2%。由此可见,1 mL发酵产物未能抑制哈维弧菌生长,并且其中营养物质会促进弧菌生长;而2 mL发酵产物能有效抑制海水中哈维弧菌生长,并一直保持至试验结束(图5)。
同样,100 mL灭菌海水中,接种灿烂弧菌的初始菌密度为(3.0±0.2)×103CFU/mL。对照组灿烂弧菌呈指数生长,在6 h时进入指数生长阶段,此时灿烂弧菌密度为(11.4±0.8)×103CFU/mL;在24 h时,灿烂弧菌密度达到最大,为(155.0±7.1)×103CFU/mL。两个试验组灿烂弧菌密度尽管也繁殖生长,但速度显著低于对照组,12 h时进入指数生长阶段;在24 h时进入平台期,试验组1和试验组2中灿烂弧菌密度分别为(50.8±1.1)×103、(25.0±7.1)×103CFU/mL,比同时间对照组弧菌密度分别降低67.3%和83.9%。由此可见,1 mL和2 mL发酵产物均能抑制海水中灿烂弧菌的繁殖生长,且试验组2效果更好。

图5 无菌发酵产物在海水中对哈维弧菌的抑制效果Fig.5 Antibacterial effect of sterile fermentation products on Vibrio harveyi in seawater
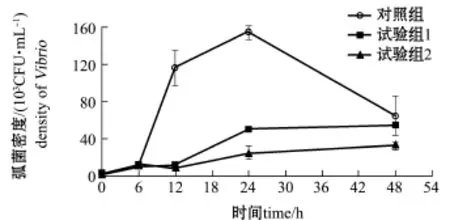
图6 无菌发酵产物在海水中对灿烂弧菌的抑制效果Fig.6 Antibacterial effect of sterile fermentation products on Vibrio splendidus in seawater
3 讨论
弧菌可导致诸多海水养殖生物的病害发生,给海水养殖业带来巨大的损失[25]。从1965年至今,海绵及其共附生放线菌是海洋天然活性产物的最主要来源之一,约占已发现海洋天然活性产物数量的35%[26]。因此,筛选具有抑制弧菌作用的海绵共生放线菌,并研究其抑制弧菌效果,对于防治海水养殖病害具有重要价值。
3.1 FH菌株的抑菌活性
本研究中,从繁茂膜海绵中分离筛选出的FH菌株,初步鉴定为球孢链霉菌Streptomyces globisporus,对海水养殖主要病原细菌如哈维弧菌Vibrio harveyi、灿烂弧菌Vibrio splendidus具有较强的抑制作用。王勇[27]从海泥中分离筛选出一株弗氏链霉菌Streptomyces fradiae DL-4,其代谢产物对大肠杆菌E.coli、鳗弧菌Vibrio anguillarum、哈维弧菌Vibrio harvey、杀鲑气单胞菌Aeromonas salmonida、金黄葡萄球菌Staphlococcus aureus等革兰氏阴性细菌和革兰氏阳性细菌显示出较强的抑菌作用。王高学等[28]从泥样中分离筛选出6株链霉菌属Streptomyces放线菌,其代谢产物对鳗弧菌Vibrio anguillarum、肠型点状气单胞菌Aeromonaspunctata f.instestinalis、金黄葡萄球菌Staphlococcus aureus等显示出较强的杀菌作用。同为链霉菌属放线菌,其代谢产物均对多种弧菌具有抑制作用。链霉菌属是产生抗生素种类和数量最多的一大类放线菌,目前,约2/3临床应用的抗生素来源于链霉菌属[29]。FH菌株对革兰氏阳性菌的抑菌活性需进一步检测。
3.2 FH菌株的最佳发酵条件
以抑制弧菌为指示效果,FH菌株发酵培养条件正交试验优化结果为温度25℃、pH 7.5、装液量30 mL。在此基础上进行时间优化,结果表明,在72~168 h时,发酵粗提物对哈维弧菌的抑菌效果较好,在15~72 h时发酵粗提物对灿烂弧菌的抑菌效果较好。综合考虑对2株指示菌的抑制效果和生产时间成本等问题,选择72 h为适宜发酵时间。从今后生产角度考虑,发酵时间可延长到96 h,为进一步扩大生产提供了参考依据。原居林等[30]从福建琅琦岛海泥中分离得到一株对多种水产病原菌具有较强抑制作用的链霉菌属Streptomyces菌株FA-F-5,以嗜水气单胞菌Aeromonas hydrophila为指示菌,优化得出最佳发酵培养条件为pH 8、温度25℃、装液量100 mL(1000 mL瓶)、发酵时间168 h。同为海洋链霉菌属,FA-F-5与FH菌株优化结果相近。苑孟等[31]以枯草芽孢杆菌Bacillus subtilis为指示菌,对拟诺卡氏菌属Nocardiopsis放线菌Y18的发酵条件进行优化,得出最佳优化条件为温度28℃、pH 8、装液量200 mL (1000 mL瓶),培养时间6 d。虽然Y18与FH菌株不同属,但优化结果差异不大。顾忠旗[32]以嗜水气单胞菌Aeromonas hydrophila为指示菌,对海洋放线菌DL2-F-5 Streptomyces fradiae发酵条件的优化结果为温度33℃、pH 6.0、发酵时间96 h。虽然DL2-F-5与FH菌株同属,但优化结果差异较大。放线菌产生抑菌活性物质的适宜条件与其所属种属相关性不大,不同的放线菌其发酵条件需根据实际条件进行优化。
3.3 FH菌株抑菌产物的稳定性
王高学等[20]对弗氏链霉菌Streptomyces fradiaeDL2-F-5贮藏时间对发酵液抑菌活性的影响进行试验,其抑菌成分可在室温条件下稳定保存150 d。邵光灿等[33]对链霉菌属Streptomyces海洋放线菌F1次级代谢产物进行储藏稳定性检测,发现抑菌物质可在室温条件下保存30 d。而本研究中链霉菌属FH菌株发酵粗提物抑菌活性的稳定性试验显示,发酵粗提物在4℃、-20℃条件下,保存60 d其抑菌活性较为稳定,但在室温条件下保存其抑菌活性不稳定,在室温贮存方面具有劣势。这些试验结果均为海绵放线菌FH的生产开发研究提供了理论依据。
3.4 FH菌株的生长曲线
本研究中,对海绵放线菌FH菌株在正交试验最优条件下的生长曲线进行了测定,FH菌株在ISP2液体培养基中摇瓶培养,0~15 h为适应期, 15~72 h为指数生长期,72~120 h为稳定期, 120 h以后为衰亡期。张红丹等[34]对不吸水链霉菌公主岭新变种Streptomyces ahygroscopicus n.var. gongzhulingensis Ruan et Zhang在YEME培养基中摇床振荡培养时的生长曲线进行测定,结果显示, 0~36 h为生长延迟期,36~84 h为对数生长期, 84~108 h为稳定期,108 h以后为衰亡期。由生长曲线可见,FH菌株适应期短,稳定期长。
3.5 灭菌海水中FH菌株发酵产物的抑菌试验
海绵放线菌FH菌株的发酵产物在灭菌海水中对弧菌的抑制试验结果表明,其发酵产物能够有效地抑制海水中弧菌的增长,有望降低弧菌病的发病率。对放线菌F1-F-12进行鲫防治试验[28],投喂添加放线菌发酵液饲料的鲫体内气单胞菌数量与对照组相比明显减少。因此,将具有抑菌活性的放线菌开发成生物渔药并应用于海水养殖业,具有一定的实际应用价值,值得进一步深入研究。
[1] 闫茂仓,陈少波,单乐州,等.海水养殖动物致病弧菌的研究进展[J].水产科学,2009,28(8):475-481.
[2] 向赟,吴宇学,王刚,等.不同温度下哈维氏弧菌和白斑综合症病毒对凡纳滨对虾的致病性[J].大连海洋大学学报,2015,30 (1):56-61.
[3] 陶然,刘瑞,王晴,等.哈维氏弧菌硫氧还蛋白还原酶在大肠杆菌中的表达及对大菱鲆的免疫保护作用[J].大连海洋大学学报,2012,27(2):137-142.
[4] 吴后波,潘金培.弧菌属细菌及其所致海水养殖动物疾病[J].中国水产科学,2001,8(1):89-93.
[5] 张晓华,钟英斌,陈吉祥.哈维氏弧菌的生物学特性、流行病学及检测技术[J].中国海洋大学学报,2007,37(5):740-748.
[6] 杨先乐.我国的海水养殖及其病害控制[J].水产科技情报, 2001,28(1):7-10,14.
[7] 王印庚,方波,张春云,等.养殖刺参保苗期重大疾病“腐皮综合征”病原及其感染源分析[J].中国水产科学,2006,13(4):610-616.
[8] 陈四清,李杰,韩茵,等.仿刺参养殖区泥样中灿烂弧菌拮抗菌的快速筛选及其保护作用[J].中国海洋大学学报,2014,44 (11):30-36.
[9] 原居林.一株抗菌海洋放线菌的分离鉴定及其活性成分的初步研究[D].杨凌:西北农林科技大学,2008.
[10] Manivasagan P,Venkatesan J,Sivakumar K,et al.Pharmaceutically active secondary metabolites of marine actinobacteria[J]. Microbiological Research,2014,169(4):262-278.
[11] 吴梧桐,王友同,吴文俊.海洋活性物质研究若干进展[J].药物生物技术,2000,7(3):179-183.
[12] Faulkner D J.Marine natural products[J].Natural Product Reports,2000,17:7-55.
[13] Bergmann W,Burke D C.Contributions to the study of marine products.XXXIX.The nucleosides of sponges:III.spongothymidine and spongouridine[J].The Journal of Organic Chemistry, 1995,20(11):1501-1507.
[14] Wang Guangyi.Diversity and biotechnological potential of the sponge-associated microbial consortia[J].Journal of Industrial Microbiology&Biotechnology,2006,33(7):545-551.
[15] 李侠,程璐.4株海洋放线菌对半滑舌鳎病原弧菌的拮抗作用[J].江苏农业科学,2011(1):268-270.
[16] 张海涛.海绵放线菌的分离和多样性研究[D].大连:中国科学院大连化学物理研究所,2006.
[17] 信艳娟,艾江宁,刘亚男,等.一株海洋放线菌的分离鉴定及活性研究[J].生物技术进展,2012,2(5):354-358.
[18] 惠娇.放线菌NB-8发酵条件优化及抑菌机理的研究[D].保定:河北大学,2011.
[19] 黄苛,刘祝祥,肖怀东,等.放线菌JSM20.1发酵条件优化及活性物质特性初步研究[J].微生物学杂志,2008,28(6):70-74.
[20] 王高学,段星,原居林,等.一株抗多种水产病原菌放线菌的鉴定、发酵优化及其应用[J].上海水产大学学报,2008,17 (5):591-597.
[21] 谷俊,林亲雄,邢莹莹,等.海洋放线菌M324抗菌物质的发酵优化与性质的初步研究[J].药物生物技术,2006,13(5):347-350.
[22] Sujatha P,Raju K V V S N B,Ramana T.Studies on a new marine streptomycete BT-408 producing polyketide antibiotic SBR-22 effective against methicillin resistant Staphylococcus aureus [J].Microbiological Research,2005,160(2):119-126.
[23] 穆兰,廖辉伟,尹贇,等.一种筛选常用中草药用作抑菌剂的新方法[J].中国食品添加剂,2008(6):112-117,122.
[24] Austin B,Austin D A.Bacterial Fish Pathogens:Diseases in Farmed and wild Fish[M].2nd ed.Chichester,UK:Ellis Horwood Ltd,1993:265-314.
[25] 潘晓艺,沈锦玉,尹文林,等.水生动物的弧菌病及其致病机理[J].大连水产学院学报,2006,21(3):272-277.
[26] Blunt J W,Copp B R,Munro M H G,et al.Marine natural products[J].Natural Product Reports,2010,27(2):165-237.
[27] 王勇.抗水产病原菌海洋放线菌菌株DL-4的鉴定、发酵优化及其生物学特性研究[D].杨凌:西北农林科技大学,2011.
[28] 王高学,顾忠旗,原居林,等.杀灭水产病原菌的放线菌筛选及防治试验研究[J].安徽农业科学,2007,35(9):2613-2614,2673.
[29] Procópio R E,Silva I R,Martins M K,et al.Antibiotics produced by Streptomyces[J].The Brazilian Journal of Infectious Diseases, 2012,16(5):466-471.
[30] 原居林,王高学,王建福,等.海洋放线菌FA-F-5对水产病原菌的抑制作用[J].西北农林科技大学学报:自然科学版, 2008,36(1):79-85.
[31] 苑孟,俞勇,李会荣,等.海洋放线菌Y18的分子鉴定、生物活性及其抗菌物质发酵条件优化[J].极地研究,2014,26(3):292-299.
[32] 顾忠旗.一株抗菌海洋放线菌的分离鉴定及其活性成分的初步研究[D].杨凌:西北农林科技大学,2007.
[33] 邵光灿,钱冬萌,宋旭霞,等.海洋放线菌F1发酵条件优化及抑菌物质性质的初步研究[J].中国海洋药物,2014,33(3):43-48.
[34] 张红丹,杜茜,张正坤,等.放线菌769抑菌谱及液体培养生长曲线的测定[J].中国植保导刊,2010,30(7):5-9.
Isolation,optimization of fermentation conditions and inhibition of Vibrio in a sponge-associated actinobacterium FH
DU Ying-xia1,LI Jing-ying2,FU Min2,ZHANG Xin2,QU Chun-qiang2,LI Xiao-yi2, ZHANG Ju-lin2,GU Ying3,WANG Xuan-jun4,FU Wan-tao2,5
(1.College of Fisheries and Life Science,Dalian Ocean University,Dalian 116023,China;2.College of Marine Science and Environment,Dalian Ocean University,Dalian 116023,China;3.Fisheries Administrative Management Station of Changhai,Dalian 116500,China;4.Marine Surveillance and Fishery Administration Bureau of Dalian,Dalian 116001,China;5.Key Laboratory of Offshore Marine Environmental Science and Technology of Liaoning Province's University,Dalian 116023,China)
A sponge-associated actinobacterium FH with strong bioactivity was isolated from marine sponge Hymeniacidon perlevis,and identified by 16S rDNA gene sequence analysis as Streptomyces globisporus.The inhibition of Vibrio harveyi and Vibrio splendidus by FH strain was studied and the fermentation condition of FH strain was optimized,including influence of preservation temperature and time on the antibacterial effect of fermented product. The dry weight of mycelium revealed that the growth curve of FH strain showed a lag phase in 0-15 h,log phase in 15-72 h,stationary phase in 72-120 h and decline phase after 120 h.The optimal fermentation of FH strain was observed under conditions of temperature 25℃,pH 7.5 and loading volume 30 mL in the orthogonal experiment, with the best antibacterial effect on Vibrio harveyi and Vibrio splendidus by the crude extracts of FH strain fermented in 72 h under this condition.However,there was no significant difference in the antibacterial effects in the crude extracts of FH strain stored at 4℃and-20℃for 60 days and stored 7 days at room temperature(P>0.05).Addition of 2 mL fermentation product of FH strain in 100 mL sterilized seawater led to effectively inhibit the growth of Vibrio harveyi and Vibrio splendidus.The findings indicated that the sponge-associated actinobacterium FH and its fermentation product had potential application in the field of mariculture.
sponge-associated actinobacterium;Vibrio;optimization of fermentation condition
Q93
A
10.16535/j.cnki.dlhyxb.2017.04.014
2095-1388(2017)04-0457-08
2016-09-29
国家“十二五”科技支撑计划项目(2015BAD13B05);海洋行业标准制修订计划项目(201502007-T)
杜英侠(1991—),女,硕士研究生。Email:Duyingxiayiyi@163.com
付晚涛(1969—),男,博士,教授。Email:fuwantao@dlou.edu.cn
