环糊精衍生物制备及催化水相碳-碳交联偶合反应
2017-07-24郭旭明周兴龙张佳楠
郭旭明,王 露,周兴龙,张佳楠,邬 峰
(河南科技大学 化工与制药学院,河南 洛阳 471023)
环糊精衍生物制备及催化水相碳-碳交联偶合反应
郭旭明,王 露,周兴龙,张佳楠,邬 峰
(河南科技大学 化工与制药学院,河南 洛阳 471023)
以β-环糊精为原料,通过磺酰化、叠氮化以及氨基化反应得到单(6-氨基-6-去氧)-β-环糊精,应用红外光谱、质谱和元素分析等手段,对反应中间产物及最终产物的结构进行了分析和表征。在水相中,以单(6-氨基-6-去氧)-β-环糊精、2,6-二溴甲基吡啶及醋酸钯(Pd(OAc)2)反应制得催化剂体系,用于催化水相Suzuki交联偶合反应。考察了温度、缚酸剂和反应时间等条件对催化反应产率的影响。试验结果表明:当卤代芳烃为1.0 mmol,芳基硼酸为1.5 mmol,催化剂为0.05% mmol时,50 ℃下反应6 h,联芳烃的产率可达97%。
单(6-氨基-6-去氧)-β-环糊精;催化;水相;Suzuki交联偶合反应
0 引言
β-环糊精(β-cyclodextrin,β-CD)具有无毒、低成本和制备简单等特性,广泛应用于药品、食品、农业和工业等领域中[1]。β-CD在水中的溶解度不高,但由于其表面多个位置有羟基,可对其进行选择性修饰,改善其在水中的溶解度[2-3]。
文献[4]用三步合成的方法,使β-CD与1,4-丁烷磺内酯在碱性条件下合成了磺丁基醚-β-CD,通过调整pH值得到不同取代度产物,产率可达80%。文献[5]用β-CD和1,1’-羰基二咪唑合成了一种纳米海绵多孔材料,可作为新型生物功能织物面料。文献[6]采用吡啶为溶剂合成单(6-O-对甲苯磺酰基)-β-CD,利用L-精氨酸和单(6-O-对甲苯磺酰基)-β-CD进行反应,合成了氨基酸修饰的β-CD。文献[7]以β-CD为原料,在NaOH催化下,用缩合剂合成羟丙基-β-CD,并将其应用于药物反应中。
水具有无毒、易得、廉价及导电性好等优点,在许多催化反应中对反应的选择性和反应速度都有促进作用,是理想的绿色溶剂,成为目前催化反应的研究热点。
Suzuki交联偶合反应用卤代芳烃和有机硼为底物,适用范围广,对环境污染小,对水不敏感,稳定性较好,被广泛地用于构建C--C单键。使用配体与过渡金属配合得到的催化剂体系用于Suzuki交联偶合反应,可获得较高的产率[8]。其中,有机膦配体使用较多,但有机膦有毒,不稳定,且对配体结构有较高的要求。由于环糊精无毒无害以及结构的特殊性,可对其进行改性,增强其与金属离子的配位能力,使催化剂体系更稳定,催化效率更高,并减少环境污染[9]。
文献[10]以β-CD和醋酸钯(Pd(OAc)2)在碱性条件下直接配位,得到Pd(Ⅱ)-β-CD配合物,催化了水相溴代芳烃与苯硼酸的Suzuki交联偶合反应,产率可达96%。文献[11]以β-CD合成了一种新型水溶性配体,并与Pd(OAc)2配位催化了水相碘代芳烃与烯烃的Heck交联偶合反应,产率达96%。文献[12]对烷基咪唑改性的β-CD与Pd(OAc)2的配位反应进行了研究,并应用于催化水相Suzuki交联偶合反应。文献[13]通过对Pd(OAc)2催化Suzuki交联偶合反应进行研究,发现β-CD的加入可明显提高反应产率。
本文以β-CD为原料合成得到了单(6-氨基-6-去氧)-β-CD,合成步骤简单安全,产率高。产物在水中的溶解性良好,并且可与Pd(OAc)2有效配位,形成均一溶液。以水为反应介质进行了催化反应研究。所制备催化剂体系在温度较低、时间较短的情况下,对Suzuki偶联反应有较高的催化效率。
1 试验
1.1 仪器与试剂
质谱(mass spectrometry,MS),采用美国Thermo-Fisher公司Exactive Orbitrap型质谱仪测定;核磁共振氢谱(1H nuclear magnetic resonance spectroscopy,1HNMR),采用美国Bruker公司Bruker DRX 500型核磁共振波谱仪测定;傅里叶变换红外光谱(Fourier transform infrared spectrum,FT-IR),采用美国Nicolet公司IS10型傅里叶变换红外光谱仪测定;元素分析(elemental analysis,EA),采用德国Elementar公司vario EL Cube型元素分析仪测定;气相色谱(gas chromatography,GC),采用美国Varian公司CP-3800型气相色谱仪测定。
甲酸胺、碳酸铯(Cs2CO3)、联苯、卤代芳烃及芳基硼酸均购于上海阿拉丁试剂公司;β-CD购于北京奥博星试剂公司,水重结晶后使用;Pd(OAc)2和钯碳(Pd/C)购于陕西开达化工有限责任公司,其中,Pd(OAc)2质量分数为99.9%,Pd/C催化剂中Pd质量分数为5%;2,6-二溴甲基吡啶由实验室合成,并经过核磁共振波谱和液相色谱分析确认;原料2,6-二羟甲基吡啶购于上海阿拉丁试剂公司;200~300目柱层析硅胶购于青岛海洋化工厂。其他试剂均为分析纯,除特殊说明外,未经进一步处理。水为重蒸水。
1.2 单(6-氨基-6-去氧)-β-CD的合成
式(1)为单(6-氨基-6-去氧)-β-CD的合成反应式。取适量β-CD溶于0.75 mol/L NaOH溶液中,搅拌;冰浴下缓慢加入对甲苯磺酰氯,反应4 h,过滤。用1 mol/L HCl溶液调节pH值至6~7,冰箱冷藏12 h,过滤得到粗产品,重结晶2次,所得固体于60 ℃真空干燥得式(1)中产物a 5.0 g,产率45%。取适量a溶解于N,N-二甲基甲酰胺(DMF)中,加入叠氮化钠,105~110 ℃搅拌2 h;冷至室温,加入丙酮产生白色沉淀,过滤得式(1)中b的粗产物。b的粗产物在水-丙酮中重结晶,得到式(1)中目标产物b 1.3 g,产率74%。取适量b,甲酸铵,5% Pd/C,加入水-甲醇混合溶剂,搅拌回流2 h;滤去Pd/C,水洗滤渣,活性炭吸附脱色;滤液中加入丙酮,析出白色沉淀,抽滤,滤饼干燥得式(1)中白色粉末c 0.5 g,产率55%。

1.3 水相Suzuki交联偶合反应
取适量单(6-氨基-6-去氧)-β-CD于圆底烧瓶中,加入一定量干燥后的DMF溶解,再缓慢滴加溶有2,6-二溴甲基吡啶的DMF溶液。加入无水K2CO3,氮气置换数次,80 ℃下反应8 h,过滤,得DMF溶液。除去DMF,得白色固体。取适量白色固体于圆底烧瓶中,加入一定量的Pd(OAc)2,移入蒸馏水。氮气下室温搅拌12 h,形成均匀黄色溶液,此溶液为2,6-二亚甲基单(6-氨基-6-去氧)-β-CD吡啶/Pd(OAc)2/H2O催化剂储备液。催化剂合成反应如式(2)所示。进行催化反应时,按照所需量移取,移取后氮气保护。该储备液放置1个月未发生变化。
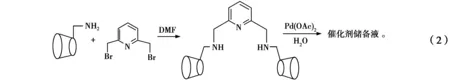
在耐压反应管中移取一定量的催化剂母液,加入所需量的卤代芳烃、芳基硼酸、缚酸剂和四丁基溴化胺(tetrabutyl ammonium bromide,TBAB),加水至总体积为2 mL,氮气保护,于一定温度下反应一定时间。Suzuki交联偶合反应如式(3)所示。反应结束后,使用乙醚(10 mL×3)萃取反应液,2 mol/L HCl溶液(10 mL×3)洗涤乙醚相;使用蒸馏水(10 mL×3)充分洗涤乙醚相,使用无水Na2SO4干燥乙醚相12 h,浓缩乙醚相至适当体积。使用气相色谱研究交联偶合反应,气相色谱定量分析方法为内标法,联苯为内标物。偶联产物经过柱分离,得到分离产率,并对交联偶合产物进行核磁共振氢谱验证。

2 结果与讨论
2.1β-CD衍生物结构分析
图1是β-CD衍生物质谱图。图1a中:m/z1 311是最大丰度中性分子单-6-O-对甲苯磺酰基-β-CD(M=1 288)加上一个钠离子(MNa+=23)后的正离子的相对分子质量。图1b中:m/z1 182是最大丰度中性分子单-6-叠氮基-β-CD(M=1 159)加上一个钠离子(MNa+=23)后的相对分子质量。图1c中:m/z1 156是最大丰度中性分子单(6-氨基-6-去氧)-β-CD(M=1 133)加上一个钠离子(MNa+=23)后的正离子的相对分子质量,说明生成了β-CD衍生物单(6-氨基-6-去氧)-β-CD。

图1 β-CD衍生物质谱图
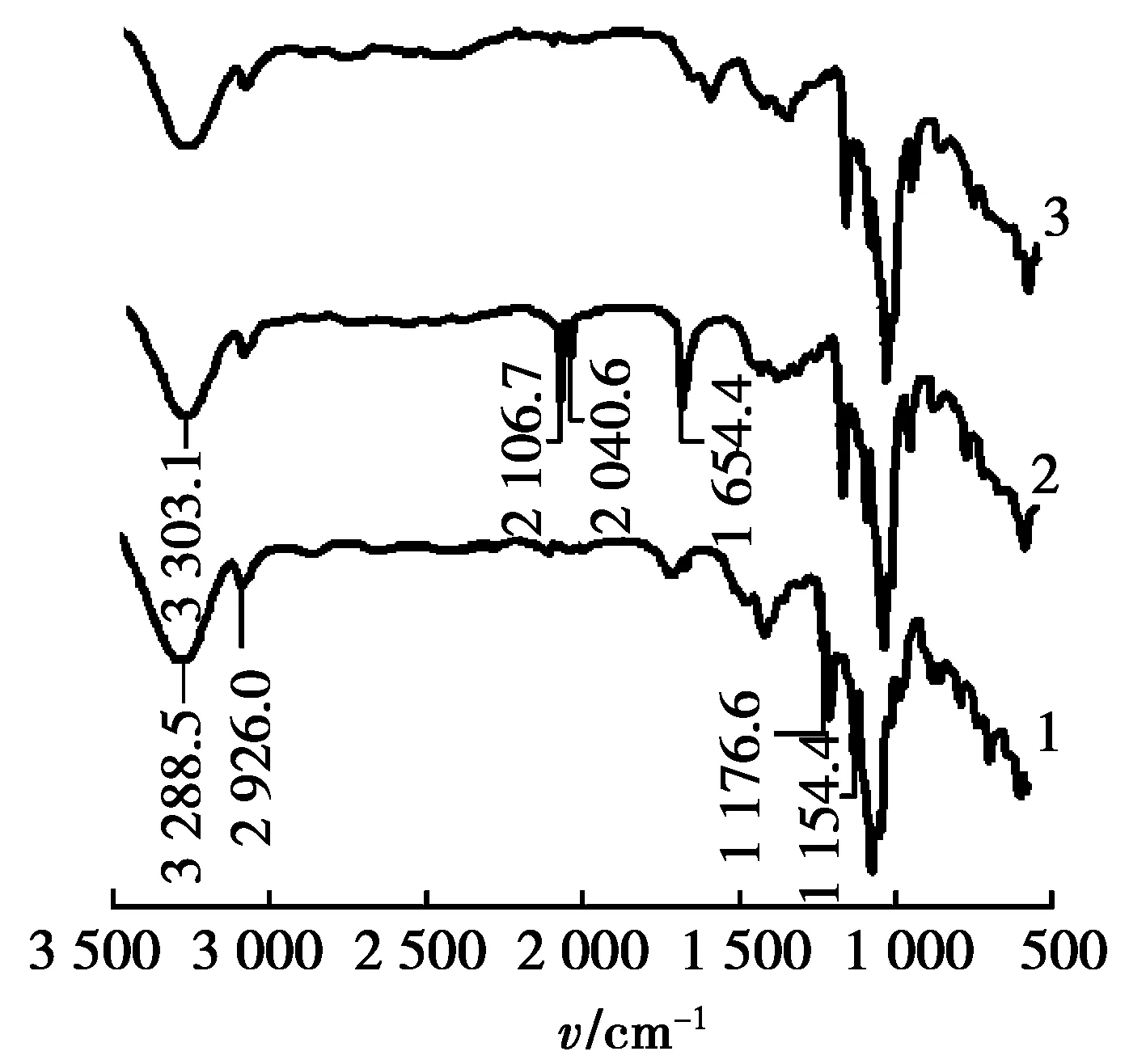
1. 单-6-O-对甲苯磺酰基-β-CD; 2. 单-6-叠氮基-β-CD; 3. 单(6-氨基-6-去氧)-β-CD。图2 β-CD衍生物红外光谱图
碳、氢、氧、氮元素分析结果:式(1)中产物c的分子式为C42H71O34N。理论值:w(C)=44.48%;w(H)=6.27%;w(O)=48.01%;w(N)=1.24%。实测值:w(C)=44.82%;w(H)=6.88%;w(O)=47.02%;w(N)=1.28%。可知最终产物(见式(1)中c)元素组成的理论值与实测值一致。
图3是以水为溶剂的配体(2,6-二亚甲基单(6-氨基-6-去氧)-β-CD吡啶,C91H147N3O68)及配合物(2,6-二亚甲基单(6-氨基-6-去氧)-β-CD吡啶钯,C91H147N3O68Pd)的紫外光谱图。由图3可以看出:配体和配合物的紫外光谱图发生了较大的变化,紫外光谱曲线1中,264 nm的吸收峰基本消失,最大吸收峰蓝移。这是由于配合物的生成,配体上氮元素的电子给与了钯金属离子,配合物与配体相比,电子云密度发生了改变,导致紫外吸收发生改变,由此可说明已生成配合物。

图3 配体及配合物紫外光谱图
2.2 催化反应
2.2.1 缚酸剂对水相Suzuki偶联反应产率的影响
表1为缚酸剂对水相Suzuki偶联反应产率的影响。反应条件:溴苯1 mmol,对甲基苯硼酸1.5 mmol,催化剂0.05% mmol,TBAB 1.5 mmol,缚酸剂1.5 mmol,反应温度50 ℃,反应时间6 h,氮气保护。由表1可知:在所考察的缚酸剂中,Cs2CO3催化产率最高,达到了完全转化;其次是Na3PO4·12H2O的催化反应产率,几乎达到了定量转化;Na2CO3和K2CO3催化反应产率也较高,均在90%以上;而(CH3CH2)3N催化反应产率最低,仅为36%,推测是由于有机碱在水中的溶解性较低所致。由于Cs2CO3价格较高,故催化反应研究中选用Na3PO4·12H2O为缚酸剂。
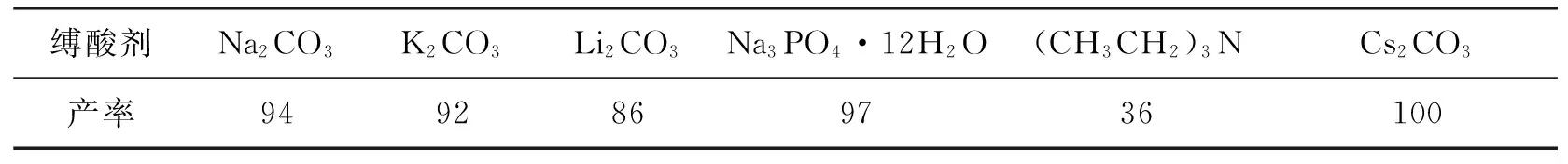
表1 缚酸剂对水相Suzuki偶联反应产率的影响 %
2.2.2 温度对水相Suzuki偶联反应产率的影响
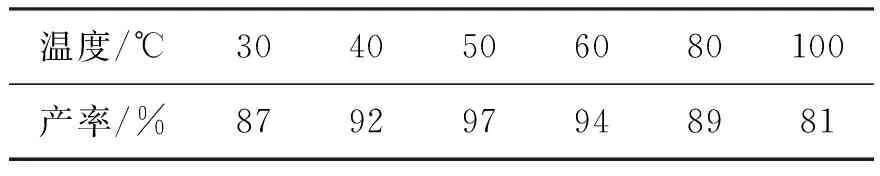
表2 温度对水相Suzuki偶联反应产率的影响
表2为温度对水相Suzuki偶联反应产率的影响。反应条件:溴苯1 mmol,对甲基苯硼酸1.5 mmol, 催化剂0.05% mmol,TBAB 1.5 mmol,Na3PO4·12H2O 1.5 mmol,反应时间6 h,氮气保护。由表2可见:随着反应温度的升高,Suzuki偶联反应的产率明显上升,当温度达到50 ℃时,产率最高。研究结果发现:随着温度的进一步升高,反应后出现了少量钯黑,且温度越高,钯黑越多,产率明显下降。故确定50 ℃为最佳反应温度。
2.2.3 反应时间对水相Suzuki偶联反应产率的影响
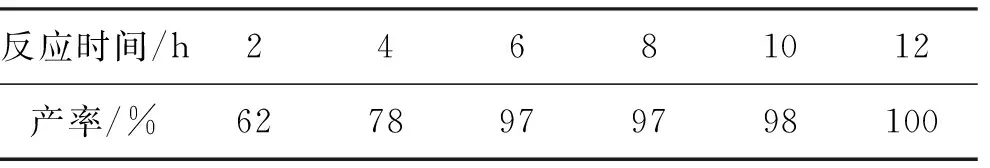
表3 反应时间对水相Suzuki偶联反应产率的影响
表3为反应时间对水相Suzuki偶联反应产率的影响。反应条件:溴苯1 mmol,对甲基苯硼酸 1.5 mmol,催化剂0.05% mmol,TBAB 1.5 mmol,Na3PO4·12H2O 1.5 mmol,反应温度50 ℃,氮气保护。由表3可见:随着反应时间的延长,Suzuki偶联反应产率增加。反应时间为6 h时,产率达到97%,但随着反应时间的进一步延长,产率没有明显提升,故确定反应时间为6 h。
2.2.4 催化反应体系的底物普适性
表4为底物对水相Suzuki偶联反应的影响。反应条件:卤代芳烃1 mmol,芳基硼酸1.5 mmol,催化剂0.05% mmol,TBAB 1.5 mmol,Na3PO4·12H2O 1.5 mmol,反应温度50 ℃,反应时间6 h,氮气保护。在确定的催化反应条件下,考察了含不同取代基的卤代芳烃与芳基硼酸的Suzuki偶联反应,反应式见式(4)。

由表4可以看出:溴代芳烃反应产率明显高于氯代芳烃。富电性溴代芳烃与溴苯相比较,反应产率有一定的下降(序号7、8、9),缺电性溴代芳烃的反应产率稍高(序号10、11)。空间位阻对催化反应产率也有一定的影响(序号4、5、6),卤代芳烃中邻位取代的甲基造成了反应产率的降低。研究了不同取代基的芳基硼酸对反应产率的影响,芳基硼酸上的取代基对反应产率的影响没有溴代芳烃上的取代基影响大,含有给电子基团的芳基硼酸反应产率稍高(序号5、8)。研究结果发现:在催化条件下,氯代芳烃的反应产率较低,延长催化反应时间,氯代芳烃反应产率增加不明显(序号12、13)。
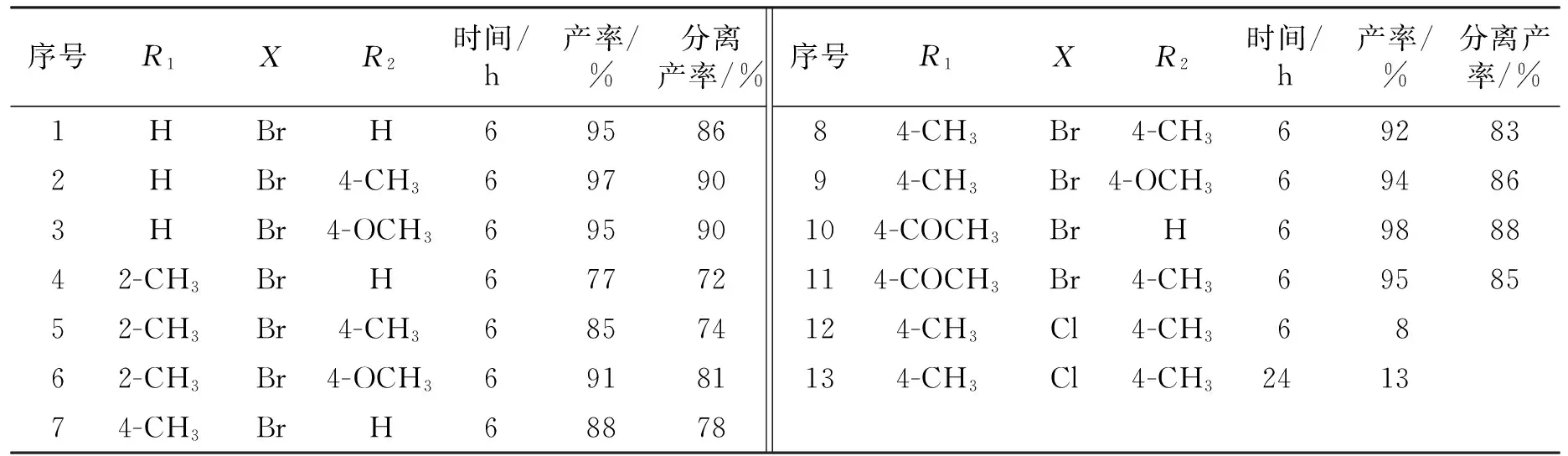
表4 底物对水相Suzuki偶联反应的影响
3 结论
(1)以β-环糊精(β-CD)为原料,经过磺酰化、叠氮化和氨基化,合成得到了单(6-氨基-6-去氧)-β-CD,合成路线温和易控。
(2)使用合成制备的单(6-氨基-6-去氧)-β-CD与2,6-二溴甲基吡啶反应得到配体,再与Pd(OAc)2在水中反应,得到了一个稳定的钯催化剂体系。
(3)把该催化剂体系应用于催化水相Suzuki偶联反应,中等活性的溴代芳烃产率一般在90%以上。
[1] 杨黎燕,谢婷婷,邢壮壮,等.β-环糊精聚合物在药学领域的应用研究[J].化工科技,2016,24(1):78-82.
[2] 马水仙,赵雪秋,王淑惠,等.山姜素与甲基化β-环糊精的包合行为研究[J].云南民族大学学报(自然科学版),2016,25(1):29-33.
[3] 沈海民,方红果,武宏科,等.环糊精衍生物的分子形态及其构筑策略研究进展[J].化工进展,2015,34(2):430-446.
[4] MA D Y,ZHANG Y M,XU J N.The synthesis and process optimization of sulfobutyl etherβ-cyclodextrin derivatives[J].Tetrahedron,2016,72(22):3105-3112.
[5] MIHAILIASA M,CALDERA F,LI J,et al.Preparation of functionalized cotton fabrics by means of melatonin loadedβ-cyclodextrin nanosponges[J].Carbohydrate polymers,2016,142:24-30.
[6] 赵美霞,李洋.L-精氨酸-β-环糊精的合成和结构表征[J].河南大学学报(自然科学版),2013,43(4):402-404.
[7] 彭彩云,张耿,陈文明,等.羟丙基-β-环糊精的合成及其表征[J].中国医药导报,2010,7(36):30-31,51.
[8]SUZUKI A.Cross-coupling reactions of organoboranes:an easy way to construct C—C bonds (Nobel lecture)[J].Angewandte chemie international edition,2011,50(30):6722-6737.
[9] 栾玉新.新型水溶性钯催化剂:设计、制备及其在Suzuki-Miyaura交叉偶联反应中的应用[D].杭州:浙江工业大学,2014.
[10] KABOUDIN B,SALEMI H,MOSTAFALU R,et al.Pd(II)-β-cyclodextrin complex:synthesis,characterization and efficient nanocatalyst for the selective Suzuki-Miyaura coupling reaction in water[J].Journal of organometallic chemistry,2016,29(3):229-242.
[11] DINDULKAR S D,JEONG D,KIM H,et al.Functionalizedβ-cyclodextrin as supramolecular ligand and their Pd(OAc)2complex:highly efficient and reusable catalyst for Mizoroki-Heck cross-coupling reactions in aqueous medium[J]. Carbohydrate research,2016,430:85-94.
[12] KAIROUZ V,SCHMITZER A R.ChemInform abstract:imidazolium-functionalizedβ-cyclodextrin as a highly recyclable multifunctional ligand in water[J].ChemInform,2014,45(47):3117-3124.
[13] DECOTTIGNIES A,FIHRI A,AZEMAR G,et al.Ligandless Suzuki-Miyaura reaction in neat water with or without nativeβ-cyclodextrin as additive[J].Catalysis communications,2013,32:101-107.
国家自然科学基金项目(21006057);河南省科技攻关国际合作基金项目(134500510034)
郭旭明(1965-),男,河南焦作人,副教授,博士,硕士生导师,主要研究方向为绿色化学与均相催化.
2016-10-12
1672-6871(2017)03-0100-05
10.15926/j.cnki.issn1672-6871.2017.03.021
O621.3
A
