园艺作物褪黑素的研究进展
2017-07-24巩彪史庆华
巩彪,史庆华
(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室/农业部黄淮海设施农业工程科学观测实验站,山东泰安 271018)
园艺作物褪黑素的研究进展
巩彪,史庆华
(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室/农业部黄淮海设施农业工程科学观测实验站,山东泰安 271018)
褪黑素是一种在生物体中广泛存在的吲哚胺类化合物,在动物中具有调节昼夜节律、提高免疫力和抗衰老的作用,是一种对人类健康有益的保健佳品。现已发现褪黑素在高等植物中广泛存在,其生物合成途径以L-色氨酸为底物,途径色胺、5-羟色胺、N-乙酰-5-羟色胺,最终生成褪黑素。目前,植物中鉴定到的褪黑素合成关键酶有:L-色氨酸脱羧酶(TrpDC)、色氨酸羟化酶(T5H)、5-羟色胺-N-乙酰转移酶(SNAcT)、N-乙酰-5-羟色胺甲基转移酶(AcSNMT)和羟基吲哚-O-甲基转移酶(HIOMT)。虽然目前有关褪黑素在园艺作物中的功能研究还不是很多,但已有研究表明,褪黑素在园艺作物中具有促进生长,增加产量,促进种子萌发,调节光周期,调控根系发育,延迟叶片衰老,影响果实成熟和贮藏等生理功能。而褪黑素的抗氧化特性又赋予它较强的活性氧(ROS)清除能力,且褪黑素能提高光照、温度、水分、盐碱、重金属和氧化胁迫下的抗氧化酶活性。此外,褪黑素还参与了包括生长素(IAA)、赤霉素(GA)、脱落酸(ABA)、乙烯(ETH)、水杨酸(SA)、多胺(PAs)和一氧化氮(NO)等物质介导的信号转导途径,组成了控制园艺作物生长、发育和抗性获得的复杂信号网络。文中从“褪黑素在植物中的生物合成,园艺作物中的褪黑素含量及影响因素,褪黑素在园艺作物生长、发育中的作用,褪黑素在园艺作物胁迫应答中的作用,褪黑素调控植物生长发育和抗逆性的信号转导网络”5个方面对褪黑素在园艺生产中的作用进行综述。重点阐述已经发现的褪黑素在园艺作物上的功能作用,对其潜在生理功能进行了预测,并从提升园艺作物褪黑素含量方面展望了今后需重点开展的研究。
褪黑素;园艺作物;生长;发育;胁迫应激
0 引言
褪黑素(Melatonin)又名N-乙酰-5-甲氧基色胺(N-acetyl-5-methoxytryptamine),属吲哚类色胺。1958年,LERNER等[1]首次从牛的松果体中提取出褪黑素,并证实它是一种类激素物质,参与动物的生长、发育调控和信号转导。褪黑素曾被认定为动物专属激素,直至BALZER和HARDELAND[2]从单细胞藻类Gonyaulax polyedra中分离并鉴定出了褪黑素,才证明植物界也有天然褪黑素的存在。自此,褪黑素在植物及农业科学领域受到了科研工作者的广泛关注,成为新的研究热点[3]。随着物质分离及鉴定技术、植物生理与细胞生物学理论、分子生物学理论、测序技术等研究手段的迅猛发展,科学家对植物中褪黑素的合成、含量、分布及功能等进行了更为全面、深入的研究。鉴于褪黑素在植物中具有多效调节作用,且对人类健康大有裨益;褪黑素在园艺作物中的研究日益增多。因此,本文综述了园艺作物中的褪黑素及其功能,以期为褪黑素在园艺作物生产中的应用提供理论依据。
1 褪黑素在植物中的生物合成
MURCH等[4]以金丝桃(Hypericum monogynum)幼苗为试材,采用同位素示踪技术,通过供应外源C14标记的色氨酸,检测到具有放射性的色胺、5-羟色氨酸、5-羟色胺、吲哚乙酸和褪黑素。其中,5-羟色氨酸和5-羟色胺被证明是动物中褪黑素的合成前体,说明褪黑素在植物和动物中的生物合成途径有所交叉[5]。ARNAO[6]以L-色氨酸为底物研究了植物褪黑素的生物合成:L-色氨酸在L-色氨酸脱羧酶(TrpDC)的催化下进行脱羧反应,生成色胺;色胺在色氨酸羟化酶(T5H)的作用下反应生成5-羟色胺;随后,5-羟色胺-N-乙酰转移酶(SNAcT)催化5-羟色胺生成N-乙酰-5-羟色胺;最后,N-乙酰-5-羟色胺可在N-乙酰-5-羟色胺甲基转移酶(AcSNMT)或羟基吲哚-O-甲基转移酶(HIOMT)的催化作用下生成褪黑素。目前,科学家已成功从植物中克隆出褪黑素合成关键酶基因TrpDC、T5H、AcSNMT和HIOMT,并进行了表达分析研究[7],但至今尚未克隆到植物SNAcT,这说明褪黑素在植物中的合成代谢过程比早期预料更为复杂。
褪黑素是一种即亲水又亲脂的小分子化合物,可在细胞内及细胞间自由穿梭,故至今植物中褪黑素的合成部位仍不明确[3]。近年,TAN等[8]提出了植物叶绿体和线粒体是褪黑素合成关键细胞器的假说,其假说建立的依据为:褪黑素是生物体中一种重要的抗氧化剂,而叶绿体和线粒体是植物活性氧(ROS)产生的主要部位,这两种细胞器产生的大量褪黑素可用来清除过剩的ROS,从而降低细胞面对的氧化压力。虽然证明了植物叶绿体和线粒体可以合成和代谢褪黑素,且可从线粒体中检测到褪黑素合成相关酶的活性;但更有说服力的褪黑素合成关键基因的组织定位及亚细胞精细定位分析尚未见报道。
2 园艺作物中褪黑素的含量及影响因素
VANTASSEL等[9]采用放射免疫沉淀结合气相色谱-质谱连用技术从牵牛花(Ipomoea nil)和番茄(Solanum lycopersicum)中鉴定到褪黑素,这是首例园艺作物中报道的植物源褪黑素。此后,科学家陆续从更多的园艺作物中成功分离并鉴定出了植物源褪黑素(表1)。通常,在这些园艺作物中,种子中的褪黑素含量最高,果实中的褪黑素含量最低。表1中褪黑素含量低于50 pg·g-1的食用器官有猕猴桃(Actinidiachinensis)、黄瓜(Cucumis sativus)、香蕉(Musa acuminata)、苹果(Malus domestica)和草莓(Fragaria ×ananassa)的果实;而以种子为食用器官的籽用芥菜(Brassica nigra)、杏(Prunus amygdalus)和向日葵(Helianthus annuus)中褪黑素含量相对较高。植物各器官中褪黑素含量通常符合如下规律:种子>叶>根>花>果实[6];并且同一组织中的褪黑素分布也不均匀,如褪黑素在羽扇豆(Lupinus micranthus)叶片中的含量表现为:叶尖>叶中>叶基[10]。褪黑素的这种分布梯度形式与生长素极为相似,这预示着两种吲哚胺类化合物在植物中可能具有相似或协同的生理功能[11]。
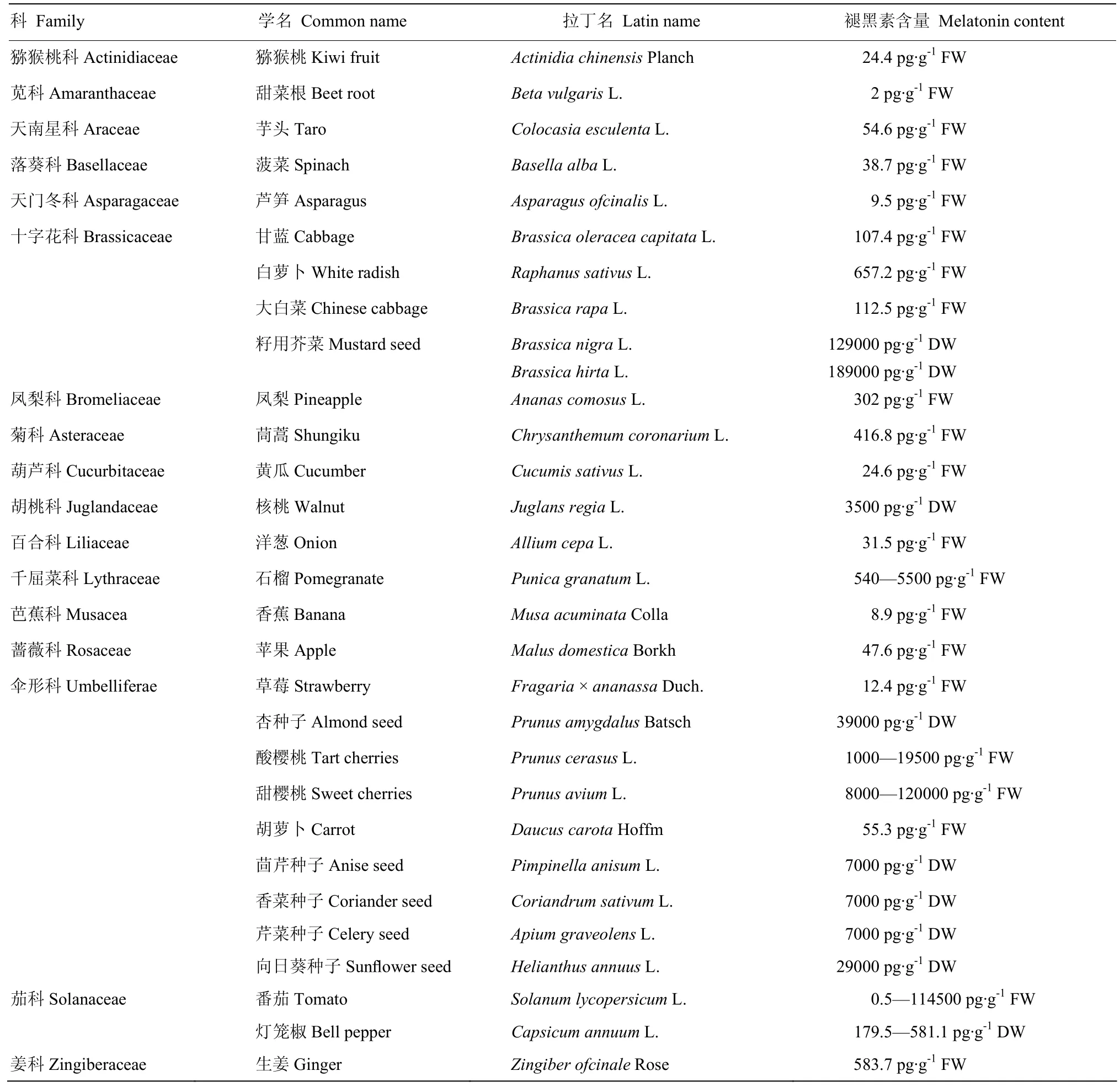
表1 园艺作物中的褪黑素含量Table 1 The content of melatonin in horticultural crops[6]
园艺作物中褪黑素含量受品种、生长环境、栽培方式、采收时间和加工方式等因素的影响。如樱桃(Prunus avium)中,‘Montmorency’(13.46 ng·g-1)的褪黑素含量是‘Balaton’(2.06 ng·g-1)的6倍[12];番茄中,‘Marbone’(114.5 ng·g-1)的褪黑素含量是‘Catalina’(4.1 ng·g-1)的28倍[13];草莓中,‘Festival’(11.26 ng·g-1)的褪黑素含量是‘Camarosa’(1.4 ng·g-1)的8倍[13];造成这种差异的主要因素是品种自身的基因型。不同年份的气候及环境因素也可影响园艺作物的褪黑素含量。如2010年收获的‘MARBONE’番茄较2009年同期收获的该品种番茄褪黑素含量提高了6倍;而2010年收获的‘Festival’草莓中褪黑素含量仅为2009年同期收获的该品种草莓的33%[13]。大田栽培的番茄褪黑素含量显著高于人工气候室栽培的番茄,而人工气候室培养的番茄褪黑素含量又显著高于离体培养的番茄[14]。对于大多数番茄品种而言,果实套袋遮阴可显著提高褪黑素含量,而辣椒(Capsicum annuum)套袋遮阴则降低褪黑素含量[15]。植物中褪黑素含量的动态变化受光周期和昼夜节律的调控,故一天当中的采收时间对产品器官中褪黑素的含量也是有影响的。虽然夜间采摘的樱桃褪黑素含量显著高于白天采摘的樱桃;但就白天采摘的樱桃而言,其果实中褪黑素含量的高峰值通常出现在温度最高、光照最强的14:00[16]。这表明褪黑素不仅是简单的响应光周期,其还参与了抵御光伤害的保护机制。另有研究表明,采收时期也可影响产品器官的褪黑素含量。在樱桃中褪黑素含量遵循绿熟期>转色期>完熟期的规律[16];而桑叶中褪黑素含量也表现为幼叶>功能叶>老叶[17];辣椒中褪黑素含量随着成熟也呈现先增后降的趋势[18]。由此可见,植物中褪黑素含量与哺乳动物类似,表现为幼嫩组织>成熟组织>衰老组织,说明褪黑素是一类保幼或衰老拮抗物质。园艺产品中褪黑素的含量还受采后加工工艺的影响。KIRAKOSYAN等[19]比较了冷冻樱桃、冻干粉、樱桃果汁和樱桃果干中褪黑素的含量,发现樱桃果汁和樱桃果干不含褪黑素,而冷冻樱桃和冻干粉中可检测到褪黑素,且冷冻樱桃中褪黑素含量显著高于樱桃冻干粉;这可能是因为褪黑素不稳定,在破坏细胞结构的加工过程中易降解。另外,果实经发酵制成的果酒中褪黑素含量往往高于鲜果,这可能是由于果酒中褪黑素不仅来源于原材料本身,还可在酿制过程中产生[20]。而以桑叶加工制成绿茶和黑茶,其成品茶中褪黑素含量仅为鲜叶的15%[17]。另外,中国多数名优茶品,如龙井茶、乌龙茶中均可检测到褪黑素的存在。因此,选择高褪黑素水平的品种,配以合适的栽培条件和栽培技术,适时采收,对维持园艺作物较高的褪黑素含量至关重要。对于以获得营养保健功能为主要目标的果蔬深加工产品,则需考虑适宜的加工技术以最大限度的保持产品中的天然褪黑素含量。但目前这一领域的研究仍然欠缺。
3 褪黑素在园艺作物生长、发育中的作用
3.1 褪黑素对园艺作物生长和产量形成的影响
HERNÁNDEZ-RUIZ等[11]首次在植物中提出褪黑素可能是一种类似激素的生长调节物质的观点:因为褪黑素可促进离体羽扇豆下胚轴的生长,其在植物组织中的分布及作用形式与吲哚乙酸(Indole-3-acetic acid,IAA)类似;该结论在多种植物中得到验证[21]。化学结构上褪黑素的侧链没有IAA的羧基,其促进生长的活性约为IAA作用效果的10%—50%[11],且褪黑素与IAA受体无结合位点,表明褪黑素和IAA虽共为吲哚胺类化合物,但信号调控机理却存在较大的差异[3]。由于植物中尚未发现褪黑素的特异结合受体,褪黑素尚不能定义为一种植物激素。尽管如此,越来越多的研究开始专注于探索并确定褪黑素在植物体内所执行的功能和信号转导网络。
水稻(Oryza sativa)超表达动物SNAcT可显著促进秧苗生长,并使其表现出花期延迟和产量降低的特点[22]。这与本文第2节中提到的“褪黑素是一类保幼或衰老拮抗物质”的观点相吻合,说明褪黑素具有促进营养生长,抑制生殖生长的作用。而用50 µmol·L-1褪黑素处理大豆(Glycine max),可显著促进大豆植株生长,并增加产量[23]。向葡萄(Vitis vinifera)幼果喷施100 mg·L-1的褪黑素溶液,可引起葡萄果实内源褪黑素积累,促进果实膨大[24]。由此可见,褪黑素对作物的生长有促进作用;不同的是,内源褪黑素含量的增加降低了水稻产量,而外源褪黑素处理却增加了大豆和葡萄的产量。褪黑素对作物产量的影响看似矛盾,但笔者分析认为:首先,大豆试验采用苗期褪黑素处理,而在产量形成期并未添加褪黑素;而转基因水稻的褪黑素在整个生育期均处于较高水平,故大豆表现为增产而水稻表现为减产。其次,就引文图中的表型差异来看,褪黑素在大豆试验中促进植株生长的效果要优于水稻;而营养体的充分生长为生殖生长提供了更为充足的光合产物。第三,褪黑素抑制产量形成的本质在于抑制生殖生长,即种子的形成;而葡萄的浆果是由子房发育而来,与番茄等浆果类作物相同,子房在果实发育前期的膨大需要依赖IAA的刺激以形成强库获得营养,而褪黑素与IAA作用效果相似,这可能是褪黑素促进葡萄果实膨大的具体机制。第四,低浓度褪黑素(10 µmol·L-1)可促进糖类代谢、光合作用和蔗糖在韧皮部的装载与运输,从而促进植株生长;而高浓度的褪黑素(1 mmol·L-1)则抑制韧皮部蔗糖装载,使叶片积累过剩的蔗糖、己糖和淀粉,反馈抑制了叶片光合作用,抑制植株的生长[25]。褪黑素影响植株生长和光合作用的浓度效应在樱桃中也获得证实[26]。超表达SNAcT类似于持续补充褪黑素,而外源施用则是短期补充褪黑素,即形成了褪黑素供应量上的差异。综上所述,这4点因素可能是褪黑素对产量影响差异的主要原因。
3.2 褪黑素对园艺作物成熟、衰老和贮藏保鲜的调控作用
成熟、衰老和贮藏保鲜是园艺产品生产中相互矛盾的过程。但日渐增多的研究表明褪黑素可灵活应用于园艺作物成熟、衰老和贮藏保鲜调控。采用50 µmol·L-1和100 µmol·L-1的褪黑素预处理番茄,均可促进番茄的成熟[27]。其调控机制为:褪黑素激活ACS4表达,增强了乙烯的合成,通过NR、ETR4、EILs和ERF2等信号转导途径,促进PSY1表达合成番茄红素,使番茄转色;调控TBG4、PG2A、Exp1、XTH5和PE1表达降解细胞壁,软化果实;调控PIPs表达控制果实失水;调控ADH2和AAT表达促进糖分转化;由此形成了促进番茄成熟的表型特征。类似的研究结果在葡萄中也得到了证实[24]。在苹果果实成熟过程中,褪黑素与丙二醛含量的变化始终呈负相关,表明褪黑素在果实成熟过程中的主要作用是消除呼吸跃变产生的ROS,以维持细胞内的氧化还原平衡[28]。但也有研究表明,不同浓度的褪黑素在处理不同物种、不同熟度的果实时可能会得到截然相反的结果。例如:以100 µmol·L-1褪黑素处理完全成熟的桃(Amygdalus persica),可降低果实的呼吸速率,提高抗坏血酸含量和抗氧化酶活性,抑制糖分通过呼吸作用的降解,并减少ROS积累和膜脂过氧化反应,增加果实硬度和鲜度,延长了果品的货架期[29]。
拟南芥(Arabidopsis thaliana)在经历幼苗、成熟、衰老的过程中内源褪黑素含量不断上升,且外源喷施褪黑素可显著抑制拟衰老进程;另外,发现褪黑素可降低与IAA信号拮抗的AXR3和IAA17表达,而IAA17可诱导衰老相关基因SEN4和SAG12表达,故褪黑素可通过降低IAA17及衰老相关基因的表达抑制植物的衰老进程[30]。另外,1 mmol·L-1褪黑素可显著抑制大麦(Hordeum vulgare)叶片的衰老和叶绿素降解;认为褪黑素抑制叶片衰老的主要作用机理在于协同激动素(Kinetin,KT)并拮抗脱落酸(Abscisic Acid, ABA)[31]。且长期浇灌褪黑素亦可显著抑制苹果叶片的衰老;通过蛋白质组学分析发现,褪黑素可抑制苹果叶片质体中的绝大多数水解酶活性,而这些水解酶参与了大分子蛋白的水解、氧化还原与胁迫响应、转录调控、光合作用及其他衰老相关进程[32]。
3.3 褪黑素对园艺作物根系发育的影响
褪黑素可促进根系的发生、伸长、促进侧根和不定根发育。0.1 µmol·L-1褪黑素可促进籽用芥菜根系伸长,而100 µmol·L-1褪黑素则抑制籽用芥菜根系伸长,这与IAA对植物根系发育的低促高抑现象相一致;且褪黑素可诱导籽用芥菜根系积累IAA,说明褪黑素和IAA间存在着相互影响[33]。外源添加500 µmol·L-1褪黑素可显著促进黄瓜侧根的发生;并且转录组分析表明,褪黑素可引起121个基因的上调表达和196个基因的下调表达;通过GO和Pathway富集分析,ZHANG等[34]认为褪黑素促进黄瓜侧根发育的主要机制在于其可激活根系发生相关激素和转录因子通路的活性,并降低根系发生过程中呼吸作用产生的ROS伤害。另外,研究还发现,外源添加50 µmol·L-1褪黑素可显著促进番茄幼茎的周皮部及新生不定根的尖端积累一氧化氮(Nitric oxide,NO),加速不定根再生;这说明NO作为褪黑素的下游信号参与了不定根再生的调控;且NO在褪黑素诱导的不定根发生过程中担当了褪黑素和IAA的共同下游信号,促进了IAA的合成、极性运输与激素信号感知[35]。
尽管褪黑素在影响植物根系发育过程中与IAA关系密切,但PELAGIO-FLORES等[36]认为褪黑素调控根系形态建成不依赖于IAA信号。另外,在肯定褪黑素能够促进主根伸长和侧根生长的基础上,利用IAA响应标签DR5:uidA证明了褪黑素与IAA在根系发育过程中并没有信号交联,而是两个相对独立的信号转导途径。由此可见,褪黑素和IAA这两种化学结构相似的吲哚胺类化合物间的作用关系极为复杂。
4 褪黑素在园艺作物胁迫应答中的作用
4.1 褪黑素对非生物胁迫的抗性调控
园艺生产中光能的高效利用及光对植株生长、发育、产量和品质的形成一直是科学研究的核心问题。采用100 mmol·L-1和500 mmol·L-1的褪黑素处理短日照植物可显著抑制短日条件下植株的开花率,且只有在光照处理结束前或者是黑暗处理的前半段时间施加褪黑素才有效[37]。这暗示着褪黑素变化水平受昼夜节律的影响,并可调控植物的光周期,进而影响开花的一些早期步骤。另外,在辣椒栽培中采用套袋遮阴技术可使辣椒果实的褪黑素水平显著降低,这说明太阳辐射可引起褪黑素含量的上升[15]。在小麦(Triticum aestivum)中的研究也表明,光照条件下叶片中的褪黑素含量显著高于黑暗条件下;同时,光照处理能显著提升叶片中褪黑素合成前体的积累[38]。另外,光质也可影响植物内源褪黑素的含量,表现为红光处理>蓝光处理>白光处理[39]。光对褪黑素的诱导效应暗合了“叶绿体是褪黑素合成关键细胞器的假说[8]”,其依据为:辣椒果皮及植物叶片富含叶绿体,而光照在促进植物光合作用的同时不可避免的产生过剩光能,致使自由电子与O2的结合形成ROS;另外,红光和蓝光等单一光质可能会特异性的增大光系统I(Photosystem I,PSI)或光系统II(Photosystem II,PSII)光能向电能的转化效率,进而增加PSII和PSI间电子传递的不平衡性,为自由电子与O2结合生成ROS创造了条件;而褪黑素是一种抗氧化剂,故光诱导叶绿体产生大量褪黑素来清除过剩的ROS以降低细胞面对的氧化压力是有一定生物学意义的。然而,目前尚无系统的光质和光强对植物褪黑素含量的影响及褪黑素缓解植物强光伤害的直接证据。
温度是影响园艺作物,尤其是蔬菜作物反季节栽培的关键环境因子,不适宜的温度往往会导致园艺作物大幅减产、品质劣变,严重时甚至绝产绝收。为此,园艺科研工作者也一直致力于研究植物的温度适应机制及高效、安全的植物生长调节剂以应对突发的温度变化。多数植物经高温胁迫后,褪黑素合成关键基因的表达量显著上升,表明褪黑素在植物抵抗高温胁迫中具有重要作用[40],且褪黑素可诱导高温胁迫下热激因子和热激蛋白的表达,并提高作物的存活率[41]。在黄瓜中的一些研究表明:外源添加褪黑素可提高高温胁迫下黄瓜幼苗抗坏血酸代谢活性[42],增强ROS清除能力[43],提高氮代谢能力[44],促进高温逆境下黄瓜幼苗的生长。在褪黑素调控植物耐冷性研究领域,LEI等[45]以胡萝卜(Daucus carota)为试材,发现褪黑素可提高低温胁迫下胡萝卜的细胞活力,增强细胞膜结构的稳定性,抑制细胞程序化死亡产生的DNA有序降解,这是褪黑素提高植物耐冷性的首例报道。POSMYK等[46]研究表明,渗透胁迫能提高低温胁迫下黄瓜种子的发芽率;同时,渗透胁迫强度与黄瓜种子发芽过程中的内源褪黑素含量呈显著正相关。进一步研究表明,适宜的渗透胁迫诱导的内源褪黑素提升有利于清除低温胁迫诱导的ROS,稳定膜结构;而高渗胁迫诱导的过量内源褪黑素则破坏了蛋白质的氧化平衡态,降低了黄瓜幼芽的低温抗性。将人类的SNAcT在植物中异源表达可促进植物内源褪黑素的积累,并赋予植物更强的耐冷性[47]。外源褪黑素提高植物耐冷性的研究在多类植物中亦有报道。以200 µmol·L-1褪黑素处理甜瓜(Cucumis melo)幼苗可显著缓解低温胁迫诱导的生长抑制,提高低温胁迫下氮代谢关键酶活性,增强氮素吸收和同化能力,并提高脯氨酸和可溶性糖等渗透调节物质积累,降低细胞膜损伤[48]。另外,外源褪黑素还可诱导一系列低温响应因子(CBFs、DREBs、COR15a、CAMTA1、ZATs和SIZ1)的表达[49-50],这表明褪黑素具有响应低温并转录激活相关代谢进程的生理功能。且褪黑素处理植物可以获得类似低温驯化的效果:稳固低温胁迫下的细胞膜结构,增加抗氧化酶活性和PSII运行活性,并增强与低温适应相关的糖酸代谢[51]。
园艺作物栽培具有需水量大的特点,水分胁迫或生理性干旱往往会不同程度的影响作物的生长和发育,并对产量构成极显著的影响。100 µmol·L-1褪黑素处理黄瓜幼苗可显著提高渗透胁迫下黄瓜幼苗的光合速率,抑制叶绿素降解,并提高抗氧化酶活性,进而提高黄瓜幼苗的抗旱性[52]。中国很多干旱/半干旱地区的果园长期处于缺水状态,果树虽能生长,但却影响其产量。WANG等[53]研究表明,外源喷施褪黑素可抑制长期干旱胁迫下苹果叶片的衰老,并缓解其干旱症状,提高叶片光能转化效率和碳同化量,其调控机制主要是褪黑素能激活苹果自身的抗氧化代谢,清除过剩的ROS,保持较高的细胞活力。ZUO等[54]从耐旱苹果砧木(Malus zumi)中克隆了受干旱诱导的褪黑素合成关键基因AcSNMT,并在拟南芥中进行异源表达。亚细胞定位分析表明,AcSNMT主要定位在细胞核和细胞膜上,其控制合成的褪黑素可有效清除干旱诱导的ROS,并提高干旱胁迫下转基因植株的生长势和成活率。MENG等[55]在葡萄中也验证了褪黑素对干旱胁迫下ROS代谢的调控作用及抗旱机制。此外,还发现褪黑素能保护干旱胁迫下葡萄叶绿体膜结构和基粒片层结构,增加叶片厚度和栅栏组织紧实度,并调控气孔关闭以降低水分散失。
全世界约有8.31×108hm2盐碱地,占世界耕地面积的10%,严重制约着农业生产[56]。此外,设施园艺也因环境密闭,土壤缺乏雨水淋溶,施肥过多等因素面临着土壤次生盐渍化问题。但适度盐碱可显著提高冬枣(Ziziphus jujuba)、番茄、葡萄等园艺作物的产品品质;比如山东东营等轻度盐碱地区也形成了一批地方名优果品。因此,如何提高园艺作物的耐盐碱性成为盐碱地区发展特色园艺产业的关键环节。LI等[57]研究表明,以0.1 µmol·L-1褪黑素预处理苹果幼苗可显著缓解盐胁迫对苹果幼苗生长、光合作用的抑制;其缓解机理主要是外源褪黑素提高了苹果抗氧化酶活性,清除了盐胁迫诱导的ROS;此外,外源褪黑素还能激活Na+-K+反向转运蛋白的基因表达,提高盐胁迫下的K+/Na+。在柑橘(Citrus reticulata)中的研究也表明,外源添加1 µmol·L-1褪黑素能缓解盐胁迫诱导的叶片失绿症状,降低根、茎、叶中的Na+积累,提高酚类、抗坏血酸和谷胱甘肽等还原性物质的含量,促进相关抗氧化酶活性,缓解盐胁迫诱导的氧化伤害[58]。在黄瓜中,外源褪黑素不仅能提高其耐盐性[59],还能提高其硝酸盐耐受性[60]。除发现褪黑素能提高盐胁迫下黄瓜的抗氧化系统运行活性外,还发现褪黑素能上调赤霉素(Gibberellin,GA)信号,并抑制ABA信号,从而促进盐胁迫下黄瓜种子的发芽率。盐胁迫48 h即可诱导向日葵內源褪黑素的积累,并且盐胁迫诱导褪黑素积累在根系维管束和皮质间的分布也呈现区域化特点,如向日葵子叶等富含油脂的组织中褪黑素含量显著高于其他组织[61]。且外源褪黑素能促进盐胁迫下向日葵的下胚轴伸长和根系生长,在一定程度上缓解盐胁迫对向日葵幼苗根系发育的抑制。另外,研究表明,外源添加0.5 µmol·L-1褪黑素能显著提高碱性盐胁迫下番茄幼苗的生物量,保护光合机构,促进抗氧化系统运行活性,平衡番茄植株的Na+-K+代谢等[62]。这些外源褪黑素提高园艺作物耐盐碱性的基础研究为盐碱地区园艺作物栽培技术的革新提供了理论支撑。
4.2 褪黑素对生物胁迫的抗性调控
植物生长发育过程中经常遭受真菌、细菌、病毒和害虫等生物的侵害。在受到生物胁迫时,植物会产生水杨酸(Salicylic acid,SA)、茉莉酸(Jasmonic acid,JA)、乙烯(Ethylene,ETH)和ABA等内源激素调控应答反应。近年来研究表明,褪黑素能通过与SA、JA等所调控的生物胁迫信号传导途径互作,调控植物对生物胁迫的抗性。
用于研究细菌性病害致病机理的模式菌株Pseudomonas syringe pv. tomato DC3000(DC3000)侵染植物可诱导内源褪黑素积累,表明褪黑素在植物抗病响应中可能发挥重要作用[63-64]。而外源喷施褪黑素可诱导植物病程相关蛋白的基因表达,以及由SA和ETH信号激活的防御相关基因的表达,且显著降低病变程度;而外源褪黑素对SA和ETH信号控制的npr1、ein2和mpk6突变体无抗病诱导效果,说明褪黑素与SA和Eth信号存在密切关系[63]。LEE等[64]研究发现拟南芥褪黑素合成关键基因SNAcT突变后对DC3000表现为敏感型,且该突变体中褪黑素和SA含量及防御相关基因(PR1、ICS1和PDF1.2)表达量显著低于野生型植株。而外源添加褪黑素虽无法提高SA缺陷型突变体(nahG)的抗病性,却可促进snat突变体防御基因的表达;另外,外源褪黑素可促进病程相关蛋白(PR1)的抑制子NPR1由细胞质转移到细胞核,这些证据均说明褪黑素作为SA的上游信号激活植物的抗病反应链。SHI等[65]研究表明,DC3000侵染拟南芥后,能促进褪黑素和NO含量的提高,而外源褪黑素也能单独诱导NO的产生;并且外源褪黑素与NO处理拟南芥均能增强其抗病性,并激活与SA信号相关的防御基因的表达。这说明NO作为褪黑素的下游信号,担当第二信使的角色,沟通褪黑素与SA之间的信号网络,激活植物的抗病调控系统。
植物除SA信号介导的抗病机制外,还包括表皮组织、细胞壁等组成的机械抗病机制、苯丙氨酸途径介导的抗病机制等。ZHAO等[66]研究指出,外源褪黑素能够下调表达拟南芥的转化酶抑制因子,激活细胞壁转化酶活性,促进蔗糖代谢,积累六碳糖。而褪黑素诱导的细胞壁转化酶活性能通过合成纤维素、木糖和半乳糖来增加细胞壁的强度并促进胼胝质在细胞壁的沉积,褪黑素通过改善细胞壁组成和结构提高了植物的抗病性。另外,YIN等[67]发现,外源褪黑素能降低由盘二孢属(Marssonina)引起的苹果斑点病,其主要调控机理为褪黑素能维持发病后细胞内的氧化还原状态相对平衡,提高苯丙氨酸解氨酶、多酚氧化酶、几丁质酶、葡聚糖酶等相关病程防御酶类的活性。
5 褪黑素调控植物生长发育和抗逆性的信号转导网络
图1显示,褪黑素促进植物生长主要通过增强IAA的生物合成,促进细胞的伸长和膨大,表现为诱导根系生长、侧根和不定根发生、果实膨大等。虽然共为吲哚胺类化合物,但褪黑素与IAA却不共用一套信号转导网络[36]。褪黑素能抑制生长素拮抗转录因子IAA17的表达,而IAA17能阻断生长素信号[30];这相当于褪黑素间接放大了IAA信号。就这一点而言,褪黑素和IAA间并非绝对孤立,而是存在信号对话的。且笔者研究也表明,褪黑素在诱导番茄不定根发生过程中具有促进IAA极性运输和感知的作用[35]。另外,褪黑素在种子发芽过程中可诱导GA合成并抑制ABA的合成[59]。GA的生理功效主要为促进生长和延迟衰老,而ABA则是衰老诱导类激素。但有关褪黑素、GA和ABA之间的关系目前仅限于发芽试验,尚未有更多的结论支持其调控机制。结合褪黑素的抗氧化功能和IAA17抑制功能在植物抗衰老中的研究[30-31],笔者认为,褪黑素延缓叶绿素降解,维持叶片组织内部较好的氧化还原平衡,协同促进衰老拮抗类激素的功能是其抑制植物叶片衰老的主要调控机制。而健康的叶片能更好的进行光合作用,这又从碳营养的角度解释了褪黑素促进植物生长,提高产量的生理机制。另一个有趣的问题是褪黑素能诱导番茄果实成熟过程中ETH的释放,促进果实成熟,并提高商品品质[27]。然而,ETH也是植物中的衰老诱导类激素,这似乎与前文提到的观点存在矛盾。笔者推测,褪黑素在合成上的多途径特性可能使其具有发育时期及组织器官的时空特异性,这需要从启动子元件的构成进行系统分析,并辅以试验验证。
环境胁迫和激素等多种刺激能够诱导植物细胞产生多胺(Polyamine,PAs)和NO。而PAs和NO均为具有较强反应活性的自由基,作为两个活跃的小分子信号物质,他们都容易得失电子。褪黑素能诱导低温胁迫下胡萝卜多胺的合成,并增强其抗寒性[45]。而褪黑素在诱导抗病性[65]、抗碱性[68]和生根[35]过程中均产生NO,且需要NO作为下游信号。笔者近年研究发现,在番茄系统诱导的多效抗性上,NO是PAs的下游信号,其能激活包含抗氧化系统在内的多条植物抗逆信号通路[69]。这样,就组成了目前的‘褪黑素→PAs→NO→SA→抗病基因→抗病性获得’和‘褪黑素→PAs→NO→抗氧化系统→ROS清除→非生物胁迫抗性获得’两条信号通路。当然,褪黑素对细胞壁组织的机械强化[66],褪黑素与ROS之间的接触反应[70]也为植物抗逆性状的获得做出了贡献。另外,褪黑素可直接通过转录因子激活调控逆境相关功能基因的表达,如衰老交联基因(SAGs)控制的衰老[31];C-重复绑定因子(CBFs)和低温响应基因(COR15a)控制的耐冷性[49];热激因子(HSFAs)和热激蛋白(HSPs)控制的耐热性[41];干旱响应原件绑定因子(DREBs)和干旱胁迫抗性基因(CAMTA1)控制的耐旱性[49];质膜Na+/H+反向转运体(SOS)、液泡膜Na+/H+反向转运体(NHX)和Na+转运体(HKT)控制的耐盐碱性等[68]。综上所述,褪黑素的这些信号转导网络通路系统化的增强了植物的逆境抵抗能力,提高了逆境条件下植株的存活率和生长势。

图1 褪黑素调控植物生长发育和抗逆性的信号转导网络Fig. 1 The signal transduction network of melatonin in plant growth, development and stress tolerance
6 结语与展望
虽然褪黑素广泛存在于植物组织,但是褪黑素在植物体内的含量仍然极低,且具有明显的组织特异性。中国饮食文化中常用的煎、炸、炒、蒸、煮等工艺均不利于食物中褪黑素的保存,故以褪黑素营养获得为主的食物源主要集中在适于鲜食的果蔬类园艺作物。但褪黑素在植物体内是具有类似激素活性的物质,利用基因编辑技术全面提升植株褪黑素含量可能会破坏植物自身褪黑素代谢的平衡,对植株的生长、发育带来一些不良影响。据此,笔者提出两点建议用于提升园艺作物褪黑素含量:①应用组织特异型启动子或诱导型启动子结合褪黑素合成关键基因实现园艺作物食用器官或特定发育时期的诱导表达。如利用果实特异启动子可使褪黑素合成关键基因在果实中表达,在提高果实褪黑素含量的基础上减少了褪黑素过量积累对植株的负面影响;再如利用化学诱导表达系统TetR结合褪黑素合成关键基因,在园艺产品采收前一段时间对其进行诱导表达,可提高采收后产品的褪黑素含量。②利用拟南芥突变体库挖掘褪黑素过量积累型的突变体,定位该关键基因,采用CRISPRCas9对园艺作物进行靶向基因编辑,创制富含褪黑素的园艺新种质。
褪黑素的研究对全球生态环境的改善有促进作用。在自然环境压力巨大、生物胁迫频繁爆发的园艺生产系统,褪黑素促生长和抗逆调控机理的研究及外源褪黑素在促进作物生长和提高抗性的成功案例必定会为园艺作物高产、优质生产做出重大贡献。而褪黑素作为一种新型生长调节物质,具有高效、环保的特点,它的开发和利用可以大大促进园艺作物的健康生长,提高肥料利用率,降低病虫害的发生及农药用量,可在中国化肥、农药使用零增长方案实施过程中发挥重要的作用,在促进园艺产业健康发展方面具有较大的开发潜力。
[1] LERNER A B, CASE J D, TAKAHASHI Y, LEE T H, MORI W. Isolation of melatonin, the pineal gland factor that lightens melanocytes. Journal of the American Chemical Society, 1958, 80(10): 2587-2587.
[2] BALZER I, HARDELAND R. Photoperiodism and effects of indoleamines in a unicellular alga, Gonyaulax polyedra. Science, 1991, 253(5021): 795-797.
[3] ARANO M B, HEMANDEZ-RUIZ J. Melatonin in plants: more studities are necessary. Plant Signaling and Behavior, 2007, 2: 381-382.
[4] MURCH S J, KRISHNARAJ S, SAXENA P K. Tryptophan is a precursor for melatonin and serotonin biosynthesis in in vitro regenerated St. John's wort (Hypericum perforatum L. cv. Anthos) plants. Plant Cell Reports, 2007, 19(7): 698-704.
[5] POSMYK M M, JANAS K M. Melatonin in plants. Acta Physiologiae Plantarum, 2009, 31(1): 1-11.
[6] ARNAO M B. Phytomelatonin: discovery, content, and role in plants. Advances in Botany, 2014, e815769(2).
[7] PARK W J. Melatonin as an endogenous plant regulatory signal: debates and perspectives. Journal of Pineal Research, 2011, 54(3): 143-149.
[8] TAN D X, MANCHESTER L C, LIU X, ROSALES-CORRAL S A, CASTROVIEJO D A, REITER R J. Mitochondria and chloroplasts as the original sites of melatonin synthesis: a hypothesis related to melatonin’s primary function and evolution in eukaryotes. Journal of Pineal Research, 2013, 54(2): 127-138.
[9] VANTASSEL D L, LI JA, ONEILL S D. Melatonin-identification of a potential dark signal in plants. Plant Physiology, 1993, 102: 117.
[10] HERNÁNDEZ-RUIZ J, AMAO M B. Distribution of melatonin in different zones of lupin and barley plants at different ages in the presence and absence of light. Journal of Agricultural and Food Chemistry, 2008, 56(22): 10567-10573.
[11] HERNÁNDEZ-RUIZ J, CANO A, AMAO M B. Melatonin: a growth-stimulating compound present in lupin tissues. Planta, 2004, 220(1): 140-144.
[12] BURKHARDT S, TAN D X, MANCHESTER L C, HARDELAND R, REITER R J. Detection and quantification of the antioxidant melatonin in Montmorency and Balaton tart cherries (Prunus cerasus). Journal of Agricultural and Food Chemistry, 2001, 49(10): 4898-4902.
[13] STÜRTZ M, CEREZO A B, CANTOS-VILLAR E, GARCIAPARRILLA M C. Determination of the melatonin content of different varieties of tomatoes (Lycopersicon esculentum) and strawberries(Fragaria ananassa). Food Chemistry, 2011, 127(3): 1329-1334.
[14] ARANO M B, HEMANDEZ-RUIZ J. Growth conditions influence the melatonin content of tomato plants. Food Chemistry, 2013, 138(2-3): 1212-1214.
[15] RIGA P, MEDINA S, GARCIA-FLORES L A, GIL-IZQUIERDO Á. Melatonin content of pepper and tomato fruits: Effects of cultivar and solar radiation. Food Chemistry, 2014, 156(4): 347-352.
[16] ZHAO Y, TAN D X, LEI Q, CHEN H, WANG L, LI Q T, GAO Y, KONG J. Melatonin and its potential biological functions in the fruits of sweet cherry. Journal of Pineal Research, 2012, 55(1): 79-88.
[17] POTHINUCH P, TONGCHITPAKDEE S. Melatonin contents in mulberry (Morus spp.) leaves: Effects of sample preparation, cultivar, leaf age and tea processing. Food Chemistry, 2011, 128(2): 415-419.
[18] KORKMAZ A, DEGER O, CUCI Y. Profiling the melatonin content in organs of the pepper plant during different growth stages. Scientia Horticulturae, 2014, 172(172): 242-247.
[19] KIRAKOSYAN A, SEYMOUR E M, LLANES D E U, KAUFMAN P B, BOLLING S F. Chemical profile and antioxidant capacities of tart cherry products. Food Chemistry, 2009, 115(1): 20-25.
[20] RODRIGUEZ-NARANJO M I, GIL-IZQUIERDO A, TRONCOSO A M, CANTOS-VILLAR E, GARCIA-PARRILLA M C. Melatonin is synthesised by yeast during alcoholic fermentation in wines. Food Chemistry, 2011, 126(4): 1608-1613.
[21] HERNÁNDEZ-RUIZ J, CANO A, ARNAO M B. Melatonin acts as a growth-stimulating compound in some monocot species. Journal of Pineal Research, 2005, 39(2): 137-142.
[22] BYEON Y, BACK K. An increase in melatonin in transgenic rice causes pleiotropic phenotypes, including enhanced seedling growth, delayed flowering, and low grain yield. Journal of Pineal Research, 2014, 56(4): 408-414.
[23] WEI W, LI Q T, CHU Y N, REITER R J, YU X M, ZHU D H, ZHANG W K, MA B, LIN Q, ZHANG J S, CHEN S Y. Melatonin enhances plant growth and abiotic stress tolerance in soybean plants. Journal of Experimental Botany, 2014, 66(3): 695-707.
[24] MENG J F, XU T F, SONG C Z, YU Y, HU F, ZHANG L, ZHANG Z W, XI Z M. Melatonin treatment of pre-veraison grape berries to increase size and synchronicity of berries and modify wine aroma components. Food Chemistry, 2015, 185: 127-134.
[25] ZHAO H, SU T, HUO L, WEI H, JIANG Y, XU L, MA F. Unveiling the mechanism of melatonin impacts on maize seedling growth: sugar metabolism as a case. Journal of Pineal Research, 2015, 59(2): 255-266.
[26] SARROPOULOU V, DIMASSI-THERIOU K, THERIOS I, KOUKOURIKOU-PETRIDOU M. Melatonin enhances root regeneration, photosynthetic pigments, biomass, total carbohydrates and proline content in the cherry rootstock PHL-C (Prunus avium × Prunus cerasus). Plant Physiology and Biochemistry, 2012, 61: 162-168.
[27] SUN Q, ZHANG N, WANG J, ZHANG H, LI D, SHI J, LI R, WEEDA S, ZHAO B, REN S, GUO Y D. Melatonin promotes ripening and improves quality of tomato fruit during postharvest life. Journal of Experimental Botany, 2014, 66(3): 657-668.
[28] LEI Q, WANG L, TAN D X, ZHAO Y, ZHENG X D, CHEN H, LI Q T, ZUO B X, KONG J. Identification of genes for melatonin synthetic enzymes in ‘Red Fuji’ apple (Malus domestica Borkh.cv.Red) and their expression and melatonin production during fruit development. Journal of Pineal Research, 2013, 55(4): 443-451.
[29] GAO H, ZHANG Z K, CHAT H K, CHEN N, YANG Y, WANG D N, YANG T, CAO W. Melatonin treatment delays postharvest senescence and regulates reactive oxygen species metabolism in peach fruit. Postharvest Biology and Technology, 2016, 118: 103-110.
[30] SHI H, REITER R J, TAN D X, CHAN Z. INDOLE-3-ACETIC ACID INDUCIBLE 17 positively modulates natural leaf senescence through melatonin-mediated pathway in Arabidopsis. Journal of Pineal Research, 2015, 58(1): 26-33.
[31] ARANO M B, HERNANDEZ-RUIZ J. Protective effect of melatonin against chlorophyll degradation during the senescence of barley leaves. Journal of Pineal Research, 2009, 46(1): 58-63.
[32] WANG P, SUN X, XIE Y, LI M, CHEN W, ZHANG S, LIANG D, MA F. Melatonin regulates proteomic changes during leaf senescence in Malus hupehensis. Journal of Pineal Research, 2014, 57(3): 291-307.
[33] CHEN Q, QI W B, REITER R J, WEI W, WANG B M. Exogenously applied melatonin stimulates root growth and raises endogenous indoleacetic acid in roots of etiolated seedlings of Brassica juncea. Journal of Plant Physiology, 2009, 166(3): 324-328.
[34] ZHANG N, ZHANG H J, ZHAO B, SUN Q Q, CAO Y Y, LI R, WU X X, WEEDA S, LI L, REN S, REITER R J, GUO Y D. The RNA-seq approach to discriminate gene expression profiles in response to melatonin on cucumber lateral root formation. Journal of Pineal Research, 2014, 56(1): 39-50.
[35] WEN D, GONG B, SUN S, LI S, WANG X, WEI M, YANG F, LI Y, SHI Q. Promoting roles of melatonin in adventitious root development of Solanum lycopersicum L. by regulating auxin and nitric oxide signaling. Frontiers in Plant Science, 2016, 7(925): 718.
[36] PELAGIO-FLORES R, MUNOZ-PARRA E, ORTIZ-CASTRO R, LOPEZ-BUCIO J. Melatonin regulates Arabidopsis root systemarchitecture likely acting independently of auxin signaling. Journal of Pineal Research, 2012, 53(3): 279-288.
[37] KOLAR J, JOHNSON H J, MACHACKOVA I. Exogenously applied melatonin (N-acetyl-5-methoxytryptamine) affects flowering of the short-day plant Chenopodium rubrum. Physiology Plantarum, 2003, 118(4): 605-612.
[38] BYEON Y, PARK S, KIM Y S, PARK D H, LEE S, BACK K. Light-regulated melatonin biosynthesis in rice during the senescence process in detached leaves. Journal of Pineal Research, 2012, 53(1): 107-111.
[39] AFREEN F, ZOBAYED S M A, KOZAI T. Melatonin in Glycyrrhiza uralensis: response of plant roots to spectral quality of light and UV-B radiation. Journal of Pineal Research, 2006, 41(2): 108-115.
[40] BYEON Y, BACK K. Melatonin synthesis in rice seedlings in vivo is enhanced at high temperatures and under dark conditions due to increased serotonin N-acetyltransferase and N-acetylserotonin methyltransferase activities. Journal of Pineal Research, 2014, 56: 189-195.
[41] SHI H, TAN D X, REITER R J, YE T, YANG F, CHAN Z. Melatonin induces class A1 heat-shock factors (HSFA1s) and their possible involvement of thermotolerance in Arabidopsis. Journal of Pineal Research, 2015, 58(3): 335-342.
[42] 徐向东, 孙艳, 郭晓芹, 孙波, 张坚. 褪黑素对高温胁迫下黄瓜幼苗抗坏血酸代谢系统的影响. 应用生态学报, 2010, 21(10): 2580-2586.
XU X D, SUN Y, GUO X Q, SUN B, ZHANG J. Effects of exogenous melatonin on ascorbate metabolism system in cucumber seedlings under high temperature stress. Chinese Journal of Applied Ecology, 2010, 21(10): 2580-2586. (in Chinese)
[43] 徐向东, 孙艳, 孙波, 张坚, 郭晓芹. 高温胁迫下外源褪黑素对黄瓜幼苗活性氧代谢的影响. 应用生态学报, 2010, 21(5): 1295-1300.
XU X D, SUN Y, SUN B, ZHANG J, GUO X Q. Effects of exogenous melatonin on active oxygen metabolism of cucumber seedlings under high temperature stress. Chinese Journal of Applied Ecology, 2010, 21(5): 1295-1300. (in Chinese)
[44] 赵娜, 孙艳, 王德玉, 郑俊鶱. 外源褪黑素对高温胁迫条件下黄瓜幼苗氮代谢的影响. 植物生理学报, 2012, 48(6): 557-564.
ZHAO N, SUN Y, WANG D X, ZHENG J X. Effects of exogenous melatonin on nitrogen metabolism in cucumber seedlings under high temperature stress. Plant Physiology Journal, 2012, 48(6): 557-564. (in Chinese)
[45] LEI X Y, ZHU R Y, ZHANG G Y, DAI Y R. Attenuation of coldinduced apoptosis by exogenous melatonin in carrot suspension cells: the possible involvement of polyamines. Journal of Pineal Research, 2004, 36(2): 126-131.
[46] POSMYK M M, BALABUSTA M, WIECZOREK M, SLIWINSKA E, JANAS K M. Melatonin applied to cucumber (Cucumis sativus L.) seeds improves germination during chilling stress. Journal of Pineal Research, 2009, 46(2): 214-223.
[47] KANG K, LEE K, PARK S, KIM Y S, BACK K. Enhanced production of melatonin by ectopic overexpression of human serotonin N-acetyltransferase plays a role in cold resistance in transgenic rice seedlings. Journal of Pineal Research, 2010, 9(2): 176-182.
[48] 高青海, 贾双双, 苗永美, 陆晓民, 李慧敏. 亚低温条件下外源褪黑素对甜瓜幼苗氮代谢及渗透调节物质的影响. 应用生态学报, 2016, 27(2): 519-524.
GAO Q H, JIA S S, MIAO Y M, LU X M, LI H M. Effects of exogenous melatonin on nitrogen metabolism and osmotic adjustment substances of melon seedlings under sub-low temperature. Chinese Journal of Applied Ecology, 2016, 27(2): 519-524. (in Chinese)
[49] BAJWA V S, SHUKLA M R, SHERIF S M, MURCH S J, SAXENA P K. Role of melatonin in alleviating cold stress in Arabidopsis thaliana. Journal of Pineal Research, 2014, 56(3): 238-245.
[50] 邵佳蓉, 宋春波, 卞坤, 陈伟, 杨震峰. 桃果实PpSIZ1基因对低温和外源褪黑素处理的响应. 园艺学报, 2016, 43(7): 1257-1266.
SHAO J R, SONG C B, BIAN K, CHEN W, YANG Z F. Expression responses of SUMO E3 Ligase(SIZ1)to low temperature stress and exogenous melatonin in postharvest peach fruit. Acta Horticulturae Sinica, 2016, 43(7): 1257-1266. (in Chinese)
[51] FAN J, HU Z, XIE Y, CHAN Z, CHEN K, AMOMBO E, CHEN L, FU J. Alleviation of cold damage to photosystem II and metabolisms by melatonin in Bermudagrass. Frontiers in Plant Science, 2015, 6: 925.
[52] ZHANG N, ZHAO B, ZHANG H J, WEEDA S, YANG C, YANG Z C, REN S, GUO Y D. Melatonin promotes water-stress tolerance, lateral root formation, and seed germination in cucumber (Cucumis sativus L.). Journal of Pineal Research, 2013, 54(1): 15-23.
[53] WANG P, SUN X, LI C, WEI Z, LIANG D, MA F. Long-term exogenous application of melatonin delays drought-induced leaf senescence in apple. Journal of Pineal Research, 2013, 54(3): 292-302.
[54] ZUO B, ZHENG X, HE P, WANG L, LEI Q, FENG C, ZHOU J, LI Q, HAN Z, KONG J. Overexpression of MzASMT improves melatonin production and enhances drought tolerance in transgenic Arabidopsis thaliana plants. Journal of Pineal Research, 2014, 57(4):408-417.
[55] MENG J F, XU T F, WANG Z Z, FANG Y L, XI Z M, ZHANG Z W. The ameliorative effects of exogenous melatonin on grape cuttings under water-deficient stress: Antioxidant metabolites, leaf anatomy, and chloroplast morphology. Journal of Pineal Research, 2014, 57(2): 200-212.
[56] GONG B, LI X, VANDENLANGENBERG K M, WEN D, SUN S, WEI M, LI Y, YANG F, SHI Q, WANG X. Overexpression of S-adenosyl-L-methionine synthetase increased tomato tolerance to alkali stress through polyamine metabolism. Plant Biotechnology Journal, 2014, 12(6): 694-708.
[57] LI C, WANG P, WEI Z, LIANG D, LIU C, YIN L, JIA D, FU M, MA F. The mitigation effects of exogenous melatonin on salinity-induced stress in Malus hupehensis. Journal of Pineal Research, 2012, 53(3): 298-306.
[58] KOSTOPULOU Z, THERIOS I, ROUMELIOTIS E, KANELLIS A K, MOLASSIOTIS A. Melatonin combined with ascorbic acid provides salt adaptation in Citrus aurantium L. seedlings. Plant Physiology and Biochemistry, 2015, 86: 55-165.
[59] ZHANG H J, ZHANG N, YANG R C, WANG L, SUN Q Q, LI D B, CAO Y Y, WEEDA S, ZHAO B, REN S, GUO Y D. Melatonin promotes seed germination under high salinity by regulating antioxidant systems, ABA and GA4 interaction in cucumber (Cucumis sativus L.). Journal of Pineal Research, 2014, 57(3): 269-279.
[60] 王伟香, 张锐敏, 孙艳, 刘建龙. 外源褪黑素对硝酸盐胁迫条件下黄瓜幼苗抗氧化系统的影响. 园艺学报, 2016, 43(4): 695-703.
WANG W X, ZHANG R M, SUN Y, LIU J L. Effect of exogenous melatonin on the antioxidant system of cucumber seedlings under nitrate stress. Acta Horticulturae Sinica, 2016, 43(4): 695-703. (in Chinese)
[61] MUKHERJEE S, DAVID A, YADAV S, BALUŠKA F, BHATLA S C. Salt stress-induced seedling growth inhibition coincides with differential distribution of serotonin and melatonin in sunflower seedling roots and cotyledons. Physiologia Plantarum, 2014, 152(4): 714-728.
[62] LIU N, JIN Z, WANG S, GONG B, WEN D, WANG X, WEI M, SHI Q. Sodic alkaline stress mitigation with exogenous melatonin involves reactive oxygen metabolism and ion homeostasis in tomato. Scientia Horticulturae, 2015, 181: 18-25.
[63] LEE H Y, BYEON Y, BACK K. Melatonin as a signal molecule triggering defense responses against pathogen attack in Arabidopsis and tobacco. Journal of Pineal Research, 2014, 57(3): 262-268.
[64] LEE H Y, BYEON Y, TAN D X, REITER R J, BACK K. Arabidopsis serotonin N-acetyltransferase knockout mutant plants exhibit decreased melatonin and salicylic acid levels resulting in susceptibility to an avirulent pathogen. Journal of Pineal Research, 2015, 58(3): 291-299.
[65] SHI H, CHEN Y, TAN D X, REITER R J, CHAN Z, HE C. Melatonin induces nitric oxide and the potential mechanisms relate to innate immunity against bacterial pathogen infection in Arabidopsis. Journal of Pineal Research, 2015, 59(1): 102-108.
[66] ZHAO H, XU L, SU T, JIANG Y, HU L, MA F. Melatonin regulates carbohydrate metabolism and defenses against Pseudomonas syringae pv. tomato DC3000 infection in Arabidopsis thaliana. Journal of Pineal Research, 2015, 59(1): 109-119.
[67] YIN L, WANG P, LI M, KE X, LI C, LIANG D, WU S, MA X, LI C, ZOU Y, MA F. Exogenous melatonin improves Malus resistance to Marssonina apple blotch. Journal of Pineal Research, 2013, 54(4): 426-434.
[68] LIU N, GONG B, JIN Z, WANG X, WEI M, YANG F, LI Y, SHI Q. Sodic alkaline stress mitigation by exogenous melatonin in tomato needs nitric oxide as a downstream signal. Journal of Plant Physiology, 2015(186/187): 68-77.
[69] GONG B, LI X, BLOSZIES S, WEN D, SUN S, WEI M, LI Y, YANG F, SHI Q, WANG X. Sodic alkaline stress mitigation by interaction of nitric oxide and polyamines involves antioxidants and physiological strategies in Solanum lycopersicum. Free Radical Biology and Medicine, 2014, 71(6): 36-48.
[70] ZHANG N, SUN Q, ZHANG H, CAO Y, WEEDA S, REN S, GUO Y D. Roles of melatonin in abiotic stress resistance in plants. Journal of Experimental Botany, 2015, 66(3): 647-656.
(责任编辑 赵伶俐)
Review of Melatonin in Horticultural Crops
GONG Biao, SHI QingHua
(College of Horticulture Science and Engineering, Shandong Agricultural University, State Key Laboratory of Crop Biology, Huang-Huai-Hai Region Scientific Observation and Experimental Station of Environment-Controlled Agricultural Engineering, Ministry of Agriculture, Tai’an 271018, Shandong)
Melatonin is a kind of indoleamine compound that is widely existed in organism. In animal, melatonin acts as a health care product for human and plays a role in the regulation of circadian rhythm, improving immunity and anti-aging. Melatonin has been detected in a number of plant species up to now. And the biosynthesis pathway of melatonin includes L-tryptophane, tryptamine, 5-hydroxytryptamine and N-acetyl-5-hydroxytryptamine. The key enzymes involving melatonin biosynthesis have been detected in plants, including L-tryptophan decarboxylase (TrpDC), tryptophan hydroxylase (T5H), serotonin-N- acetyltransferase (SNAcT), 5-serotonin-N-acetyltransferase (AcSNMT) and hydroxyindole-O-methyltransferase (HIOMT). The roles of melatonin in the horticultural crops kingdom are not clear enough. In recent years, several studies showed that melatonin has roles in regulating the growth of plants, increasing yield, activating seed germination, regulating photoperiod, regulating rhizogenesis, delaying leaf senescence, influencing fruit ripening and storage. The antioxidant properties of melatonin would seem to explain, at least partially,its ability to fortify plants reactive oxygen species (ROS) scavenging that subjected to stresses, such as light, temperature, water, saline-alkali, heavy metal and oxidative stress. In addition, melatonin also involves some signaling transduction pathways including auxin (IAA), gibberellic acid (GA), abscisic acid (ABA), ethene (ETH), salicylic acid (SA), polyamine (PAs) and nitric oxide (NO), which form a complicated signaling network of growth, development and stress tolerance in horticultural crops. Recent data on five fields of “the biosynthesis of melatonin in plants, the melatonin of horticultural crops and influence factor for their melatonin content; roles of melatonin in growth and development of horticultural crops; roles of melatonin in stress response of horticultural crops, signal transduction network of melatonin in plant growth, development and stress tolerance” were reviewed in this paper. And the values of melatonin in horticultural industry were also forecasted. This review presented a summary of the investigations in the plant melatonin field, and the potential functions of increasing melatonin content in horticultural crops were also predicted.
melatonin; horticultural crops; growth; development; stress response
2016-12-12;接受日期:2017-03-29
国家自然科学基金(31501779)、山东省优秀中青年科学家科研奖励基金(BS2014NY005)、中国博士后科学基金资助项目(2015M582130)、山东省博士后创新项目专项资金(201502006)
联系方式:巩彪,E-mail:gb_gongbiao@163.com。通信作者史庆华,E-mail:qhshi@sdau.edu.cn
