1株嗜热性羽毛降解菌的分离鉴定及其酶学性质
2017-07-21刘艳海姚大伟刘建新杨德吉
刘艳海+姚大伟+刘建新+杨德吉
摘要:为从环境中得到1株嗜热高效角蛋白降解菌,用以羽毛粉为唯一碳源、氮源的培养基进行筛选。经筛选得到1株嗜热降解羽毛角蛋白的Y6菌株,通过对该菌株菌落、菌体形态特征、生理生化特性测定和16S rRNA分析,使用美国国立生物技术信息中心(NCBI)的BLAST进行16S rRNA的相似性比对。相似性比对结果显示,Y6菌株与地衣芽孢杆菌Xmb047(Bacillus licheniformis Xmb047)的同源性99%,初步认定该菌株为地衣芽孢杆菌(Bacillus licheniformis),命名为Y6(GenBank登陆号KY082766)。采用该菌降解完整羽毛,发酵72 h后,完整羽毛仅剩下羽轴,羽枝被完全降解,说明Y6菌株有着较强的羽毛降解能力;用不同浓度硫酸铵溶液盐析发酵产物上清液,筛选出硫酸铵浓度为70%时,分离的粗酶液总活性最高。酶活性试验表明,Y6所产蛋白酶最适反应温度为70 ℃,最适pH值为8.0,Fe3+、Zn2+对蛋白酶活性有较强的抑制作用,阴离子表面活性剂十二烷基硫酸钠(SDS)、金属蛋白酶抑制剂乙二胺四乙酸(EDTA)能较强地抑制蛋白酶活性,表明该蛋白酶属于金属蛋白酶。
关键词:嗜热性角蛋白降解菌;角蛋白酶;羽毛角蛋白;地衣芽孢杆菌Y6;酶学性质
中图分类号: S182文献标志码: A
文章编号:1002-1302(2017)10-0232-06
近年来,家禽产品的生产和消费呈全球化增长。羽毛是家禽屠宰后产生的废弃物,且产量巨大,我国羽毛产量约为100万t/年[1]。大量羽毛的废弃不仅造成资源的巨大浪费,而且污染环境。羽毛粉中各类氨基酸齐全,含必需氨基酸,特别是含硫氨基酸含量较高。因此对这类资源加以充分利用将是蛋白饲料非常重要的补充[2]。
虽然角蛋白类废弃物富含氨基酸,是饲料蛋白潜在而巨大的来源,但消化率非常低。如果能提高角蛋白类废弃物的利用率,不但可为养殖业提供大量的饲料蛋白,而且能带动所有角蛋白类废弃物的收集和加工产业链的发展,从而对这些废弃物的资源化利用和减排有积极的意义,减轻对环境造成的污染[3-4]。
笔者所在研究室已经从某些特别动物的胃肠道中分离得到100多株能降解角蛋白的微生物,如苏云金芽孢杆菌NJY1,短小芽孢杆菌NJK4、NJQ2和蜡样芽孢杆菌NJQ3等,在实验室试验和中试试验中都表明,它们单独或联合进行固体发酵,羽毛粉的降解率能达到80%,降解产物体外消化率达85%[5-6]。但是,这些微生物的应用也有缺點:最佳发酵温度在37 ℃,降解速度较慢,正常1个周期需要6~7 d才能充分降解。因此,对于规模化生产,设备周转慢、投资量大,这是制约菌株工业化发酵的重要条件[7]。为了分离1株高效耐高温的羽毛角蛋白降解菌,笔者从云南腾冲热泉水中取样,经过富集培养,采用以羽毛粉为唯一碳源、氮源的培养基进行筛选,以期为进一步研究羽毛粉的微生物发酵奠定基础。
1材料与方法
1.1样品采集
样品采集自云南腾冲热泉水。
1.2培养基
营养培养基:10.0 g胰蛋白胨,5.0 g酵母提取物,10.0 g氯化钠,补足蒸馏水至1 000 mL,pH值7.0;营养琼脂培养基:10.0 g胰蛋白胨,5.0 g酵母提取物,10.0 g氯化钠,15.0 g 琼脂粉,补足蒸馏水至1 000 mL,pH值7.0;筛选培养基:15.0 g羽毛粉,0.5 g NaCl,0.01 g CaCl2,0.4 g MgSO4·7H2O,0.35 g KH2PO4,0.7 g K2HPO4,15.0 g琼脂粉,补足蒸馏水至1 000 mL,pH值7.0;种子培养基:10.0 g胰蛋白胨,5.0 g酵母提取物,10.0 g氯化钠,补足蒸馏水至1 000 mL,pH值7.5;发酵培养基:15.0 g羽毛粉,0.5 g NaCl,0.01 g CaCl2,0.4 g MgSO4·7H2O,0.35 g KH2PO4,0.7 g K2HPO4,补足蒸馏水至1 000 mL,pH值7.5。
1.3增殖培养
量取1 mL采集的样品于营养培养基中,55 ℃、150 r/min培养24 h。
1.4筛选
取营养培养基中的菌液100 μL,涂布于筛选培养基平板,55 ℃培养24 h。挑选生长良好的单菌落,重新划线筛选培养基平板,纯培养,保种备用。
1.5细菌鉴定
1.5.1菌落及菌体形态观察将分离纯化的菌株划线接种于营养琼脂培养基平板上,55 ℃培养24 h。肉眼观察菌落的形状、颜色、表面质地以及菌落边缘。经革兰氏染色后于光学显微镜及电镜下观察菌体形态。
1.5.2菌株生长温度范围测定将100 μL纯培养得到的菌液接种到装有3 mL营养培养基的试管中,分别于35、40、45、50、55、60、65、70、75、80 ℃水浴培养12 h。通过测定培养液中的D600 nm来确定其生长温度范围及最适生长温度。
1.5.3菌株生长pH值范围测定将纯培养得到的100 μL菌液分别接种到pH值为5.5、6.0、6.5、7.0、7.5、8.0、8.5、90、9.5、10.0的3 mL营养培养基中,55 ℃培养12 h。通过测定培养液中的D600 nm来确定其生长pH值范围及最适生长pH值。
1.5.4生理生化特性的鉴定参照文献[8]对该菌株的生理生化特性进行鉴定。
1.5.516S rRNA分析吸取1 mL过夜培养的菌液,98 ℃金属浴10 min,金属浴后,将溶液于13 000 r/min离心3 min,吸取5 μL作为PCR扩增模板。采用16S rRNA基因的通用引物[9]配成 50 μL 体系进行PCR反应。上游引物(1492R):5′-GGTTACCTTGTTACGACTT-3′,下游引物(8F):5′-AGAGTTTGATCCTGGCTCAG-3′。PCR扩增条件:95 ℃ 5 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 90 s,30个循环;72 ℃ 5 min。用1%琼脂糖凝胶电泳鉴定PCR产物。PCR产物由生工生物工程(上海)股份有限公司进行测序分析,测序结果与GenBank中已发表的基因序列进行同源性比较。
1.5.6系统进化树的构建与分析用BLASTn程序在GenBank中进行相似性对比,选取相似性较大的序列用Mega 5.0进行系统发育分析,用邻接法(Neighbor-Joining,简称N-J)构建系统进化树[8]。
1.6羽毛降解能力测定
将筛选得到的纯化菌株分别接种至种子培养基中,55 ℃、150 r/min培养过夜。将种子液分别接种至装有50 mL发酵培养基的250 mL锥形瓶中,55 ℃、150 r/min培养,观察羽毛降解情况。
1.7粗酶的制备
从羽毛粉培养基平板挑选单个菌落接种至种子培养基上,55 ℃摇床培养过夜。按照10%的接种量接种羽毛粉发酵培养基,在55 ℃的条件下,在摇床上以150 r/min的转速培养72 h,取发酵液,于4 ℃、5 000 r/min离心10 min,取上清液。
去上述上清液分别加入硫酸铵,使硫酸铵饱和度分别达10%、20%、30%、40%、50%、60%、70%、80%,室温下静置 24 h,8 000 r/min离心20 min弃去上清液,沉淀用0.2 mol/L磷酸缓冲盐溶液(PBS)溶解至原体积的1/10。随后对蛋白酶活性进行测定。选择合适的硫酸铵浓度,盐析后沉淀采用 1/10 原体积的0.2 mol/L PBS溶解,装入透析袋中,然后置于4 ℃,用去离子水透析24 h,透析袋中即为粗酶液。
1.8粗酶蛋白酶酶学性质的研究
1.8.1蛋白酶活性的测定参照Folin试剂显色法[10],略有改动。取上述粗酶液1 mL,置于60 ℃水浴中预热2 min,再加入经同样预热的1 mL 2%酪蛋白溶液,精确保温30 min;时间到后,立即加入2 mL 0.4 mol三氯乙酸以终止反应,继续置于水浴中保温20 min,使残余蛋白质沉淀后离心。取1 mL离心后的上清液,加入5 mL 0.4 mol/L碳酸钠溶液、1 mL已稀释的福林试剂,摇匀,40 ℃保温发色20 min后进行吸光度(D660 nm)测定。酶活单位:在40 ℃下1 min水解酪蛋白产生 1 μg 酪氨酸,定义为1个蛋白酶活性单位。
1.8.2温度对酶活性的影响将粗酶液、酪蛋白混合后的反应液分别置于40、50、60、70、80、90、100 ℃水浴中反应 30 min,测定蛋白酶活性。
1.8.3酶的热稳定性以酪蛋白为底物,将粗酶液置于不同温度(50、60、70、80、90、100 ℃)中水浴处理,每20 min测定蛋白酶活性,研究不同温度对蛋白酶稳定性的影响。
1.8.4酶的最适作用pH值采用不同pH值6.5、7.0、7.5、8.0、8.5、9.0的Tris-盐酸缓冲液和pH值9.4、10.0的硼砂-氢氧化钠缓冲液配制2%酪蛋白底物,测定粗酶液的最适作用pH值。
1.8.5激活剂、抑制剂等不同试剂对酶活性的影响为研究激活剂、抑制剂对酶活性的影响,向酶液中加入不同的抑制剂、激活剂、表面活性剂、还原剂,如乙二胺四乙酸(EDTA)、十二烷基硫酸钠(SDS)、Tween-80、苯甲基磺酰氟(PMSF)、TritonX-100、异丙醇、甘油和二甲基亚砜(DMSO)等,使各种试剂终浓度为5%,60 ℃下作用30 min,分析残余酶活性。以去离子水代替修饰剂,在相同条件下测定酶活性,将此酶活性视为100%。
1.8.6金属离子对酶活性的影响分别将含有0.1 mol/L [JP3]Ca2+、Mg2+、Zn2+、Mn2+、Ba2+、Fe2+、Fe3+的200 μL 0.05 mol/L、pH值7.5的Tirs-HCl缓冲液与1.8 mL粗酶液混合,使反应体系中金属离子的浓度达到10 mmol/L,60 ℃作用30 min,分析残余酶活性。以去离子水代替代替修饰剂,在相同条件下测定酶活性,将此酶活性视为100%。
2结果与分析
2.1菌株筛选
在以羽毛为唯一碳源和氮源的培养基上,经过多次传代,分离到纯的菌株,命名为Y6。
2.2菌体、菌落形态特征
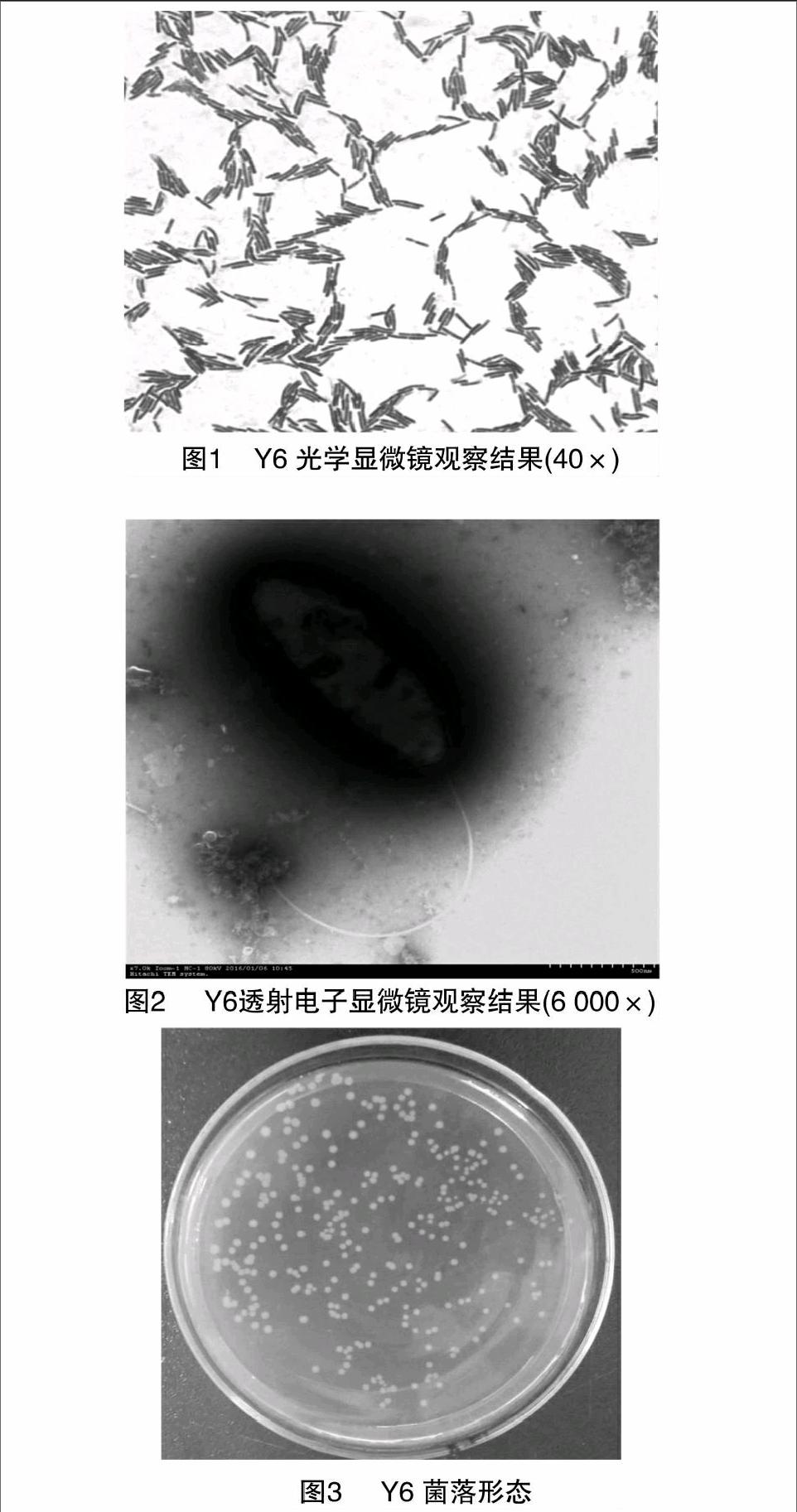
Y6为革兰氏阳性芽孢杆菌(图1),大小约(0.5~2.5)μm×(1.2~10.0)μm,电子显微镜测量其大小为0.5 μm×2.0 μm(图2)。Y6在普通营养琼脂平板上,于 55 ℃ 恒温培养12 h,菌落呈乳白色,圆盘状,边缘整齐或不整齐,表面光滑,有微皱褶突起,不透明(图3)。
2.3生长温度范围及生长pH值范围
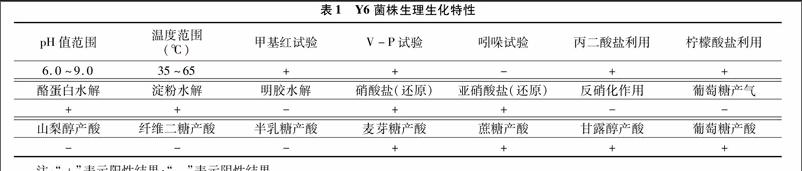
将菌株置于不同温度、pH值下培养,12 h后使用分光光度计测定菌液的D600 nm,以空白营养培养基作为对照。如图4所示,培养温度对Y6菌株的生长有着明显的影响,在所选温度范围内,菌体密度随温度的差异而变化,当培养温度低于37 ℃时,菌体生长缓慢;当培养温度在45~60 ℃之间时,菌体生长情况较好,且菌体的最适培养温度为55 ℃,属于嗜热菌。如图5所示,在pH值7.0~9.0时,菌体生物量较大,最适生长pH值为7.5。本試验结果与晏爱芬等分离的嗜热地衣性芽孢杆菌(Bacillus licheniformis)NHH4最适生长温度一致[11],同时两者都具有较宽的反应温度范围。
2.4Y6菌株的生理生化特性
由表1可见,Y6菌株甲基红试验呈阳性,伏-普(V-P)试验呈阳性,吲哚试验呈阴性;能利用丙二酸盐、柠檬酸盐;能水解酪蛋白、淀粉,不能水解明胶;葡萄糖产气呈阴性,能利用麦芽糖、蔗糖、葡萄糖、甘露醇;不能利用山梨醇、纤维二糖、半乳糖;反硝化作用呈阴性;硝酸盐还原作用呈阳性;亚硝酸盐还原作用呈阳性。由形态观察及生理生化特征结果可以初步确定该菌株为芽孢杆菌属。
2.5细菌16S rRNA基因分析
本研究分离的Y6菌株16S rRNA基因扩增电泳结果显示,该菌基因约为1 400 bp(图6)。该基因的GenBank登录号为KY082766。使用美国国立生物技术信息中心(NCBI)的BLAST进行16S rRNA的相似性比对,结果显示,该基因与地衣芽孢杆菌(Bacillus licheniformis)strain Xmb047(GenBank登录号:KT986173)的同源性99%。利用Mega5.0软件进行多重序列比对,并绘制系统进化树。如图7所示,Y6菌株与地衣芽孢杆菌属地衣芽孢杆菌(Bacillus licheniformis)PF1-3.1(GenBank登录号:KT720020)的亲缘关系最近,同源性较高。结合细菌形态学及生理生化特性鉴定,初步认定该菌株为地衣芽孢杆菌,命名为Y6。
2.6羽毛降解效果
如图8所示,与对照组相比,36 h时试验组小羽开始掉落;随着时间的推移,试验组羽毛上的小羽逐渐降解,大约 72 h 时,小羽完全降解,仅剩下羽柄,而对照组的羽毛基本没有变化。由此可知,Y6有较强的羽毛降解能力。
2.7硫酸铵饱和度对酶提取的影响
由图9可以看出,随着硫酸铵浓度的不断增加,沉淀的蛋白酶活性也不断增强(呈线性正相关),当硫酸铵浓度达70%时,沉淀中的蛋白酶活性占总蛋白酶活性的100%。为获得较大的回收率,本试验采用70%的硫酸铵盐析沉淀蛋白酶。
2.8温度对蛋白酶活性的影响
如图10所示,该蛋白酶在40~70 ℃之间随温度升高,酶活性逐渐增大,且温度高達80 ℃时酶活性为38.38 U/mL,最适温度为60~80 ℃;70 ℃时,酶活性最高,为50.52 U/mL;高于90 ℃时,酶活性降低迅速。结果表明, 该蛋白酶为一种高温型蛋白酶,该酶的最适反应温度(70 ℃)高于Suntornsuk等报道的由B. licheniformis FK 14生产的热稳定性角蛋白酶的最适温度60 ℃,同时,两者都具有较宽反应温度范围,在40~90 ℃ 范围内均能保持较高的酶反应活性[12]。
如图11所示所示,将粗酶液置于不同温度中处理不同时间,用福林-酚法测定酶活性,粗酶在60~80 ℃之间,热稳定
性较好,可见温度相对低的情况对粗酶破坏较轻;在高温条件下,酶活性下降迅速,100 ℃作用20 min,粗酶活性完全丧失。结果表明,该蛋白酶具有一定的耐热性,属于耐热性蛋白酶。
2.9pH值对蛋白酶活性的影响
由图12可知,角蛋白粗酶在不同pH值缓冲体系中,60 ℃ 下用福林-酚法测定角蛋白酶活性,该酶的最适pH值为7.5~8.5,当pH值为8.0时,酶活性达到最大值 50.24 U/mL,表明该角蛋白酶为碱性蛋白酶。Cheng等从地衣芽孢杆菌(Bacillus licheniformis)PWD-1中提取了1种蛋白酶,最适pH值为8.5[13],比本试验提取的蛋白酶稍微耐碱。
2.10不同试剂对酶活性的影响
如图13所示,EDTA、SDS、Tween-80、PMSF和TritonX-100抑制了蛋白酶的活性,其中EDTA、SDS对蛋白酶有很强的抑制作用,其处理分别只能达到总酶活性的34%、49%;异丙醇、甘油和DMSO对蛋白酶活性几乎没有影响。
2.11金属离子对酶活性的影响
如图14所示,在金属离子中,Zn2+、Fe3+对蛋白酶抑制作
用最强,其处理的酶活性分别仅为酶总活性的21%、18%;Mn2+能大幅度增强蛋白酶的活性,为总酶活性的1.95倍;其余离子如Ca2+、Mg2+、Ba2+、Fe2+对蛋白酶活性影响不大。
3讨论
微生物降解羽毛角蛋白和产角蛋白酶的过程中,目前地衣芽孢杆菌是被研究最多的,也是被认为具有较强降解能力的芽孢杆菌属。以美国北卡罗莱纳州立大学的William等为代表,对地衣芽孢杆菌PWD-1(Bacillus licheniformis PWD-1)的降解能力、产酶特性、降解机制及分子生物学进行深入全面的研究[14-16],也将地衣芽孢杆菌PWD-1的角蛋白酶基因KerA转入枯草芽孢杆菌进行基因工程方面的研究[17-18]。国内外很少有嗜热性菌株降解羽毛粉的研究,傅伟从土壤中分离出地衣芽孢杆菌ZJUQH(Bacillus licheniformis ZJUQH),并研究得出其最适发酵温度为37 ℃[19]。本研究的菌株分离于云南腾冲热海,是一种嗜热性地衣芽孢杆菌。根据菌落形态、菌体形态特征、细菌生理生化特性、细菌16S rRNA基因分析,初步认为Y6为地衣芽孢杆菌属。Y6最适生长温度为55 ℃,此温度下发酵羽毛粉能抑制环境中大部分杂菌的生长,大大提高了发酵效率。
角蛋白酶是一种十分重要的工业酶,广泛应用于饲料、肥料、洗涤剂、皮革和制药行业。但是在我国,角蛋白酶的品种和生产菌株都很单一。笔者分离的蛋白酶来源于嗜热细菌地衣芽孢杆菌Y6(Bacillus licheniformis Y6),是一种嗜热耐碱蛋白酶,在较高的温度范围(40~90 ℃)和较宽泛的pH值范围(6.5~10.0)中均能发挥作用。EDTA、SDS强烈抑制该蛋白酶活性,说明该酶可能是一种金属蛋白酶。抑制剂PMSF对该蛋白酶活性影响较小,PMSF为丝氨酸酶抑制剂,可能是由于丝氨酸不是该淀粉酶的活性中心。本研究以酪蛋白为底物,测定Y6所产蛋白酶的活性,酪蛋白水解活性测定是评测蛋白酶活性的标准方法,与使用不溶性的角蛋白或羽毛粉角质溶解活性测定相比,能够提供准确的结果。菌株蛋白酶生产力由酪蛋白水解活性估计测定结果与角质溶解活性测定结果具有很好的相关性[20]。
角蛋白降解菌筛选的标准通常为产透明圈大小和观察降解完整羽毛的能力[21]。由于Y6菌株最适生长温度为55 ℃,该温度下羽毛琼脂培养基水分蒸发较快,透明圈还没有完全形成,培养基已被蒸干,严重干扰试验结果。因此,本试验采用观察降解完整羽毛的标准进行定性分析其降解能力,72 h后完整羽毛仅剩下羽轴,该菌无法彻底降解羽轴,其发酵条件的优化须进一步研究。
4结论
从云南腾冲热泉水中取样,经过富集培养,以羽毛粉为唯一碳源和氮源的培养基筛选,最终获得1株嗜热性羽毛降解菌,进一步通过16S rRNA测序,初步鉴定菌株Y6为地衣芽孢杆菌,暂时命名为地衣芽孢杆菌Y6(Bacillus licheniformis Y6)。在完整羽毛降解的试验中发现,36 h时试验组小羽开始掉落,大约72 h时,小羽完全降解,仅剩下羽柄,具有较强的降解羽毛的能力。
Bacillus licheniformis Y6所产蛋白酶是一种嗜热耐碱蛋白酶,该酶的最适反应温度、最适反应pH值分别为70 ℃、8.0。在测定金属离子对蛋白酶活性的影响时,结果显示,2价金属离子Ba2+、Ca2+、Mg2+、Fe2+没有增强其蛋白酶的活性,说明该酶在催化反应过程中不需要Ba2+、Ca2+、Mg2+、Fe2+金属离子的参与,Fe3+、Zn2+对蛋白酶活性有较强的抑制作用。阴离子表面活性剂SDS对蛋白酶有较强的抑制作用,金属蛋白酶抑制剂EDTA能较强地抑制蛋白酶的活性,表明该蛋白酶可能属于金属蛋白酶。3种有机溶剂DMSO、异丙醇、甘油对蛋白酶活性几乎没有影响,表明该蛋白酶在耐有机溶剂生物催化剂方面有潜在的应用前景,在洗涤工业生产中也有较大的应用价值。
参考文献:
[1]Eslahi N,Dadashian F,Nejad N H. An investigation on keratin extraction from wool and feather waste by enzymatic hydrolysis[J]. Preparative Biochemistry & Biotechnology,2013,43(7):624-648.
[2]王政,郭士兵,姚大伟,等. 高效降解角蛋白菌株的分离筛选与鉴定[J]. 中国农学通报,2009,25(18):22-24.
[3]Boone D R,Castenholz R. Volume one:the Archaea and the deeply branching and phototropic bacteria[M]. 2nd ed. New York:Springer-Vedag,2001:243-245.
[4] Bressollier P,Letourneau F,Urdaci M,et al. Purification and characterization of a keratinolytic serine proteinase from Streptomyces albidoflavus[J]. Applied and Environmental Microbiology,1999,65(6):2570-2576.
[5] Tapia D M T,Contiero J. Production and partial characterization of keratinaseproduced by a microorganism isolated from poultry processing plantwastewater[J]. African Journal of Biotechnology,2008,7(3):296-300.
[6] Williams C M,Richer C S,MacKenzie J M,et al. Isolation,identification,and characterization of feather-degrading bacterium[J]. Applied and Environmental Microbiology,1990,56(6):1509-1515.
[7]王爽. 角蛋白降解菌NJQ2和NJQ3混合固态发酵羽毛粉的研究[D]. 南京:南京农业大学,2012:34-36.
[8]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:349-370.
[9]聂康康,姚大伟,郭俊清,等. 一株高效羽毛降解菌株的分离与鉴定[J]. 氨基酸和生物资源,2010,32(1):18-20.
[10]中华人民共和国商业部. 蛋白酶活力测定法:SB/T 1037—1999[S].北京:中国标准出版社,2004.
[11]晏爱芬,余丽,林连兵. 腾冲热海嗜热芽孢杆菌的分离鉴定[J]. 科学技术与工程,2012,12(15):3564-3567.
[12]Suntornsuk W,Tongjun J,Onnim P,et al. Purification and characterisation of keratinase from a thermotolerant feather-degrading bacterium[J]. World Journal of Microbiology and Biotechnology,2005,21(6/7):1111-1117.
[13]Cheng S W,Hu H M,Shen S W,et al. Production and characterization of keratinase of a feather-degrading Bacillus licheniformis PWD-1[J]. Bioscience Biotechnology and Biochemistry,1995,59(12):2239-2243.[HJ1.83mm]
[14]Shin J C H. Recent development in poultry waste digestion and feather utilization-a review[J]. Poultry Science,1993,72(9):1617-1620.
[15]Williams C M,Richter C S,Mackenzie J M,et al. Isolation,identification,and characterization of a feather-degrading bacterium[J]. Applied and Environmental Microbiology,1990,56(6):1509-1515.
[16]Lin X,Lee C G,Casale E S,et al. Purification and characterization of a keratinase from a feather-degrading Bacillus licheniformis strain[J]. Applied and Environmental Microbiology,1992,58(10):3271-3275.
[17]Lin X,Kelemen D W,Miller E S,et al. Nucleotide sequence and expression of kerA,the gene encoding a keratinolytic protease of Bacillus licheniformis PWD-1[J]. Applied and Environmental Microbiology,1995,61(4):1469-1474.
[18]Lin X,Shih J,Swaisgood H E. Hydrolysis of feather keratin by immobilized keratinase[J]. Applied and Environmental Microbiology,1996,62(11):4273-4275.
[19]傅伟. 地衣芽孢杆菌降解羽毛角蛋白及其发酵产角蛋白酶的研究[D]. 杭州:浙江大学,2007:55-57.
[20]Gessesse A,Hatti-Kaul R,Gashe B A,et al. Novel alkaline proteases from alkaliphilic bacteria grown on chicken feather[J]. Enzyme and Microbial Technology,2003,32(5):519-524.
[21]亓魯,姚大伟,杨德吉. 羽毛粉麸皮混合固态发酵条件优化[J]. 畜牧与兽医,2014,46(3):10-14.
